Introducción
Factor de necrosis tumoral alfa (TNF-α) es el nombre descriptivo que se ha dado a un factor sérico obtenido en 1975 de ratones tratados con endotoxina. Este factor demostró una capacidad para inducir necrosis en un sarcoma murino inducido por metilcolantreno1. La caracterización molecular del TNF-α en la década de los ochenta reveló su identidad a caquectina, un factor sérico previamente descrito que produce pérdida de peso y fiebre en modelos animales de experimentación2,3. Las diversas actividades biológicas del TNF-α pronto fueron evidentes. Aparte de sus propiedades tumoricidas, la inyección de TNF-α en animales o humanos produce signos y síntomas de choque, que incluyen lesiones multiorgánicas, mediante sus efectos promotores de la inflamación del endotelio vascular. Se reconoció el posible papel del TNF-α en la artritis reumatoide (AR) al demostrar a) su capacidad de degradar cartílago y hueso in vitro; b) sus propiedades productoras de artritis en modelos animales; c) la co-localización de los receptores TNF en el sinovio de pacientes con AR y el nexo entre pannus y cartílago, y d) su papel esencial en la regulación de la producción de interleucina (IL) 1 en cultivos celulares del sinovio de pacientes con AR (una mezcla de células linfoides, macrófagos, células dendríticas, células B, células endoteliales y fibroblastos)4,5.
Se obtuvo evidencia del papel del TNF-α en la AR y, por consiguiente, su posible utilidad como diana para las intervenciones terapéuticas, al observar cómo se aliviaron los signos clínicos y lesiones tisulares en la artritis inducida por colágeno en ratones por la administración de un anticuerpo anti-TNF-α monoclonal6. En 1992, 20 pacientes con AR activa, a pesar de haber sido tratados con fármacos antirreumáticos modificadores de la enfermedad (FAME), fueron los primeros que recibieron tratamiento con un agente anti-TNF-α, el infliximab (Remicade®, Centocor, Inc, Malvern, Pa). En este ensayo clínico abierto, realizado por nuestro equipo en la Kennedy Institute of Rheumatology Division, la seguridad y efecto antiinflamatorio marcado de la administración intravenosa de infliximab se asoció con una importante reducción en la proteína C reactiva (PCR) y velocidad de sedimentación globular7. Un ensayo clínico multicéntrico, aleatorio y controlado con placebo, realizado un tiempo después en Europa, confirmó el efecto antiinflamatorio de una única infusión intravenosa de infliximab8. Sin embargo, los pacientes sufrieron una recidiva a las 3-8 semanas de suspender el tratamiento (se relacionó la duración del efecto favorable hasta la recidiva con la dosis del fármaco [1 o 10 mg/kg]), lo cual demostró la necesidad de un tratamiento repetido9.
Más adelante, en un ensayo clínico controlado y realizado de forma aleatoria, se estableció la eficacia y dosis óptima de infliximab, así como su mayor eficacia terapéutica al administrarse conjuntamente con el metotrexato (MTX)10,11. La respuesta clínica sostenida lograda con el tratamiento a largo plazo (2 años) de infliximab con MTX ha sido demostrada en un estudio con doble enmascaramiento y controlado con placebo: el ensayo clínico multicéntrico internacional Anti-Tumor Necrosis Factor Trial in Rheumatoid Arthritis With Concomitant Therapy (ATTRACT)12-14. En este estudio, los pacientes se distribuyeron de forma aleatoria en 4 regímenes diferentes de tratamiento con infliximab más dosis semanales de MTX (dosis media 15 mg/sem) o sólo MTX. Las radiografías realizadas a las 24, 54 y 102 semanas demostraron un retraso o detención (e incluso mejoría de un 39 a un 54% de los pacientes) en la pérdida de espacio articular (equivalente a la pérdida de cartílago) y erosión ósea. Estos resultados contrastan con las lesiones progresivas observadas en el grupo control, donde los pacientes sólo recibían tratamiento con MTX12,14. Estos datos apoyan la hipótesis de un papel importante del TNF-α en la evolución de la inflamación y destrucción cartilaginosa y ósea en la AR.
Infliximab
Infliximab, un anticuerpo monoclonal quimérico (Fv1 murino, IgG1 humano), se une específicamente a TNF-α, tanto soluble como unido a membrana, con una gran afinidad (Ka = 1010 M-1) para formar inmunocomplejos estables que no se disocian15. La unión de infliximab a TNF-α bloquea la unión entre éste y sus receptores, y detiene el inicio del proceso de señalización intracelular que conduce a la transcripción genética y posterior actividad biológica. La unión in vitro de infliximab a TNF-α ligado a membrana produce lisis en las líneas celulares mediante un mecanismo de citotoxicidad dependiente de complemento o anticuerpos16,17. No se ha confirmado que esta acción in vitro tenga una correlación in vivo. La semejanza entre los resultados clínicos observados con el infliximab y el etanercept, otro antagonista anti-TNF, sugiere que la lisis celular quizá sea una acción innecesaria porque el etanercept no presenta un efecto citolítico similar in vitro.
El tratamiento con infliximab de los pacientes que presentan AR ha brindado una oportunidad para realizar unas investigaciones clínicas que han aclarado algunos aspectos de los efectos celulares y moleculares de este fármaco y han contribuido al entendimiento de la patogenia de la AR.
Farmacocinética y la respuesta clínica
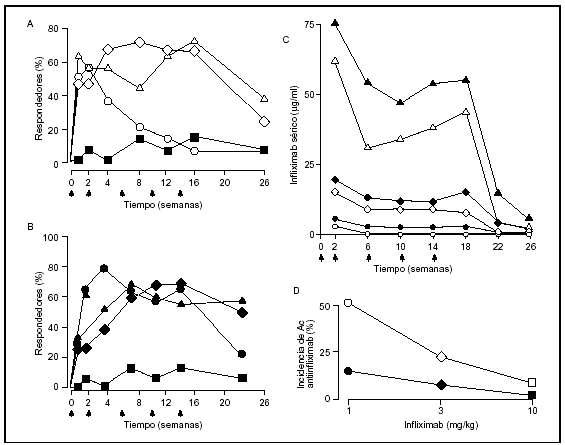
La respuesta terapéutica a infliximab evidencia una relación con la farmacocinética del infliximab y la expresión basal de TNF-α en el tejido sinovial. Las mediciones de la concentración sanguínea de infliximab y la expresión de TNF-α en las articulaciones sugieren que el bloqueo del TNF-α que se produce en el mismo lugar de producción principalmente las células macrófagos en la articulación sea la clave para entender su modo de acción. Existen unas relaciones estrechas entre la dosis administrada de infliximab, su concentración sanguínea, la duración de la respuesta clínica y la eventual reaparición de las manifestaciones clínicas al eliminar el infliximab de la sangre10,11. La administración repetida de infliximab a una dosis de 1 mg/kg se asocia con una pérdida rápida de la respuesta terapéutica y aceleración del aclaramiento sanguíneo10. Sin embargo, este estudio también ha demostrado la sinergia de infliximab combinado con MTX (fig. 1), que se explica en parte por la menor incidencia de anticuerpos antiinfliximab observada con el tratamiento combinado. Estos datos indican que los anticuerpos actúan sobre los mecanismos efectores y, al parecer, no intervienen contra los acontecimientos primarios del proceso patológico. En vista del porcentaje de pacientes que evidencian una respuesta inicial al infliximab (60-70%), es probable que en la población de pacientes que no responden el TNF-α no sea una molécula esencial en la regulación de la red de citocinas en ese momento de la evolución patológica. Esta conclusión se deriva de la correlación documentada entre la buena respuesta clínica a infliximab y un nivel significativo de expresión de TNF-α en la biopsia sinovial antes del tratamiento18.
Figura 1. Eficacia, aspectos farmacocinéticos y producción de anticuerpos en el tratamiento con infliximab. Eficacia del tratamiento con infliximab, basado en criterios de respuesta de Paulus 20%, en monoterapia (1A) y en combinación con metotrexato (1B). Infliximab 1 mg/kg ( ○), infliximab 3 mg/kg (◊), infliximab 10 mg/kg ( Δ) y placebo más metotrexato ( ¿ ) Las flechas indican los tiempos de infusión de infliximab y placebo. Farmacocinética del infliximab (1C) en monoterapia (símbolos en blanco) y en combinación con metotrexato (símbolos en negro). (1D) Incidencia de anticuerpos antiinfliximab en monoterapia (símbolos blancos) y en combinación con metotrexato (símbolos negros). Datos adaptados de Maini RN, et al10.
Funciones del infliximab en la regulación de citocinas implicadas en la inflamación reumatoide
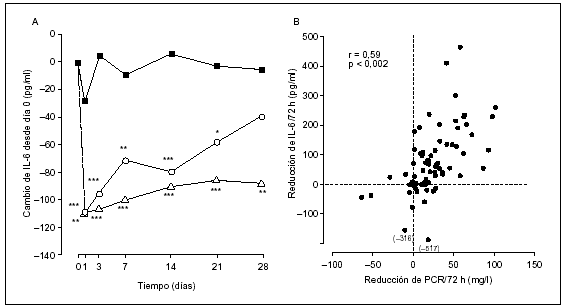
En nuestro primero estudio, tras la administración de infliximab, se observaron reducciones simultáneas en las concentraciones sanguíneas de proteína C reactiva e IL-67. Esta correlación y la rápida reducción (horas) en las concentraciones séricas de IL-6 en pacientes tratados con infliximab, pero no en los que recibieron placebo, fue confirmada en un estudio posterior (fig. 2)19. La producción por los hepatocitos de proteína C reactiva se regula sobre todo por la IL-6, por tanto, estas observaciones apoyan la conclusión de que la regulación inhibidora de la producción de IL-6 en articulaciones afectadas por la AR se debe al bloqueo del TNF-α. El papel dominante del TNF-α en la regulación de IL-6 en AR, demostrado in vivo, coincide con los datos obtenidos acerca de la menor producción de IL-6 tras añadir anticuerpos anti-TNF-α a cultivos celulares in vitro de membrana sinovial afectada por AR20. La reducción en la síntesis de IL-1 por el tejido sinovial al agregar anticuerpo anti-TNF-α in vitro fue la observación que sugirió a investigadores la posible participación de una cascada de citocinas en la AR21. Sin embargo, ha sido más difícil verificar estas observaciones in vivo. La cuantificación de la IL-1α y la IL-1β inmunorreactivas por análisis de imágenes histológicas del sinovio antes de administrar infliximab, y 2 semanas después ha mostrado una reducción en la síntesis de IL-1, que confirma su relación con el TNF-α18. La evolución de los niveles séricos de IL-1 con distintos análisis ha obtenido resultados discrepantes19,22, en todo caso, los niveles séricos de esta citocina son muy bajos y difíciles de detectar en el laboratorio, lo que sugiere la necesidad de estudios locales (tisulares) para evaluar el comportamiento de esta citocina.
Figura 2. Influencia de una única infusión de infliximab sobre las concentraciones séricas de IL-6 (2A), y la correlación de éstos con los niveles séricos de proteína C reactiva (PCR) valorados a las 72 h de la infusión de infliximab (2B). Infliximab 1mg/kg ( ○), infliximab 10 mg/kg ( Δ), y placebo ( ¿ ). Infliximab frente a placebo: *p < 0,05, **p < 0,01, ***p < 0,001 frente a placebo. Datos obtenidos de Charles P, et al19.
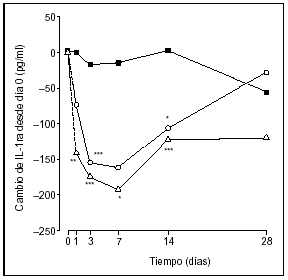
Después del tratamiento con infliximab, la observación de una reducción en las concentraciones séricas del antagonista del receptor de la IL1 (IL-1ra) y los receptores TNF solubles también ha proporcionado evidencias de la regulación de dos anticitocinas importantes por el TNF-α (fig. 3)19. La reducción simultánea en las moléculas pro y antiinflamatorias es un ejemplo interesante del predominio de TNF-α en la red de citocinas y una posible explicación de porqué el tratamiento anti-TNF-α no produce una remisión duradera, sino la persistencia del desequilibrio entre las citocinas. En consecuencia, la enfermedad recidiva al interrumpir el tratamiento.
Figura 3. Efecto de una única infusión de infliximab en los niveles circulantes de IL-1ra. Infliximab 1mg/kg ( ○), infliximab 10 mg/kg ( Δ) y placebo ( ¿ ). Infliximab frente a placebo: *p < 0,05, **p < 0,01, ***p < 0,00. Datos obtenidos de Charles P, et al19.
Funciones del infliximab en el reclutamiento celular en la sinovial reumatoide
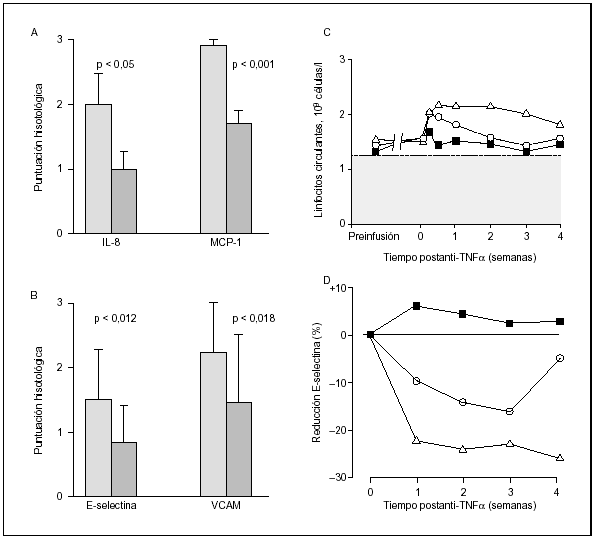
Se ha demostrado en un estudio temprano que la reducción notable en la hinchazón y dolor a la palpación de las articulaciones con el tratamiento con infliximab se asocia con una reducción en la celularidad sinovial de pacientes con AR23. En un análisis inmunohistológico detallado de biopsias tomadas antes y después de administrar infliximab, se ha observado que la reducción en las células CD3+ y CD68+ se acompaña de una reducción en las moléculas de adhesión celular vascular 1 e intercelular 1 y en la E-selectina24. Las concentraciones sanguíneas de E-selectina soluble y molécula de adhesión intercelular 1 soluble disminuyeron en un grado similar con infliximab, pero no con el placebo. Esta reducción evidencia una estrecha correlación con el aumento de los linfocitos circulantes25. En otros estudios se ha observado que la expresión de las quimiocinas IL-8 y proteína quimiotáctica monocítica 1 también disminuye a las 2 semanas en las biopsias sinoviales obtenidas después del tratamiento con infliximab (fig. 4)24,26. Estos datos indican que el tratamiento anti-TNF-α regula la expresión de las moléculas de adhesión y quimiocinas en los vasos afectados por la AR. Esto ha conducido a la hipótesis de que la inversión de la retención y migración de leucocitos circulantes a las articulaciones inflamadas por la AR podría ser un mecanismo de acción importante.
Figura 4. Valoración histológica en biopsias sinoviales de rodillas (4A y 4B), recuento de linfocitos circulantes (4C), y expresión de las quimiocinas y moléculas de adhesión (4D), antes y después de una única infusión de infliximab. Barra gris: pretratamiento con infliximab; barra sombreada: postratamiento. Infliximab 10 mg/kg ( Δ), infliximab 1 mg/kg ( ○) y placebo más metotrexato ( ¿ ). 4A: Datos obtenidos de Taylor PC, et al26. 4B: Datos obtenidos de Tak PP, et al24. 4C y D: Adaptación autorizada por Paleolog EM, et al25.
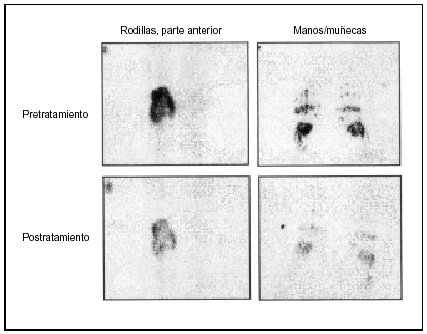
Se ha obtenido evidencia de una reducción en el reclutamiento articular de leucocitos a través de gammagrafías de polimorfonucleares marcadas con 111indio en las manos y las rodillas de pacientes con AR antes y después del tratamiento con infliximab (fig. 5)26. Como la enfermedad inflamatoria depende de la llegada de leucocitos, es probable que esta reducción en su movimiento sea otro factor importante en el mecanismo de acción del infliximab.
Figura 5. Gammagrafía isotópica con leucocitos marcados con 111Indio. Imágenes de manos y rodillas pre y postratamiento (22 h después) con infliximab en dosis única de 10 mg/kg. Datos obtenidos de Taylor PC, et al26.
Funciones de infliximab en la regulación de la angiogénesis en la sinovial reumatoide
Desde las primeras etapas de la enfermedad, la inflamación reumatoide del sinovio se acompaña por una angiogénesis muy intensa. La mayor densidad vascular abre un camino para un aumento en el tráfico hemático de células inmunes e inflamatorias a las articulaciones. Este aumento conduce a la formación del pannus vascular que invade y destruye el cartílago y hueso en la "zona desnuda" donde se une el sinovio al hueso subcondral.
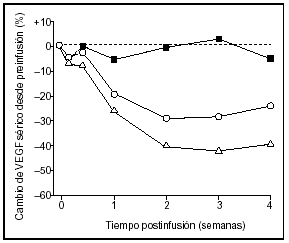
El factor de crecimiento endotelial vascular (VEGF) es una citocina específica implicada en la neoformación vascular que está aumentada en las articulaciones y sangre de pacientes con AR25,27,28. El tratamiento con infliximab reduce los niveles circulantes de VEGF y la densidad de la neovascularización sinovial25,29 (fig. 6)25. En este sentido, existen evidencias directas de una reducción en el número de vasos sanguíneos en pacientes tratados con infliximab. Esta disminución de la angiogénesis puede ser relevante para entender los efectos antiinflamatorios y antidestructivos del infliximab. Por otro lado, aunque no haya sido confirmado, la exudación de plasma mediada por el VEGF también parece reducirse con infliximab.
Figura 6. Niveles séricos del factor de crecimiento endotelial vascular (VEGF) en pacientes con AR al inicio y tras la administración de una única dosis de infliximab. Infliximab 1 mg/kg ( ○), infliximab 10 mg/kg ( Δ) y placebo más metotrexato ( ¿ ). Datos obtenidos de Paleolog EM, et al25.
Utilidad del infliximab en la prevención de la destrucción cartilaginosa y ósea
Los datos más evidentes de la capacidad de la terapia anti-TNF-α para prevenir la destrucción cartilaginosa y ósea (erosiones óseas) se han obtenido a través del estudio histológico de las articulaciones en modelos de artritis inducida por colágeno en el ratón6. En este modelo, la conservación de los condrocitos y la matriz cartilaginosa y la ausencia de invasión ósea por el pannus fueron rasgos notables de la respuesta al tratamiento con infliximab. En los pacientes con AR incluidos en el ensayo ATTRACT (13) se ha observado un efecto protector del cartílago y hueso (incluso un posible efecto reparador) al comparar las radiografías de las manos y los pies realizadas en situación basal y a 54 semanas en pacientes tratados con infliximab12,25. Asimismo, el etanercept en monoterapia durante 1 año reduce significativamente la progresión de las erosiones óseas en pacientes con AR temprana comparado con MTX30. Todos estos datos apoyan claramente la capacidad de la terapia anti-TNF en la prevención de la destrucción cartilaginosa y ósea, y además sugieren que los mecanismos de destrucción tisular en la AR están influenciados por el TNF-α. Sin embargo, queda aún por establecer de forma definitiva si la asociación de MTX a las terapias anti-TNF contribuye a potenciar esta acción protectora tisular. Por otra parte, se ha documentado una reducción en las metaloproteasas matriciales 1 y 3 tras el tratamiento con infliximab. Aunque no se conocen bien los fundamentos celulares y moleculares del efecto específico del anti-TNF-α en este caso, los datos sugieren una implicación de esta terapia en una regulación inhibidora de las enzimas que actúan sobre la matriz31.
En modelos animales, la IL-1 parece tener un papel importante en la destrucción del cartílago y se ha propuesto que ésta quizá sea una mejor diana terapéutica en la AR. Por otro lado, el efecto protector en la articulación del tratamiento con anti-TNF-α sugiere que con este tratamiento se produce una regulación de la producción de IL-132,33. La activación y función de los osteoclastos parece involucrar a la IL-1 y TNF-α, además del activador de los receptores del ligando NFκB (RANKL), también conocido como la citocina relacionada con TNF inducida por activación (TRANCE), y la interacción de RANKL con RANK34,35. Aunque hacen falta más estudios para dilucidar la importancia relativa de estos mecanismos.
Conclusión
El tratamiento de la AR con infliximab ha iluminado las diversas vías que se regulan por el TNF-α y su mecanismo de acción. Estos estudios han logrado empezar a desenredar estas vías celulares complejas y citocina-dependientes, y ofrecen una nueva perspectiva para el tratamiento de la AR. Las lecciones que hemos aprendido ayudarán sin duda a orientar las investigaciones futuras encaminadas a desarrollar la próxima generación de fármacos antirreumáticos, más eficaces y seguros.
Agradecimientos
Queremos agradecer al Arthritis Research Council por su apoyo a nuestro trabajo a través de subvenciones al The Kennedy Institute of Rheumatology. También agradecemos a Centocor, Inc por proporcionar un apoyo adicional a los estudios clínicos de infliximab.