Caso clínico
Varón de 63 años de edad, con antecedentes de meningioma parietal derecho y ameloblastoma maxilar izquierdo que consultó por tumefacción difusa y dolor abarticular en antebrazos, brazos y piernas. Los síntomas se habían iniciado de forma rápidamente progresiva 10 meses antes y provocaban una limitación significativa de la movilidad de codos, muñecas y tobillos. No existían antecedentes de fotosensibilidad, fenómeno de Raynaud o enfermedades de interés entre los familiares.
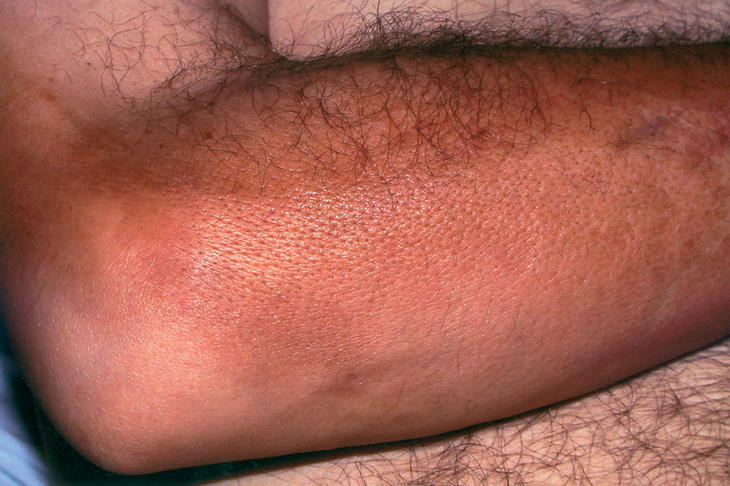
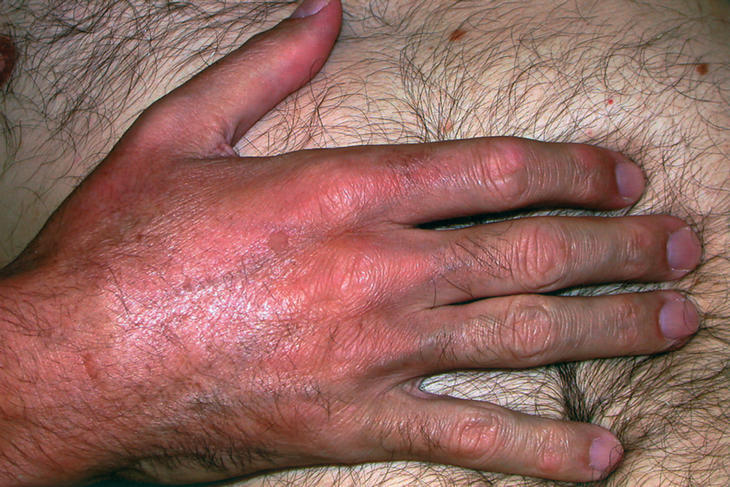
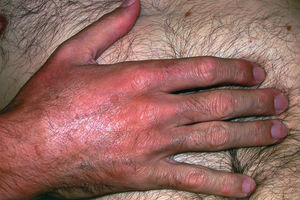
La exploración física puso de manifiesto un extenso hundimiento en la región parietal derecha, resultante de la craniectomía, así como una deformidad facial izquierda, secundaria a la resección parcial del maxilar superior izquierdo. En la región frontal derecha se observaba una lesión hiperqueratósica de 1 cm de diámetro compatible con carcinoma basocelular. La piel de brazos, antebrazos, piernas y tercio inferior de los muslos estaba notablemente engrosada, con aspecto de «piel de naranja» y con depresiones lineales coincidentes con los planos musculares y las venas superficiales. La presión y la palpación profunda de la piel era dolorosa y, al pellizcarla entre los dedos, se formaban pliegues superficiales, pero resultaba imposible desplazarla sobre los planos profundos (fig. 1). En los dedos de las manos y pies, la piel tenía una consistencia elástica y formaba los pliegues normales sobre las articulaciones metacarpofalángicas, metatarsofalángicas e interfalángicas, cuya movilidad era normal e indolora (fig. 2). La extensión de los codos y las rodillas estaba restringida por la induración subcutánea. No se palpaba engrosamiento sinovial ni había signos de sinovitis o derrame en ninguna de las articulaciones periféricas. En la exploración neurológica destacaba una paraparesia izquierda con amiotrofia de todos los grupos musculares (fuerza proximal y distal, 3/5) interpretada como secuela de la intervención neuroquirúrgica. El resto de la exploración física fue normal.
Figura 1. Piel del antebrazo del paciente con aspecto de «cáscara de naranja».
Figura 2. Pliegues normales de la piel sobre las articulaciones interfalángicas y metacarpofalángicas (las manos no estaban afectadas por el proceso).
En las pruebas de laboratorio, el hemograma demostró una leve anemia normocrómica normocítica (hemoglobina, 112 g/l), 7,6 * 109 leucocitos/l con 12% de eosinófilos, elevación de la proteína C reactiva (30 mg/l) y de la VSG (32 mm durante la primera hora). Los ANA fueron positivos a título de 1/80. En el proteinograma se objetivó una hipergammaglobulinemia policlonal (22 g/l; valores normales hasta 15 g/l). Las cifras de IgG fueron de 340 mg/dl (valores normales hasta 240 mg/dl). Las siguientes determinaciones en suero fueron normales: glucosa, urea, creatinina, calcio, fósforo, cloro, sodio, potasio, transaminasas, fosfatasa alcalina, bilirrubina, triglicéridos, colesterol total, creatinincinasa, lactatodeshidrogenasa, albúmina y dosificación del complemento. La serología frente a Borrelia burgdorferi, el factor reumatoide (látex y Waaler-Rose), los anticuerpos anti-ADN, anti-ENA, anticentrómero, anti-ScL70 y antitiroideos fueron negativos.
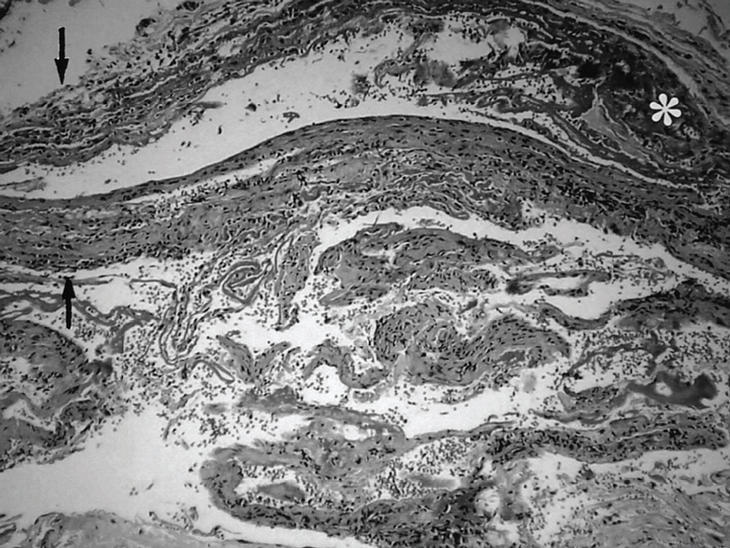
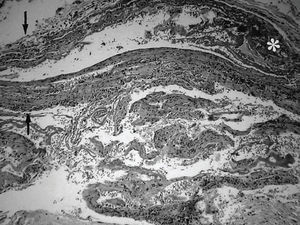
Se realizó una biopsia quirúrgica profunda que incluyó piel y músculo. Su estudio histológico evidenció abundantes infiltrados inflamatorios con eosinófilos, linfocitos y monocitos localizados en la dermis reticular, septos interlobulares de la hipodermis y, sobre todo, en la fascia superficial. Esta última presentaba un acentuado engrosamiento, así como áreas de necrosis y fibrosis que se adentraban en el perimisio. La dermis superficial y la epidermis no presentaron alteraciones. No hubo signos de vasculitis ni se identificaron depósitos cálcicos (fig. 3). La exéresis de la lesión hiperqueratósica frontal derecha confirmó el diagnóstico preliminar de carcinoma basocelular.
Figura 3. Detalle histológico de la biopsia del paciente en el que puede apreciarse el marcado engrosamiento facial (flechas) y áreas de necrosis con depósitos de material eosinofílico (asterisco) (HE × 80). (Cortesía del Dr. I. Antón Badiola, servicio de Anatomía Patológica.)
Diagnóstico
Fascitis eosinofílica.
Discusión
La fascitis eosinofílica fue descrita inicialmente en 1974, por el Dr. Laurence E. Shulman1, durante el VI Congreso Panamericano de Reumatología (Toronto). Se caracteriza histológicamente por la presencia de infiltrados inflamatorios mixtos en las fascias musculares, que se extienden hacia la hipodermis y que evolucionan hacia una fibrosis parcheada2-4. La esclerosis resultante hace que las fascias lleguen a alcanzar 15 veces su espesor normal4 y se adhieran tanto al perimisio como a la hipodermis3,4,6. La afección de la dermis reticular es de escasa intensidad, mientras la dermis superficial y la epidermis suelen respetarse2-5.
La expresión clínica de las alteraciones anatomopatológicas mencionadas consiste en una primera fase de tumefacción dolorosa en las extremidades involucradas. Las lesiones de la fascitis eosinofílica tienden a la simetría, con predilección por las extremidades superiores, sobre todo antebrazos y brazos, aunque puede producirse afección unilateral. Habitualmente, las manos, los pies, el cuello y la región facial quedan libres2-6. Durante las fases iniciales, la inspección permite apreciar un relieve abollonado de la piel, con acentuación de las depresiones correspondientes a los folículos pilosebáceos, lo que produce el típico aspecto de «piel de naranja». A diferencia de la esclerosis sistémica, la piel puede pellizcarse4. Durante el curso clínico, algunas venas van quedando fijadas en profundidad por la fibrosis y marcan depresiones lineales en la piel, a modo de canales. La presión, la palpación profunda y los movimientos de las articulaciones provocan dolor. Conforme avanza el proceso y se produce fibrosis, la piel se adhiere más a la fascia y al músculo subyacente4,6,7, limitando de modo indirecto los movimientos de las articulaciones. No es infrecuente la aparición de un síndrome del túnel carpiano. Frente a la esclerosis sistémica, el fenómeno de Raynaud8 y la afección visceral son raras4,6. Ocasionalmente, se han descrito artritis, tendosinovitis y miositis9, afección pleuropulmonar10 o renal11.
La fascitis eosinofílica puede presentarse a cualquier edad. En adultos afecta de forma similar a ambos sexos12, y aunque se desconoce su verdadera incidencia, se describen dos picos situados en la segunda y quinta décadas de la vida4.
Durante las fases activas de la enfermedad y en cerca del 80% de los pacientes, se aprecia eosinofilia periférica e hipergammaglobulinemia, sobre todo a expensas de la IgG. La eosinofilia periférica, que puede desaparecer en períodos de inactividad, no siempre se acompaña de infiltración tisular por eosinófilos4,6. El incremento de los reactantes de fase es habitual, aunque inespecífico y, excepto en casos aislados, no se detectan autoanticuerpos6,13. Algunos autores consideran que la concentración sérica de aldolasa puede constituir un buen indicador de la actividad de la fascitis eosinofílica14.
No existen criterios consensuados para el diagnóstico, que se establece sobre la base de las manifestaciones clínicas y los hallazgos histológicos, siendo fundamental que la biopsia incluya todas las capas de la piel, fascia y músculo2,4,6. En la determinación de la extensión del proceso pueden resultar de ayuda diversas técnicas de diagnóstico por la imagen, incluida la gammagrafía15 y la resonancia magnética16. Esta última también puede contribuir a precisar el mejor lugar para realizar la biopsia. El principal diagnóstico diferencial se establece respecto a las formas cutáneas de la esclerosis sistémica, otros síndromes esclerodermiformes y algunas paniculitis, como la lúpica4.
La etiopatogenia de la fascitis eosinofílica sigue sin establecerse todavía. En un principio se concedió especial importancia a los esfuerzos físicos como desencadenantes de la enfermedad, pues se presentaban casi en la mitad de los enfermos. Sin embargo, se han ido aportando nuevos factores potencialmente implicados en su desarrollo, incluyendo disolventes orgánicos17, derivados del L-triptófano18 o algunos fármacos19, e incluso se han referido fascitits asociadas a eosinofilia provocados por Borrelia burgdorferi20. Diversos estudios han demostrado un aumento significativo del factor transformador del crecimiento celular beta (TGF-ß1) y del ARNm del procolágeno tipo I en la piel de pacientes afectados. Mediante técnicas de hibridación in situ, se ha demostrado que la mayoría de los fibroblastos que expresan activamente los genes del procolágeno tipo I están situados en la fascia, la hipodermis y la dermis profunda21,22. Además, se ha descrito su asociación con procesos neoplásicos23-25 e incluso la progresión hacia una verdadera esclerosis sistémica26. En el paciente descrito se habían desarrollado consecutivamente tres tumores de origen ectodérmico: un meningioma, un ameloblastoma y un carcinoma basocelular. No hemos hallado referencias en la bibliografía respecto a una potencial asociación entre tumores ectodérmicos y fascitis eosinofílica, por lo que consideramos que constituyó un hecho casual.
Aunque existen algunos casos autolimitados, la administración de glucocorticoides (0,5-1 mg/kg/día), sobre todo en fases precoces, acelera la normalización de los parámetros de laboratorio y la mayoría de las manifestaciones cutáneas4,6. La induración subcutánea se resuelve con mayor lentitud y de forma incompleta. Los antipalúdicos de síntesis también han demostrado cierta eficacia en los períodos iniciales de la enfermedad4; en cambio, los antiinflamatorios no esteroides tienen una utilidad discutida. Adicionalmente, se han utilizado cimetidina, metotrexato, D-penicilamina y colquicina, pero el escaso número de pacientes tratados no permite extraer conclusiones sobre la eficacia de dichos tratamientos.
Correspondencia: Dr. N. Gómez Rodríguez. Unidad de Reumatología. Colón-28 Clínica.Colón, 28, 1.o 36201 Vigo. España.
Manuscrito recibido el 18-11-2002 y aceptado el 4-2-2003.