Introducción
La artrosis es una enfermedad degenerativa de las articulaciones que se caracteriza por presentar una degradación progresiva del cartílago articular, acompañada de cambios tisulares del hueso y de la sinovia1-3. Esta patología repercute en forma importante en nuestra sociedad y es frecuente en la práctica cotidiana del reumatólogo4-6. Su tratamiento médico es controvertido y constituye un problema para el clínico7.
El tratamiento médico de la artrosis habitualmente se fundamenta en la combinación de analgésicos y antiinflamatorios no esteroides (AINE), a los que se une con frecuencia la instilación de esteroides intraarticulares. Desde hace unos años se vienen empleando los denominados "condroprotectores", entre los que se encuentran diversos constituyentes de la sustancia fundamental del cartílago, como es el condroitin sulfato, y del líquido sinovial, como es el hialuronato de sodio5,8-10.
En condiciones normales, el condrocito sintetiza los elementos de la sustancia fundamental que la rodea y mantiene un balance entre la síntesis y la degradación del tejido cartilaginoso. Diversos factores son capaces de romper este equilibrio en favor de un aumento del metabolismo del tejido cartilaginoso que conduce al inicio de la lesión artrósica11-14.
Los osteófitos marginales constituyen el segundo elemento histológico característico que aparece en la artrosis. El hueso subcondral de debajo de la lesión cartilaginosa reacciona aumentando su densidad, hallazgo que es interpretado por la mayoría de autores como una reacción defensiva para intentar detener la progresión de la enfermedad3,11,13.
El hiyaluronato de sodio es un polímero de la familia de los glucosaminoglicanos, integrante importante de la matriz extracelular del cartílago hialino. Su presencia en el líquido sinovial proporciona la viscosidad que permite a la articulación el movimiento, disminuyendo al mínimo las fricciones. Su administración en forma intraarticular (terapia de viscosuplementación) en el caso de las artrosis tiende a mejorar la función de la articulación aumentando la viscosidad del líquido sinovial. Algunos autores consideran, además, que interviene en los procesos de reparación tisular del cartílago articular retrasando la aparición de la lesión artrósica.
Se trata de una molécula que ha sido objeto de varios trabajos de investigación tanto experimentales como en pacientes. Los resultados obtenidos han sido variables, pero con un predominio de los positivos, especialmente en los estudios experimentales. Los efectos benéficos suelen iniciarse entre dos y 4 semanas a partir de la primera inyección, y su acción puede permanecer hasta un año8,15-17. Aunque la mayoría de estudios con hialuronato son experimentales, los modelos experimentales de artrosis en el animal, y específicamente el modelo de la meniscectomía parcial en el conejo, han demostrado reproducir los elementos histológicos de manera similar a los encontrados en el ser humano18-26.
La microscopía electrónica de barrido y la espectroscopia de rayos X por dispersión de energía más conocido como microanálisis, son los métodos empleados desde hace varios años para analizar muestras de diferentes materiales, incluyendo tejidos biológicos. Estas técnicas tienen la capacidad de detectar y medir la presencia de elementos como iones y electrólitos que constituyen una fracción de masa local del tejido en términos relativos al mismo microvolumen27,28. En este sentido, puede tener un gran valor en el estudio de los cambios histopatológicos de los tejidos de las articulaciones artrósicas, y muy especialmente en el tejido óseo subcondral.
El objetivo de este trabajo fue estudiar los efectos del hialuronato de sodio por vía intraarticular en un modelo de artrosis experimental en conejos mediante parámetros macroscópicos, microscópicos y de microscopía electrónica de barrido.
Material y método
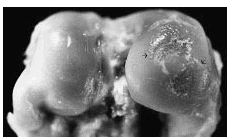
Para este experimento se utilizaron 45 conejos hembras de raza Nueva Zelanda con un peso de entre 2 a 2,50 kg. Los conejos se mantuvieron en las mismas condiciones de alimentación y de medio ambiente, y se dividieron en 4 grupos de 10 animales. A todos ellos se les practicó una artrosis experimental según la técnica descrita por Moskowitz et al25. El estudio incluyó también un grupo de cinco conejos, no operados y sin tratamiento, que constituyó el grupo de controles sanos (fig 1).
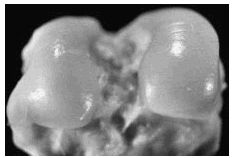
Figura 1. Control sano correspondiente a los cóndilos femorales. Se aprecia indemnidad de la superficie del cartílago, coloración blanquecina y brillante.
El modelo de artrosis experimental siguiendo la técnica de Moskowitz consistio en: después de anestesiar a los conejos con 1,5 ml de ketamina intramuscular, se procedió a aplicar las medidas de asepsia y antisepsia. Seguidamente se les practicó una incisión pararrotuliana interna hasta identificar los meniscos internos de cada rodilla, y se realizó la meniscectomía de aproximadamente el 30% del menisco total. Se suturó por planos y se sometió a observación durante el período de recuperación.
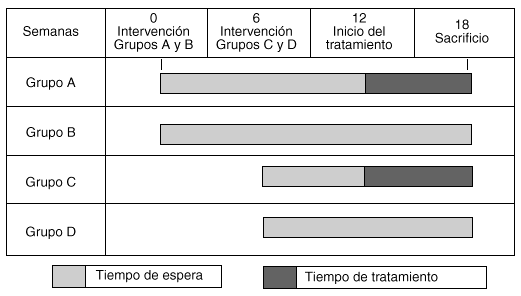
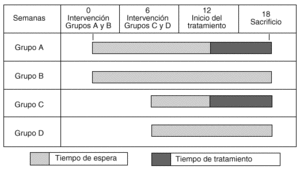
Los cuatro grupos a los que se les practicó una artrosis experimental fueron denominados grupo A, tratado tardíamente (entre las 12 y 18 semanas); grupo B, no tratado (control del grupo A); grupo C, tratado tempranamente (entre las semanas 6 y 12), y grupo D, no tratado (control del grupo C) (gráfico 1).
Se denominó tratamiento temprano al recibido por el animal antes de establecerse la lesión artrósica (a partir de la sexta semana) y tratamiento tardío al recibido después de la semana 12, cuando la lesión artrósica está bien establecida.
El grupo A recibió tratamiento tardío con hialuronato de sodio, Orthosvic® (2.000.000 Da de PM), 300 μl intraarticular una vez por semana, durante seis semanas desde la duodécima semana de la meniscectomía hasta la semana 18, cantidad razonable considerando la capacidad y el tamaño de la articulación. Al grupo C se le administró el mismo tratamiento desde la sexta hasta la duodécima semana. Los grupos B y D fueron sometidos a la meniscectomía, sin recibir tratamiento y representaron los controles de los grupos A y C, respectivamente (tabla 1).
Los animales fueron sacrificados por sobredosis intramuscular de ketamina; los grupos A y B a las 18 semanas, y los grupos C y D a las 12 semanas.
Estudio macroscópico
Las articulaciones de las rodillas fueron expuestas y luego se tomó el extremo distal de cada fémur. Se realizó una limpieza de las piezas anatómicas, se procedió a efectuar una valoración de las úlceras en el cartílago, según la extensión y la profundidad. Además, se valoraron la aparición y extensión de los osteófitos marginales. Las lesiones fueron registradas y dibujadas por tres observadores a ciegas, mediante la transcripción y representación de la lesión, en un diseño gráfico sobre papel, para luego ser recortadas y pesadas; de esta manera se determinó la proporción relativa del tamaño de la lesión y se midió indirectamente el deterioro de las capas superficiales con relación al resto de la pieza anatómica.
Estudio microscópico
Las muestras se fijaron en una solución de formol al 10% con tampón PBS a un pH de 7,2 durante 10 días. Luego se descalcificaron con ácido nítrico al 5% hasta obtener una textura lo suficientemente blanda como para cortar la pieza fácilmente. Con posterioridad se incluyeron en parafina, luego se procedió a deshidratar con soluciones de alcohol a concentraciones ascendentes y por último se realizaron cortes de 5 a 7 μde espesor, que fueron montados en láminas desparafinadas y rehidratadas, las cuales se colorearon con hematoxilina-eosina y se visualizaron en un microscopio Polyvar Reichert-Jung de alta resolución. En la interpretación de los hallazgos microscópicos, no se utilizó ninguna escala de valoración microscópica porque consideramos que este método puede reflejar una alta variabilidad según el sitio del corte histológico.
Grafico 1. Esquema de administración de tratamiento por grupos.
Simplemente se procedió a anotar los cambios microscópicos observados en el tejido cartilaginoso.
Estudio de microscopia electrónica de barrido
Los extremos distales del fémur fueron reducidos progresivamente con una lima tanto en su región anterior como en la posterior tratando de preservar el punto medio hasta un espesor de aproximadamente 4 a 5 mm. Se lavaron con agua destilada y se secaron con aire comprimido para eliminar los residuos contaminantes de tamaño considerable procedentes de la reducción de las piezas anatómicas. Luego se sumergieron en acetona durante varias horas y se sometieron durante varios minutos a ultrasonido para eliminar los restos de menor tamaño. Se colocaron en un evaporador de alto vacío para ser cubiertos con grafito y proceder a la determinación relativa del calcio mediante un equipo de espectroscopia de rayos X por dispersión de energía (EDX), marca Kevex modelo Delta-3, acoplado a un microscopio electrónico de barrido (SEM) marca Hitachi modelo S-2500. Las zonas analizadas fueron las siguientes: punto medio del cartílago articular, línea subcondral calcificada y hueso trabecular. El estudio consiste en emitir un haz de rayos X contra la superficie de la muestra examinada; éste es a su vez reflejado de forma dispersa, dependiendo de la constitución de los elementos del material estudiado, pasando posteriormente a través de una ventana de berilio a un detector especial en condición de vacío y a baja temperatura con nitrógeno líquido. Los rayos pasan luego a un amplificador de señal, y todo ello es procesado con un analizador multicanal y con la ayuda de ordenadores.
Resultados
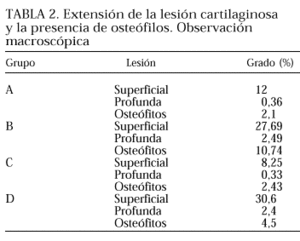
En la tabla 2 se exponen los resultados de la observación macroscópica. En todos los parámetros analizados, los conejos de los grupos B y D (figs. 4 y 5) presentaron unas lesiones condrales más extensas que los de los grupos que recibieron tratamiento, A y C (figs. 2 y 3). Esta reducción de la lesión condral en los grupos tratados apoya el efecto benéfico sobre la lesión artrósica de la administración del hialuronato de sodio por vía intraarticular tanto en la fase inicial como en la tardía, si bien su administración temprana es claramente más efectiva (menor lesión condral en el grupo C respecto al grupo A).
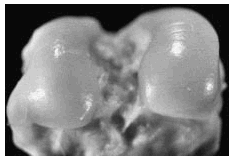
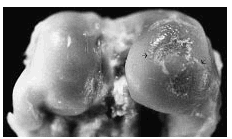
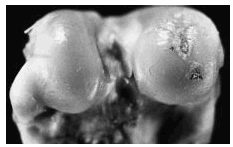
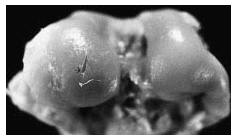
Figura 2. Grupo A, tratamiento tardío. Lesión ulcerativa de poca profundidad (flecha) en el centro del cóndilo interno, rodeada de cartílago opaco con fibrilación superficial.
Figura 3. Grupo C, tratamiento temprano. Se observa ulceración poco extensa, superficial, así como algunas irregularidades dadas por la fibrilación superficial (flecha).
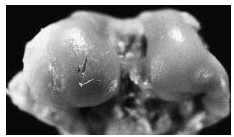
Figura 4. Grupo B, control del grupo A. Se observa úlcera extensa y profunda en el área del cóndilo interno, con exposición del hueso subcondral (flecha).
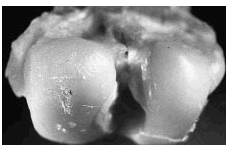
Figura 5. Grupo D, control del grupo C. Se aprecia lesión ulcerativa más extensa y profunda, hasta exponer el hueso subcondral (flecha) y otra lesión adyacente de menor tamaño de profundidad similar, ambas rodeadas de cartílago opaco fibrilado.
Obsérvese que los conejos del grupo B (fig. 4), que permanecieron más tiempo con la artrosis al sacrificarse a la semana 18, desarrollaron osteófitos de mayor tamaño que los del grupo D (fig. 5), sacrificados a la semana 12; estos datos indican que el tiempo de evolución de la artrosis es importante para la aparición y el tamaño de los osteófitos. Por otra parte, la profundidad y extensión de la lesión condral en ambos grupos fue similar (tabla 2).
Finalmente, cabe destacar que el tamaño de los osteófitos fue similar en los conejos de los grupos A y C, lo que apunta a que las lesiones osteofíticas presentan una notable tendencia al crecimiento en las últimas 18 semanas, tal como sucede también en el grupo B.
El estudio microscópico en términos generales nos permitió corroborar la valoración macroscópica, objetivando un deterioro importante de la superficie del cartílago articular, con presencia de solución de continuidad, fibrilación superficial y ulceraciones profundas y extensas de claro predominio en los conejos de los grupos B y D con respecto a los de los A y C, que recibieron tratamiento (datos no expuestos).
El análisis por microscopia electrónica de barrido evidenció en todos los casos una disminución del grosor del cartílago con irregularidad de la superficie articular (figs. 6-10).
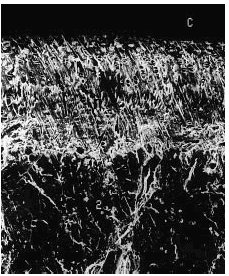
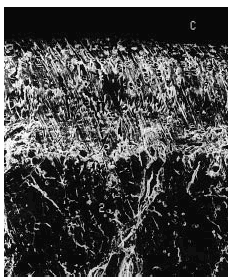
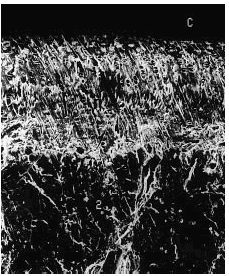
Figura 6. Grupo control sano. Se observa indemnidad de la superficie del cartílago, con buen espesor (1). Se aprecian la línea subcondral calcificada (punta de flecha) y el área del hueso subcondral (2). Microscopio de barrido aumento ´340.
Figura 7. Grupo A, tratamiento tardío. Cartílago del mismo espesor, con discreta irregularidad en la superficie. La línea subcondral (punta de flecha) presenta mayor densidad y no se observan cambios óseos. Microscopio de barrido aumento ´340.
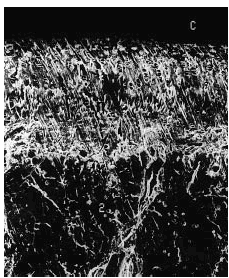
Figura 8. Grupo B, control grupo A. Superficie del cartílago muy irregular, fibrilaciones profundas y espesor disminuido. Microscopio de barrido aumento ´340.
Figura 9. Grupo C, tratamiento temprano. Obsérvese discreta irregularidad de la superficie articular. Se conserva buen espesor del cartílago. Aumento de la densidad del hueso subcondral (punta de flecha). Microscopio de barrido aumento ´340.
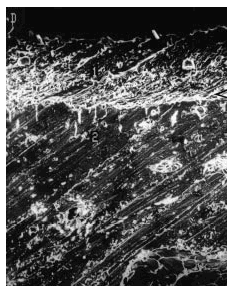
Figura 10. Grupo D, control grupo C. Franca disminución del espesor del cartílago. Presencia de irregularidad en el cartílago restante. Microscopio de barrido aumento ´340.
Las concentraciones relativas de calcio en el cartílago articular y en el hueso fueron similares en todos los grupos de conejos analizados y similares al grupo control sano (sin menisectomía). Sin embargo, los valores de calcio relativo en el hueso subcondral fueron significativamente más altos en los grupos B (47,28%) y D (49,41%) que en los grupos A (28,52%) y C (39,21%), tratados con hialuronato sódico. En estos dos últimos grupos los valores fueron además muy similares a los obtenidos en el grupo control sano (30,84%).
Discusión
En este estudio se pone de manifiesto que la administración del hialuronato de sodio intraarticular disminuye o retrasa la aparición de las lesiones típicas que se presentan en un modelo de artrosis experimental en conejos. En este sentido, la extensión y profundidad de las úlceras en el cartílago articular en los grupos de animales que recibieron el medicamento fueron menores que los obtenidos en el grupo de conejos sin tratamiento. Además, la presencia y extensión de los osteófitos fue menor en aquellos grupos a los que se administró hialuronato de sodio.
El estudio se basa en un modelo de artrosis experimental, y aunque los datos obtenidos deben extrapolarse con cautela a la práctica clínica, los modelos experimentales nos han brindado la posibilidad de comprender mejor los cambios que ocurren en el condrocito y en la matriz extracelular, sobre todo en los estadios iniciales de la enfermedad, así como valorar las diferentes acciones terapéuticas.
La microscopia electrónica de barrido constituye una nueva herramienta que proporciona datos importantes para valorar y comparar las alteraciones que se producen en los tejidos involucrados en la artrosis. Además de la representación fotográfica, los análisis de las concentraciones relativas de elementos que forman parte constitucional de los tejidos, como el calcio, pueden dar idea del grado de compromiso o alteración de la fisiología tisular.
En este caso hemos determinado que existe un aumento de las concentraciones de calcio relativo en el hueso subcondral en las muestras de animales que fueron sometidos a la artrosis experimental; en mayor proporción en aquellos que no recibieron el tratamiento con hialuronato de sodio, comparados con los que sí lo recibieron, lo que indica un efecto benéfico de la administración intraarticular de hiyaluronato de sodio (tanto en fases iniciales como tardías) también en el tejido subcondral.
En resumen, podemos concluir que la administración intraarticular de hialuronato de sodio disminuye sensiblemente la extensión e intensidad de las lesiones articulares en un modelo experimental de artrosis, mejorando notablemente las lesiones producidas en el cartílago articular, disminuyendo el tamaño de los osteófitos marginales y reduciendo la densidad del hueso subcondral.
Agradecimiento
El Orthosvisc utilizado en este trabajo fue gentilmente suministrado por el Dr. D.T. Swann (Anika Reserch Inc., Woburn, Massachussets, EE.UU.)
Este trabajo fue realizado con el apoyo financiero del CDCHT de la Universidad de Los Andes, Mérida (Venezuela), a través del proyecto M-530-95. Conicit proyecto G-97000820.