Introducción
La artritis reumatoide (AR) es una enfermedad autoinmune crónica, ampliamente distribuida y clínicamente compleja. Las características de los pacientes, sus preferencias ante una determinada técnica o procedimiento y la expresión de la enfermedad pueden constituir una fuente importante de variabilidad en su tratamiento. El estudio sobre el manejo de la AR en España (emAR) ha supuesto una oportunidad única para conocer el tratamiento que se hace de la AR en nuestro país, pero también de estudiar si las características de los pacientes difieren de una comunidad autónoma a otra dentro del ámbito español. En este artículo describimos las características generales de los pacientes incluidos en el estudio emAR, la recogida global en la historia clínica de datos sociodemográficos, y analizamos la existencia de diferencias regionales en la expresión clínica de la enfermedad.
Pacientes, material y método
Unidad de estudio
La unidad de estudio fue las historias clínicas (HC) de individuos mayores de 16 años diagnosticados de AR atendidos en servicios de atención especializada de toda España. Se excluyeron las HC imposibles de localizar y las que no incluían la información necesaria.
Selección y tamaño de la muestra
Se realizó un muestreo estratificado por comunidad autónoma y bietápico por centro hospitalario y paciente. Se asignó un número de HC a cada comunidad autónoma proporcional a su población. Con el fin de que la muestra representase suficientemente a todo el territorio nacional, en aquellas comunidades autónomas en las que el número de HC asignado fue inferior a 25 en razón de su población, se les asignó este número mínimo de HC para revisar.
A continuación se obtuvo un listado de los centros hospitalarios existentes en cada comunidad autónoma a partir del Catálogo Nacional de Hospitales de 1996. Se excluyeron aquellos hospitales en los que no existían las especialidades de reumatología y medicina interna por considerar poco probable que hubiera un volumen suficiente de pacientes con AR. Se realizó una selección aleatoria de los centros dentro de cada comunidad autónoma de forma que su probabilidad de elección fuera proporcional al número de camas de cada centro (que se utilizó como variable subrogada de la población atendida). Se seleccionaron en cada comunidad autónoma tantos centros hospitalarios como para asegurar una población de AR atendida cinco veces superior al tamaño muestral asignado a cada comunidad autónoma. A continuación se contactó con los potenciales centros participantes mediante un modelo de carta estandarizado solicitando su participación en el estudio. En aquellos centros en los que no se obtuvo respuesta o en ella no se indicaban los motivos por los que rechazaban participar en el estudio, se contactó telefónicamente con el responsable del servicio con el fin de recabar su participación o aclarar los motivos de no participación. Los centros no participantes en el estudio fueron sustituidos por el centro inmediatamente posterior en la lista de aleatorización.
Se solicitó a los centros un listado de todos los pacientes diagnosticados de AR que hubieran sido atendidos durante los años 1997 y 1998, con independencia del número de contactos o si dichos contactos correspondieron a ingresos, consultas externas o interconsultas de otros servicios. Una vez recibidos todos los listados de una misma comunidad autónoma, se realizó un muestreo sistemático con el que se obtuvo la población a estudio para cada comunidad. El último centro elegido únicamente aportó los pacientes necesarios para completar el tamaño muestral de la comunidad autónoma, es decir, la diferencia entre el número de pacientes previstos y el conseguido con el hospital anteriormente seleccionado. Las HC que, una vez revisadas, no correspondían a pacientes diagnosticados de AR fueron sustituidas dentro de cada centro por la siguiente HC dentro de la lista de aleatorización. Las no localizables o incompletas no fueron sustituidas (se consideró que hasta un 30% de las HC no podrían ser resumidas por este motivo, por lo que dichas pérdidas ya estaban contempladas en el tamaño muestral).
El número total de pacientes con AR aportados por los centros en sus listados y sobre los que se realizó la aleatorización fue de 9.299. Considerando una precisión del 5%, un error alfa de un 5% y un efecto diseño de 3, se consideró una muestra mínima de 1.085 HC que, asumiendo un 15% no localizables y un 15% incompletas, implicó la aleatorización de 1.550 en todo el territorio nacional. De éstas, 53 no fueron resumidas por corresponder a comunidades autónomas que finalmente no participaron en el estudio por diferentes motivos (Murcia, Ceuta y Melilla), y 118 no fueron localizadas o estaban incompletas, por lo que el tamaño muestral final fue de 1.379 HC resumidas.
Adquisición de datos
Revisión de la historia clínica. Se recabó la información objetiva sobre los pacientes incluidos en el estudio a través de la revisión de la HC, en que se recogía los datos producidos en los 2 años previos a la fecha de revisión. En los casos en los que la HC fue imposible de localizar y/o los datos contenidos eran incompletos se recabó la fecha de nacimiento y el sexo, lo que permitió comprobar que no exis-tían diferencias significativas con la población a estudio en estos parámetros. Las HC ilocalizables y/o incompletas se distribuyeron homogéneamente en todos los centros participantes, sin que hubiera una sobrerrepresentación de ninguno de ellos.
Los datos se recogieron en cuestionarios estandarizados e iguales para todos los casos. En cada centro participante se seleccionó uno o varios médicos responsables de extraer la información contenida en la HC y rellenar los cuestionarios. Uno de los miembros del equipo investigador (V.V.) se desplazó a los centros que accedieron a participar, pero que no pudieron seleccionar un médico responsable. La persona designada en cada centro recibió un extenso cuaderno con las instrucciones y definiciones necesarias para asegurar la homogeneidad en la recogida de datos. Los investigadores de cada centro conservaron una copia de la hoja de recogida de datos estandarizada de cada sujeto para su eventual utilización.
Mediciones. Los datos recogidos de las HC incluyeron los siguientes grupos de variables:
1. Características sociodemográficas de los pacientes. Fecha de nacimiento, sexo, estado civil, nivel de educación, profesión, situación laboral y lugar de residencia.
2. Características de la enfermedad. Fecha de inicio y de diagnóstico de la AR, factor reumatoide, clase funcional del ACR, valores máximo y mínimo de la velocidad de sedimentación globular (VSG) y la proteína C reactiva (PCR) a lo largo del período de estudio, número máximo y mínimo de articulaciones inflamadas a lo largo del período de estudio, entre otras; comorbilidad (existencia de diabetes mellitus, hipertensión arterial, enfermedad péptica, hepatopatía crónica de cualquier origen, insuficiencia renal crónica o anticoagulación oral); manifestaciones extraarticulares o síntomas específicos de la AR (pleuritis, fibrosis pulmonar, vasculitis, fenómeno de Raynaud, subluxación C1-C2, nódulos, síndrome del túnel del carpo, síndrome de Sjögren, escleritis, síndrome de Felty o amiloidosis); cirugía ortopédica a lo largo de la evolución de la enfermedad. Para la presencia de manifestaciones extraarticulares se utilizaron las siguientes definiciones: pleuritis y fibrosis pulmonar documentada en la HC y/o por la presencia de signos radiológicos compatibles con el diagnóstico; vasculitis reumatoide documentada o existencia de uno o más de los siguientes criterios: mononeuritis múltiple o neuropatía periférica aguda, gangrena periférica o úlceras cutáneas profundas o enfermedad extraarticular activa (pleuritis, pericarditis, escleritis) si se asocia a infartos digitales o evidencia anatomopatológica de vasculitis; fenómeno de Raynaud documentada en la HC; subluxación C1-C2 documentada por la radiografía lateral de columna cervical en flexión forzada; nódulos reumatoides documentados en la HC; síndrome del túnel del carpo definido por la presencia de clínica y exploración física compatible y/o existencia de electromiograma compatible; síndrome de Sjögren documentado en la HC y definido por xeroftalmia subjetiva u objetiva (test de Shirmer o Rosa de Bengala positivos) más xerostomía subjetiva y objetiva (biopsia de glándula salival positiva); escleritis/epiescleritis documentada en la historia clínica; síndrome de Felty documentado en la historia clínica y amiloidosis documentada anatomopatológicamente.
3. Características del médico responsable. Cuando en una HC más del 50% de los evolutivos estaban firmados por un mismo médico, se consideró que éste era el facultativo responsable, del que se recogieron los siguientes datos: edad y sexo, especialidad y tipo de formación (vía MIR u otras), cargo asistencial (residente, facultativo especialista de área, jefe de sección o jefe de servicio) y actividad profesional (sólo pública o pública y privada).
4. Variables administrativas. Estos datos permitirían establecer la demanda asistencial en cada paciente: fecha de primera visita y procedencia (atención primaria, otros especialistas, petición propia, urgencias), número de visitas totales en 2 años, ingresos hospitalarios (incluyendo número de ingresos, estancias, servicio responsable y causas del ingreso con descripción de la cirugía, si la hubo); visitas a otros servicios médicos (detallando los especialistas consultados); visitas a otros profesionales no médicos (enfermería, fisioterapia, servicios sociales).
5. Pruebas diagnósticas realizadas en los últimos 2 años para establecer la demanda de pruebas complementarias en cada paciente: número y tipo de pruebas de imagen; número y tipo de pruebas de laboratorio; número y tipo de otras pruebas diagnósticas.
6. Tratamientos realizados en los últimos 2 años, incluyendo dosis máximas y mínimas, y causas de suspensión durante el período de estudio de antiinflamatorios no esteroides (AINE), corticoides, fármacos modificadores de la enfermedad (FAME), incluyendo el primer FAME utilizado así como la fecha de inicio de este primer FAME y la utilización de combinaciones de FAME; analgésicos; infiltraciones intraarticulares y periarticulares (incluyendo los fármacos empleados); protectores gástricos, y fármacos para el tratamiento o profilaxis de la osteoporosis.
7. Instrumentos de seguimiento clínico de los pacientes. Se recogió mediante estimación semicuantitativa (nunca, ocasionalmente, habitualmente o siempre) el número de visitas en las que se había utilizado algunos de los siguientes: duración de la rigidez matutina, evaluación articular mediante elementos descriptivos de las articulaciones inflamadas, dolorosas, afectadas y dañadas o deformadas, o recuentos articulares formales (recuento del ACR, índice articular de Ritchie, recuento de 28 articulaciones u otro tipo de recuento articular); valoración del dolor (adjetiva, escala analógica visual o escala Lickert); valoración de la actividad de la enfermedad del médico y del paciente (mediante escalas adjetivas [igual/mejor/peor o ninguna/leve/moderada/grave] o escala analógica visual); valoración de la capacidad funcional mediante instrumentos cuantitativos (fuerza de la mano, tiempo de marcha en 15 metros), descriptivos (clase funcional del ACR, clase funcional de Steinbrocker) o cuestionarios de funcionalidad (Health Assessement Questionnaire y Arthritis Impact Measurement Scales, entre otros); cuestionarios de calidad de vida (Medical Outcome Survey Short Form-36 o 12, European Quality of Life Index, Nottingham Impact Profile, Sickness Impact Profile, entre otros).
Con el fin de no repetir una serie de variables comunes a todos los pacientes atendidos en un mismo servicio, se completó un cuestionario único para cada uno de ellos en el que se recogieron los datos descriptivos del centro hospitalario y del servicio. Estos datos fueron idénticos para cada uno de los pacientes atendidos en un mismo servicio e incluyeron:
1. Características generales del centro. Localización (comunidad autónoma y localidad); nivel del centro (según grado de especialización y dotación de cada centro que incluye número de camas, total de especialidades, especialidades complejas y equipos de alta tecnología y trasplantes); tamaño (población atendida, distribución de la población entre rural y urbana y número de camas); existencia de facilidades o barreras arquitectónicas para los pacientes.
2. Características generales del servicio. Se incluyen: especialidad (medicina interna o reumatología), lugar de asistencia a los pacientes (sólo en el hospital, sólo en centros de especialidades o en ambos), número de médicos de plantilla y formación de residentes (incluyendo el número de residentes por año), número de camas de hospitalización, número de ingresos anuales, número de primeras consultas y sucesivas, demora de consultas, entre otras; otras características como el sistema de monitorización de fármacos (en el hospital, en atención primaria o compartido), existencia de consultas específicas (consultas monográficas de AR, consultas multidisciplinarias, consulta de enfermería, consulta telefónica), y la realización de ensayos clínicos o investigación clínica en AR u otras afecciones.
Determinación de la actividad de la enfermedad. Uno de los principales problemas a los que tuvimos que enfrentarnos al prescindir de la entrevista con el enfermo en la metodología del estudio fue la determinación del grado de actividad de la enfermedad. Para ello clasificamos a los pacientes en tres grupos según dos parámetros: el número de articulaciones tumefactas (NAT) y los reactantes de fase aguda (VSG y/o PCR). Se clasificó al paciente como portador de una enfermedad no activa cuando el NAT era menor o igual a 5 y la VSG/PCR era normal en la mejor y la peor evaluación del paciente durante el período del estudio. Se consideró que tenían una enfermedad activa remitente aquellos casos en los que el NAT era mayor de 5 y la VSG/PCR anormal en la peor evaluación del paciente y el NAT era menor o igual a 5 y la VSG/PCR era normal en la mejor evaluación del paciente. Por último, se definió enfermedad activa persistente cuando el NAT era mayor de 5 y la VSG/PCR anormal en la mejor y peor evaluación del paciente durante el período del estudio. Con los datos contenidos en la HC fue posible clasificar en uno de estos tres grupos al 94,7% de los pacientes. Mediante esta clasificación, algunos pacientes clasificados en la categoría de enfermedad no activa mantenían de hecho cierta actividad de la enfermedad y no cumplían criterios de remisión completa1, pero es seguro que ningún paciente con actividad inflamatoria a lo largo del estudio ha sido clasificado dentro de este grupo.
Introducción de los datos en soporte magnético
Los cuestionarios originales fueron remitidos al equipo investigador principal para su introducción en la base de datos del estudio. Todos los datos se introdujeron por parte del equipo investigador (V.V.) o un administrativo especialmente entrenado en una base de datos relacional creada a tal efecto. Los datos se exportaron a una hoja de calculo (JMP®, SAS Institute Inc., Cary, NC, EE.UU.) para su análisis estadístico.
Control de calidad
La calidad de los datos contenidos en el estudio fue controlada mediante diversas estrategias. En primer lugar, se elaboró un cuaderno de instrucciones que contenía todas las definiciones de cada una de las preguntas del cuestionario que pudieran resultar confusas. En segundo lugar se realizó un estudio piloto en dos centros con la participación de seis revisores y un total de 185 HC revisadas. Los resultados de este estudio piloto arrojaron un tiempo aceptable para la cumplimentación de los cuestionarios y no se detectaron errores importantes en las preguntas realizadas, por lo que básicamente no fue necesario modificar el cuestionario inicial. Todos los cuestionarios fueron revisados por un miembro del equipo investigador (V.V.) antes de ser incluidos en la base de datos, contactando con la persona responsable en cada uno de los centros para solucionar las cuestiones dudosas. La base de datos fue depurada mediante un protocolo de monitorización para la detección de inconsistencias o campos con valores perdidos que no habían sido cumplimentados correctamente. En cualquier caso, no se detectaron errores sistemáticos en la introducción de datos y sólo se detectó menos de un 2,5% de errores aleatorios que fueron corregidos.
Análisis estadístico
Para el análisis descriptivo se utilizó la media (desviación estándar [DE]) o mediana (desviación intercuartil: percentiles 25-75) para las variables continuas según se ajustaran a una distribución normal o no y el porcentaje para las variables cualitativas. Las diferencias por subgrupos de pacientes se analizaron mediante la prueba de la *2, la de la t de Student o la de la U de Mann-Whitney. Se analizaron las asociaciones univariantes mediante los coeficientes de correlación de Pearson y Spearman para las variables continuas, y regresión logística cuando la variable de respuesta era discontinua.
Resultados
Características sociodemográficas de los pacientes
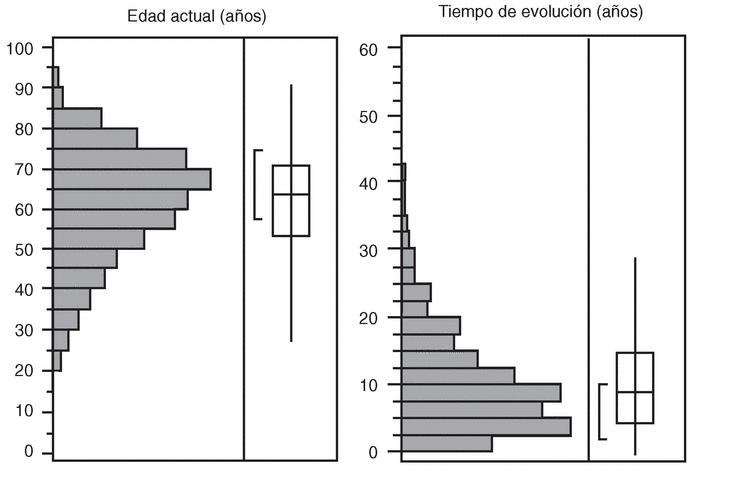
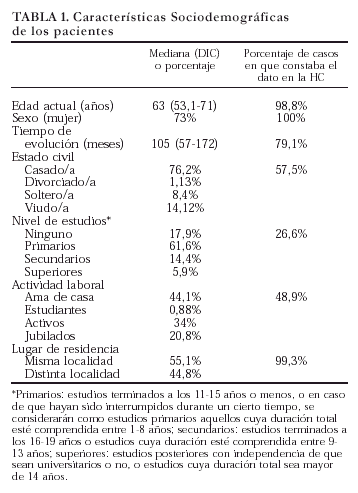
La mediana de edad en la fecha de revisión de la HC fue de 63 años (53,1-71) y el 73% de los pacientes eran mujeres. La mediana de edad al inicio de la enfermedad fue de 51 años (39-61) y el tiempo de evolución de la enfermedad de 105 meses (57-172). La distribución por edades y tiempo de evolución se expone en la figura 1. Se trata de una población con una distribución muy amplia entre las diferentes fases de evolución de la enfermedad. No se observaron diferencias significativas en edad, sexo o tiempo de evolución entre las diferentes comunidades autónomas.
Figura 1. Distribución de la población estudiada según la edad (izquierda) y el tiempo de evolución (derecha) en la fecha de revisión de la historia clínica.
La recogida sistemática en la HC de otros datos sociodemográficos fue muy desigual. En la tabla 1 se exponen las características sociodemográficas de los pacientes y el porcentaje de casos en los que el dato constaba en la HC. Así, el estado civil faltaba en el 42% de las HC revisadas, el nivel de estudios en el 73% y la profesión o situación laboral del paciente en el 51%. Por el contrario, el lugar de residencia del paciente sólo faltaba en el 1% de las HC.
Características de la enfermedad
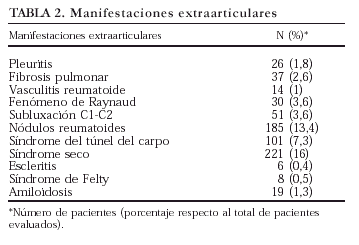
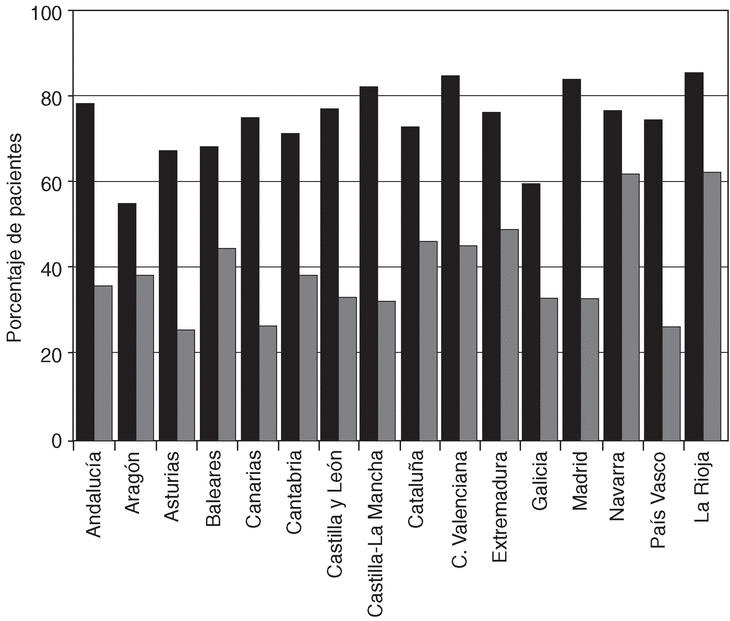
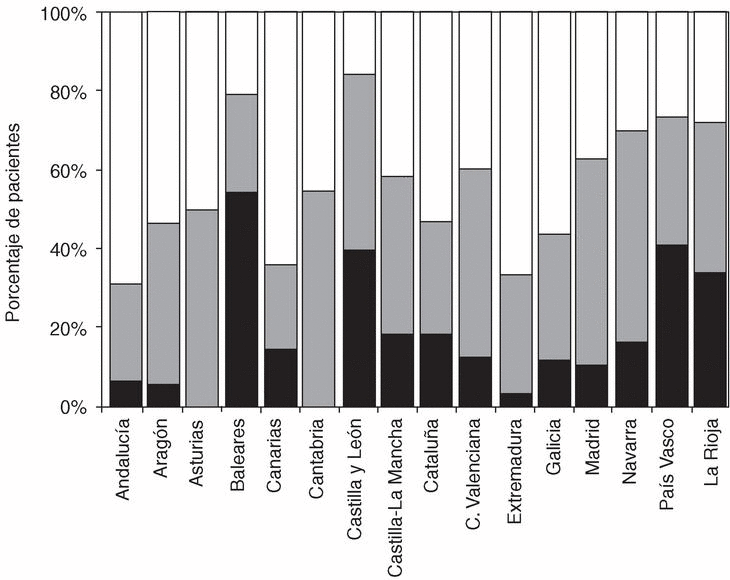
Factor reumatoide y manifestaciones extraarticulares. El 75% de los pacientes tuvo al menos una determinación positiva del factor reumatoide y el 37,4% tenía alguna manifestación extraarticular recogida en la HC (tabla 2). Como se presenta en la figura 2 se detectó una marcada variabilidad en estos dos parámetros, que osciló entre el 55 y el 80% para la positividad del factor reumatoide y entre el 24 y el 60% para la presencia de manifestaciones extraarticulares.
Figura 2. Distribución del porcentaje de pacientes con factor reumatoide positivo (barras negras) y manifestaciones extraarticulares (barras grises) por comunidades autónomas.
Actividad de la enfermedad. El 49% de los pacientes no había tenido actividad de la enfermedad o ésta fue leve a lo largo del período de estudio, mientras que el 51% sí había tenido una AR activa a lo largo del seguimiento. Entre aquellos que habían tenido actividad de la enfermedad, un 36% del total tenía una actividad que había pasado por exacerbaciones y remisiones a lo largo del periodo de estudio y un 15% había mantenido actividad inflamatoria persistente a lo largo de los 2 años. Sin embargo, existió una amplia variabilidad entre una región geográfica y otra en la actividad de la enfermedad (fig. 3), de modo que mientras en comunidades como Andalucía o Extremadura la mayoría de los pacientes mantuvo un grado leve de actividad a lo largo de 2 años, en otras como Castilla y León, Baleares o el País Vasco el porcentaje de pacientes con enfermedad activa y persistente era muy superior al resto.
Figura 3. Distribución del porcentaje de pacientes con enfermedad activa persistente (barras negras), enfermedad activa remitente (barras grises) y enfermedad inactiva (barras blancas) por comunidades autónomas.
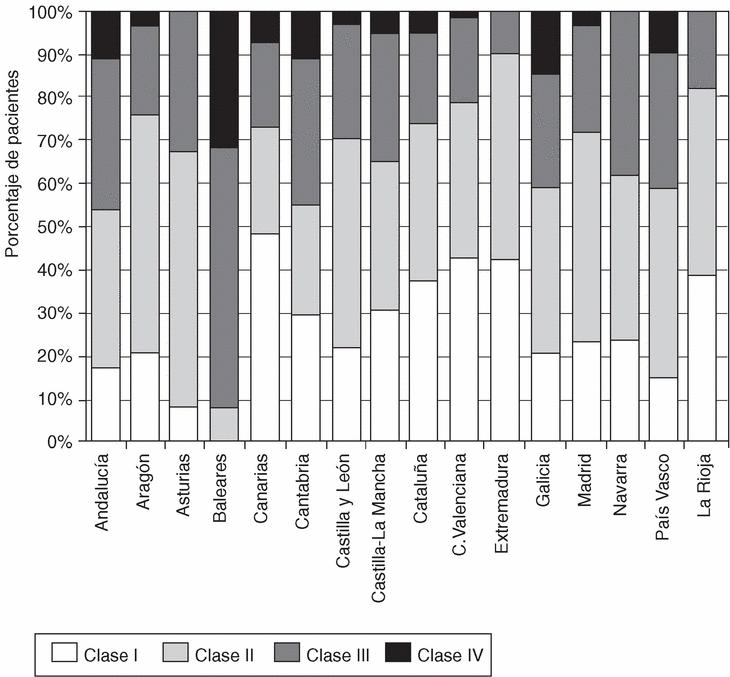
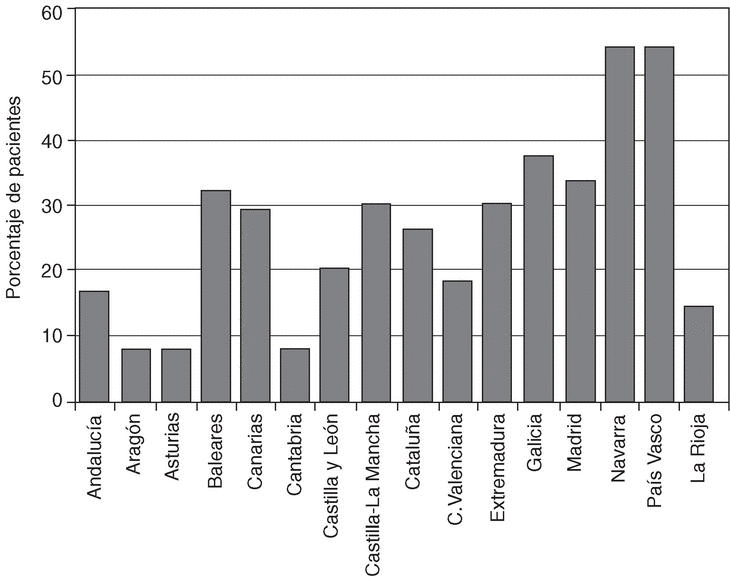
Clase funcional y cirugía ortopédica. La mayoría de los pacientes se encontraba en una clase funcional II (40%). Una proporción similar de pacientes fue clasificado en una clase funcional I (27%) y III (26%). Sólo el 7% de los enfermos se clasificó dentro de la clase funcional IV. Un 25,9% de los pacientes necesitó algún tipo de cirugía articular a lo largo de la evolución de su enfermedad, de ellos, aproximadamente la mitad (14%), el recambio total de alguna de sus articulaciones. De nuevo la proporción de pacientes clasificados en cada una de las clases funcionales del ACR y de pacientes sometidos a algún tipo de cirugía ortopédica fue muy variable en cada comunidad autónoma (figs. 4 y 5).
Figura 4. Distribución del porcentaje de pacientes en función de la clase funcional del ACR por comunidades autónomas.
Figura 5. Distribución del porcentaje de pacientes sometidos a al menos una intervención quirúrgica ortopédica a lo largo de su evolución por comunidades autónomas.
Incapacidad laboral. La situación laboral de los pacientes constaba en casi la mitad de las historias revisadas (49,1%). En aquellas historias en las que constaba este dato y los pacientes eran laboralmente activos, la existencia de incapacidad transitoria (IT) e incapacidad permanente (IP) se recogió en el 75,2 y el 79,4% de las HC, respectivamente. La incidencia de IT registrada en pacientes con AR laboralmente activos fue de 14,4 personas por 100 pacientes en 2 años y la prevalencia acumulada de IP del 9,6%. También se observaron diferencias entre comunidades autónomas en la proporción de pacientes laboralmente activos, que varió entre el 5,6 y el 40,9%.
Comorbilidad
Para poder analizar la variabilidad en el tratamiento de los pacientes con AR, un aspecto que se tuvo en cuenta fue la existencia de otras enfermedades concomitantes como hipertensión arterial (HTA), diabetes, enfermedad péptica, insuficiencia renal, hepatopatía y terapia anticoagulante. El 37% de los enfermos tenía alguna de estas enfermedades además de la AR. La HTA fue la comorbilidad más frecuente (20%) seguida de la enfermedad péptica (14%) y la diabetes (7%). La insuficiencia renal, la hepatopatía y la terapia anticoagulante representaban un 3% de los pacientes.
Procedencia de los pacientes
En el 92,6% de las HC constaba cuál había sido la primera fecha en que el paciente había sido atendido en el servicio y en el 68,6% cuál había sido la procedencia del paciente. La primera visita se produjo durante el período de estudio en el 10% de los pacientes. La mayoría de ellos fueron derivados a los servicios de atención especializada por médicos de atención primaria (56,5%); el 28,2% de los casos fueron referidos por otros especialistas (cirugía ortopédica y traumatología y medicina interna en más de la mitad de los casos), el 13,3% por servicios de urgencia, y sólo el 1,9% de los casos a petición de los propios enfermos. Un 14% de los pacientes correspondieron a traslados de un servicio de reumatología a otro dentro de la medicina pública o de reumatólogos privados a la medicina pública.
Sólo en el 39% de las HC se conservaba el parte de interconsulta (PIC), y en la mayoría de ellos también la fecha en que se había solicitado. La mediana de tiempo transcurrido entre la solicitud del PIC y la primera visita en el servicio fue de 1 (0-2) meses, un tiempo que se puede considerar razonable, ya que al menos en el 75% de los casos habrían sido de 2 meses o menos.
Excluyendo a los pacientes atendidos previamente en otros servicios de reumatología que en su mayoría habían ya recibido tratamiento con algún FAME, hubo diferencias significativas en el tiempo desde el inicio de la enfermedad hasta la primera consulta, en función de la procedencia de los pacientes. Así, este tiempo fue significativamente menor en los pacientes derivados por servicios de urgencia (5 meses [2-23]) y significativamente mayor en los pacientes derivados por otros especialistas (14 meses [5-48]). Este intervalo de tiempo se agrupó en torno a la mediana general en los pacientes derivados desde atención primaria y en los pacientes atendidos a petición propia.
Discusión
El estudio emAR fue diseñado para analizar diferencias regionales en el tratamiento de la artritis reumatoide. Sin embargo, la selección aleatoria de los pacientes estudiados y la magnitud de la muestra cerca de un 1% de las AR en España ha supuesto una buena oportunidad para conocer las características de los pacientes con AR atendidos en los servicios de atención especializada del territorio nacional. En este artículo hemos descrito los hallazgos más sobresalientes sobre las características sociodemográficas de los pacientes, su enfermedad, su comorbilidad y su procedencia.
Nuestros resultados indican que las tres cuartas partes de los pacientes con AR son mujeres con una mediana de edad de 63 años y una mediana de evolución de la enfermedad de 8,75 años. Aproximadamente un 10% de la población prevalente con AR presenta una enfermedad de reciente comienzo (< 2 años de evolución). El 75% de los pacientes son positivos para el factor reumatoide en España, algo más del 35% tiene o ha tenido alguna manifestación extraarticular, la mitad pasó por períodos de actividad inflamatoria importante a lo largo de 2 años (el 15% de forma persistente durante este período), sólo la cuarta parte de los pacientes mantiene una capacidad funcional intacta, y otra cuarta parte ha necesitado algún tipo de cirugía ortopédica motivada por su enfermedad. Además, hasta un 37% de los pacientes presentaba al menos una enfermedad asociada. Todos estos datos dibujan una situación de la AR en España bastante aproximada a la de otras grandes cohortes de pacientes con la misma enfermedad2-6.
En conjunto, las características sociodemográficas corresponden a las de una población prevalente típica de sujetos con AR7,8, no existiendo grandes diferencias entre comunidades autónomas en la edad, el sexo o el tiempo de evolución de la enfermedad. Sí se observan diferencias en otras características sociodemográficas. Por ejemplo, en la proporción de pacientes laboralmente activos, que varió entre el 5,6 y el 40,9% dependiendo de la comunidad autónoma. También en el porcentaje de pacientes que viven en la misma localidad en que son atendidos, que varió entre el 12,5 y el 91,3%. Estos datos pueden ser relevantes para el tratamiento de la enfermedad en términos de accesibilidad al sistema y cuidados recibidos, y deberían ser tenidos en cuenta para organizar la asistencia a los pacientes en función de sus características y sus demandas. Por ejemplo, resulta llamativo que, aunque el médico de atención primaria sigue siendo el principal referente de pacientes a las consultas de atención especializada, un número no despreciable de pacientes accede a este sistema a través de los servicios de urgencia. Estos pacientes tienen un menor tiempo de espera para acceder a la atención especializada, lo que podría tener relación con un inicio más explosivo de la enfermedad. Sin embargo, aunque los factores relacionados con una mayor demora pueden depender también de las características sociodemográficas del paciente9, las diferencias observadas según la procedencia de los enfermos deben hacer reflexionar sobre el sistema de derivación actual entre atención primaria y atención especializada y analizar los puntos en que éste es manifiestamente mejorable.
Nuestro esquema de clasificación de la actividad de la enfermedad incluyó en una misma categoría a los pacientes en remisión o con una baja actividad inflamatoria, por lo que no podemos precisar qué porcentaje de pacientes se encuentra en remisión completa. Es probable que algunos pacientes clasificados como enfermedad no activa no cumplieran de hecho criterios de respuesta clínica significativa o remisión de la enfermedad. Pero, complementariamente, es también seguro que ningún paciente con actividad inflamatoria a lo largo del estudio fue clasificado dentro de este grupo, por lo que sí podemos afirmar que al menos la mitad tuvo períodos de actividad inflamatoria importante y que un 15% tenía una enfermedad persistentemente activa a lo largo de 2 años. A la espera de los resultados definitivos del estudio EMECAR, no existen datos precisos sobre la expresión clínica de la AR, la frecuencia de manifestaciones extraarticulares o comorbilidad asociada en España. Dado que nuestra fuente de datos fue la revisión de la HC, es difícil establecer si nuestros hallazgos reflejan una realidad clínica o sólo parte de ella. Sin embargo, nuestros resultados coinciden en gran medida con los resultados preliminares del estudio EMECAR en la prevalencia de algunas manifestaciones extraarticulares, como síndrome de Sjögren, nódulos reumatoides, neumopatía intersticial, serositis, vasculitis o síndrome de Felty10.
Aunque globalmente estas características de la enfermedad fueron similares a las de otras cohortes nacionales e internacionales en la prevalencia de positividad para el factor reumatoide11, manifestaciones extraarticulares o clasificación del estado funcional según los criterios del ACR12, dos hechos resultan especialmente notables: en primer lugar, que las cifras de pacientes sometidos a algún tipo de cirugía ortopédica13-15 y la repercusión laboral de la enfermedad16 parecen ser menores en comparación con las de otras cohortes nacionales u otros países de nuestro entorno. Mientras que parece claro que la tasa de cirugía ortopédica en España es comparativamente baja, es probable que el impacto de la AR sobre la vida laboral de los pacientes no se indague de forma activa o no quede reflejado de forma explícita en la HC. En un estudio previo en un área sanitaria de Madrid, habíamos observado una incidencia de IT de 45,7 por 100 personas activas/año y una prevalencia de IP del 31%17, cifra bastante por encima de la encontrada en este estudio. La incapacidad laboral representa un concepto muy importante dentro de los costes de la enfermedad18,19, constituye el marcador de incapacidad funcional más directo en la población laboralmente activa y, por tanto, debería formar parte de la HC en estos pacientes.
En segundo lugar, que existen marcadas diferencias de una comunidad autónoma a otra en la expresión clínica de la enfermedad. Por ejemplo, la positividad para el factor reumatoide varió entre el 55 y el 80%, la presencia de manifestaciones extraarticulares entre el 24 y el 60%, el porcentaje de pacientes con enfermedad persistentemente activa entre el 0 y el 50%, y el porcentaje de pacientes clasificados en clase funcional IV del ACR entre el 0 y el 30%. Estas diferencias podrían estar relacionadas con un sesgo en la selección de los pacientes o en el número de pacientes aportados por cada comunidad autónoma. Sin embargo, se solicitó expresamente que los listados de pacientes que luego fueron aleatorizados incluyeran a todos los sujetos con el diagnóstico de AR con independencia de cualquier otro criterio. Las diferencias se mantuvieron también entre comunidades autónomas que aportaron un número alto de pacientes a la revisión. Es posible que algunos centros hayan derivado su atención hacia pacientes más graves y otros hacia la población general, o que la antigüedad de cada centro pueda haber sesgado de alguna forma el patrón de paciente atendido, de más reciente comienzo en aquellos servicios con menor antigüedad y viceversa. Sin embargo, es posible que dichas diferencias existan aun cuando no hayamos sido capaces de delimitar un patrón geográfico bien definido que las explique. Sabemos que existen factores genéticos que pueden asociarse a una mayor o menor agresividad de la enfermedad20-22. Debidas o no a estos factores genéticos, sabemos que existen diferencias en la prevalencia23,24 y la expresión clínica25-27 de la enfermedad en diferentes poblaciones, pero también una marcada variabilidad en la presentación clínica y el desenlace de la enfermedad en cohortes con un mismo origen geográfico7,8,28. De hecho, es posible que no todos los pacientes diagnosticados de AR, definida según los criterios aceptados en la actualidad11, padezcan la misma enfermedad. Nuestros resultados indican que la AR es clínicamente variable en España, pero estos datos sólo se podrán confirmar en estudios poblacionales.
Por último, hemos podido analizar con qué frecuencia se recogen determinados aspectos relacionados con la enfermedad en la HC. La recogida en la HC, por ejemplo, de las características sociodemográficas de la población es muy desigual y, para algunas variables, globalmente baja. Aunque no es el objeto de este artículo, es también importante señalar que el seguimiento de los pacientes sigue basándose en escalas adjetivas con escasa presencia de instrumentos estandarizados29. La importancia de estos aspectos parece estar infravalorada en la práctica clínica diaria, en contra de las recomendaciones de diferentes grupos30,31. Se ha descrito que las variables sociodemográficas influyen en la expresividad de la enfermedad4,32, el acceso de los pacientes a la atención especializada9 o la repercusión funcional de la misma33. Por ejemplo, el estado civil y las relaciones sociales de los pacientes con AR influyen en el grado de dolor que experimentan, y existen diferencias significativas en la evolución de los pacientes en función de su actividad laboral34. Por ello es necesario insistir en la necesidad de que todas ellas queden reflejadas en la HC de los pacientes con AR.
En resumen, globalmente, las características sociodemográficas y clínicas de los pacientes con AR en nuestro país son similares a las de otros estudios basados en cohortes de prevalencia, pero parecen existir diferencias entre comunidades autónomas en algunas de estas características. A pesar de las recomendaciones de diferentes grupos sobre lo que debería constituir el conjunto mínimo de datos a recoger en la HC para cada paciente con AR, existen numerosos aspectos que siguen sin ser integrados en la HC de los pacientes.
Agradecimiento
Los autores desean agradecer a la Sociedad Española de Reumatología su ayuda en el desarrollo del proyecto.
eGrupo de Estudio emAR (Sociedad Española de Reumatología)
Grupo emAR (por orden alfabético)
Dr. Aragón (Talavera de la Reina), Dr. Arboleya (Gijón), Dra. Aznar (Tudela), Dr. Baixauli Rubio (Valencia), Dr. Barbeito (Alcoy), Dr. Belmonte (Castelló), Dr. Beltrán (Zaragoza), Dr. Cabezas (Logroño), Dr. Carreño (Madrid), Dr. Casado (Badalona), Dr. Ciria (Barcelona), Dr. Corral (Salamanca), Dr. de Agustín (Barcelona), Dra. de Paco (Mataró), Dr. del Rincón (Cáceres), Dr. Doña (Huelva), Dr. Espadaler (Palma de Mallorca), Dr. Fernández Campillo (Orihuela), Dr. Fernández Domínguez (Orense), Dr. Fiter (Barcelona), Dr. Fraiz (Baracaldo), Dr. García Aparicio (Salamanca), Dr. García Meijide (Santiago de Compostela), Dr. Giménez Ubeda (Zaragoza), Dr. Giralt (Barcelona), Dr. González (Madrid), Dr. Gracia (Logroño), Dra. Grandal (Sevilla), Dra. Ibero (Elda), Dr. Inxausti (San Sebastián), Dra. Iovani (Elda), Dra. Jiménez Alfaro (Burgos), Dr. Jiménez Zorzo (Zaragoza), Dra. Larrosa (Sabadell), Dr. López Longo (Madrid), Dr. Macías (Cádiz), Dr. Manero (Zaragoza), Dr. Martín (Huelva), Dr. Mayol (Castelló), Dr. Monteagudo (Madrid), Dr. Navarro (Elche), Dra. Navío (Madrid), Dr. Ordás (Oviedo), Dr. Pascual (Málaga), Dr. Pecondón (Zaragoza), Dr. Peiró (Cuenca), Dr. Rodríguez de Castro (Mahón), Dr. Rodríguez Lozano (Las Palmas), Dr. Romero (Córdoba), Dr. Rosas (Las Palmas), Dr. Rosas (Villajoyosa), Dr. Saiz (Torrelavega), Dr. Salazar (Badajoz), Dra. Sampedro (Toledo), Dra. Sandoval (Tudela), Dr. Santos (Toledo), Dr. Senén (Gijón), Dr. Tamarit (Valencia), Dr. Tovar (Elche), Dra. Ureña (Málaga), Dr. Vargas (Huelva), Dr. Zubeita (Toledo).
Este trabajo ha sido financiado por Norvartis Farmacéutica España, S.A.