Introducción
El lupus eritematoso sistémico (LES) es la enfermedad autoinmune que presenta mayor diversidad clínica e inmunológica, ya que puede afectar a cualquier órgano y presenta una gran variedad de manifestaciones, tanto clínicas como inmunológicas1. La afección sistémica incluye artritis, nefropatía, alteraciones hematológicas y afección neurológica2-4. Desde un punto de vista epidemiológico, se han descrito diferencias en su expresión clínica, según la edad o el sexo de los pacientes5-7. En la etiopatogenia del LES, se ha postulado el posible papel etiológico o desencadenante de diversas infecciones virales, ya que se han descrito manifestaciones clínicas e inmunológicas similares a las que se presentan en el LES en personas con infección por citomegalovirus, virus de Epstein-Barr o parvovirus B198.
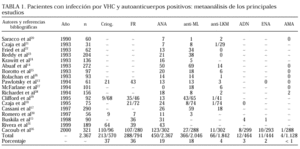
De todos los virus conocidos, el virus de la hepatitis C (VHC), aislado de un chimpancé infectado en 19889, es sin duda el que más se ha relacionado con fenómenos autoinmunes. La existencia de pequeñas variaciones dentro de cada uno de los genotipos, las denominadas cuasiespecies, confiere al virus una gran capacidad para eludir constantemente al sistema inmune10. La primera descripción de la existencia de manifestaciones extrahepáticas asociadas al VHC fue realizada por Pascual et al en 1990, al describir a 2 pacientes con infección por el VHC y crioglobulinemia11. Desde entonces, son numerosos los estudios que han relacionado la infección por el VHC con gran número de manifestaciones autoinmunes, tanto clínicas como inmunológicas. Cacoub et al12 han descrito la presencia de alguna manifestación clínica o inmunológica extrahepática en el 70% de la mayor cohorte de pacientes VHC estudiada (1.614 pacientes). Dentro de las infecciones virales, la producida por el VHC es la que se ha asociado con mayor frecuencia a la detección de autoanticuerpos, con porcentajes que oscilan entre el 1 y el 20% (tabla 1)13-31. Finalmente, en los últimos años se han publicado diversos estudios que han relacionado la infección crónica por el VHC con ciertas enfermedades autoinmunes sistémicas, especialmente con el síndrome de Sjögren32, la artritis reumatoide33 o la panarteritis nudosa34, y más recientemente con el LES.
Lupus eritematoso sistémico y VHC
Estudio de la infección por VHC en pacientes con lupus eritematoso sistémico
Estudios de prevalencia. Se han realizado diversos estudios que han analizado la prevalencia de infección por el VHC en series de pacientes con LES. El primer estudio fue realizado en 1995 por Marchesoni et al35, que detectaron anticuerpos anti-VHC en cuatro (6%) de 71 pacientes con LES. Tres de los 4 pacientes presentaban una historia previa de hepatitis, aunque sólo en uno se detectó elevación de las enzimas hepáticas. De los 4 pacientes LES-VHC, uno fue considerado como falso positivo, por el resultado negativo del RIBA y la PCR. En otro estudio, Kowdley et al36 encuentran anticuerpos anti-HCV (ELISA-2) en cinco (12%) de 42 pacientes con LES, aunque sólo tres (7%) fueron positivos en el RIBA y dos (5%) fueron PCR positivos. En uno de los pacientes, el resultado positivo del ELISA-1 no se confirmó en el ELISA-2, la RIBA y la PCR, por lo que se consideró que era un falso positivo. Ninguno de los pacientes VHC+ presentaba signos de enfermedad crónica hepática, y sólo en uno se detectaron enzimas elevadas. En cambio, dos estudios realizados en Israel37 y Turquía38 han detectado un porcentaje muy bajo (1-3%) de infección por el VHC, un hecho posiblemente relacionado con el ámbito geográfico en el que se han realizado dichos estudios. En series más cortas de pacientes con LES no suele detectarse infección por VHC. Yamabe et al39 no detectan infección por VHC en 14 pacientes con nefropatía lúpica, y Dalekos et al40 no detectan infección en 12 pacientes con LES. Finalmente, Cacoub et al41 encuentran anticuerpos anti-VHC (ELISA-2) en siete (11%) de 62 pacientes, aunque el RIBA-2 fue positivo sólo en uno (2%).
Recientemente, hemos descrito la presencia de anticuerpos anti-VHC (ELISA-3) en 18 (13%) de 134 pacientes consecutivos diagnosticados de LES42, respecto a dos (1%) de 200 donantes sanos estudiados. El RIBA-3 fue positivo en 15 pacientes con LES, indeterminado en uno y negativo en los dos restantes. El ARN-VHC se detectó en 10 pacientes (todos eran positivos para ELISA-3 y RIBA-3) y en los 2 donantes. En los 3 pacientes con RIBA indeterminado o negativo, la detección del ARN-VHC fue negativa. Así, confirmamos la infección por VHC en 15 (11%) de los pacientes con LES y en dos (1%) de los donantes (p < 0,001).
Por tanto, de los 442 pacientes con LES analizados en total (tabla 2), se han detectado anticuerpos anti-VHC por técnica de ELISA en un total de 36 (8%), observándose mayores prevalencias en los estudios realizados en la zona mediterránea occidental respecto a la oriental. Este porcentaje, cercano al 10%, es muy superior a la prevalencia que se observa en la población sana de nuestro entorno (1-2%), lo que sugiere la existencia de una relación entre VHC y LES.
Falsos positivos de las pruebas de ELISA-VHC en pacientes con LES. Un aspecto importante que se deriva de nuestro trabajo42 es la descripción de falsos positivos en la determinación por ELISA-3 de anticuerpos anti-VHC en pacientes con LES, tal como hemos observado en 3 de nuestros pacientes (con confirmación negativa mediante RIBA-3 y ARN-VCH) y ausencia de datos clínicos y/o biológicos de hepatopatía. Algunos autores ya habían descrito la existencia de falsos positivos en la serología VHC en pacientes con enfermedades autoinmunes, especialmente en casos de ELISA de primera y segunda generación y en pacientes con hipergammaglobulinemia marcada, aunque ninguno de nuestros pacientes con LES la presentaba. Resulta muy interesante analizar las características de estos 3 pacientes, ya que todos presentaban un perfil clínicoinmunológico muy homogéneo, con la presencia de datos clínicos considerados específicos de LES, títulos elevados de anticuerpos antinucleares (ANA) (>= 1/160) y valores elevados de anticuerpos anti-ADNds (> 30 U/ml), y ninguno de ellos presentaba datos de afección hepática. Todo ello nos hace pensar que se trata de pacientes con un LES «verdadero» y un resultado falsamente positivo en el ELISA-3.
En los estudios realizados hasta ahora (tabla 2) se ha confirmado el resultado positivo del ELISA mediante técnica de RIBA en 23 (64%) de los 36 pacientes con LES en los que se habían detectado anticuerpos anti-VHC mediante ELISA. Por tanto, la existencia de falsos positivos por ELISA se ha podido constatar en 13 pacientes con LES (36%). Finalmente, tan sólo dos estudios han analizado la presencia del ARN del VHC en el suero de estos pacientes con LES: Kowdley et al36 confirmaron la detección del ARN en 2 (67%) de sus 3 pacientes LES-VHC-RIBA+, mientras que en nuestro estudio se detectó el virus en 10 (77%) de los 13 pacientes RIBA+. Por tanto, todos estos datos aconsejan la confirmación de la infección por VHC en pacientes con LES mediante la detección sérica del ARN del VHC.
Casos descritos de lupus eritematoso sistémico en pacientes infectados por el VHC
Se han publicado de forma aislada casos de pacientes con infección crónica por el VHC en los que se ha realizado un diagnóstico de LES. Históricamente, Perek et al43 describieron en 1984 a un paciente con LES, hepatomegalia y crioglobulinemia, que podría ser el primer caso descrito de infección por VHC en un paciente con LES. Después del aislamiento del VHC en 1989, se han descrito algunos casos de asociación entre el LES y el VHC44-46. Borisova et al47 describen a una paciente con LES y coinfección por el VHC y el virus de la hepatitis B (VHB), McMurray48 describe el inicio coincidente del VHC y el LES en otro paciente y Albero et al49 presentan un caso similar. Recientemente se han descrito 2 nuevos casos de pacientes con LES e infección por VHC50,51. Por otra parte, algunos autores han descrito a pacientes con LES dentro de sus series de casos con infección crónica por el VHC. Cacoub et al16 identificaron en su cohorte de 321 pacientes infectados por el VHC a un total de seis (2%) con LES, mientras que Rivera et al52, en un estudio realizado sobre 28 pacientes infectados por el VHC con afección musculosquelética, encontraron como diagnóstico final LES en un 4%.
Simulación del lupus eritematoso sistémico por la infección por VHC
Manifestaciones clínicas comunes. Dentro del cortejo autoinmune clínico e inmunológico que se asocia a la infección por el VHC existen manifestaciones que se solapan claramente con varios de los criterios diagnósticos propuestos por el ACR53 (tabla 3), y que en caso de coincidir en un mismo paciente, pueden ocasionar un diagnóstico de LES. A continuación, analizaremos aquellas manifestaciones que se observan con relativa frecuencia en pacientes con infección por el VHC, como la afección articular y renal, ciertas hemocitopenias, ANA y anticuerpos antifosfolipídicos (AAF).
1. Afección articular. Las características de la artritis asociada a la infección por VHC (poliartritis no erosiva y no deformante, de pequeñas y grandes articulaciones)15,54 son similares a las de la artritis que puede observarse en el paciente con LES. La afección articular se ha descrito clásicamente en pacientes con enfermedades hepáticas. Ya en 1967 se describió a 13 pacientes con «cirrosis de Laennec» y una poliartritis inflamatoria no erosiva55, en lo que quizá sea la primera manifestación «extrahepática» descrita en un paciente con hepatopatía crónica. Pocos años después se describió la presencia de artritis o artralgias transitorias en una hepatitis aguda, que se autolimitaban al iniciarse la fase de ictericia56. Desde el descubrimiento del VHC, se han descrito numerosos casos de poliartritis en pacientes con infección crónica por el VHC54,57-61. Actualmente, se considera que la afección articular es una de las manifestaciones extrahepáticas más frecuentes, e incluso se ha descrito el aislamiento del ARN del VHC en el líquido sinovial62. La afección articular puede aparecer en un paciente con infección por el VHC ya conocida, o puede ser la manifestación clínica inicial de dicha infección36. Aunque se han descrito de forma aislada numerosos casos de artritis en pacientes infectados por el VHC54,57-61, la evaluación en grandes series evidencia porcentajes diversos. Excepto en el trabajo de Rivera et al31, en el que se describe un 20% de pacientes con artritis, los demás autores presentan porcentajes cercanos al 5%15,16,30. Por ejemplo, Cacoub et al16 detectan artralgias en 60 (19%) y artritis en seis (2%) de los 321 pacientes estudiados. Por tanto, aunque la existencia de poliartralgias es un hecho frecuente en el paciente infectado por el VHC (cerca del 20% de pacientes)16, la artritis se describe con menos frecuencia.
2. Afección renal. La afección renal más frecuente es la glomerulonefritis (GN), asociada en muchas ocasiones a la existencia de un síndrome crioglobulinémico, aunque existen casos no asociados a crioglobulinemia63,64. Los tipos de nefropatía relacionados con más frecuencia con la infección por el VHC son la GN membranoproliferativa63 (con características similares a los tipos III-IV de nefropatía lúpica) y la GN membranosa65,66 (equivalente a la nefropatía lúpica tipo V). Los pacientes VHC con GN membranoproliferativa suelen presentar en un 50% de casos alteración del sedimento urinario y/o insuficiencia renal, un 25% un síndrome nefrótico y el restante 25% un síndrome nefrítico64,67-74. En cambio, la mayoría de pacientes con GN membranosa (> 80%) se presenta con un síndrome nefrótico, mientras que el resto presenta proteinurias inferiores al intervalo nefrótico66,67,73,75,76. Aunque sin especificar el tipo de lesión, algunos estudios analizan la afección renal en series de pacientes VHC+. Rivera et al31 describen nefropatía en 20 (11%) de 189 pacientes con infección por el VHC analizados, mientras que Romero et al30 encuentran un porcentaje del 5%. Ya que el paciente con infección por el VHC puede presentar en ocasiones un perfil hepático normal, la afección renal en uno de estos pacientes, junto a otros datos clínicos e inmunológicos, puede hacernos pensar erróneamente en una nefropatía lúpica, y es muy importante determinar en estos casos la posible existencia de crioglobulinas. Debemos tener en cuenta, además, que en algunos de los pacientes con VHC y nefropatía, ésta puede reflejar el deterioro renal que se suele observar en pacientes con afección hepática grave (síndrome hepatorrenal), por lo que su nefropatía no estaría relacionada con fenómenos inmunológicos.
3. Afección hematológica. El paciente con infección por el VHC puede presentar de forma frecuente plaquetopenia o leucopenia, al igual que los pacientes con LES. La plaquetopenia es uno de los hallazgos hematológicos más frecuentemente descritos en el paciente con VHC, e incluso suele ser uno de los motivos de sospecha diagnóstica de dicha infección. Nagamine et al77 describen plaquetopenia (< 150.000/μl) en 151 (41%) de 368 pacientes VHC, y Rivera et al31 (< 100.000/μl) en 55 (29%) de 189 pacientes. La leucopenia es otro de los hallazgos hematológicos frecuentes en la infección crónica por el VHC. Sólo Rivera et al31 la estudian en su serie de pacientes y la encuentran en un 17% (< 4.000/μl). La existencia de hemocitopenias en el paciente con infección por el VHC está en relación directa con el hiperesplenismo que presentan muchos de los pacientes.
Manifestaciones inmunológicas comunes. La presencia de ANA (anticuerpos antinucleares) positivos en el paciente con infección por el VHC debe considerarse como un dato frecuente. Aunque el porcentaje de ANA en estos pacientes varía mucho según los diversos estudios, debido a las distintas técnicas y al título considerado como positivo, el análisis de los principales trabajos revela que sobre un total de 2.367 pacientes analizados13-31, 450 (19%) presentaban títulos de ANA iguales o superiores a 1/40. En 4 estudios13,16,19,31 se detallan los valores de los títulos. Se describen títulos superiores o iguales a 1/160 en 29 (36%) de los 80 pacientes VHC-ANA+, mientras que los restantes 51 (64%) presentaban títulos de 1/40-1/80. Títulos superiores o iguales a 1/320 se describen en 14 pacientes, y superiores o iguales a 1/640 en cuatro, aunque en estos pacientes con títulos tan elevados de ANA, no se describen las posibles especificidades asociadas. Por otra parte, la prevalencia de AAF en pacientes con infección por el VHC es también significativamente elevada (17%), tal como analizaremos más adelante.
Aspectos diferenciales del lupus eritematoso sistémico y la infección por el VHC
A diferencia de las manifestaciones que acabamos de analizar, existen afecciones que podríamos considerar como «propias» del LES y que se observan con extraordinaria rareza en la infección por VHC (tabla 4). Éstas deberían ser atribuidas a la existencia de un LES «verdadero» coexistente con la infección crónica por el VHC.
Manifestaciones clínicas diferenciales. Respecto a las manifestaciones cutáneas, no hemos encontrado en ningún trabajo realizado en pacientes infectados por el VHC la descripción de exantema malar, lupus discoide ni fotosensibilidad. En nuestro estudio42, al comparar a los pacientes con LES sin infección por VHC con aquellos con LES e infección por el VHC, estos últimos presentaron una menor frecuencia de afección cutánea específica de LES (el 40 frente al 76%; p = 0,01). Por otra parte, tan sólo se ha publicado el caso de un paciente con infección por el VHC que desarrolló aftas orales y genitales78, aunque no se ha descrito la presencia de aftas orales en ningún otro trabajo realizado en pacientes VHC.
La afección del sistema nervioso central no es una de las manifestaciones extrahepáticas descritas habitualmente en estos pacientes. Cacoub et al16 no describen ningún caso en sus 321 pacientes, aunque sí se ha descrito algún caso aislado79. Petty et al79 describen a 2 pacientes infectados por el VHC con crioglobulinemia que presentaron isquemia cerebral y convulsiones, y Shingal et al80 describen, a su vez, a uno con trombosis del seno venoso cerebral que comenzó con crisis comicial. La afección del sistema nervioso central (SNC) en el paciente con crioglobulinemia es un hecho relativamente frecuente81-86, por lo que la existencia de afección del SNC en un paciente VHC+ debería estar asociada a la presencia de crioglobulinas.
No se ha descrito la existencia de serositis (pleuritis y/o pericarditis) en las grandes series de pacientes infectados por el VHC, pero sí que existen casos aislados. Safadi et al87 describen un paciente cirrótico con infección por el VHC que presentó ascitis y derrames pleural y pericárdico, con crioglobulinemia asociada y resolución de la serositis tras iniciar tratamiento con ribavirina. Existe algún otro caso aislado de derrame pleural88 o pericárdico89. Por otra parte, en algún caso se ha demostrado que la ascitis a través de una comunicación peritoneopleural puede ser responsable de la serositis90. Por tanto, en el paciente infectado por el VHC con serositis (especialmente pleuritis) debemos descartar la existencia de crioglobulinemia o que esta pleuritis sea secundaria a una ascitis torácica asociada a la insuficiencia hepática. Finalmente, y dentro de las manifestaciones hematológicas, la descripción de anemia hemolítica en el paciente con infección por el VHC es un hecho excepcional91, relacionado casi siempre con la administración de interferón (INF)92-95 o con procesos neoplásicos asociados96.
Manifestaciones inmunológicas diferenciales. En el aspecto inmunológico, ya hemos visto en la introducción que los porcentajes de positividad de anticuerpos anti-ADN en pacientes con infección por el VHC son muy bajos (un 4% en la serie de Buskila et al15, un 3% en la de Cacoub et al16). El estudio de anticuerpos anti-ADN se ha realizado en un total de 464 pacientes con infección por el VHC15,16,19, con positividad en 12 (3%), aunque no se describen los títulos. En nuestro estudio42, al comparar con los pacientes con LES sin esta infección, aquellos con LES y VHC presentaron una menor frecuencia de anticuerpos anti-ADNds (el 33 frente al 81%; p < 0,001), además de presentar una mayor frecuencia de valores bajos de C4 (el 73 frente al 39%; p = 0,002) y CH50 (el 73 frente al 44%; p = 0,03) y crioglobulinemia (el 60 frente al 22%; p = 0,02). Además, los mayores valores de anticuerpos anti-ADN se observaron en los pacientes con LES sin infección por el VHC. Finalmente, no hemos encontrado en ningún estudio la positividad de anticuerpos anti-Sm en pacientes con infección por el VHC.
Lupus eritematoso sistémico, VHC y crioglobulinas
El interés del análisis de las crioglobulinas en el LES y su posible relación con el VHC empieza por una cuestión histórica, ya que antes de 1989 no se habían realizado estudios sobre este tema. Precisamente, es en el año 1989 cuando se aísla el VHC. Es bien conocido que el síndrome crioglobulinémico puede originar un cuadro multisistémico caracterizado por afección articular, nefropatía e hipocomplementemia. Previamente existían pocos estudios acerca del significado clínico de la crioglobulinemia en el LES, con una prevalencia observada del 16-83% en series pequeñas de pacientes97-103. Las crioproteínas que se detectan en el LES contienen inmunoglobulinas, principalmente IgG e IgM, y fracciones del complemento97,99,104,105. También se ha analizado la existencia de autoanticuerpos en el crioprecipitado, especialmente anti-ADNds, anti-ADNss y, más raramente anti-RNP, y se ha descrito su correlación con los anticuerpos aislados del fluido glomerular de pacientes con LES106.
Recientemente, hemos analizado el papel del VHC en la crioglobulinemia asociada con el LES. En nuestro estudio107 hemos detectado crioglobulinas en el 25% de nuestros pacientes con LES, en la mayoría de casos con cantidades muy pequeñas de crioglobulinas circulantes (criocrito < 1%). De forma similar, Gripenberg et al108 también encuentran bajos valores de crioglobulinas (< 0,05 g/l) en el 81% de sus pacientes con LES. Algún estudio encuentra asociación entre la presencia de crioglobulinas y la actividad lúpica97,109, o con la afección renal101,106,110, aunque nosotros al igual que otros autores108 no hemos encontrado asociación clínica significativa. El dato principal de nuestro estudio fue la detección de infección por VHC en el 21% de los pacientes con LES y crioglobulinas, frente a sólo el 4% de los pacientes con LES sin crioglobulinas. Tal como hemos comentado anteriormente, en los pacientes con crioglobulinemia asociada al VHC pueden observarse numerosas manifestaciones clínicas e inmunológicas similares al LES. Por tanto, nuestro estudio ha puesto de manifiesto la importancia de estudiar la infección por el VHC en los pacientes con LES y crioglobulinemia, ya que podríamos estar frente a un paciente con crioglobulinemia asociada al VHC que esté simulando un LES, con las implicaciones pronósticas y terapéuticas que ello representa.
Lupus eritematoso sistémico, VHC y tratamiento con interferón
El tratamiento con INF se ha asociado con mucha frecuencia a la aparición de manifestaciones clínicas e inmunológicas de tipo autoinmune. La administración de INF se ha asociado a la detección posterior de diversos autoanticuerpos, especialmente antinucleares y anticuerpos antitiroideos, aunque también se ha descrito la aparición de anticuerpos anti-ADN111. Por otra parte, uno de los aspectos más interesantes asociado a la administración de INF es el desencadenamiento en algunos pacientes de una enfermedad autoinmune que hasta entonces permanecía latente. Son numerosas las enfermedades autoinmunes sistémicas descritas aunque la más frecuente es el LES, ya que se han descrito un total de 14 pacientes que han desarrollado un LES después de la administración de INF112-121. Por tanto, en la valoración de las manifestaciones autoinmunes asociadas al VHC siempre debe descartarse un tratamiento previo con INF.
Implicaciones clínicas de la coexistencia de lupus eritematoso sistémico y VHC
Tal como hemos comentado en apartados anteriores, la infección crónica por el VHC se ha asociado a la presencia de numerosas manifestaciones autoinmunes clínicas e inmunológicas. En este contexto de autoinmunidad, es posible que la coincidencia de varias de estas manifestaciones en un mismo paciente pueda ocasionar el diagnóstico de LES. En nuestro estudio, dividimos a los pacientes con LES y positividad para anticuerpos anti-VHC en tres grupos diferenciados. En el primer grupo incluimos a los pacientes con resultado positivo de ELISA y confirmación negativa mediante RIBA-3 y PCR; consideramos a estos pacientes portadores de un LES con una falsa positividad por ELISA-3 para VHC. En el segundo grupo incluimos a aquellos pacientes con al menos dos de los siguientes criterios «específicos» de LES: eritema malar, lesiones discoides, lupus cutáneo subagudo, fotosensibilidad, criterios neurológicos, ANA ≥ 1/160, anti-ADNds > 15 U/ml o anticuerpos anti-Sm. Finalmente, en el tercer grupo incluimos a los restantes pacientes, que presentaban un cuadro clínico muy similar, caracterizado principalmente por afección articular, criterios hematológicos, títulos bajos de ANA (1/40 o 1/80) y anti-ADNds (< 15 U/ml), y presencia de crioglobulinas42.
La infección crónica por el VHC es capaz de producir diversas manifestaciones autoinmunes clínicas y serológicas (artritis, nefropatía, hemocitopenias y bajos títulos de ANA o anti-ADNds) las cuales, en combinación, pueden ocasionar que un paciente infectado por el VHC cumpla criterios suficientes para poder ser diagnosticado de LES. Es lo que, sin duda, ocurre con el tercero de los subgrupos de pacientes LES-VHC que describimos42. Todos ellos presentaban un LES de «bajo voltaje», caracterizado principalmente por afección articular, criterios hematológicos, títulos bajos de ANA (1/40 o 1/80) y anti-ADNds < 15 U/ml, y presencia de crioglobulinas en 4 de 5 pacientes estudiados. Creemos que en este subgrupo de pacientes la infección crónica por el VHC (asociado en muchos casos con crioglobulinemia) es capaz de inducir un síndrome clínico superponible al de un lupus leve, un síndrome lupus-like, que es capaz de simular un LES de acuerdo con los criterios revisados del ARA de 198253.
Por otra parte, hemos analizado la existencia de manifestaciones clínicas e inmunológicas típicas del LES que no se han descrito o que suelen ser extraordinariamente raras en pacientes con VHC, y que hemos considerado como «específicas» de LES: son especialmente las manifestaciones cutáneas lúpicas, las manifestaciones neurológicas, valores elevados de ANA y anticuerpos específicos del LES como los anti-ADNds y los anti-Sm. El segundo grupo de pacientes LES-VHC que hemos descrito presenta al menos dos de estas manifestaciones específicas. Creemos que estos pacientes deben considerarse como un LES «verdadero», coexistente con una infección por el VHC asociada. Respecto al papel etiopatogénico del VHC en estos pacientes, caben dos posibilidades: la asociación puramente casual o la asociación etiopatogénica. En un país con una moderada frecuencia de infección por el VHC, en algún paciente cabe la posibilidad de la asociación por azar de LES y VHC. De todas formas, la hipótesis de que el VHC pueda estar relacionado etiopatogénicamente con el LES es muy atractiva. En este sentido, las implicaciones terapéuticas se centran en definir si el paciente tiene dos enfermedades distintas, con una etiopatogenia y un enfoque terapéutico independientes (LES «verdadero» más infección por VHC) o por el contrario se trata de una única enfermedad (infección por el VHC que produce un síndrome lupus-like y simula un LES).
Síndrome antifosfolipídico y VHC
Prevalencia de la infección por VHC en el síndrome antifosfolipídico
La afección hepática en el síndrome antifosfolipídico (SAF) es poco frecuente122,123. Existen muy pocos estudios que hayan analizado la prevalencia de infección por VHC en pacientes con SAF. Nuestro grupo ha descrito recientemente124 una prevalencia similar (2%) a la observada en la población general en un grupo de 88 pacientes con SAF, y en otro estudio reciente40 no se detectó infección por VHC en ninguno de los 24 pacientes con SAF analizados. Por tanto, aunque son pocos los datos de los que se dispone, no parece existir una prevalencia aumentada de infección por VHC en series de pacientes con SAF (tabla 5).
Prevalencia de anticuerpos antifosfolipídicos en pacientes VHC
El estudio de los AAF en los pacientes VHC es un tema controvertido y de reciente actualidad. Del total de 1.073 pacientes analizados en 8 estudios16,40,125-130, 183 (17%) presentaban anticuerpos anticardiolipina (aCL), aunque los porcentajes varían mucho según los estudios (entre el 8 y el 37%) (tabla 6). Por ejemplo, en un estudio reciente, Prieto et al130 han detectado IgG-aCL en un 22% de los pacientes. Dichos aCL se encuentran con mayor frecuencia en pacientes que además de la infección por el VHC, presentaban crioglobulinemia, frente a aquellos que no la presentan (el 16 frente al 4%). Excepto por el isotipo IgG, estos aCL tienen las características de aquellos detectados en otras infecciones, esto es, título bajo, ausencia de eventos trombóticos y ausencia de anticuerpos anti-ß2GPI. La elevada proporción de aCL en pacientes con crioglobulinemia en comparación con aquellos que no la presentan y la ausencia de anticuerpos antinucleosoma, sugieren que estos aCL podrían ser secundarios a daño endotelial inducido por la crioglobulinemia o por el VHC en sí, más que por una activación policlonal inespecífica linfocitaria130.
Trombosis en pacientes con infección por el VHC
A pesar de que la existencia de AAF en pacientes VHC es un hecho relativamente frecuente, la presencia de manifestaciones trombóticas en los pacientes VHC-AAF+ es un hecho inhabitual. Del total de 853 pacientes con aCL e infección por el VHC en los que se revisó la existencia de fenómenos trombóticos de repetición40,125,126,128,129, sólo cinco (0,7%) las presentaron. Aunque en el estudio de Prieto et al130 se describen episodios trombóticos en 9 pacientes VHC con AAF positivos (infarto miocárdico en cinco, trombosis venosa profunda en dos, isquemia cerebral en uno y trombosis de la arteria central de la retina en uno), sólo dos de los pacientes VHC presentaron episodios trombóticos repetidos. De forma aislada, Puri et al131 han descrito un paciente VHC con trombosis venosa y arterial, y aCL-IgG positivos. Existen otros casos descritos de pacientes con trombosis, VHC y AAF132-135.
Síndrome antifosfolipídico, VHC y tratamiento con interferón
Aunque la administración de INF se ha asociado a la detección posterior de diversos autoanticuerpos, se ha descrito de forma excepcional la aparición de anticuerpos antifosfolipídicos125,136. A diferencia de lo que ocurría con el LES, no se ha descrito ningún caso de SAF desencadenado tras la administración de INF.
Implicaciones clínicas de la coexistencia de síndrome antifosfolipídico y VHC
La mayoría de los estudios publicados sugiere que la presencia de AAF en pacientes con infección por el VHC no parece tener un significado clínico claramente definido, debido a que habitualmente los AAF detectados son independientes del cofactor137 y a que su presencia no suele asociarse a manifestaciones clínicas trombóticas. Por tanto, en los pacientes con infección crónica por el VHC los AAF probablemente constituyan un epifenómeno secundario a la reacción cruzada entre antígenos virales y fosfolipídicos que ocurre durante la respuesta inmunológica frente al virus, por lo que en la práctica clínica no se recomienda su determinación sistemática en pacientes VHC138.