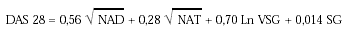Introducción
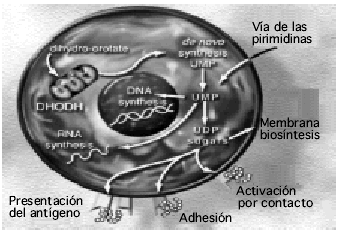
La artritis reumatoide (AR) es una enfermedad sistémica asociada con diversos niveles de morbimortalidad, de etiología desconocida, caracterizada por provocar inflamación crónica de las articulaciones diartrodiales que comporta su destrucción progresiva y aparición, con distintos grados, de deformidad e incapacidad funcional que prácticamente siempre son significativas. Hace 15 años Sherrer et al1 publicaron el primer estudio derivado de bases de datos masivas de pacientes con AR evaluados con el Cuestionario de Salud Health Assessment Questionnaire (HAQ) desde su diagnóstico. Sobre casi 700 pacientes seguidos durante una media de 12 años, se evidenció que la incapacidad funcional y la progresión radiológica de la AR siguen un curso acelerado durante los primeros años de enfermedad y que sólo un 10% de los pacientes quedan exentos de desarrollar incapacidad funcional significativa. El objetivo del tratamiento farmacológico debe ser disminuir la actividad inflamatoria de la enfermedad para minimizar la posibilidad de lesión articular, aliviar el dolor, mantener el mejor grado funcional y de calidad de vida posibles y, finalmente, conseguir una remisión completa2. Los fármacos modificadores de la enfermedad o de acción lenta intentan la remisión al reducir la actividad inflamatoria, principalmente sinovial, y sus consecuencias. La leflunomida, derivado del isoxazol, presenta un mecanismo de acción teórico muy atractivo; su metabolito activo (A771726) inhibe en los linfocitos T la enzima mitocondrial dihidroorotato deshidrogenasa y evita la piridinosíntesis de novo, así como la glucosilación de las moléculas de adhesión3 (fig. 1) manteniendo la vía alternativa4; de aquí que la adición de uridina al medio normalice el crecimiento de las células T afectadas por el fármaco5. Los linfocitos Th1 necesitan la piridinosíntesis de novo para proliferar al ser activados; de aquí que el efecto antiproliferativo del medicamento se realice sobre el principal brazo efector de los mecanismos fisiopatológicos conocidos de la artritis reumatoide4,6, teniendo un efecto inmunomodulador al no afectar a los linfocitos Th2 según se ha demostrado en modelos de artritis murina6 y más recientemente en estudios experimentales con linfocitos humanos7. Diversos ensayos clínicos multicéntricos controlados con placebo y/o comparador activo en fase III (1.839 pacientes con leflunomida) han demostrado un perfil de eficacia similar a metotrexato8,9 y la sulfasalacina10 mantenido en el tiempo (24 meses), pero con mejor tolerancia hematológica, pulmonar, renal y parecido perfil de tolerancia hepática. En marzo del 2001 la Agencia Española del Medicamento hizo pública una nota informativa11 donde se comunicaba la presencia de 295 alteraciones hepáticas de una base de datos estimada a escala mundial de 104.000 pacientes, año de los cuales dos casos desarrollaron cirrosis y 15 insuficiencia hepática, que fue mortal en 9 de ellos. En muchos de los casos notificados existían otros factores de riesgo. Así, en los casos considerados graves, 101 pacientes (78%) recibían tratamiento simultáneo con otros medicamentos con potencialidad para inducir toxicidad hepática. Además, en 33 de estos casos graves (27%) existían otros factores de riesgo como antecedentes de consumo excesivo de alcohol, alteraciones de la función hepática, insuficiencia cardíaca aguda, enfermedad pulmonar grave o carcinoma de páncreas. Las reacciones hepáticas aparecieron en el transcurso de los 6 primeros meses de tratamiento. La Agencia Española del Medicamento también consideró que en estos casos no se realizó una monitorización adecuada y probablemente no se respetaron las indicaciones de lavado del producto.
Figura 1. Probables mecanismos de acción de la leflunomida.
Metodología
Estudio multicéntrico, naturalístico, abierto, no controlado, observacional, longitudinal y prospectivo, en el que el propio paciente es el control de sí mismo. Reclutamos para el estudio a pacientes de consultas externas de los hospitales Carlos Haya de Málaga, Ruiz de Alda de Granada y Vigil de Quiñones de Sevilla. Se les administró una dosis de inicio de 100 mg durante los 3 primeros días, seguidos de una dosis de mantenimiento de 20 mg diarios. Los criterios de inclusión fueron edad igual o superior a 18 años, diagnóstico de artritis reumatoide según los criterios de la ARA (1987) y enfermedad activa (DAS28 > 3,2). Se admitía tratamiento concomitante con antiinflamatorios no esteroides (AINE) o corticoides (máxima 10 mg/día de prednisona o equivalente). Los criterios de exclusión eran: inmunodeficiencia importante, hipersensibilidad a la leflunomida o a alguno de sus excipientes, infecciones graves, hemoglobina < 9 g/dl, leucopenia < 3.500/μl, plaquetopenia < 120.000/μl, alteración de la función hepática, alteración de la función renal, pacientes en edad fértil que no utilizaron algún método anticonceptivo, embarazo o lactancia e hipoproteinemia intensa (albúmina < 3g/dl). La evaluación de los pacientes se realizó al inicio y en las semanas 4, 12 y 26. Los parámetros de valoración fueron: medida del dolor mediante escala analógica visual, valoración de la actividad de la enfermedad según paciente y médico, de la incapacidad funcional mediante la escala modificada del Health Assessment Questionnaire (MHAQ), duración de la rigidez matutina e índice DAS (Disease Activity Score), que contempla el número de articulaciones dolorosas (NAD), articulaciones tumefactas (NAT), velocidad de sedimentación globular (VSG) y estado de salud general (SG) en el día de la visita según la siguiente fórmula:
Las medidas analíticas de eficacia fueron la VSG, la proteína C reactiva (PCR) y el título de factor reumatoide, y las de tolerancia, las determinaciones de las tres series del hemograma, cifras de GOT-ALT, GPT-AST y perfil bioquímico elemental. Se valoró en la anamnesis y exploración clínica de cada revisión la aparición de efectos secundarios medicamentosos.
Análisis estadístico
En la evaluación estadística se han utilizado el análisis de la variancia para series repetidas y las pruebas de Friedman, Wilcoxon y McNemar, realizando, en todo caso, contraste bilateral. Los resultados se han considerado estadísticamente significativos cuando el error alfa fue inferior a 0,05.
Resultados
En el estudio se incluyó a 98 pacientes, de los que se evaluaron 97 en tres centros hospitalarios. La edad media (± DE) de los pacientes fue de 57,2 ± 12,0 años y el rango de edad fue de 25 a 76 años; la mediana de edad se sitúa en 57,9 años. La frecuencia de mujeres en la muestra (78,7%) se encuentra en proporción casi de 4 a 1 respecto a la de varones. La media de edad de las mujeres con AR activa (57,9 ± 11,9 años) es similar a la de los varones (56,8 ± 12,3 años), diferencia que no es estadísticamente significativa (p = 0,748; prueba de la t de Student para grupos independientes).
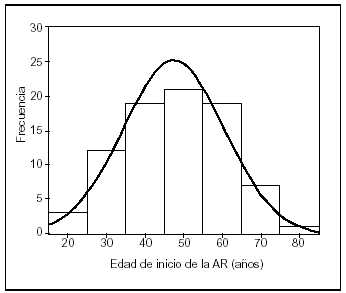
La AR comenzó en los pacientes a los 47,5 ± 13,0 años de edad (rango, 18-76 años) (fig. 2); la mediana de la edad de comienzo se sitúa en 47,2 años. La media de edad de comienzo en las mujeres (47,4 ± 13,0 años) es similar a la de los varones (47,7 ± 13,3 años), no siendo esta diferencia estadísticamente significativa (p = 0,915; prueba de la t de Student para grupos independientes).
Figura 2. Distribución por edades de comienzo de la enfermedad.
El tiempo transcurrido desde el comienzo de la enfermedad hasta el diagnóstico fue de 2,2 ± 3,4 años (rango, 0 a 26 años); la mediana del tiempo se sitúa en 1,0 años. El tiempo transcurrido desde el comienzo de la enfermedad hasta el diagnóstico en las mujeres (2,3 ± 4,1 años) es similar al de los varones (1,7 ± 2,1 años), no alcanzando esta diferencia significación estadística (p = 0,633; prueba de Mann-Whitney para grupos independientes).
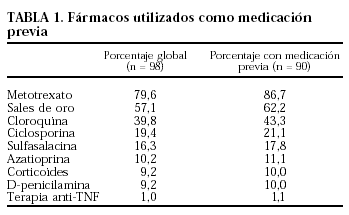
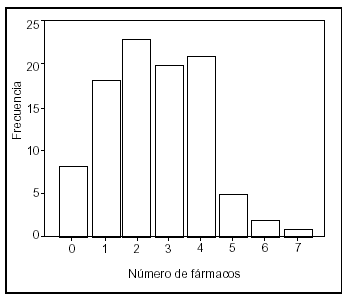
El 91,8% de los pacientes habían recibido medicación previa (tabla 1), habiendo estado tratados, por término medio, con 2,8 ± 1,4 fármacos (mínimo 1 y máximo 7), siendo la mediana de tres fármacos (fig. 3).
Figura 3. Frecuencia del número de fármacos recibidos como medicación previa.
El peso medio de los pacientes en la visita inicial fue de 69,3 ± 10,6 kg (rango, 45-102 kg). La mediana del peso se situó en 69 kg. Si bien existen algunas modificaciones a lo largo del estudio, no se aprecian diferencias significativas en las semanas 4 (p = 0,357) y 28 (p = 0,706) respecto del peso medio inicial (semana 0).
La presión arterial sistólica (PAS) media en la visita inicial fue de 132,3 ± 13,7 mmHg (rango, 100-170 mmHg). La mediana era de 130 mmHg. Si bien existen algunas modificaciones a lo largo del estudio, no se aprecian diferencias significativas en las semanas 4 (p = 0,722), 12 (p = 0,778) y 28 (p = 0,719) respecto de la TAS media inicial (semana 0).
La presión arterial diastólica (PAD) media fue de 77,7 ± 8,0 mmHg (rango, 60-95 mmHg). La mediana era de 80 mmHg. Si bien existen algunas modificaciones a lo largo del estudio, no se aprecian diferencias significativas en las semanas 4 (p = 0,229), 12 (p = 0,120) y 28 (p = 0,082) respecto de la PAD media inicial (semana 0).
La puntuación media en la escala analógica visual de dolor (EAV) en la visita inicial fue de 6,6 ± 1,4 cm (rango: 1,4 a 9,0 cm). La mediana de puntuación en la EAV fue de 7,0 cm. Se aprecia una disminución significativa en las semanas 4 (p = 0,00002), 12 (p = 0,0008) y 26 (p = 0,000001), respecto de la puntuación media inicial (semana 0), lo que indica que la puntuación disminuye ya en la semana 4 y el descenso se mantiene hasta la semana 26.
La valoración global de la actividad de la enfermedad según el médico en la visita inicial fue de 6,5 ± 1,1 cm (rango, 1,0-9,5 cm) en la EAV. La mediana de puntuación en la EAV fue de 6,5 cm. Se aprecia una disminución significativa en las semanas 4 (p < 0,000001), 12 (p < 0,000001) y 28 (p = 0,0001), respecto de la puntuación inicial (semana 0), lo que indica que, en la opinión del médico, la actividad de la enfermedad disminuye ya en la semana 4 y el descenso se mantiene hasta la semana 28.
La valoración global de la actividad de la enfermedad según el paciente en la visita inicial fue de 6,7 ± 1,3 cm (rango, 1,0-9,0 cm) en la EAV. La mediana de puntuación en la EAV fue de 7,0 cm. Se aprecia una disminución significativa en las semanas 4 (p = 0,00007), 12 (p = 0,0005) y 28 (p = 0,00008), respecto de la puntuación inicial (semana 0), lo que indica que, en la opinión del paciente, la actividad de la enfermedad disminuye ya en la semana 4 y el descenso se mantiene hasta la semana 28.
La valoración global de la incapacidad funcional en la visita inicial fue de 1.351 ± 0,577 puntos (rango: 0,250-2,625 puntos) en la MHAQ. La mediana de la puntuación inicial fue de 1,375 puntos. Se aprecia una disminución significativa en las semanas 4 (p = 0,0001), 12 (p = 0,0001) y 26 (p = 0,0001), respecto de la puntuación inicial (semana 0), lo que indica que la incapacidad funcional disminuye ya en la semana 4 y el descenso se mantiene hasta la semana 26.
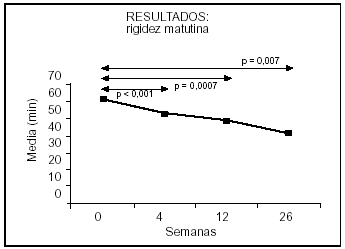
La duración de la rigidez matutina (fig. 4) en la visita inicial fue de 59,8 ± 73,0 min (rango, de 0-8 h). La mediana de la rigidez matutina se situó 37,5 min. Se aprecia una disminución significativa en las semanas 4 (p = 0,0002), 12 (p = 0,002) y 26 (p = 0,036) respecto de la rigidez media inicial (semana 0).
Figura 4. Evolución de la rigidez matutina.
El número medio de articulaciones dolorosas en la visita inicial fue de 15,2 ± 6,4 articulaciones (rango, 2-28 articulaciones). La mediana fue de 15 articulaciones. Se aprecia una disminución muy significativa en las semanas 4 (p < 0,00001), 12 (p = 0,0096) y 26 (p = 0,00017) respecto del número inicial (semana 0). El número medio de articulaciones inflamadas en la visita inicial fue de 10,2 ± 6,5 articulaciones (rango, 0-26 articulaciones). La mediana fue de 10 articulaciones. Se aprecia una significativa disminución en las semanas 4 (p = 0,0003), 12 (p = 0,0002) y 26 (p = 0,016), respecto del número inicial de articulaciones inflamadas (semana 0).
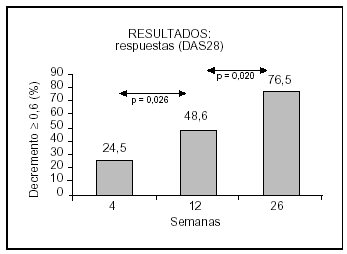
La puntuación DAS28 de la actividad de la enfermedad en la visita inicial fue de 6,31 ± 0,92 puntos (rango, 4,25-8,35 puntos). La mediana fue de 6,44 puntos. Se aprecia una disminución muy significativa en las semanas 4 (p < 0,00001), 12 (p = 0,0001) y 26 (p < 0,00001), respecto de la puntuación inicial (semana 0). Los porcentajes de respuesta significativa (descenso de la puntuación DAS28 de 0,6 puntos o más) se presentan en la figura 5.
Figura 5. Porcentaje de descenso significativo en la puntuación DAS 28.
La VSG media en la visita inicial fue de 38,4 ± 23,2 mm/h (rango, 3-114 mm/h). La mediana de VSG se situó 34 mm/h. No se aprecia una disminución significativa en las semanas 4 (p = 0,781) y 12 (p = 0,187), pero la reducción sí es significativa en la semana 26 (p = 0,036), respecto de la VSG media inicial (semana 0).
La PCR media en la visita inicial fue de 12,7 ± 17,2 (rango, 0,3-73,5). La mediana de PCR fue de 6. No se aprecia una disminución significativa en la semana 4 (p = 0,873), pero la reducción sí es significativa en las semanas 12 (p = 0,027) y 26 (p = 0,023), respecto de la PCR media inicial (semana 0).
El nivel de factor reumatoide (FR) medio en la visita inicial fue de 174,4 ± 204,5 (rango, 1-860). La mediana de FR se situó en 106. No se aprecia una disminución significativa en las semanas 4 (p = 0,323) y 12 (p = 0,402), pero la reducción sí es significativa en la semana 26 (p = 0,022), respecto del FR medio inicial (semana 0).
Los valores medios de la serie roja no varían de forma significativa a lo largo del estudio respecto del valor medio inicial. La cifra media de leucocitos en la visita inicial fue de 7.003 ± 2.498/μl (rango, 3.510-15.440/μl). Si bien existen algunas oscilaciones a lo largo del estudio, no se aprecian diferencias significativas en la semana 28 (p = 0,232) respecto del valor de leucocitos medio inicial (semana 0). La cifra media de plaquetas en la visita inicial fue de 297.000 ± 89.002/μl (rango, 158.000-571.000/μl). La mediana se situó en 277.000. No se aprecia una disminución es significativa en las semanas 4 (p = 0,073) y 12 (p = 0,083), pero la reducción sí es significativa en la semana 26 (p = 0,029), respecto del valor medio inicial (semana 0), si bien los valores medios se encuentran dentro de la normalidad en todas las evaluaciones. El valor medio de GOT en la visita inicial fue de 21,0 ± 10,0 U/l (rango: 9-61 U/l). La mediana de GOT se situó en 17 U/l. Si bien existen algunas oscilaciones a lo largo del estudio, no se aprecian diferencias significativas en la semana 4 (p = 0,270) ni a la 12 (0,055) respecto del valor medio de GOT inicial (semana 0), pero sí se produce un aumento significativo en la semana 26 (p = 0,008) respecto del valor medio de la visita inicial, aunque el valor alcanzado se encuentra dentro del rango de normalidad. La cifra media de GPT en la visita inicial fue de 29 ± 19 U/l (rango, 6-81 U/l). La mediana de GPT se situó en 25 U/l. No se aprecian diferencias significativas en las semanas 4 (p = 0,469), 12 (p = 0,794) y 26 (p = 0,318) respecto del valor medio de GPT inicial (semana 0).
Globalmente, 33 pacientes (34%) refirieron acontecimientos adversos (AA) en, al menos, una de las visitas. De éstos, 22 (66,7% de los pacientes con AA) comunicaron acontecimientos adversos sólo en una visita, otros 10 (30,3%) en dos visitas y uno (3,0%) en tres visitas.
Se registraron 10 abandonos (tabla 2) y en 7 casos se tuvo que reducir la dosis a 10 mg (tabla 3)
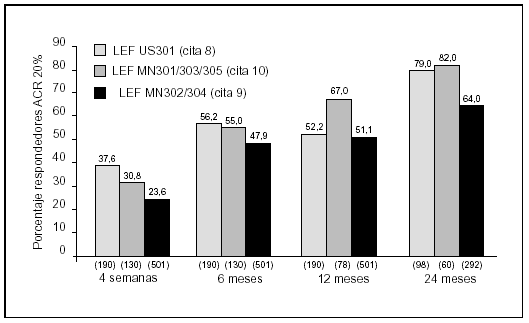
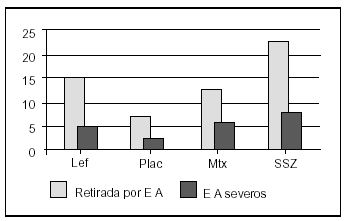
En este estudio la leflunomida ha sido eficaz en el alivio de los síntomas y signos de la AR. La mejoría fue rápida y significativa en la media de las variables de desenlace establecidas para el seguimiento. Los fármacos antirreumáticos modificadores de la enfermedad (FAME) se usan desde hace años de forma empírica sin un mecanismo de acción claramente definido para muchos de ellos; sin embargo, existen importantes evidencias científicas del mecanismo de acción de la leflunomida a diversos niveles del ciclo celular que podría implicar a células T activadas y no a otras células en crecimiento de estirpe mielocítica o epitelial con síntesis de pirimidinas por vía alternativa12. La terapia mantenida con FAME se presenta difícil, bien por falta de eficacia13, bien por toxicidad14. La leflunomida ha entrado recientemente en nuestro arsenal terapéutico no sólo con unos índices de eficacia tan válidos como los FAME más activos, sino con resultados consistentes entre los diferentes estudios que mejoran conforme se prolonga la duración del tratamiento (fig. 6). Su efecto protector para evitar o retrasar el daño radiológico en relación con placebo y comparadores activos también ha quedado señalado15. De igual forma existen estudios donde se demuestra su eficacia como fármaco activo para evitar el menoscabo funcional propio de la artritis reumatoide8,16. Nuestros resultados concuerdan con los de la bibliografía en cuanto a rapidez de acción y tasa de respuesta, que ya es evidente en todos los parámetros a las primeras 4 semanas y se mantiene hasta los 6 meses. La toxicidad obligó en nuestro estudio a retirar la medicación en el 8% de las ocasiones y a disminuir la dosis en un 7% de casos. La ineficacia obligó a la retirada en un 2%. En la figura 7 se exponen las tasas de retirada en los estudios en fase III de la molécula en relación con comparadores activos. Los datos obtenidos de este estudio observacional son alentadores ante una nueva alternativa terapéutica para la AR que es segura si se monitoriza correctamente y se siguen las indicaciones de la ficha técnica. Queda para un futuro el uso de combinaciones con otros FAME que deben evaluarse conforme existan evidencias en la bibliografía17- 19.
Figura 6. Consistencia de resultados del tratamiento con leflunomida (LEF) en estudios fase 3.
Figura 7. Tasas de retirada por efectos adversos (EA) en los estudios en fase 3 de la leflunomida (Lef) en relación con placebo (Plac) y otros comparadores activos: metotrexato (Mtx) y sulfasalacina (SSZ).