El etanercept (ETN) es una proteína de fusión que contiene dos cadenas idénticas monoméricas recombinantes del receptor humano p75 del factor de necrosis tumoral (TNF), unidas a dominios del fragmento Fc de la IgG1 humana. Cada molécula de ETN puede unirse a dos de TNF alfa y, actuando como transportadora y antagonista, volverlo biológicamente inactivo1.
El ETN contiene 134 aminoácidos y tiene un peso molecular de 150 kD. Su absorción es lenta tras la administración subcutánea. Su vida media es de 115 h, con una concentración sérica máxima que se alcanza a las 51 ± 14 h. La biodisponibilidad de una dosis subcutánea de ETN es del 58%, comparada con la misma dosis intravenosa (100%). La farmacocinética del compuesto no parece estar afectada por el sexo, la edad ni la raza. Su aclaramiento es lento y no parece alterarse en la insuficiencia hepática o renal. No se han objetivado interacciones farmacológicas, clínicamente significativas, del ETN con la digoxina, la warfarina, el metotrexato (MTX), la aspirina, los antiinflamatorios no esteroides (AINE) ni con los glucocorticoides2.
Eficacia
El ETN ha sido evaluado en numerosos ensayos clínicos aleatorizados, comparativos frente a placebo o MTX, en pacientes con artritis reumatoide (AR), tanto en los EE.UU. como en Europa3-7. En estos estudios han sido incluidos más de 2.000 pacientes con AR, disponiéndose en la actualidad de datos del seguimiento controlado de la terapia con ETN en estos sujetos, de hasta 51 meses. La conclusión fundamental que se obtiene del examen de este programa de investigación es que el ETN, a la dosis de 25 mg subcutáneos inyectados 2 veces por semana, es un fármaco eficaz, bien tolerado y seguro para el tratamiento de la AR, tanto en pacientes con un comienzo reciente del proceso como en aquellos con enfermedad avanzada y refractaria a MTX y otros fármacos modificadores de enfermedad (FAME). El inicio de la respuesta terapéutica al ETN es rápido (1-2 semanas). La mejoría clínica puede incrementarse adicionalmente en los 3 o 6 primeros meses de administración del ETN, y se mantiene en el tiempo, hasta más allá de los 4 años. Ensayos específicos realizados en población geriátrica con AR revelan un resultado similar. En el momento de redactar este documento existen, además, estudios en marcha que investigan el uso del ETN en pacientes con AR y comorbilidad (diabetes mellitus).
Un estudio3 comparó 2 dosis de ETN (10 y 25 mg subcutáneos 2 veces en semana) con placebo, durante 6 meses, en pacientes con AR activa a pesar del uso previo de diversos FAME (más de uno y menos de cuatro). Al final del período de tratamiento, el 59% de los pacientes que recibieron 25 mg de ETN y el 51% de los que se inyectaron 10 mg presentaban respuestas ACR 20, frente al 11% en el grupo placebo (p < 0,001 para cada grupo que había recibido ETN frente al grupo placebo). A los 6 meses, asimismo, las respuestas ACR 50 y 70 fueron del 40 y el 15% en los pacientes que habían recibido 25 mg de ETN, frente al 5 y el 1% en el grupo placebo, respectivamente (p < 0,05 para todas las comparaciones de ETN 25 mg frente a placebo).
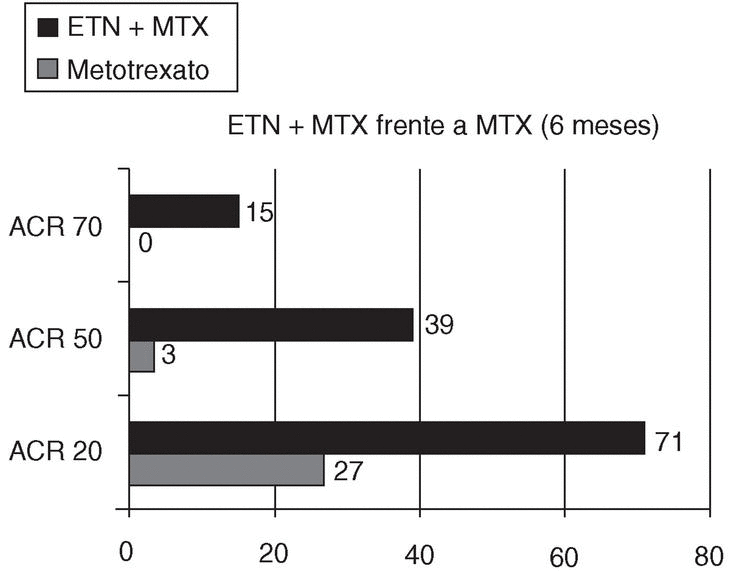
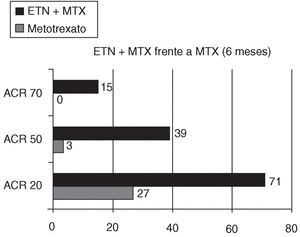
En un segundo estudio4 se investigó si la adición de ETN a la terapia con MTX podía suponer un beneficio añadido en pacientes con AR activa a pesar de tratamiento con MTX. Se comprobó, efectivamente, que la combinación de 25 mg subcutáneos 2 veces en semana de ETN con un tratamiento con MTX (a dosis estables de 15-25 mg/semana) originaba una mejoría rápida y mantenida, con respuestas ACR 20, 50 y 70, a los 6 meses de este tratamiento combinado, del 71, 39 y 15%, respectivamente, mientras que los pacientes que continuaban recibiendo sólo MTX, tras la aleatorización presentaban, al final del mismo período, respuestas ACR 20, 50 y 70, del 27, 3 y 0% (p < 0,001) (fig. 1).
Figura 1. Respuestas ACR en pacientes con artritis reumatoide tratados con metotrexato (MTX) o la combinación de metotrexato + etanercept (ETN).
El estudio ERA5 (Early Rheumatoid Artritis) se realizó en pacientes con AR de reciente comienzo (con menos de 3 años de evolución de la enfermedad) que no habían recibido previamente MTX. Se aleatorizaron 632 pacientes para recibir: a) MTX oral, en escalada rápida de la dosis hasta llegar a 20 mg/semana a los 2 meses de iniciado el tratamiento; b) 10 mg subcutáneos 2 veces en semana de ETN, o c) 25 mg subcutáneos de ETN 2 veces a la semana. A los 2 años de tratamiento se demostró que: a) la respuesta ACR 20 era mejor con ETN 25 mg que con MTX (p < 0,05); b) las respuestas ACR 50 y 70 fueron similares para ETN 25 mg y MTX, y c) se obtuvieron mejores resultados de eficacia con ETN 25 mg que con 10 mg.
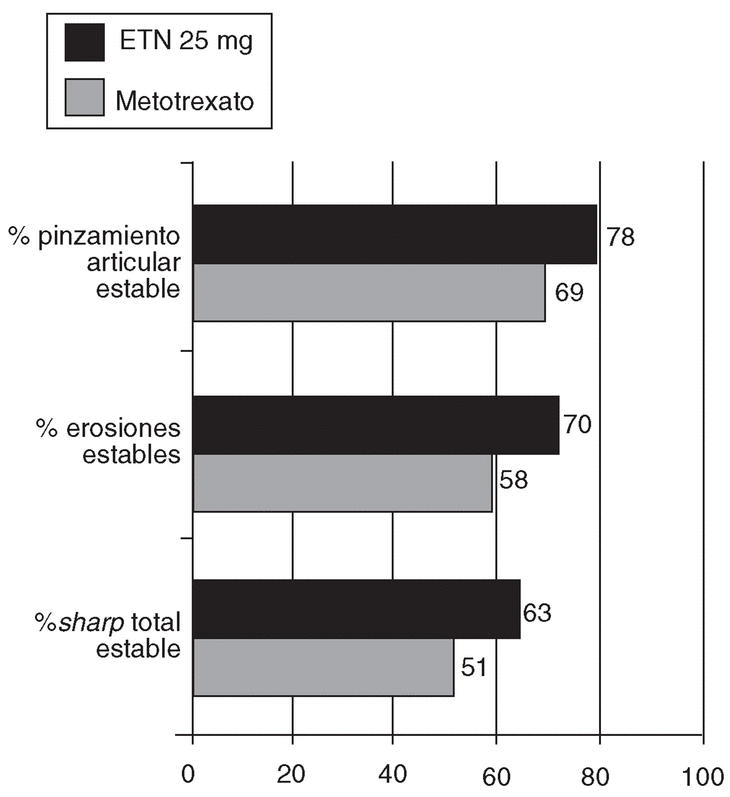
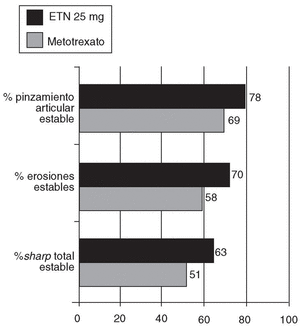
El estudio ERA5 confirmó por primera vez que el ETN es capaz de inhibir el daño estructural en la AR. Efectivamente, la progresión media, tras 24 meses de observación, del índice total de Sharp fue de 3,16 para el grupo tratado con MTX frente a 1,33 en el grupo que recibió 25 mg de ETN (p = 0,001). La progresión media de la puntuación de erosiones fue de 1,86 en los pacientes que recibieron MTX y de 0,66 en los que tomaron 25 mg de ETN (p = 0,001). No se observaron diferencias estadísticamente significativas en el cambio de puntuación del pinzamiento articular entre ambos grupos de tratamiento. El porcentaje de pacientes que no presentaban incremento en los anteriores parámetros, tras 2 años de tratamiento, se representa en la figura 25.
Figura 2. Porcentaje de pacientes con artritis reumatoide de reciente comienzo y que presentan parámetros radiológicos de daño estructural estable, tras 2 años de tratamiento con metotrexato o etanercept (ETN).
El ETN ha sido también probado en un ensayo clínico realizado en niños con artritis crónica juvenil (ACJ) de curso poliarticular (independientemente de su forma de comienzo) que no toleraban o presentaban una respuesta inadecuada al MTX6. En una primera fase abierta de este estudio, de 3 meses de duración, 69 niños con ACJ con edades comprendidas entre los 4 y los 17 años, recibieron 0,4 mg/kg de ETN en 2 dosis semanales (con un máximo de 25 mg por dosis), presentando el 74% de los mismos una mejoría del 30% o superior en al menos 3 de 6 indicadores de actividad de la enfermedad. Tras completar este período, los 51 niños respondedores fueron aleatorizados para recibir, en estudio doble ciego de 4 meses de duración, la misma dosis de ETN o placebo, observándose que el 81% de estos últimos abandonaban el estudio por reactivación de su enfermedad, frente al 28% de los que continuaban con ETN (p = 0,003). La mediana de tiempo hasta producirse la recidiva de la actividad de la enfermedad fue de 28 días para el grupo placebo y de más de 116 días en el grupo ETN (p < 0,001). Con posterioridad a esta fase, el estudio se ha continuado con una extensión abierta en la que se ha observado una recuperación de la eficacia del ETN en los pacientes que durante el período doble ciego recibieron placebo.
Finalmente, más de 600 pacientes procedentes de estudios de corta duración han continuado siendo evaluados de forma abierta, en un programa de seguimiento a largo plazo de la eficacia y seguridad de ETN7. El 17-28% de estos sujetos con AR alcanzan un 100% de mejoría en los parámetros individuales previos de actividad de la enfermedad, al cabo de una mediana de observación de 25 meses.
Seguridad
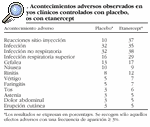
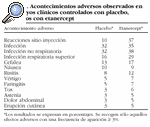
El ETN puede ser considerado como un fármaco seguro y bien tolerado7. En ensayos clínicos controlados con placebo, el acontecimiento adverso más frecuente (37%) en los pacientes que recibieron ETN fueron las reacciones locales en el punto de inyección (eritema, prurito, tumefacción)8,9 (tabla 1). Las reacciones alérgicas a ETN se han descrito en el 1,7% de los pacientes incluidos en ensayos clínicos. La tasa de infecciones en general y la de infecciones no respiratorias fue similar entre ETN y placebo. Sólo las infecciones del tracto respiratorio superior fueron más frecuentes en los pacientes tratados con ETN (29%) que en los que recibieron placebo (16%). El 4% de los pacientes incluidos en ensayos clínicos abandonaron el tratamiento por efectos adversos, tanto con ETN como con placebo. En los ensayos clínicos el porcentaje de acontecimientos adversos graves fue similar entre los grupos que recibían ETN y los que formaban MTX o placebo. El 6% de los pacientes con AR expuestos a ETN en ensayos clínicos hasta los 51 meses presentaban infecciones serias (requirieron hospitalización o tratamiento con antibióticos por vía intravenosa). La experiencia poscomercialización ha permitido detectar infecciones serias y casos de sepsis en pacientes tratados con ETN que, a veces, recibían otra terapia inmunodepresora acompañante y/o presentaban enfermedades asociadas que predisponían a la infección (p. ej., diabetes mellitus avanzada o mal controlada)10,11. Se han descrito 9 casos de tuberculosis por cada 100.000 pacientes expuestos al fármaco12.
La frecuencia de aparición y el tipo de las neoplasias aparecidas en 1.299 pacientes con AR tratados durante más de 5 años con ETN fueron similares a las esperadas para la población general13. Se han detectado anticuerpos anti-ETN, de carácter no neutralizante, en el 3% de los pacientes adultos y pediátricos. No se ha podido establecer una correlación entre el desarrollo de estos anticuerpos y la respuesta clínica o la aparición de efectos secundarios. La inmunogenicidad a largo plazo del ETN es, sin embargo, desconocida. En los ensayos clínicos, el porcentaje de pacientes tratados con ETN que desarrollaron anticuerpos antinucleares (11%) o anti-ADNn (15% por radioinmunoanálisis y 3% por critidia) fue superior a placebo, aunque ningún sujeto presentó datos clínicos sugerentes de lupus. No se conoce, no obstante, el impacto que pueda tener a largo plazo el tratamiento con ETN sobre la inducción de cuadros autoinmunes10. En la experiencia poscomercialización se han recogido casos de pacientes con inducción de autoanticuerpos que presentaron erupciones cutáneas compatibles con lupus subagudo14 o lupus discoide.
El tratamiento con ETN y otros agentes inhibidores del TNF se ha relacionado con casos raros de exacerbación o inducción de enfermedades desmielinizantes del sistema nervioso central (esclerosis múltiple, neuritis óptica, mielitis transversa)15. A finales de 2001 se habían recogido entre 20 y 25 casos de la anterior asociación. Se han sugerido diferentes posibilidades para explicar esta combinación16: a) asociación por el azar; b) la perturbación del sistema TNF/receptores TNF por los agentes anti-TNF podría potencialmente precipitar o exacerbar un cuadro desmielinizante subyacente, y c) asociación entre enfermedades autoinmunitarias y la esclerosis múltiple. El conocimiento de estos hallazgos obliga a contraindicar el uso de ETN en pacientes con esclerosis múltiple preexistente y otras enfermedades desmielinizantes del SNC y a monitorizar estrechamente a los pacientes con AR tratados con ETN, vigilando el posible desarrollo de síntomas y signos neurológicos e interrumpiendo su utilización ante el más mínimo hallazgo de daño en la sustancia blanca cerebral o medular espinal.
Se han descrito, asimismo, casos infrecuentes de asociación entre la terapia con ETN y cuadros de pancitopenia, incluyendo anemia aplásica10. No se han podido establecer si existen factores de riesgo para el desarrollo de estas alteraciones hematológicas. No se conoce el efecto del ETN sobre la fertilidad y desarrollo del feto humano. En ratas y conejos el producto no es teratogénico. Recientemente, además, se ha descrito el caso de una paciente con AR tratada con ETN que experimentó una ovulación exitosa, con embarazo y parto normales17.
En general, los acontecimientos adversos del ETN en niños son similares a los descritos para adultos, aunque la cefalea, las náuseas, los vómitos y el dolor abdominal aparecen con mayor frecuencia en individuos de menos de 17 años que reciben el fármaco. Dado que no se recomienda administrar vacunas con virus vivos en pacientes que reciben ETN, es aconsejable que los pacientes con ACJ hayan completado el programa de inmunizaciones antes de iniciar esta terapia10.
Otras consideraciones
La información proporcionada por la Base de Datos sobre Terapias Biológicas de la Sociedad Española de Reumatología (BIOBADASER) nos permite afirmar que la tasa de interrupción de estos tratamientos es del 12,4% anual en España, sin que se objetivaran diferencias de ETN frente a infliximab18. En otros estudios se ha encontrado, tras 51 meses de tratamiento con ETN, una tasa de discontinuación del 29%: un 8% por falta de eficacia y un 9% por efectos secundarios13. En un estudio sueco19 se halló que la eficacia de ETN es similar a la de infliximab. En pacientes con fallo terapéutico a ETN, el infliximab puede ser eficaz y a la inversa también es posible. Queda por saber si tras el control terapéutico óptimo de un paciente con AR con ETN, la terapia de mantenimiento debe plantearse con el mismo esquema de dosificación o éste puede ser reducido. Sería, asimismo, interesante conocer de antemano índices o parámetros aislados de respuesta o resistencia al ETN en pacientes con AR que nos permitieran su selección e indicación terapéutica eficiente. En este sentido, no parece que el polimorfismo simple del nucleótido en el sexto exón del TNFR2 se asocie como predictor de respuesta para el ETN en pacientes con AR20. La combinación de ETN con el antagonista del receptor de la interleucina 1 (anakinra) ha sido probada en pacientes con AR y parece exhibir un buen perfil de seguridad21. Datos observacionales sugieren, finalmente, que la combinación de ETN con MTX proporciona un beneficio añadido a los pacientes con AR con respecto al uso exclusivo de ETN22. Un ensayo clínico, actualmente en marcha, intentará confirmar la impresión anterior.