Introducción
La Agencia Europea del Medicamento1 autorizó la comercialización de adalimumab (Humira®), válida en toda la Comunidad Europea, el 8 de septiembre de 2002. La indicación aprobada es para el tratamiento de la artritis reumatoide activa, moderada a grave, en pacientes adultos, cuando la respuesta a fármacos antirreumáticos modificadores de la enfermedad, incluyendo el metotrexato, haya sido insuficiente.
Humira® puede ser administrado con metotrexato o con otros fármacos antirreumáticos modificadores de la enfermedad (FAME), aunque también se administra en monoterapia en caso de intolerancia a los FAME o cuando el tratamiento continuado con ellos es inapropiado.
La dosis recomendada de Humira® es de 40 mg, administrados en semanas alternas, como dosis única en inyección por vía subcutánea. En monoterapia, los pacientes que experimentan una disminución de respuesta pueden beneficiarse de un incremento en la intensidad de dosis a 40 mg/semana.
En pacientes ancianos no se requiere ajuste de dosis, y no ha sido estudiado en niños y adolescentes ni en pacientes con insuficiencia renal y/o hepática.
El Humira® está contraindicado en los casos de hipersensibilidad al principio activo o a alguno de sus excipientes, en casos de tuberculosis activa u otras infecciones graves tales como sepsis, e infecciones por gérmenes oportunistas y en la insuficiencia cardíaca moderada a grave (New York Heart Association [NYHA] clases III/IV).
Anticuerpo monoclonal humano. Mecanismo de acción
Por tecnología guiada de fagos, selección guiada de genes VH/VL humanos obtenidos desde el anticuerpo murino MK195F, se obtiene una versión totalmente humana del anticuerpo antifactor de necrosis tumoral (anti-TNF) murino, de similar afinidad, con mayor vida media plasmática, menor inmunogenicidad y posibilidad de uso crónico con y sin otros FAME.
Humira® se une específicamente al TNF y neutraliza su función biológica al bloquear su interacción con los receptores p55 y p75 del TNF de la superficie celular. Modula también la respuesta biológica inducida o regulada por el TNF, incluyendo cambios en los niveles de las moléculas de adhesión responsables de la migración leucocitaria (ELAM-1, VCAM-1 e ICAM-1 con una CI50 de 1-2 * 1010 M).
Eficacia
Humira® se ha evaluado en más de 2.500 pacientes, distribuidos en 4 ensayos de fase I, 2 de fase II, 4 de fase III y 3 estudios de continuación. Tras su administración se ha demostrado una rápida acción, al observarse una respuesta del American College of Rheumatology (ACR) 20, asociado con metotrexato, tras la primera inyección, valorada a la primera semana2, y también en monoterapia, evaluada a las 2 semanas3. Las respuestas del tratamiento con Humira®, a las 52 semanas asociado a metotrexato, en la artritis reumatoide, han sido del 59% en el índice ACR 20, 42% en ACR 50 y del 23% en el ACR 704, y la eficacia se mantiene a largo plazo y de forma sostenida, hasta los 5 años, en las artritis refractarias al tratamiento con FAME5,6. El 90% de este estudio de extensión era tratado en monoterapia, 40 mg cada 2 semanas, o de forma semanal si el DAS (Disease Activity Score) aumentaba en 1,2 unidades. Al 10% restante se le mantuvo metotrexato de forma concomitante (fig. 1). El estudio ARMADA2 demostró que la administración de Humira® a dosis de 20, 40 o 80 mg, por vía subcutánea, cada 2 semanas, en pacientes con artritis reumatoide refractarios al tratamiento con metotrexato, producía una mejoría significativa, rápida y sostenida a las 24 semanas, en comparación con metotrexato y placebo. Un total de 217 pacientes de este estudio continuaron un seguimiento, abierto, con 40 mg quincenales, durante 24 meses. A los 2 años se evaluó a 201 pacientes que mantenían una respuesta ACR 20 el 72%, ACR 50 el 46% y ACR 70 el 24%, y se demostró su efecto sostenido7. Por otro lado, se comparó la respuesta al Humira® en pacientes con artritis reumatoide precoz (¾ 2 años) frente a otros con evolución superior a 2 años, durante 6 meses. La mejoría de los que recibieron Humira® y metotrexato fue superior en ambos grupos, frente a los que recibieron placebo y metotrexato8 (fig. 2). La interrupción prolongada en su administración (> 70 días), aproximadamente 5 veces su vida media, no influyó en la respuesta tras su reintroducción y no aumentó el riesgo de anafilaxia o reacción inmunológica9.
Figura 1. Eficacia de Humira® en monoterapia a 5 años en artritis reumatoides refractarias a los FAME. De Van de Putte et al6.
Figura 2. Respuesta a Humira® en artritis reumatoides precoces frente a tardías. De Keystone et al8.
En el estudio STAR se administró, de forma aditiva, Humira® quincenal, a 636 pacientes con artritis reumatoide activa, en tratamiento con FAME (1, 2 y 3 o más, distintos), refractarios a su programa terapéutico, durante 24 semanas, y con diseño doble ciego y placebo control. Los resultados demostraron una mejoría estadísticamente significativa en el índice ACR 20, 50 y 70, desde la segunda semana de la administración del fármaco activo10.
En todos los estudios se ha demostrado un retraso en la progresión de las erosiones, disminución de la interlínea articular e índice total de Sharp, con la administración de Humira®5-8,11,12.
En un seguimiento de 619 pacientes con artritis reumatoide activa y una media de duración de la enfermedad de 11 años, en estudio doble ciego, aleatorizado y controlado con placebo, la administración de Humira® (40 mg quincenales o 20 mg semanales) frente a placebo, durante un año, se observó que la media de erosiones fue de 0,0 para el primer grupo, 0,4 para el segundo y 1,7 para el placebo, mientras que la disminución de la interlínea era de 0,1, 0,5 y 1,1, respectivamente (p ¾ 0,001)13. Resultados similares se han obtenido a los 2 años14.
Humira® es, pues, efectivo en la actividad de la enfermedad, medida a través de los índices ACR y DAS, así como en la progresión de las lesiones radiológicas, pero también presenta una mejoría significativa en el dolor15, la función física18, la fatiga16, la calidad de vida relacionada con la salud17 y la percepción de salud, medida por el Health Assessment Questionnaire Disability Index (HAQDI), el Functional Assessment of Chronic Illness Therapy-Fatigue (FACIT-F), el Short Form-36 (SF-36) y el Health Utilities Index Mark 3 (HUI3)18.
Seguridad
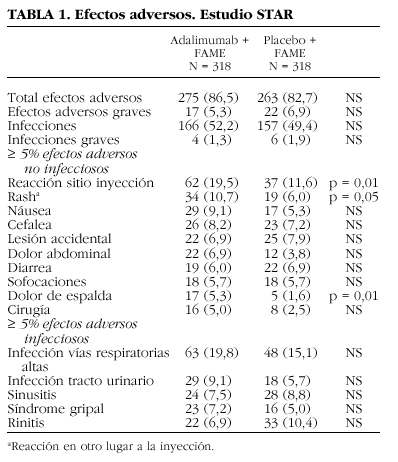
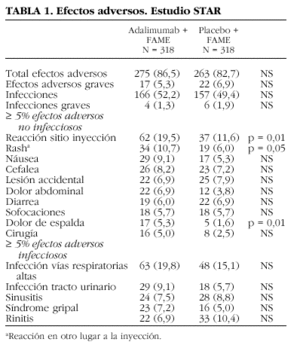
Los datos preclínicos no han mostrado riesgos especiales para los seres humanos según los estudios de toxicidad a dosis única, de dosis repetidas y genotoxicidad1. En los estudios controlados con placebo y estudios de seguimiento a largo plazo, en los que la mayoría de los pacientes recibía 40 mg de Humira® en semanas alternas, la proporción de pacientes que interrumpió el tratamiento debido a reacciones adversas durante la parte del doble ciego y controlada fue del 6,6% para los pacientes que recibían Humira® y del 4,2% para los pacientes tratados con placebo. La reacción adversa muy frecuente (< 1/10) según la clasificación de la Agencia Europea de Evaluación de Medicamentos fue el dolor en el sitio de inyección, y frecuente (> 1/100, = 1/10) la reacción en ese lugar (20% de eritemas, picores, hemorragia o hinchazón, comparado con el 14% del grupo placebo)19. No fue necesario suspender el tratamiento por este motivo. En la tabla 1 se expresan los resultados del estudio STAR (Safety Trial of Adalimumab in Rheumatoid Arthritis)13. Como puede observarse, únicamente había diferencias significativas en la reacción en el lugar de la inyección y en el dolor de espalda.
Se ha descrito un total de 13 infecciones tuberculosas en los ensayos clínicos con Humira®, incluidos los grupos control. Estos casos se observaron entre los 3 y 8 meses de tratamiento, y antes de que los protocolos de prevención se instauraran, en estudios de determinación de dosis, es decir, a dosis más altas de las recomendadas. No se produjo ningún caso de muerte por este motivo y todos los pacientes se recuperaron con la terapia habitual20. Antes de iniciar Humira® se debe evaluar en todos los pacientes la existencia de tuberculosis activa o inactiva (latente)1.
Se han analizado muestras séricas de los pacientes para la detección de autoanticuerpos a distintos tiempos. En ensayos controlados, el 11,1% de los pacientes tratados con Humira® y el 6,1% de los tratados con placebo, que tuvieron títulos de anticuerpos antinucleares basales negativos, se positivaron a la semana 247. Las diferencias entre ambos grupos no eran estadísticamente significativas. En ese período de tratamiento, 18 de los 41 pacientes tratados con Humira® y 3 de 9 de los controles, que tenían anticuerpos antinucleares positivos antes del tratamiento, se negativizaron. También, en la semana 24, 8 de los 204 pacientes con Humira® (3,9%) y ninguno de los controles presentaron anticuerpos anti-ADN. Ninguno desarrolló síntomas de lupus-like7. En el estudio STAR10 el 26,5% de los pacientes tratados presentaron anticuerpos antinucleares, frente al 15,2% de los controles, mientras que el 11,1% de los tratados con Humira® y el 12,2% de los controles, que eran positivos en la determinación basal, se negativizaron. En cuanto a los anticuerpos anti-ADN, se positivaron el 12,5% del grupo con Humira® y el 1% de placebo, mientras que la conversión de positivo a negativo se produjo en el 13% del grupo con Humira® y ninguno en el grupo control. Tampoco se evidenciaron síntomas de lupus, nefritis o síntomas del sistema nervioso central10.
Hasta el 31 de agosto de 2002, 2.468 pacientes (4.870 pacientes/año) habían recibido Humira®. Se observaron 48 casos de tumores malignos (1,94%). De ellos, se esperaban 38 casos de neoplasias no cutáneas y se observó el mismo número. Se declararon 10 casos de linfoma (8 de células B, 1 de células T y un caso de Hodgkin), lo que coincide con la incidencia esperada en los pacientes con artritis reumatoide de las características de la población estudiada. En definitiva, Humira® presenta una gran rapidez en su comienzo de acción, que se mantiene a largo plazo, e inhibe de forma significativa la progresión radiológica. Ha demostrado una mejora significativa de la calidad de vida, además de que simplifica su administración al poder ser autoadministrado por el propio paciente, por vía subcutánea, mediante una jeringa especial precargada, ergonómica y que no precisa reconstitución, manteniendo un adecuado perfil de seguridad.