Introducción
En la última década se han realizado múltiples ensayos clínicos con los diferentes fármacos antirresortivos que actualmente utilizamos en el tratamiento de la osteoporosis1-10. En todos estos estudios se observó un incremento de la densidad mineral ósea (DMO) y una reducción en los riesgos de fracturas. Dada la excelente correlación existente entre la masa ósea y la resistencia del hueso, era lógico asumir que el mecanismo principal por el que estos medicamentos reducían el riesgo de fractura era el aumento de la DMO que producían.
Sin embargo, a pesar de que la resistencia ósea se relaciona de forma exponencial con la masa ósea, llama la atención que los pequeños incrementos de la masa ósea que estos fármacos ocasionan difícilmente pueden explicar, por sí solos, las grandes reducciones del riesgo de fractura observados. Estas dudas se acentuaron al observar otros hechos como los siguientes:
1. El fluoruro sódico incrementa de forma marcada la DMO sin reducir las fracturas11.
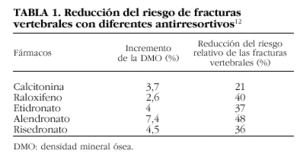
2. La calcitonina, el raloxifeno y los bisfosfonatos producen diferentes aumentos de la DMO en la columna vertebral pero reducen de forma similar el riesgo de fracturas vertebrales12 (tabla 1).
3. En las mujeres con alto riesgo de fracturas tratadas con diferentes antirresortivos se observa una reducción de las fracturas precozmente en los 12 primeros meses del tratamiento, antes de que se alcancen incrementos significativos en la DMO13-15.
4. Pacientes tratados con el mismo fármaco y que obtienen diferentes aumentos de la DMO tienen reducciones similares del riesgo de fracturas14. Es llamativo que el subgrupo de pacientes tratadas con raloxifeno que no incrementan su masa ósea presentan descensos de las fracturas vertebrales similares a los subgrupos que más incrementa su DMO14.
Estos hechos motivaron que diferentes grupos analizaran el papel que el incremento de la DMO, obtenido con los diferentes medicamentos, tiene en la reducción de fracturas y se iniciara la investigación de otros efectos de los fármacos sobre la calidad ósea que explicarán la reducción de las fracturas.
Los conocimientos de los últimos años indican que tanto los diferentes antirresortivos (estrógenos, raloxifeno, calcitonina y bisfosfonatos) como los nuevos osteoformadores (teriparatida) empleados en el tratamiento de la osteoporosis reducen el riesgo de fractura por múltiples mecanismos, que incluyen el aumento de la DMO y la mejora de la calidad ósea. El término calidad, incluido en la actual definición de osteoporosis, tan difícil de definir, sirve para incluir todas aquellas propiedades del hueso que no son explicables por la DMO. La microarquitectura trabecular, la composición orgánica y mineral de la matriz ósea, el remodelado óseo, el grado de mineralización, las microlesiones acumuladas, la viabilidad celular y la cantidad y calidad de los puentes de unión del colágeno son los principales factores que contribuyen a la calidad ósea.
Los mecanismos antifractura conocidos se enumeran en la tabla 2 y muchos de ellos son los mismos componentes que se incluyen en el concepto de calidad ósea. Es probable que algunos fármacos también produzcan otros efectos beneficiosos, desconocidos en la actualidad, que mejoren la calidad del hueso e incrementen su resistencia. En este estudio se analizan los diferentes efectos beneficiosos de los medicamentos utilizados en el tratamiento de la osteoporosis que contribuyen a la reducción del riesgo de fractura.
Densidad mineral ósea
Existe una buena correlación de la masa ósea con las fracturas, de tal manera que cada descenso de una desviación estándar en la DMO el riesgo de fractura se incrementa al doble16. Este hecho, junto a la evidencia de que todos los fármacos utilizados en el tratamiento de la osteoporosis que incrementan la DMO, excepto el fluoruro sódico, reducen el riesgo de fracturas, contribuyó a pensar que el efecto antifractura se debía fundamentalmente al aumento de la masa ósea.
Los densitómetros convencionales de absorciometría de rayos X de doble energía presentan limitaciones técnicas para medir los aumentos de masa ósea trabecular, lo que hace que los incrementos sean infraestimados. Por sí solos, estos problemas de medición no explican la discordancia entre el aumento de masa ósea y la reducción de fracturas. Por este motivo, diferentes autores han estudiado la contribución de los incrementos de la DMO en la reducción de las fracturas. Wasnich y Miller17, basándose en el hecho de que los fármacos que más aumentan la masa ósea reducen de forma más intensa las fracturas, estimaron que el incremento de la DMO es el principal factor que contribuye a la reducción de las fracturas17. Sin embargo, para otros autores el aumento de la DMO explica menos del 20% de la reducción del riesgo de fractura. Así, Cummings et al18, mediante un modelo de regresión logística, estimaron que cada aumento del 1% en la DMO de la columna causa una reducción del 3% en el riesgo de fracturas vertebrales. Según este modelo, en el estudio FIT el aumento de la masa ósea con alendronato sólo produce el 16% de la reducción de las fracturas vertebrales18. También Sarkar et al14 calcularon que los aumentos de la masa ósea producidos por el raloxifeno explican el 4% de la reducción de las fracturas vertebrales mientras que el 96% restante se debe a otros mecanismos. Otros autores, han obtenido conclusiones similares con el risedronato: los cambios de la DMO explicarían entre el 4 y el 28% de la reducción de las fracturas vertebrales y el 5,5% de las de cadera19.
En la actualidad, se piensa que la relación entre el aumento de DMO y la reducción de fractura no es tan fuerte como la existente entre masa y resistencia ósea20. Se estima que el incremento de la DMO producido por diferentes antirresortivos es la causa directa de la reducción de las fracturas en un porcentaje inferior al 20%. Existen otros efectos farmacológicos, no medibles con los estudios densitométricos, que mejoran la calidad ósea e intervienen de forma importante en la reducción de las fracturas.
Remodelado óseo
Las mujeres con marcadores bioquímicos del remodelado óseo aumentados tienen un mayor riesgo de fracturas vertebrales y periféricas21-23. El subgrupo que incluye al 25% de las mujeres con marcadores de formación y resorción más elevados tienen un riesgo de fracturas osteoporóticas alrededor del doble que las otras mujeres23. Este mayor riesgo de fractura es independiente de la masa ósea y, posiblemente, producido por una reducción de la resistencia del hueso en las zonas que se están remodelando. En estas zonas con alto recambio óseo existe un aumento de las perforaciones y de las desconexiones trabeculares con la consiguiente fragilidad local.
La terapia hormonal, el raloxifeno, el alendronato y el risedronato reducen las fracturas desde el primer año del tratamiento antes de que se produzcan cambios destacables en la DMO13,24,25. Todos estos antirresortivos producen precozmente un marcado descenso de los marcadores del remodelado antes de los 3 meses, lo que podría explicar el papel que tiene el frenado del remodelado óseo entre los mecanismos implicados en la reducción de las fracturas.
La reducción de la velocidad del remodelado se asocia a una disminución del riesgo de fracturas vertebrales en las mujeres tratadas con terapia hormonal sustitutiva24, raloxifeno25 y bisfosfonatos26. En las mujeres tratadas con risedronato los descensos de los marcadores del remodelado son los causantes de más del 50% del efecto antifractura, tanto en las fracturas vertebrales como periféricas26.
Se piensa que el frenado del remodelado es uno de los principales mecanismos que intervienen en la reducción de las fracturas y que la intensidad de su disminución guarda relación con los efectos antifractura. Existe una marcada relación entre la disminución del remodelado y el aumento de la masa ósea. Los antirresortivos que frenan de forma moderada el remodelado, como la calcitonina, son capaces de incrementar levemente la DMO y prevenir las fracturas vertebrales. Los aminobisfosfonatos y la terapia hormonal, que producen un mayor descenso de los marcadores del remodelado y un mayor incremento de la masa ósea, previenen también las fracturas periféricas, incluidas las de cadera. Sin embargo, parece existir un umbral por debajo del cual, aunque se produzcan descensos más acusados de los marcadores del remodelado no se consiguen mayores disminuciones del riesgo de fractura26.
Desconocemos si la excesiva reducción del remodelado puede comprometer a largo plazo la resistencia ósea y producir un hueso adinámico. Esto podría suceder porque reducciones intensas del remodelado evitarían la reparación de las microfracturas fisiológicas del hueso. Experimentos en perros tratados con altas dosis de bisfosfonatos han puesto de manifiesto en los huesos una acumulación de microlesiones y un descenso de la resistencia ósea27.
Mineralización y cristalización
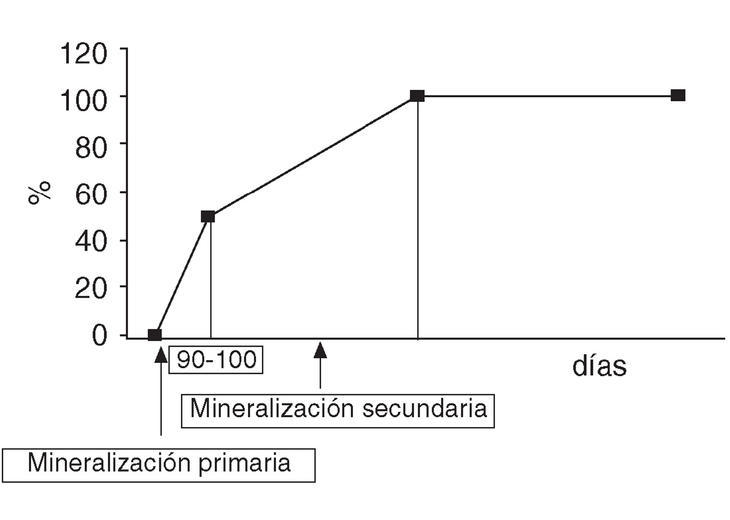
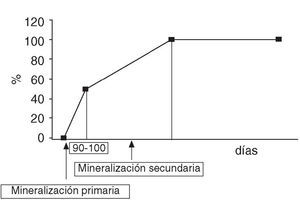
Una vez que los osteoblastos han formado la matriz orgánica comienza el proceso de mineralización que consta de 2 fases: la mineralización primaria y la secundaria (fig. 1). La mineralización primaria se inicia 5-10 días después de la formación del osteoide y dura alrededor de 90-100 días. Posteriormente, comienza la mineralización secundaria que es un proceso lento y gradual de maduración del contenido mineral que aumenta el número, el tamaño y el grado de perfección de los cristales. Se desconoce la duración de la mineralización secundaria pero se estima que puede durar años.
Figura 1. Diferentes etapas de la mineralización del tejido óseo.
Los huesos mal mineralizados, como ocurre en la osteomalacia, son más débiles y propensos a las fracturas. Enfermedades y períodos de la vida que cursan con un remodelado óseo acelerado, como ocurre en el hiperparatiroidismo primario y durante los primeros años de la menopausia, producen una mineralización incompleta por defecto de la mineralización secundaria que aumenta la fragilidad del hueso. Los antirresortivos, al reducir el remodelado, prolongan la vida de las unidades estructurales básicas y mejoran la formación ósea al producirse una más completa y homogénea mineralización secundaria28-30. Los últimos estudios sugieren que este incremento en la mineralización es el principal causante del aumento de la DMO y que los fármacos que más aumentan la masa ósea son aquellos que más prolongan la mineralización secundaria31. Actualmente se están desarrollando diferentes técnicas para medir el grado de mineralización y poder cuantificar la mejora que los antirresortivos producen en la mineralización secundaria31. Por el contrario, osteoformadores como la teriparatida y las sales de estroncio no modifican el grado de mineralización y mejoran la calidad del hueso actuando por otros mecanismos31.
Como ocurre con los cristales minerales, las propiedades de los cristales de hidroxiapatita dependen del tamaño, de la perfección y de las impurezas que contienen. Estas propiedades pueden medirse con técnicas experimentales, y se ha observado que el exceso de pequeños o de grandes cristales se asocia con una disminución de la resistencia ósea32. Múltiples factores intervienen en el tamaño y la composición de los cristales, entre los que destacan la edad, la dieta, las proteínas de la matriz y los fármacos. Los bisfosfonatos se unen a los cristales de hidroxiapatita y frenan su disolución y proliferación y estabilizan los cristales formados, pero no se conoce si esto altera las propiedades mecánicas del hueso32. Por el contrario, el fluoruro sódico se une a los cristales de hidroxiapatita e incrementa su tamaño y grado de perfección, pero las impurezas que contienen los nuevos cristales disminuyen la resistencia ósea.
Microarquitectura trabecular y cortical
Desde hace años conocemos que la osteoporosis produce unos cambios en la microarquitectura del hueso que debilitan su resistencia y lo hacen propenso a las fracturas. Estos cambios son fundamentalmente una pérdida de las trabéculas horizontales y un incremento de la porosidad cortical. Técnicas experimentales entre las que destacan la tomografía computarizada (TC) periférica y la resonancia magnética (RM) de alta resolución pueden valorar las alteraciones en la microarquitectura del hueso33. Para ser el tratamiento de la osteoporosis efectivo debe mejorar, o al menos evitar, este deterioro de la arquitectura, tanto en el hueso esponjoso como en el cortical.
Diferentes antirresortivos y osteoformadores han demostrado que previenen o mejoran la microarquitectura ósea. El tratamiento con risedronato durante un año evita el deterioro de la arquitectura trabecular en las mujeres con osteoporosis posmenopáusica34. El alendronato tiene efectos beneficiosos sobre la arquitectura ósea al preservar la integridad trabecular y frenar el desarrollo de la porosidad cortical35,36. La terapia hormonal sustitutiva y el raloxifeno también conservan la arquitectura trabecular37. Osteoformadores como el fragmento aminoterminal 1-34 de la teriparatida (PTH) no sólo mantienen la arquitectura trabecular sino que la mejoran al aumentar el grosor y posiblemente las interconexiones trabeculares38. Los efectos beneficiosos de la teriparatida sobre el hueso cortical son menos evidentes, aunque los estudios realizados en los últimos años indican que no incrementa la porosidad y produce un efecto neto beneficioso al aumentar más la aposición externa perióstica que el incremento de la resorción endóstica que ocasiona38,39.
A la vista de los conocimientos actuales podemos indicar que uno de los mecanismos de actuación de los medicamentos en la reducción de las fracturas es la preservación o mejoría de la microarquitectura ósea. Los agentes antirresortivos mantienen esta arquitectura, mientras que los nuevos fármacos osteoformadores incluso la mejoran. En los próximos años podremos disponer de técnicas válidas capaces de valorar esta microarquitectura y que complementen los estudios densitométricos.
Componentes orgánicos del hueso
El colágeno tipo I es el mayor componente orgánico del hueso y contribuye de forma importante a la configuración de sus propiedades biomecánicas. En la osteogénesis imperfecta las alteraciones del colágeno producen una gran debilidad de las estructuras óseas. En la osteoporosis primaria existe una alteración en el colágeno que se caracteriza por una reducción de los puentes de unión inmaduros que origina una reducción de la resistencia ósea40.
Diferentes investigadores han observado que la resistencia del hueso guarda relación con la proporción entre colágeno maduro e inmaduro41. Este cociente se obtiene al dividir la concentración existente en el hueso biopsiado de los puentes de unión maduros (piridinolina) respecto a las concentraciones de puentes de unión inmaduros (dihidroxilisilnornorleucina). En las biopsias realizadas a los 5 años de tratamiento el risedronato mantiene la proporción de los puentes de unión mientras que en el grupo control osteoporótico se observa un aumento de este cociente al reducirse los puentes inmaduros42. Estos hallazgos indirectamente nos indican que algunos bisfosfonatos mantienen viable la poblacion de osteocitos que continúa formando nuevo colágeno.
Aunque en los últimos años se han incrementado los conocimientos sobre otras proteínas óseas (decorina, biglicano, osteonectina, sialoproteína ósea, osteocalcina, osteopontina, etc.) que intervienen en la configuración de las propiedades biomecánicas del hueso, en la actualidad desconocemos si los medicamentos que utilizamos tienen algún efecto sobre ellas40.
Aumento del tamaño óseo
El tamaño del hueso es uno de los factores determinantes de la resistencia ósea de tal manera que cuanto más grande es nuestro esqueleto mayor es su resistencia. Esto hace que los varones, al tener un esqueleto de mayor tamaño que el de las mujeres, sean menos propensos a sufrir fracturas. El tamaño del hueso es particularmente importante en los huesos largos tubulares donde la resistencia a las fuerzas de torsión está relacionada de forma exponencial con el diámetro óseo43. Estudios en animales indican que los andrógenos incrementan la aposición perióstica y el tamaño de los huesos. En humanos la administración del fragmento 1-34 de PTH incrementa de forma más significativa la aposición perióstica que la resorción endóstica, y el tamaño y la resistencia de los huesos corticales38,39.
Conclusiones
En el futuro, el gran reto será disponer de medios técnicos que valoren cada uno de los factores implicados en la reducción de las fracturas. Estas técnicas deberían ser capaces de determinar la resistencia ósea de una forma sencilla, barata y fiable, similar a como actualmente medimos la DMO con los densitómetros de rayos X de doble energía. Actualmente, sólo disponemos de algunas técnicas experimentales y cruentas, pues precisan biopsia ósea, que valoran de forma parcial alguno de los factores de la resistencia ósea. Cuando podamos valorar con precisión estos factores y los efectos de los fármacos sobre ellos se podrá determinar con mayor rigor el riesgo de fractura individual e instaurar el tratamiento específico para cada paciente.