Introducción
Habitualmente, el desarrollo de nuevos tratamientos oncológicos acontece tras la identificación de dianas terapéuticas implicadas en la patogenia de un determinado tumor a partir de la investigación básica y/o experimental. Sin embargo, la estrategia de inhibir la ciclooxigenasa 2 (COX-2) con el fin de prevenir o tratar diferentes neoplasias ha seguido un proceso inverso. Así, fueron en primer lugar las observaciones clínicas y los estudios poblacionales de cohortes los que sugirieron que el uso de antiinflamatorios no esteroideos (AINE), un grupo de fármacos que inhiben la actividad de la enzima ciclooxigenasa, se asociaba a una menor incidencia de neoplasias colorrectales, entre otras. Esta evidencia clínica impulsó una importante labor de investigación en el laboratorio que condujo a la identificación de la diana molecular de estos fármacos, la isoforma COX-2, y su papel en el proceso de transformación y progresión neoplásica. Por último, recientemente, el círculo de la investigación terapéutica oncológica se ha cerrado mediante el desarrollo de fármacos que inhiben selectivamente esta isoforma, los coxib, con lo cual no tan sólo se ha confirmado la participación de la COX-2 en estos procesos carcinogénicos, sino que se dispone de un nuevo grupo farmacológico para la prevención y/o tratamiento de determinadas neoplasias1.
Esta revisión abordará las evidencias epidemiológicas, experimentales y clínicas que apoyan la utilidad de los AINE y, más en concreto, los inhibidores selectivos de la COX-2, en la prevención y tratamiento de determinados tumores malignos. La mayor parte de la información hace referencia a neoplasias digestivas, especialmente al cáncer colorrectal (CCR). Ello se debe a que este tumor presenta unas características que hacen que sea un modelo idóneo para el desarrollo y la evaluación de las nuevas estrategias terapéuticas y preventivas. En primer lugar, el CCR representa una de las neoplasias más frecuentes en los países occidentales, siendo la segunda causa de muerte por cáncer2. Por otro lado, más del 90% de estos tumores se originan a partir de una lesión premaligna, el pólipo adenomatoso o adenoma, lo que favorece el estudio de los mecanismos moleculares implicados en el proceso oncogénico. En este sentido, en los últimos años ha sido posible caracterizar las alteraciones génicas que acontecen a lo largo de la secuencia adenoma-carcinoma. En este modelo secuencial, el desarrollo del CCR refleja la activación de determinados oncogenes (KRAS) y la inhibición de diversos genes supresores (APC, SMAD4, TP53)3. La acumulación de mutaciones en estos genes, independientemente del orden en que se adquieren, es la responsable de la iniciación y progresión tumoral4. Por último, en la actualidad se dispone de diferentes modelos experimentales de CCR que facilitan enormemente la investigación preclínica de nuevos fármacos.
Evidencias epidemiológicas
La mayor parte de estudios epidemiológicos publicados hasta la actualidad demuestran que el uso de aspirina u otros AINE se asocia a una reducción del riesgo de desarrollar CCR5. Las evidencias se basan en estudios de casos y controles, y de cohortes. De los 15 estudios observacionales publicados hasta la actualidad, en 9 se observa una disminución del riesgo de presentar esta neoplasia6-14. Además, en 5 de los 6 estudios de cohortes también se observa una reducción del 30-40% en la incidencia de CCR15-19. En uno de ellos, el consumo regular de aspirina a dosis bajas redujo la mortalidad por CCR20, mientras que en otro el beneficio era únicamente relevante cuando éste se mantenía durante un perío do superior a 10 años18. Por el contrario, el único ensayo clínico aleatorizado publicado hasta la actualidad no ha confirmado estos resultados21. En él, la administración de una dosis de 325 mg en días alternos no comportó ningún beneficio con relación al riesgo de presentar CCR. Sin embargo, es importante señalar que este estudio se interrumpió a los 4 años de seguimiento dado que existían diferencias a favor de la aspirina en la prevención del infarto, principal objetivo del estudio. Esta finalización precoz puede justificar la ausencia de diferencias en relación con la incidencia de CCR, sobre todo si se tiene en cuenta que el proceso de transformación y progresión tumoral es largo.
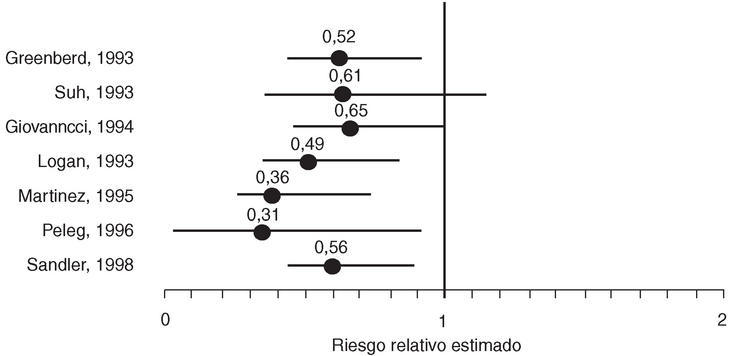
El efecto de los AINE también se ha evaluado en pacientes con adenoma colorrectal esporádico. En consonancia con los resultados observados en el CCR, los 7 estudios observacionales publicados (5 estudios de casos y controles y 2 de cohortes) también demuestran una disminución del riesgo de desarrollar esta lesión, tanto en relación con el consumo de aspirina como de otros AINE8,11,16,22-25 (fig. 1).
Figura 1. Estudios referentes a la relación entre el consumo de antiinflamatorios no esteroideos y la incidencia de adenomas colorrectales.
Mecanismos de acción de los antiinflamatorios no esteroideos
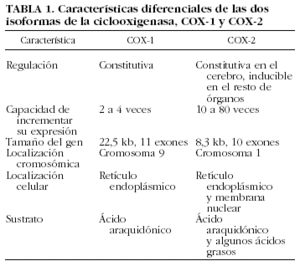
La ciclooxigenasa es la enzima responsable del metabolismo del ácido araquidónico y su conversión a prostaglandina H2, precursor de los prostanoides (PGD2, PGE2, PGF2, PGI2, TXA2). Recientemente, se han descrito dos isoformas de la ciclooxigenasa, COX-1 y COX-2, con una homología del 60% y una afinidad y capacidad para convertir el ácido araquidónico a PGH2 de rango similar26,27. Las características diferenciales de ambas isoformas se resumen en la tabla 1. Entre ellas, destacan los mecanismos de regulación y el patrón de expresión. La isoforma COX-1 se expresa de manera constitutiva en prácticamente todos los tejidos del organismo y se le atribuye un papel regulador en la homeostasis fisiológica de los diferentes órganos o tejidos, que incluye la citoprotección gástrica, la vasodilatación renal y la producción de prostanoides proagregantes y tromboxano en las plaquetas28. Por el contrario, la isoforma COX-2 es inducible, lo que comporta que sea prácticamente indetectable en la mayoría de tejidos en condiciones basales, mientras que su expresión aumenta en respuesta a citocinas, factores de crecimiento y mitógenos.
La aspirina y otros AINE inhiben tanto la COX-1 como la COX-2, mientras que los coxib (hasta la actualidad
se han comercializado dos de ellos, celecoxib y rofecoxib) inhiben selectivamente la isoforma COX-2. Todos estos fármacos inducen apoptosis mediante diversos mecanismos, algunos de ellos dependientes y otros independientes de la ciclooxigenasa. La inhibición de la COX-2 comporta un aumento de ácido araquidónico que, a su vez, estimula la conversión de esfingomielina a ceramida, un mediador de la apoptosis29. La inhibición de la COX-2 también puede inducir apoptosis a través de la alteración de la producción de prostaglandinas y de la disminución de factores angiogénicos30,31. Entre los mecanismos no dependientes de la ciclooxigenasa destacan la inhibición de la activación del factor de transcripción NF-*B32, la interferencia de la unión del receptor hormonal nuclear PPAR*33 y la disminución de la expresión del gen antiapoptótico BCL-XL34.
Diversos estudios experimentales demuestran que la administración de celecoxib en modelos tumorales murinos disminuye la proliferación celular y aumenta la apoptosis. Este efecto no se halla limitado a las células neoplásicas, puesto que se ha observado que este fármaco ocasiona una acción similar en las células endoteliales, lo que potencia su efecto antiangiogénico35,36.
Implicación de ciclooxigenasa 2 en el cáncer colorrectal
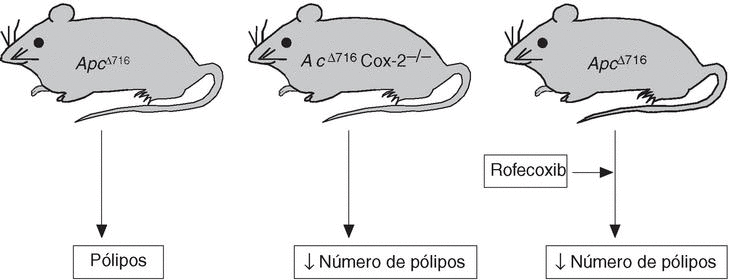
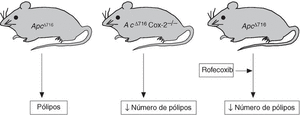
Mediante estudios de expresión génica, tanto en el ARN como en la proteína, se ha demostrado que existe sobreexpresión de COX-2 en más del 85% de muestras de CCR humano, así como en aproximadamente el 50% de los adenomas colorrectales37-39. De manera similar, también se ha observado una sobreexpresión de esta isoenzima en adenomas desarrollados en modelos experimentales de poliposis adenomatosa (ratones Apc716)40 o de carcinoma de colon inducido por carcinógenos químicos41. Además, en ambos modelos experimentales se ha demostrado que la administración de celecoxib induce una disminución de la incidencia (número de animales con lesión) y la multiplicidad (núme ro de lesiones por animal) de las neoplasias colorrectales42-44 (fig. 2).
Figura 2.Implicación de ciclooxigenasa 2 en el modelo experimental de poliposis colorrectal Apc16.
En la actualidad, existe una cierta controversia en relación con el origen celular de la sobreexpresión de COX-2 en el seno del tumor. Diversos grupos sugieren que esta isoforma se expresa fundamentalmente en las células epiteliales38,40,45. Sin embargo, otros grupos han documentado expresión de COX-2 en células estromales, ya sean células endoteliales, macrófagos o fibroblastos36,46,47. Esta aparente contradicción podría deberse al hecho de que existe más de un tipo celular que sobreexprese esta isoenzima, como sugieren algunos estudios inmunohistoquímicos36.
La sobreexpresión de COX-2, tanto en las células epiteliales como en las de la estroma adyacente, justifica que las prostaglandinas derivadas puedan ejercer su efecto favorecedor del desarrollo tumoral en ambas48. En la propia célula epitelial, las prostaglandinas modifican la expresión de genes reguladores clave, lo que comporta un aumento de su resistencia a la apoptosis y de su capacidad migratoria49. Paralelamente, la sobreexpresión de COX-2 en la estroma favorece la neovascularización, un hecho fundamental para el crecimiento tumoral, ya sea a través de su efecto en los fibroblastos o en las propias células endoteliales31.
La implicación de COX-2 en el CCR también se ha demostrado en estudios clínicos. En este sentido, existe una correlación entre la sobreexpresión de esta enzima en el tumor y el estadio de la lesión, su tamaño y la presencia de metástasis ganglionares50. La participación de COX-2 en el CCR no se halla limitada a esta observación, sino que ha sido posible correlacionar la sobreexpresión de COX-2 en muestras tumorales de pacientes afectados de esta neoplasia con una menor probabilidad de supervivencia51.
Implicación de la ciclooxigenasa 2 en otras neoplasias
Las evidencias epidemiológicas descritas anteriormente referentes al efecto protector del consumo de AINE en el CCR también se han observado en relación con otras neoplasias. En este sentido, un reciente metaanálisis demuestra una correlación negativa entre el uso de aspirina u otros AINE y el desarrollo de cáncer de esófago, ya sea escamoso o adenocarcinoma52. Por último, también existen evidencias que sugieren una asociación parecida en los tumores originados en el estómago, el páncreas y la vesícula biliar53.
De manera similar a lo descrito en el CCR, diversas neoplasias, entre las que se encuentran las de piel, pulmón, mama, próstata, vejiga y páncreas, presentan sobreexpresión de COX-21. Es importante señalar, no obstante, que esta información no necesariamente significa que la utilización de inhibidores COX-2 pueda ser útil en el tratamiento o prevención de estos tumores. En este sentido, es bien conocido que la COX-2 es un gen de respuesta temprana inducida por múltiples estímulos, por lo que existe la posibilidad de que la sobreexpresión de COX-2 sea una consecuencia y no un factor causal en el proceso de carcinogénesis específico.
Utilidad clínica de los inhibidores selectivos de la ciclooxigenasa 2
De acuerdo con las evidencias epidemiológicas, experimentales y clínicas mencionadas en los apartados anteriores, los coxib pueden tener una gran utilidad, tanto en la prevención como en el tratamiento de múltiples neoplasias. Este potencial clínico se ve reforzado por el bajo índice de efectos indeseables como consecuencia de su efecto selectivo sobre la isoforma inducible. En este sentido, la preservación de la actividad de la COX-1 que se consigue con estos fármacos permite reducir muy notablemente los efectos secundarios de los AINE no selectivos atribuibles a la disminución de las prostaglandinas gástricas o renales. Cabe destacar que algunas de las indicaciones de los coxib que se comentan a continuación están perfectamente establecidas en la actualidad, mientras otras se hallan aún en fase de evaluación.
Poliposis adenomatosa familiar
La poliposis adenomatosa familiar es una enfermedad hereditaria autosómica dominante caracterizada por la presencia de múltiples pólipos adenomatosos (más de 100) a lo largo de todo el intestino grueso. El desarrollo de pólipos suele iniciarse a partir de la pubertad, aunque habitualmente no ocasionan clínica hasta los 30-35 años de edad. Se trata de una enfermedad con un alto potencial de malignización, de manera que si no se efectúa tratamiento quirúrgico, la práctica totalidad de pacientes desarrollarán CCR antes de los 40 años de edad2,3,54. Recientemente, ha sido posible identificar mediante estudios de ligamiento el gen responsable de la poliposis adenomatosa familiar, (APC; adenomatous polyposis coli), localizado en el brazo largo del cromosoma 5. Así, los individuos afectados de esta enfermedad presentan mutaciones germinales en este gen, existiendo una correlación genotipo-fenotipo, de tal manera que la localización de dicha mutación determina el espectro clínico de la enfermedad3. La mayoría de los pacientes presentan lesiones gastroduodenales asociadas, ya sea hiperplasia glandular fúndica o adenomas duodenales. Por otra parte, es frecuente observar hipertrofia congénita del epitelio pigmentario de la retina, alteraciones óseas y dentales, y tumores desmoides (síndrome de Gardner)54.
El tratamiento de la poliposis adenomatosa familiar es siempre quirúrgico y debe realizarse sin demora en los pacientes que hayan sobrepasado los 25 años de edad. Sin embargo, se ha descrito de forma consistente la regresión de los adenomas colónicos con el tratamiento prolongado con AINE, en especial con sulindaco55-58 y, más recientemente, celecoxib59 (tabla 2). Este efecto beneficioso no se halla limitado a las lesiones colorrectales, sino que se ha observado un resultado similar en relación con los adenomas duodenales60. En estos estudios se ha conseguido una disminución significativa del número y tamaño de los pólipos, aunque la interrupción del tratamiento provoca la reaparición de las lesiones. Además, existen diversas evidencias que sugieren que la administración de AINE, a pesar de promover la regresión de los pólipos, no comporta la desaparición absoluta del riesgo de desarrollar CCR en estos pacientes61, por lo que en la actualidad únicamente está aceptada su utilización como terapia adyuvante en pacientes con pólipos en el remanente rectal y nunca como alternativa a la cirugía.
Cáncer colorrectal esporádico
Los resultados obtenidos en la poliposis adenomatosa familiar, tanto en modelos experimentales como en ensayos clínicos en humanos, han sugerido la posible utilidad de los inhibidores selectivos de la COX-2 en la prevención y/o el tratamiento del CCR esporádico.
Experimentalmente, se ha observado que la administración de celecoxib en ratones con tumores inducidos por azoximetano disminuye la incidencia y la multiplicidad tumoral62. Es interesante señalar que este efecto ocurre tanto si el inhibidor se utiliza antes y después de la administración del carcinógeno (fases de iniciación/postiniciación) como si éste se suministra exclusivamente en la fase de promoción/progresión62, lo que sugiere la potencial utilidad de estos fármacos, tanto en la prevención como en el tratamiento de estas neoplasias.
Por lo que respecta a la prevención, se están llevado a cabo dos estudios multicéntricos controlados y aleatorizados dirigidos a evaluar la utilidad de los coxib en la disminución de la recurrencia de adenomas colorrectales tras su resección endoscópica (profilaxis terciaria). En la actualidad, ambos estudios han finalizado la selección de pacientes, por lo que será posible disponer de resultados en los próximos dos años. La demostración de un efecto beneficioso en la prevención de la recurrencia de adenomas colorrectales constituiría la base racional para evaluar la eventual utilidad de estos fármacos en la prevención primaria del CCR, ya sea en la población general o en grupos con un elevado riesgo de presentar esta neoplasia.
Por lo que respecta al uso terapéutico de los coxib, existen estudios preclínicos y en fase 2 que han evaluado la utilidad de estos fármacos en combinación con citostáticos en el tratamiento del CCR. En estos estudios se ha observado que celecoxib potencia el efecto antitumoral de 5-fluorouracilo e irinotecán63, dos quimioterápicos comúnmente utilizados en el tratamiento adyuvante o de enfermedad metastásica, respectivamente. Estos esperanzadores resultados están siendo evaluados en la actualidad en diversos ensayos clínicos en fases 2 y 3.
Esófago de Barrett y cáncer de esófago
La asociación inversa entre el consumo de AINE y la incidencia de cáncer de esófago52, junto con evidencias de la sobreexpresión de la COX-2 en estos tumores64 y en el esófago de Barrett65, una lesión preneoplásica que precede al desarrollo del adenocarcinoma esofágico, ha proporcionado la base racional para la evaluación del uso de coxib en la prevención de esta neoplasia.
Estudios in vitro y en animales de experimentación han demostrado que la inhibición de la COX-2 disminuye la proliferación celular y aumenta la apoptosis en el esófago de Barrett65-67, lo que sugiere su potencial utilidad en la prevención del cáncer esofágico.