INTRODUCCIÓN
En este documento se recogen las recomendaciones relativas a la prevención y el tratamiento de los efectos adversos sobre el tracto digestivo en el paciente que precisa tratamiento con antiinflamatorios no esteroideos (AINE). Se recogen también las recomendaciones para situaciones afines que se dan en el contexto del tratamiento de estos pacientes. Estas recomendaciones han sido elaboradas y consensuadas por un panel de tres especialistas en gastroenterología y tres en reumatología designados por la Asociación Española de Gastroenterología (AEG) y la Sociedad Española de Reumatología (SER), que proporcionaron el soporte económico necesario. Basándose en las evidencias científicas disponibles, el panel ha tratado de dar respuesta a las cuestiones que surgen ante las situaciones clínicas más comunes y a las incertidumbres más frecuentes que se plantea el médico cuando indica este tipo de tratamiento, mayoritariamente por problemas reumáticos u osteomusculares.
METODOLOGÍA DE TRABAJO
El grupo de trabajo ha partido del documento base elaborado previamente por la AEG que fue publicado en la revista Gastroenterología y Hepatología a finales del año 20011 y que está disponible en la página web de la AEG (http://www.aegastro.es). En ese documento se describe, en extenso, el método de trabajo utilizado, el mismo que para la preparación del documento actual y que, en síntesis, ha sido el siguiente:
1. En un primer momento el panel elaboró una lista de las situaciones clínicas más comunes y de las áreas de conflicto o incertidumbre en las que era precisa una revisión para elaborar recomendaciones firmes. De forma consensuada se eligieron las más pertinentes en el momento actual y que podían ser de interés común para los médicos que se enfrentan a estas, en particular reumatólogos, traumatólogos, gastroenterólogos, internistas, médicos de atención primaria y cardiólogos. En la elaboración de las situaciones clínicas no se han tenido en cuenta aspectos distintos de los gastrointestinales, como son los efectos de los AINE o coxibs sobre la hipertensión arterial (HTA) o la trombosis, entre otras, que, aunque de interés en determinadas circunstancias, el panel consideró que su abordaje necesitaba de la colaboración externa fuera del ámbito de las dos sociedades.
2. Algunos miembros del panel fueron encargados de elaborar una primera propuesta basada en el documento previo de la AEG y en las nuevas evidencias existentes en la bibliografía desde junio de 2001 hasta febrero de 2003. Se efectuó una búsqueda general en Medline con las palabras clave referidas en el documento original y se seleccionaron las publicaciones que por su título o por el contenido del resumen podían aportar información a las cuestiones seleccionadas.
3. Se distribuyeron las cuestiones seleccionadas entre los panelistas para que hicieran una primera propuesta de resolución tras revisar la bibliografía más específica relativa a cada una de ellas, considerando toda la información publicada, incluida la existente antes de la elaboración del documento base de la AEG.
4. Las recomendaciones debían estar basadas en categorías de evidencia y para ello se acordó, al igual que en el documento base, aplicar las recomendaciones de la US Agency for Health Care Policy and Research (tabla I).
5. Las resoluciones de las cuestiones planteadas fueron analizadas por todos los panelistas, buscando llegar a un consenso unánime antes de elaborar la recomendación definitiva. Se decidió a priori optar por una aproximación conservadora en las situaciones donde la evidencia no fuera lo suficientemente clara para efectuar una recomendación firme. Igualmente, se decidió previamente aceptar como categoría de evidencia IIb la obtenida de análisis post-hoc en los estudios que no estaban específicamente diseñados para responder a la cuestión en concreto, siempre que fuera objetivo secundario del estudio o existiera justificación para efectuar ese tipo de análisis. En las situaciones en que no se alcanzó el consenso, se revaluó la evidencia científica y/o se buscaron fuentes alternativas de evidencia, incluyendo libros de congresos científicos de reconocido prestigio, como la DDW, la ACR o el EULAR, y finalmente se emitió la recomendación.
6. El documento con todas las propuestas se sometió a una última revisión por los miembros del panel y finalmente fue aprobado. Este documento definitivo fue sometido a un panel de revisores externos designados por la AEG y la SER.
7. El panel hace constar que no se ha realizado una evaluación económica de estas recomendaciones. Aun reconociendo que existe un buen número de estudios que han evaluado alguna de las consideraciones aquí discutidas, las particularidades de nuestro sistema sanitario hacen que todas ellas hayan de tomarse con cautela cuando han de extrapolarse a España. No obstante, dada la importancia que los aspectos económicos tienen a la hora de la toma de decisiones, esta es una tarea pendiente que merece la pena abordar por este u otros paneles o grupos de investigación en el futuro más o menos inmediato.
PREGUNTAS Y RECOMENDACIONES
Pregunta 1:
¿A partir de qué edad está indicado plantear-
se medidas de prevención de complicaciones gastrointestinales en pacientes que precisan AINE
y no presentan otros factores de riesgo?
Recomendaciones
1. Es conveniente que a todo paciente de más de 60 años de edad que recibe AINE clásico se le administre de forma concomitante gastroprotección.
Grado de recomendación B.
2. La evidencia actual refuerza esta recomendación en los pacientes con una edad igual o superior a 75 años.
Grado de recomendación B.
3. La evidencia actual no apoya el uso de gastroprotección en los pacientes en que el único factor de riesgo es la edad y reciben un inhibidor selectivo de la ciclooxigenasa 2 (COX-2).
Grado de recomendación B.
Evidencias
Recomendación 1: la edad superior a 60 años es factor de riesgo per se para la aparición de complicaciones gastrointestinales en pacientes que toman AINE.
Categoría de evidencia III.
Está bien demostrado desde hace más de 10 años2 que la edad superior a 60 años es por sí sola un factor de riesgo para la aparición de complicaciones gastrointestinales, y que este riesgo se incrementa en los pacientes que reciben AINE. Este dato se ha corroborado en múltiples estudios epidemiológicos llevados a cabo con posterioridad. En el documento de la AEG publicado en 2001, que ha servido de base para estas nuevas recomendaciones, se recoge la evidencia hasta ese momento1.
Recomendación 2: el riesgo de complicaciones aumenta de forma progresiva con la edad.
Categoría de evidencia IIb.
En el estudio MUCOSA3, donde se demostró la eficacia del misoprostol como agente profiláctico para evitar complicaciones gastrointestinales graves cuando se administraban AINE, se estableció que tener más de 75 años de edad era un factor de riesgo. En este estudio la edad media fue de 68 años y la mayoría de los pacientes tenían entre 60 y más de 75 años de edad (categoría de evidencia IIb). Recientemente, en otros estudios4,5 se ha confirmado cómo este riesgo aumenta en los distintos estratos de edad. Hernández-Díaz et al4 estimaron que se producían aproximadamente seis complicaciones del tracto gastrointestinal superior por 1.000 personas/año, en pacientes que tomaban AINE con una edad comprendida entre los 60 y los 69 años. Esta estimación ascendía a 16 por 1.000 personas/año en los pacientes con edad comprendida entre 70 y 79 años (categoría de evidencia III).
En un estudio publicado hace poco tiempo5, basado en el ensayo VIGOR, se demostró que los pacientes con una edad comprendida entre los 65 y los 74 años tenían un riesgo de padecer acontecimientos adversos del tracto digestivo superior de 2,37. Cuando el análisis se llevó a cabo en personas con una edad superior, el riesgo relativo fue de 3,87.
Recomendación 3: un análisis post-hoc del estudio VIGOR no puso de manifiesto que los pacientes con más de 65 años de edad que tomaban rofecoxib tuvieran un mayor riesgo de desarrollar úlcera gastroduodenal.
Categoría de evidencia IIb.
En el estudio VIGOR5 se demostró que la administración de rofecoxib un inhibidor selectivo de la COX-2 (coxib) reducía cuatro veces el riesgo de acontecimientos adversos del tracto digestivo superior cuando la edad se situaba entre los 65 y los 74 años y hasta 9,95 veces con una edad superior. Como ya se refirió en el documento de la AEG1, el análisis por subgrupos de edad en estudios endoscópicos no puso de manifiesto que los pacientes de más de 65 años de edad que tomaban rofecoxib tuvieran una mayor incidencia de úlcera que los pacientes menores de esa edad.
Pregunta 2:
¿Debe instaurarse gastroprotección en un paciente que recibe tratamiento con esteroides?
Recomendaciones
1. Los pacientes que reciben esteroides sin AINE no requieren gastroprotección.
Grado de recomendación B.
2. El riesgo de complicaciones aumenta de forma considerable cuando se asocian AINE y esteroides, por lo que en estos pacientes es necesario ofrecer gastroprotección.
Grado de recomendación B.
3. Los pacientes que reciben esteroides con un coxib no precisan gastroprotección.
Grado de recomendación B.
Evidencias
Recomendación 1: los pacientes que toman únicamente esteroides no tienen mayor riesgo de complicaciones gastrointestinales.
Categoría de evidencia III.
Existen dudas sobre la necesidad de prescribir gastroprotectores a los pacientes que reciben únicamente esteroides. Algunos estudios llevados a cabo hace 20 años ofrecen resultados discrepantes: en uno de ellos se encontró un riesgo aumentado de úlcera péptica dependiente de la dosis6, y en otro, el mismo riesgo que en los pacientes que recibían placebo7.
En un estudio de casos y controles publicado recien-temente8 se ha demostrado que en los pacientes que recibían únicamente esteroides se incrementaba 1,8 veces el riesgo de complicaciones gastrointestinales. Asimismo, parece existir una tendencia a un aumento de riesgo conforme las dosis de esteroides son más elevadas, aunque no hay diferencias con significación estadística9. Con estos y otros estudios no se ha podido discernir si este moderado aumento de riesgo se debe a otras causas, como la gravedad de los pacientes que reciben estos fármacos o a que en algunos casos los esteroides se administran a pacientes con más riesgo de padecer complicaciones gastrointestinales.
Recomendación 2: múltiples estudios han demostrado que la asociación entre esteroides y AINE aumenta el riesgo de complicaciones gastrointestinales.
Categoría de evidencia IIb.
En el estudio de Gabriel et al2 se demostró que la asociación de AINE y esteroides incrementa de forma importante el riesgo tanto de úlcera como de complicaciones. Posteriormente esto se ha ratificado en múltiples estudios. De hecho, esta asociación es un factor de riesgo ampliamente aceptado1 que condiciona que a estos pacientes se les deba administrar gastroprotección efectiva.
Además, en un subanálisis realizado en pacientes del estudio VIGOR5 se demostró que la administración concomitante de esteroides y AINE clásicos aumentaba el riesgo de acontecimientos adversos del tracto gastrointestinal.
Recomendación 3: los pacientes que toman rofecoxib y esteroides no tienen más riesgo gastrointestinal que los que únicamente reciben esteroides.
Categoría de evidencia IIb.
Basados en el estudio VIGOR, Laine et al5 demostraron que los pacientes con rofecoxib previamente tratados con esteroides tenían el mismo riesgo de desarrollar úlcera y complicaciones secundarias que los que no los tomaban, mientras que en los que recibían naproxeno con esteroides el riesgo prácticamente se doblaba.
Pregunta 3:
¿Cuál es la mejor opción terapéutica en un paciente que precisa AINE y está anticoagulado/descoagu-lado con derivados de la warfarina?
Recomendaciones
1. En pacientes anticoagulados debe evitarse el uso concomitante de AINE y, de manera especial, en los de más de 65 años de edad o que presentan otros factores de riesgo de hemorragia. El uso de terapias alternativas debe evaluarse de forma cuidadosa analgésicos centrales, opiáceos, infiltraciones valorando las interacciones de estos fármacos con el anticoagulante.
Grado de recomendación B.
2. En caso de que sea imprescindible el uso de AINE deben utilizarse los inhibidores selectivos de la COX-2 por su mayor seguridad gastrointestinal, su menor interferencia con los anticoagulantes orales y su ausencia de efecto antiagregante.
Grado de recomendación B.
3. Aunque no está establecido, el uso concomitante de gastroprotección inhibidor de la bomba de protones (IBP) o misoprostol podría comportar un beneficio adicional para esta población de pacientes.
Grado de recomendación C.
Evidencias
Recomendación 1: la combinación de AINE y anticoagulantes orales incrementa fuertemente el riesgo de hemorragia digestiva.
Categoría de evidencia III.
La combinación entre AINE y anticoagulantes orales (ACO) presenta, sin duda, un riesgo elevado10-13, a causa de la potenciación del efecto anticoagulante de la warfarina, el efecto antiagregante de los AINE y su potencialidad en producir lesión gastrointestinal y hemorragia.
La combinación AINE-ACO incrementa marcadamente el riesgo de ingreso hospitalario por hemorragia digestiva10-12. Por ello, se debe evitar esta combinación y usar terapias alternativas (tabla II).
Recomendaciones 2 y 3: Carecemos de ensayos clínicos controlados bien diseñados que evalúen de forma adecuada la seguridad de las combinaciones de AINE clásicos y ACO o coxib y ACO a medio y largo plazo, y en suficiente número de pacientes. Habitualmente, los pacientes anticoagulados son excluidos de los ensayos clínicos. Un estudio específicamente realizado con nabumetona y ACO14 fue llevado a cabo a corto plazo (4 semanas) y con un escaso número de pacientes, por lo que no permitió establecer la seguridad de dicha combinación. También se carece de estudios que evalúen la seguridad de ACO más AINE y gastroprotección. La recomendación, por tanto, se ha basado en evidencias indirectas.
Los inhibidores selectivos de COX-2 comportan menor riesgo de úlcera gastroduodenal y sus complicaciones.
Categoría de evidencia Ib.
El uso de coxib en lugar de AINE clásico comporta menor riesgo de úlcera gastroduodenal y sus complicaciones15-16.
Los inhibidores selectivos de COX-2 interfieren en menor medida con los ACO y con la agregación plaquetaria.
Categoría de evidencia III.
Las interacciones con los ACO son diferentes para los distintos AINE. El ácido acetilsalicíclico (AAS), la fenilbutazona o el ácido mefenámico potencian de forma muy significativa el efecto anticoagulante de la warfarina, desplazándola de la albúmina y disminuyendo su metabolismo en el hígado17. El tenoxicam, el meloxicam, el lornoxicam, la nimesulida, el etodolac, la nabumetona y el celecoxib no incrementan significativamente el INR en individuos anticoagulados, mientras que el rofecoxib produce un incremento de este del 10% en pacientes con ACO. Por el contrario, el diclofenaco, el ibuprofeno y el naproxeno incrementan el tiempo de hemorragia. El diclofenaco (150 mg), el ibuprofeno (2.400 mg) y el naproxeno (1.000 mg) inhiben la agregación plaquetaria en un 25, un 78 y un 90%, respectivamente, mientras que el celecoxib, el rofecoxib y la nabumetona no interfieren con la agregación plaquetaria18-20. En un estudio llevado a cabo con rofecoxib, indicado en pacientes anticoagulados con warfarina y sometidos a cirugía de rodilla, no se registró un incremento de los episodios hemorrágicos21.
Finalmente, algunos subgrupos de pacientes con riesgo especial de complicaciones hemorrágicas podrían obtener ventajas del uso concomitante de coxib y gastroprotección*.
Categoría de evidencia IV.
*Véase recomendación a la pregunta 7.
Pregunta 4:
En un paciente que precisa AINE por un período corto o muy corto, ¿se deben seguir las mismas medidas de protección gastrointestinal que en el tratamiento a largo plazo?
Recomendación
La indicación de gastroprotección es independiente del tiempo en que se vaya a administrar el AINE.
Grado de recomendación B.
Evidencias
El riesgo de presentar un efecto adverso gastrointestinal grave con la toma de AINE se presenta ya el primer día de administración y se mantiene durante todo el tiempo que se consume.
Categoría de evidencia III.
Estudios llevados a cabo con AINE convencionales han corroborado que las lesiones endoscópicas en la mucosa gástrica aparecen ya el primer día de administración del fármaco, alcanzando el máximo grado de lesión endoscopia al tercer día. El tiempo en que se inicia el proceso de adaptación es de unos 3 días22-24.
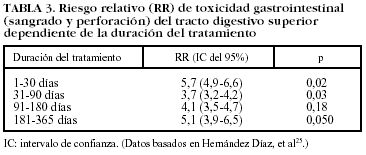
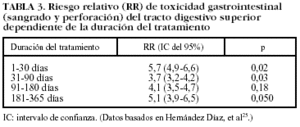
Aunque no existe consenso unánime, la mayoría de los estudios epidemiológicos señalan que el riesgo más elevado de complicaciones gastrointestinales del tracto digestivo superior se presenta durante el primer mes, reduciéndose posteriormente de forma discreta. A pesar de que existe un proceso de adaptación que podría disminuir el riesgo de complicaciones gastrointestinales, este efecto sólo se ha constatado para lesiones agudas endoscópicas y no para lesiones más graves, como la úlcera sintomática o complicaciones. En definitiva, el riesgo de presentar un evento grave de toxicidad gastrointestinal asociado con la toma de AINE está presente a lo largo de todo el tiempo que el paciente toma el fármaco4,25-30 (tabla III).
En pacientes que han recibido AINE el riesgo de complicaciones gastrointestinales se mantiene incluso después del tratamiento y desaparece completamente alrededor de 1-2 meses después de haberlo finalizado (tabla IV)4,27,30. No hay estudios que determinen el riesgo tras la interrupción del tratamiento con AINE si los pacientes han recibido gastroprotección concomitante.
Pregunta 5:
¿Cuál es la estrategia más adecuada ante un paciente con antecedentes de úlcera gastroduodenal que precisa AINE?
Recomendación
El paciente con antecedentes de úlcera gastroduodenal que precisa tratamiento con AINE debe recibir un coxib o un AINE clásico con gastroprotección (un IBP o misoprostol*).
Grado de recomendación A
*Para la conveniencia de elegir una u otra opción véase la pregunta 6.
Evidencias
El antecedente de haber padecido úlcera péptica no complicada o una complicación ulcerosa (hemorragia o perforación) es un factor de riesgo independiente para el desarrollo de complicaciones de la úlcera gastroduodenal asociada con AINE.
Categoría de evidencia Ib.
Los antecedentes de úlcera, tanto no complicada como complicada, se han identificado de forma constante como factores de riesgo en la mayoría de los estudios de cohortes que han analizado el riesgo de hemorragia y/o perforación asociado con el consumo de AINE11,28,29,31-42. Además, en el análisis post-hoc del ensayo clínico VIGOR que incluyó a 8.076 pacientes, el riesgo relativo (RR) de padecer hemorragia, perforación o úlcera sintomática en los pacientes de ambos grupos de tratamiento con el antecedente de úlcera no complicada y complicada fueron de 3,08 (intervalo de confianza [IC] del 95%: 1,98-4,77) y 3,73 (IC del 95%: 2,25-6,17), respectivamente5. En otro ensayo clínico, en que se comparaba el rofecoxib con el ibuprofeno, los pacientes con antecedentes de úlcera de ambos grupos de tratamiento tuvieron el riesgo de presentar úlcera endoscópica a las 12 semanas de seguimiento con el tratamiento antiinflamatorio incrementado (RR: 2,9; IC del 95%: 1,8-4,6)15. En el ensayo clínico MUCOSA llevado a cabo en 8.843 pacientes tratados con AINE para comparar misoprostol con placebo, los antecedentes de úlcera péptica o de hemorragia se asociaron con un riesgo significativo de complicaciones gastrointestinales tras 6 meses de seguimiento con una odds ratio (OR) de 2,29 (IC del 95%: 1,28-4,12) para el antecedente de úlcera y de 2,56 (IC del 95%: 1,30-5,06) para el antecedente de hemorragia3.
En pacientes con antecedentes de úlcera o de alguna de sus complicaciones, el riesgo de nueva úlcera gastroduodenal o complicaciones de esta es menor con un coxib que con un AINE clásico.
Categoría de evidencia Ib.
En el estudio VIGOR, el riesgo de padecer hemorragia, perforación o úlcera sintomática en los pacientes con antecedentes de úlcera gastroduodenal y sus complicaciones fue significativamente inferior en el grupo tratado con un coxib (rofecoxib) que en el grupo tratado con un AINE clásico (naproxeno), siendo el RR de rofecoxib frente a naproxeno de 0,39 (IC del 95%: 0,16-0,95) para los pacientes con antecedentes de úlcera no complicada y de 0,54 (IC del 95%: 0,20-1,43) para aquellos con antecedentes de úlcera complicada5,16.
En el otro estudio antes mencionado en que se evaluó el rofecoxib, la incidencia de úlcera endoscópica en el subgrupo de pacientes con antecedente de úlcera gastroduodenal fue inferior en el grupo en que se administró rofecoxib que en el tratado con ibuprofeno, en una proporción similar a la del análisis global en que se incluyó a todos los pacientes16.
La asociación de IBP con un AINE clásico reduce la incidencia de úlcera endoscópica en pacientes con antecedente reciente de úlcera gastroduodenal.
Categoría de evidencia Ib.
Dos estudios de prevención secundaria en pacientes tratados con AINE y con cicatrización reciente de una úlcera gastroduodenal han demostrado que la asociación de omeprazol con AINE era más eficaz que con placebo o con ranitidina en la profilaxis de la recidiva ulcerosa43,44. En otro estudio, el lansoprazol fue superior al placebo en la prevención de úlcera endoscópica en pacientes tratados con AINE y con antecedentes recientes de úlcera gastroduodenal45.
No se dispone de datos respecto a la prevención de complicaciones de la úlcera por un IBP en comparación con placebo en pacientes con antecedente de úlcera gastroduodenal que reciben AINE. En el estudio de Chan et al46, el 4,4% de los pacientes tratados con naproxeno más omeprazol presentaron recidiva hemorrágica en comparación con el 18,8% del grupo tratado con naproxeno más erradicación de Helicobacter pylori, lo que podría considerarse como equivalente a un grupo placebo de omeprazol. En un estudio reciente se ha demostrado que la combinación de omeprazol con un AINE clásico (diclofenaco) es similar al uso de un coxib (celecoxib) en la prevención de recidiva hemorrágica; la probabilidad de recidiva hemorrágica a los 6 meses fue del 4,9% (IC del 95%: 3,1-6,7) para celecoxib y del 6,4% (IC del 95%: 4,3-8,4) para omeprazol asociado con diclofenaco47.
La asociación de misoprostol con un AINE clásico reduce la incidencia de úlcera endoscópica y de complicaciones en pacientes con antecedente de úlcera gastroduodenal.
Categoría de evidencia Ib.
Un ensayo clínico ha demostrado que, en pacientes con cicatrización reciente de una úlcera, el misoprostol es superior al placebo en la prevención de recidiva ulcerosa por AINE44. En la publicación inicial del estudio MUCOSA3 no se proporcionó un análisis específico del subgrupo de pacientes con historia de úlcera o complicación, pero cuando, comparando misoprostol y placebo, se obtuvieron datos ajustados para estos factores de riesgo los resultados en la prevención de úlcera y sus complicaciones se mantuvieron estadísticamente significativos a favor de misoprostol en comparación con placebo. Además, un análisis post-hoc de este estudio reveló que la reducción del riesgo con misoprostol respecto al placebo era del 52,4 y el 50% en pacientes con antecedentes de úlcera e historia previa de hemorragia digestiva, respectivamente48.
Las evidencias con otros agentes antiulcerosos son limitadas o no han demostrado tener eficacia. A modo de resumen, se puede señalar que la famotidina a dosis altas (40 mg/12 h) ha demostrado que reduce la frecuencia de úlceras gástricas y duodenales frente a placebo en pacientes que toman AINE. La ranitidina a dosis estándar o doble no ha demostrado esta eficacia. El acexamato de cinc y el dosmalfato presentan evidencias limitadas en períodos muy cortos en prevención primaria. Para más detalles se remite al lector al anterior documento elaborado por la AEG1.
Pregunta 6:
¿Es igual de seguro para el tracto digestivo un coxib que la combinación de un AINE con un gastroprotector?
Recomendaciones
1. La utilización de un coxib a las dosis recomendadas es igual de seguro para el tracto digestivo alto que la combinación de un gastroprotector y un AINE clásico.
Grado de recomendación A.
2. La frecuencia global de complicaciones de los tractos digestivos alto y bajo es favorable a la opción de coxib frente a AINE con gastroprotector.
Grado de recomendación B.
Evidencias
Recomendación 1: en pacientes con hemorragia digestiva previa, el celecoxib a las dosis de 200 mg/12 h presenta el mismo riesgo de recidiva hemorrágica que la combinación de 100 mg/día de diclofenaco más 20 mg/día de omeprazol.
Categoría de evidencia Ib.
En un estudio reciente aleatorio se ha demostrado que en el paciente no infectado por Helicobacter pylori y con historia de hemorragia reciente por úlcera, la utilización de 200 mg/12 h de celecoxib se asocia con un 4,9% de recidiva hemorrágica tras 6 meses de tratamiento. Esta frecuencia es similar a la observada (6,4%) con la combinación de 100 mg/12 h de diclofenaco más 20 mg/día de omeprazol47.
Recomendación 2: la utilización de un coxib conlleva la reducción de complicaciones en los tractos digestivos alto y bajo.
Categoría de evidencia IIb.
Como ya se ha comentado anteriormente, en un análisis post-hoc de datos derivados del estudio VIGOR se ha demostrado que el rofecoxib a dosis altas reduce el riesgo de hemorragia digestiva baja en un 54% en comparación con dosis estándar de naproxeno, tras 12 meses de tratamiento5. No existen datos similares para el celecoxib, si bien el estudio reciente de Chan et al47, aunque centrado en hemorragia digestiva alta, también ha señalado una menor frecuencia de eventos de hemorragia digestiva baja.
Pregunta 7:
¿En qué circunstancias se debe asociar un gastroprotector con un coxib?
Recomendación
La utilización conjunta de un coxib y un gastroprotector es aconsejable en pacientes con riesgo muy alto (p. ej., historia previa de hemorragia por úlcera) que precisan tratamiento con antiinflamatorios.
Grado de recomendación C.
Evidencias
En pacientes de riesgo muy alto parece racional aconsejar la asociación de un coxib más un gastroprotector.
Categoría de evidencia IV.
No existen evidencias directas que soporten esta recomendación. No obstante, debe reseñarse que en los pacientes de riesgo, como los descritos en el estudio de Chan et al47, la frecuencia de recidiva hemorrágica es de alrededor del 5%. Esto deja, por tanto, margen para intentar una reducción mayor. Es altamente probable que la combinación de un coxib y un gastroprotector reduzca en un 50% esta frecuencia y con ello se obtenga el beneficio adicional de una reducción de la hemorragia digestiva baja; en la actualidad se está llevando a cabo un estudio para investigar esta hipótesis, cuyos resultados se conocerán previsiblemente en un plazo de 2 años. Por otro lado, existe evidencia epidemiológica que indica que la toma continua de antisecretores (IBP) reduce per se el riesgo de padecer hemorragia digestiva alta en un 50-60%39.
Pregunta 8:
¿En qué circunstancias se debe investigar y tratar la infección por Helicobacter pylori, si está pre-sente, en el paciente que precisa AINE?
Recomendaciones
1. No se dispone de evidencias suficientes para justificar el diagnóstico y el tratamiento de la infección por Helicobacter pylori de forma sistemática en todo paciente sin antecedentes de historia ulcerosa que vaya a recibir tratamiento con un AINE.
Grado de recomendación B.
2. En el paciente con historia previa de úlcera o complicación ulcerosa que va a recibir un AINE clásico, la erradicación de Helicobacter pylori, justificada por su antecedente ulceroso, no exime de llevar a cabo gastroprotección.
Grado de recomendación A.
3. En el paciente con historia previa de úlcera o complicación ulcerosa que va a ser tratado con un coxib es recomendable investigar y tratar la infección por Helicobacter pylori.
Grado de recomendación B.
4. En el paciente que desarrolla úlcera gastroduodenal activa en el transcurso del tratamiento con AINE, si este no puede discontinuarse debe hacerse tratamiento con IBP, y se debe comprobar endoscópicamente la cicatrización tras 8 semanas de tratamiento. En estas circunstancias, la erradicación de Helicobacter pylori no aporta ningún beneficio al proceso de cicatrización. No obstante, debe llevarse a cabo por la posible implicación del germen en la patogenia de la úlcera de ese paciente. En caso de úlcera gástrica es recomendable posponer la erradicación hasta que se haya confirmado la cicatrización ulcerosa.
Grado de recomendación A.
5. En los pacientes que presentan síntomas dispépticos en el transcurso de un tratamiento con AINE no está justificado investigar y tratar la infección por Helicobacter pylori en ausencia de historia ulcerosa previa.
Grado de recomendación A.
Evidencias
Recomendación 1: la infección por Helicobacter pylori y el consumo de AINE son factores de riesgo independientes para complicaciones gastroduodenales.
Categoría de evidencia III.
Un número considerable de estudios epidemiológicos y de intervención han coincidido en señalar que Helicobacter pylori es un factor de riesgo para el desarrollo de complicaciones de la úlcera gastroduodenal, y varios estudios han señalado que Helicobacter pylori y la utilización de AINE son factores de riesgo independientes para estas complicaciones46,49-69. Estos datos son consistentes cuando los análisis incluyen hemorragia por úlcera gástrica y duodenal conjuntamente o hemorragia por úlcera duodenal de forma aislada, pero existen algunos datos contradictorios cuando el análisis se limita a la hemorragia por úlcera gástrica49.
El riesgo de úlcera y de hemorragia en los pacientes que reciben AINE se incrementa si estos están infectados por Helicobacter pylori.
Categoría de evidencia Ib.
Un metaanálisis publicado recientemente, que incluía 16 estudios de cohortes y cinco estudios controlados, concluyó que la infección por Helicobacter pylori aumenta 3,53 veces el riesgo de desarrollar úlcera en los pacientes que toman AINE. En dicho metaanálisis también se puso de manifiesto el sinergismo entre estos dos factores para el riesgo de hemorragia, ya que el riesgo independiente para Helicobacter pylori (1,9) y para AINE (4,85) se incrementó a 6,13 cuando estaban presentes ambos factores66.
En pacientes sin antecedentes de enfermedad ulcerosa tratados con AINE, dos estudios de intervención aleatorios han señalado que la erradicación de la infección por Helicobacter pylori reduce de forma significativa la incidencia de úlcera endoscópica63, 67. Sin embargo, no se dispone de estudios de intervención en que se erradique Helicobacter pylori para la prevención de complicaciones en pacientes que reciben AINE sin factores de riesgo o historia ulcerosa previa. (Como se describe en el siguiente apartado, en pacientes con historia de hemorragia por úlcera la erradicación sola fue muy inferior al uso de omeprazol en la prevención de recidiva hemorrágica por AINE.)
Un estudio de coste-efectividad ha estimado que investigar y tratar Helicobacter pylori en pacientes tratados con AINE supone tan sólo un beneficio marginal con un considerable incremento del coste70 (tabla V). En otro estudio se ha señalado que la estrategia de erradicar empíricamente Helicobacter pylori en pacientes que van a recibir AINE podría ser coste-efectiva cuando estos son de edad avanzada71. Por todo ello, y mientras no se disponga de estudios en que sed evalúe la erradicación en la prevención de complicaciones ulcerosas, no parece conveniente indicarla de forma sistemática en todo paciente que deba ser tratado con AINE.
Recomendación 2: en pacientes con antecedentes de úlcera o sus complicaciones, la erradicación de la infección por Helicobacter pylori no elimina la necesidad de gastroprotección en caso de que reciban un AINE convencional.
Categoría de evidencia Ib.
En un estudio aleatorio llevado a cabo en pacientes con antecedentes de hemorragia digestiva, la erradicación de Helicobacter pylori fue muy inferior al tratamiento con IBP en la prevención de la recidiva hemorrágica asociada con el tratamiento con un AINE clásico (naproxeno)46. En el análisis post-hoc del estudio VIGOR se ha visto que el riesgo de hemorragia, perforación o úlcera sintomática en los pacientes tratados con naproxeno era independiente de la infección por Helicobacter pylori, tanto en los que tenían antecedentes de complicación ulcerosa (el 8,8% para los infectados y el 9,7% para los no infectados) como sin ellos (el 2,6 y el 2,4% para infectados y no infectados, respectivamente)5.
Recomendación 3: en los pacientes con historia previa de úlcera o complicación ulcerosa tratados con un coxib, la erradicación de la infección por Helicobacter pylori contribuye a disminuir el riesgo de úlcera o complicación, especialmente el desarrollo de úlcera duodenal.
Categoría de evidencia IIb.
En los pacientes tratados con coxib (rofecoxib) y que tenían antecedentes de úlcera o sus complicaciones, el riesgo de padecer eventos era 3,5 veces superior en los infectados por Helicobacter pylori con respecto a los no infectados (un 7 frente a un 2%)5. El efecto de la eliminación de la infección fue evidente en la prevención del desarrollo de úlceras duodenales (un 1,85% en pacientes infectados y un 0,34% en pacientes no infectados) e inapreciable en la de úlceras gástricas (el 1,18 frente al 0,88%).
Recomendación 4: la erradicación de la infección por Helicobacter pylori no supone ninguna ventaja para acelerar la cicatrización de la úlcera duodenal activa en pacientes que toman AINE y podría retrasar la cicatrización de la úlcera gástrica.
Categoría de evidencia Ib.
Varios estudios han coincidido en que el proceso de cicatrización de una úlcera duodenal activa en un paciente que recibe un AINE clásico no se modifica con la erradicación de la infección por Helicobacter pylori. Por el contrario, en el caso de la úlcera gástrica la cicatrización puede acelerarse con la presencia de la infección o retrasarse si esta se erradica64,65,72,73.
Recomendación 5: la aparición de síntomas dispépticos en pacientes medicados con AINE no se relaciona con la presencia de infección por Helicobacter pylori.
Categoría de evidencia Ib.
Se dispone de un estudio observacional en que se demostró, en un análisis de regresión logística, que la infección por Helicobacter pylori no es un factor predictivo de dispepsia en pacientes que toman AINE74. En un estudio de intervención, la erradicación de Helicobacter pylori en pacientes que recibían un AINE y omeprazol no disminuyó la aparición de síntomas dispépticos75. En el estudio HELP los porcentajes de pacientes libres de dispepsia en el grupo con tratamiento erradicador de Helicobacter pylori y en el grupo control tratado sólo con omeprazol fueron similares65.
Pregunta 9:
¿Cuál es la mejor opción terapéutica en un paciente que precisa AINE y está tomando ácido acetilsalicílico (AAS) a dosis bajas?
Recomendaciones
1. El paciente que recibe tratamiento con un AINE clásico o un coxib asociado con AAS a dosis bajas debe recibir tratamiento gastroprotector con misoprostol o, preferiblemente, con un IBP.
Grado de recomendación B.
2. El mejor perfil de seguridad en todo el tracto gastrointestinal y la ausencia de la interacción con el efecto antiagregante del AAS que se produce con algunos AINE hace que la opción del coxib ofrezca ventajas sobre el AINE clásico. La erradicación de Helicobacter pylori en estas circunstancias contribuye a reducir el riesgo de hemorragia.
Grado de recomendación B.
Evidencias
Hoy día, no se han publicado estudios específicamente diseñados para evaluar cuál es la mejor estrategia, desde el punto de vista de la seguridad gastrointestinal, en el paciente que precisa AINE y está tomando AAS a dosis bajas. Hay estudios con análisis post-hoc en que se evalúa esta cuestión, y datos indirectos de estudios que responden a otras cuestiones pero que pueden aplicarse para argumentar el tipo de recomendación que se da a la cuestión aquí planteada.
Recomendación 1: la asociación de AAS más un AINE convencional incrementa el riesgo de hemorragia que existe con cada uno de ellos por separado.
Categoría de evidencia IIb.
Se conoce a través de estudios epidemiológicos que el riesgo de hemorragia digestiva se multiplica por tres o cuatro si se añade un AINE al AAS a dosis bajas, y viceversa39. Por otra parte, en diferentes estudios se ha señalado que la incidencia de hemorragia digestiva en pacientes con enfermedad cardiovascular que reciben AAS es de 1,2 eventos/año por cien pacientes tratados76,77, cifra similar a la observada con otros AINE en los grandes estudios recientes de outcomes que presentan una tasa anual de complicaciones con naproxeno, ibuprofeno o diclofenaco que van desde el 1,4 al 1,5% por año. Por otra parte, en el estudio CLASS78 se ha evidenciado que los pacientes que recibieron un AINE clásico junto con dosis bajas de AAS presentaron una tasa anualizada de complicaciones del 2,1%, más elevada que la observada en pacientes que sólo recibieron AINE (1,2%). Si a las complicaciones se añadía la incidencia de úlceras sintomáticas, las cifras arrojaron una mayor diferencia (el 6,1 frente al 2,9%, respectivamente, en el estudio CLASS, y el 8,2 frente al 1,7% en el estudio SUCCESS-1)78,79.
El omeprazol reduce la frecuencia de hemorragia digestiva alta en los pacientes de riesgo que reciben AINE. En prevención primaria, el misoprostol reduce la frecuencia de complicaciones digestivas. El omeprazol, el lansoprazol y el misoprostol reducen la frecuencia de úlcera péptica en los pacientes de riesgo que reciben AINE.
Categoría de evidencia Ib.
Basándose en los estudios que demuestran reducción de complicaciones en el paciente que toma AINE más omeprazol46 y en los datos existentes sobre el efecto de otros IBP en la recurrencia ulcerosa43-45, estos fármacos y misoprostol3,44 son las alternativas racionales para el paciente que toma AINE y AAS a dosis bajas, con independencia de la presencia de otros factores de riesgo.
La asociación de AAS a dosis baja reduce el beneficio que muestran los coxib respecto a los AINE clásicos.
Categoría de evidencia IIb.
Puesto que los inhibidores selectivos de la COX-2 se asocian con un menor riesgo de complicaciones gastrointestinales que los AINE clásicos, se ha considerado que asociar un coxib al paciente que recibe AAS a dosis bajas y que precisa tratamiento antiinflamatorio podría ser una alternativa más segura que la adición de un AINE clásico16,78-80. Hay que señalar, no obstante, que no se han publicado estudios epidemiológicos en que se haya comparado en un mismo estudio cuál es el riesgo de complicaciones con la asociación AINE-AAS y coxib-AAS. Datos preliminares de un estudio epidemiológico que la AEG esta llevando a cabo señalan que la combinación de AAS a dosis bajas y un coxib o AINE se asocia con un incremento del riesgo de hemorragia en ambas situaciones (datos presentados en el último DDW; Gastroenterology 2003;124[Suppl 1]:A-93). Por otra parte, en el estudio CLASS78 se señaló que la asociación de dosis elevadas de celecoxib (400 mg/12 h) más AAS a dosis bajas se asociaba con una frecuencia de complicaciones igual (2,01%) o de acontecimientos clínicamente significativos (4,70%) que la asociación de AINE clásico con AAS a dosis bajas (el 2,12 y el 6%, respectivamente). No obstante, estos datos deben tomarse con cautela, pues el estudio no fue diseñado para responder a esta cuestión y no tenía poder estadístico suficiente.
Estudios más recientes, todavía no publicados pero presentados en congresos, llevados a cabo con rofecoxib (25 mg/día)81 y celecoxib (200-400 g/día)79 en los que se permitió la inclusión de pacientes que tomaban AAS a dosis bajas, han demostrado, tras 12 semanas de tratamiento, una mejor tolerabilidad81 y una menor tasa de eventos gastrointestinales graves79 para el coxib frente al AINE clásico. En uno de los estudios resultó cuantitativamente mejor la combinación celecoxib-AAS que la de AINE-AAS79. En un metaanálisis reciente, en que se revisaba el efecto del AAS sobre el beneficio que tiene el celecoxib frente a los AINE clásicos sobre el tracto gastrointestinal (úlcera endoscópica), se ha señalado que, si bien la ventaja de celecoxib se reduce de un 73 a un 51%, esta aún sigue siendo apreciable. Las conclusiones con otros parámetros de tolerabilidad analizados son similares82.
Recomendación 2:
Esta recomendación encierra aspectos independientes con niveles de evidencia diversa. Globalmente se le ha dado un grado de recomendación B, pero algunos aspectos no permiten ir más allá de una recomendación de tipo C.
Los inhibidores selectivos de la COX-2 se asocian con una reducción del riesgo de complicaciones del tracto gastrointestinal bajo cuando se comparan con AINE no específicos.
Categoría de evidencia IIb.
Existen suficientes evidencias epidemiológicas para afirmar que los AINE se asocian con complicaciones del tracto digestivo inferior de la misma forma que lo hacen en el tracto digestivo superior42,83,84. Los coxibs producen menos daño al tracto digestivo intestinal que los AINE clásicos, lo que se ha demostrado en estudios a corto plazo en individuos sanos mediante pruebas de permeabilidad intestinal y pruebas de sangre oculta en heces85-87. Hay también datos clínicos de más envergadura que demuestran que la utilización de un coxib se asocia también con una reducción del 54% del riesgo hemorragia digestiva baja. Este efecto se ha sido puesto de manifiesto en el estudio VIGOR, donde la frecuencia de la hemorragia digestiva baja fue del 0,41% en el grupo de rofecoxib (50 mg/día) frente al 0,89% en el grupo de naproxeno (500 mg/12 h)5. La lectura detallada del estudio de Chan et al47, en pacientes de riesgo, evaluando la frecuencia de recurrencia de hemorragia por úlcera péptica en sujetos que tomaban celecoxib (200 mg/día) frente a diclofenaco (100 mg/día) asociado con omeprazol (20 mg/día), permite apreciar que la frecuencia total de hemorragias digestivas (altas y bajas) fue del 6,25% (9/144) para celecoxib frente al 10,5% (15/143) para la combinación diclofenaco-omeprazol (RR: 0,59; IC del 95%: 0,26-1,31). Estos datos no fueron estimados por los autores del artículo y se derivan del análisis efectuado por un miembro de este panel (N Engl J Med 2003; 348:2464-2466). Sin embargo, puesto que no hay estudios en que se haya establecido la frecuencia de hemorragia gastrointestinal baja en pacientes que reciben coxibs y AAS, o AINE clásico y AAS, resulta difícil saber si el beneficio de los coxibs sobre los AINE clásicos se ve reducido por el AAS en este aspecto particular. Bajo esta óptica, la categoría de evidencia es de tipo III para este aspecto.
La eliminación o la ausencia de infección por Helicobacter pylori reduce el riesgo de hemorragia en pacientes que toman AAS o coxibs.
Categoría de evidencia tipo Ib.
Estudios epidemiológicos han demostrado que la infección por Helicobacter pylori aumenta el riesgo de hemorragia digestiva en pacientes que toman AAS a dosis bajas88. Estudios de intervención han evidenciado que la frecuencia de recidiva hemorrágica al cabo de 6 meses tras la erradicación de Helicobacter pylori en pacientes que tomaban AAS a dosis bajas es similar a la observada en enfermos a los que se administró omeprazol46. Igualmente, el riesgo de complicación y de úlcera gastroduodenal con un coxib fue mayor en pacientes infectados por esta bacteria que en los no infectados69. Los efectos de la erradicación de Helicobacter pylori en pacientes que toman AINE es más controvertida, aunque un reciente metaanálisis sugiere un efecto beneficioso66. (Véase recomendación a la pregunta 8.)
Los inhibidores selectivos de la COX-2 no interactúan con el efecto antiagregante del AAS, lo que puede ocurrir con algunos inhibidores duales de la COX-2, como el ibupoprofeno.
Categoría de evidencia Ib.
Ya en 1983 se conocía que el ibuprofeno impedía la inhibición irreversible de la ciclooxigenasa plaquetaria por el AAS89. Un estudio reciente ha confirmado este efecto del ibuprofeno y no lo ha demostrado para otros fármacos como el paracetamol, el diclofenaco y el rofecoxib90. El impacto de este efecto sobre la aparición de acontecimientos cardiovasculares en pacientes que reciben ibuprofeno no se conoce, pero preocupa por el amplio uso de este fármaco.
Pregunta 10:
¿Puede cambiar la necesidad de añadir un gastroprotector en pacientes que toman AAS y AINE,
o AAS y coxib, si se utiliza un antiagregante diferente del AAS?
Recomendación
No existen evidencias suficientes para llevar a cabo recomendaciones diferentes cuando se utilizan otros antiagregantes plaquetarios distintos del AAS.
Grado de recomendación C.
Evidencias
Los estudios disponibles con agentes como clopidogrel, triflusal, ticlopidina o dipiridamol sugieren en general una menor frecuencia de complicaciones gastrointestinales cuando se comparan con AAS.
Categoría de evidencia Ib.
No se dispone de estudios del efecto de estos agentes (clopidogrel, triflusal, ticlopidina o dipiridamol) combinados con AINE o coxibs.
Categoría de evidencia IV.
Un estudio epidemiológico reciente llevado a cabo en España señala que el triflusal se asocia con un riesgo menor de hemorragia digestiva alta que el AAS91. Estos datos concuerdan con los preliminares aportados por un estudio controlado en que se señaló que el triflusal se asociaba con una menor frecuencia de hemorragia gastrointestinal que el AAS92. El clopidogrel es otro fármaco de implantación creciente en el mercado que también se utiliza en la prevención secundaria de accidentes cardio y cerebrovasculares. El estudio CAPRIE93 señaló una menor frecuencia de hemorragia gastrointestinal con este agente (0,52%) que con AAS (0,72%). Wong (datos no publicados; comunicación personal) señala, sin embargo, una alta incidencia de recurrencia hemorrágica con este agente en pacientes con historia previa de hemorragia por úlcera. En un estudio retrospectivo se encontró que la ticlopidina se asociaba con lesiones endoscópicas gástricas prácticamente en la misma medida que el AAS y los AINE94. Otros estudios han encontrado una menor incidencia de hemorragia gastrointestinal, pero una mayor frecuencia global de efectos secundarios, que con AAS95,96. La estrategia actual tiende al uso de combinaciones de fármacos antiagregantes como AAS-dipiridamol, AAS-clopidogrel o AAS-GPIIb-IIIa inhibidor. Posiblemente se pueda esperar también, junto con un mayor efecto antiagregante, una mayor incidencia de complicaciones. Como ya se ha señalado, no existen estudios en los que se analicen estas combinaciones con AINE o coxibs.
Pregunta 11:
¿Se debe proceder a gastroprotección en el pa-ciente operado al que se administran AINE?
Recomendaciones
1. No existen evidencias suficientes para suponer que el paciente operado que recibe AINE deba seguir una estrategia de gastroprotección diferente a la de otros pacientes que toman AINE. Por ello, la necesidad de gastroprotección dependerá de la existencia de factores de riesgo concomitantes ya establecidos.
Grado de recomendación B.
2. En pacientes con riesgo de sangrado (gastrointestinal o en el área de la intervención) o de complicaciones es conveniente el uso de un coxib.
Grado de recomendación B.
Evidencias
Recomendación 1: los escasos datos disponibles sugieren que la frecuencia de complicaciones en los pacientes operados que reciben AINE es superior a la esperada en enfermos que no son tratados con estos fármacos.
Categoría de evidencia III.
En un análisis de 15 estudios aleatorios, controlados con placebo, en el que se incluyó a 1.520 pacientes, de los que 927 habían recibido un AINE, se recogió un episodio de hemorragia gastrointestinal significativa97.
En un estudio multicéntrico, aleatorio, en que se comparaban tres AINE clásicos en más de 11.000 pacientes, aparecieron efectos adversos graves (la mayoría episodios hemorrágicos) en un 1,38% de los pacientes tratados, con un 0,04% de hemorragia gastrointestinal (4 por 10.000 pacientes/semana). Esta cifra es difícil de interpretar dada la falta de un grupo placebo, pero en cualquier caso es superior a la esperada en pacientes sin riesgo que reciben AINE por vía oral. En un análisis de los factores de riesgo de complicaciones hemorrágicas y mortalidad en pacientes que recibieron AINE para el tratamiento del dolor quirúrgico se estableció que la edad, el riesgo anestésico elevado y la anticoagulación postoperatoria se asociaban con un incremento en la tasa de complicaciones, con un RR entre 1,04 y 6,798.
Recomendación 2: cuando existe riesgo de sangrado es preferible elegir un coxib.
Categoría de evidencia III.
Se ha establecido que los inhibidores selectivos de la COX-2 no son o son mínimamente ulcerogénicos99, no interfieren con la agregación plaquetaria100,101 y no potencian la acción de los anticoagulantes, o lo hacen mínimamente102,103. Todo ello los hace adecuados para estas situaciones. (Véanse recomendaciones a la pregunta 3.)
Pregunta 12:
¿Debe darse gastroprotección al paciente operado que recibe analgésicos* no incluidos como AINE?
Recomendación
El metamizol, pero no el tramadol ni la propifenozona, induce un moderado incremento del riesgo de hemorragia digestiva alta. Por ello, su administración en pacientes de riesgo hace racional contemplar la aplicación de medidas preventivas.
Grado de recomendación B.
Evidencias
La escasa información existente muestra que el metamizol se asocia con un ligero riesgo de hemorragia digestiva.
Categoría de evidencia III.
El riesgo de complicaciones gastrointestinales por analgésicos no incluidos como AINE ha sido poco investigado. De hecho, en una revisión sistemática104 dirigida a evaluar la eficacia analgésica y los efectos adversos de una única dosis de dipirona (metamizol) para el tratamiento del dolor postoperatorio no fue posible analizar la incidencia de efectos adversos gastrointestinales por falta de datos; no obstante, se pudo observar que, en los pocos estudios que hacían referencia a estos, no se habían presentado o fueron escasos y de poca significación (náuseas, malestar epigástrico).
El metamizol es un analgésico de muy amplio uso en la práctica clínica. Inhibe débilmente las prostaglandinas, y se ha sugerido que es seguro y bien tolerado; no obstante, en un estudio llevado a cabo en voluntarios sanos se observaron lesiones en la mucosa gástrica más frecuentes y más graves en comparación con placebo (aunque sin alcanzar diferencia estadística) tras 15 días de tratamiento a la dosis de 3 g/día, lo que no sucedía con 1,5 g/día105. Recientemente, en un estudio experimental no se encontraron lesiones en la mucosa gástrica de la rata a las 6 h de la administración oral de 120 y 500 mg/kg; en cambio, la dosis de 1.000 mg/kg indujo erosiones leves, similares a las provocadas por la misma dosis de acetaminofen. Por tanto, se constató una tolerabilidad favorable a la dipirona, ya que sólo dosis elevadas produjeron lesiones mucosas leves106.
En un estudio de casos y controles33 dirigido a analizar el riesgo de hemorragia gastrointestinal alta asociado con el uso de analgésicos no narcóticos y AINE se observó que la dipirona y la propifenazona no incrementaban de forma significativa dicho riesgo. No obstante, la dipirona evidenció una tendencia hacia un aumento de hemorragia de origen duodenal (odds ratio [OR]: 2,4; IC del 95%: 0,9-6,4) y para hemorragia de cualquier origen (OR: 1,6; IC del 95%: 0,8-3,1). La tendencia fue menor para la hemorragia de origen gástrico (OR: 1,2; IC del 95%: 0,4-3,3). En otro estudio de casos y controles más reciente107, en que se evaluaba el riesgo de hemorragia digestiva alta con analgésicos comúnmente usados como alternativa a los AINE en enfermedades reumáticas, el metamizol pero no el tramadol ni el paracetamol puso de manifiesto un incremento del riesgo (OR: 2,7; IC del 95%: 1,3-5,4), aunque fue ligero.
Pregunta 13:
¿Cuál es la seguridad gastrointestinal de paracetamol administrado de forma aislada o concomitante con AINE?
Recomendaciones
1. El paracetamol, a dosis de hasta 4 g/día, es un analgésico seguro desde el punto de vista gastrointestinal y no necesita gastroprotección.
Grado de recomendación A.
2. En pacientes que toman paracetamol y AINE se debe llevar a cabo la gastroprotección que esté recomendada por la utilización de los AINE, con independencia de la dosis de paracetamol.
Grado de recomendación B.
Evidencias
Recomendación 1: el paracetamol, a dosis de hasta 4 g/día, es igual de seguro para el tracto gastrointestinal que el placebo o los coxibs.
Categoría de evidencia Ib.
El paracetamol a dosis altas es un inhibidor leve y reversible de la COX-1; sin embargo, inhibe la síntesis de prostaglandinas en el tejido cerebral, pero no en las plaquetas o la mucosa gástrica, por lo que teóricamente es difícil afirmar que pueda tener efectos tóxicos gastrointestinales graves. Hasta el momento no se dispone de estudios que indiquen que paracetamol inhiba la COX-1 en mucosa gástrica108,109.
Estudios endoscópicos (doble ciego, aleatorios, controlados con placebo) en voluntarios sanos y jóvenes han demostrado que el paracetamol tomado durante una semana no produce daño en la mucosa gástrica, de forma similar al placebo110-112. Bradley et al113 no encontraron diferencias en los efectos secundarios en pacientes tratados con paracetamol (4 g/día) o dosis bajas de ibuprofeno (1.200 mg/día) durante 4 semanas. Más recientemente Geba et al114, en un trabajo diseñado para analizar la eficacia de rofecoxib, celecoxib y paracetamol a dosis altas en pacientes con artrosis de rodilla durante 6 semanas, encontraron un perfil de seguridad gastrointestinal muy similar en los tres fármacos.
No existen estudios a largo plazo en que se haya comparado la seguridad de dosis altas de paracetamol frente a placebo, AINE o coxibs. El paracetamol, principalmente a dosis de 3-4 g/día, se ha asociado en varios estudios con efectos adversos leves gastrointestinales, como la dispepsia. Aunque la mayoría de los estudios epidemiológicos no demuestran un incremento del riesgo de hemorragia digestiva con paracetamol, dos estudios retrospectivos han encontrado una asociación del paracetamol con efectos adversos gastrointestinales graves115-120.
Recomendación 2: la administración previa de paracetamol puede reducir la toxicidad gastrointestinal ocasionada por los AINE clásicos.
Categoría de evidencia III.
Desde hace varios años se está investigando si la administración de paracetamol puede influir de alguna forma en la toxicidad gastrointestinal de los AINE. En este sentido se llevaron a cabo algunos estudios de casos y controles en humanos que sugirieron que la administración previa del paracetamol a dosis inferior a 2 g/día reducía los efectos tóxicos gastrointestinales de los AINE, el AAS y el alcohol demostrados por endoscopia. Estos resultados se explican por la capacidad del paracetamol para inducir la síntesis de prostaglandinas en la mucosa gástrica. Sin embargo, estos trabajos se llevaron a cabo durante períodos cortos, por lo que no se pueden extrapolar a la práctica clínica del tratamiento de enfermedades crónicas y a dosis mayores a 2 g/día de paracetamol121,122.
La administración de paracetamol de forma simultánea a los AINE clásicos puede aumentar los efectos adversos gastrointestinales graves.
Categoría de evidencia III.
Recientemente, análisis epidemiológicos retrospectivos de casos y controles han sugerido que la coadministración de paracetamol a dosis mayor a 2 g/día con AINE clásicos incrementa las complicaciones gastrointestinales de los AINE. Sin embargo, estos estudios tienen importantes limitaciones, como que en la población a la que se prescribió el paracetamol existían más factores de riesgo para padecer toxicidad gastrointestinal y que no se recogieron otra serie de factores que podían influir en la toxicidad gastrointestinal116,117.
No se dispone de datos sobre la situación de la administración de paracetamol después del AINE. En la actualidad no hay datos en cuanto a la coprescripción de paracetamol y coxibs, por lo que se recomienda seguir las mismas recomendaciones que cuando se utilizan solamente coxibs.
Pregunta 14:
¿Cómo se debe actuar ante un paciente que precisa AINE o coxibs y presenta dispepsia?
Recomendaciones
1. Cuando se presentan síntomas dispépticos durante el tratamiento con antiinflamatorios (AINE o coxibs) la primera opción es reevaluar la necesidad del tratamiento.
Grado de recomendación C.
2. Cuando es necesario mantener el tratamiento antiinflamatorio, se debe asociar tratamiento antisecretor para el alivio de la dispepsia.
Grado de recomendación A.
3. Si la dispepsia aparece con un AINE clásico y el tratamiento antiinflamatonio es imprescindible, una opción es cambiar a un coxib.
Grado de recomendación A.
4. Si aun siguiendo las medidas preventivas adecuadas se presenta dispepsia en un paciente con riesgo de úlcera gastroduodenal, es pertinente realizar endoscopia digestiva alta para investigar la existencia de lesiones. La endoscopia también es pertinente cuando la dispepsia no alivia con el tratamiento antisecretor.
Grado de recomendación C.
Evidencias
Recomendación 1: si aparece dispepsia en el curso del tratamiento con antiinflamatorios, una opción racional consiste en reconsiderar la necesidad del tratamiento y retirarlo si es prescindible.
Categoría de evidencia IV.
Retirar el fármaco antiinflamatorio cuando se presentan síntomas dispépticos parece una medida racional123, pero no existe información sobre su efectividad real. Esta es la decisión que con más frecuencia (87%) tomaron los médicos de atención primaria al observar dispepsia durante el tratamiento con AINE y mucho menos el cambio de AINE (12%), según datos de una encuesta124.
Recomendación 2: los antisecretores pueden aliviar los síntomas dispépticos que se presentan durante el tratamiento con AINE.
Categoría de evidencia Ib.
Diversos ensayos clínicos aleatorios y controlados han evidenciado la eficacia de los antisecretores (antagonistas H2 e IBP) en la dispepsia asociada con el tratamiento con AINE125-127, pero en algunos ensayos clínicos la eficacia sobre los síntomas no fue el objetivo primario del estudio43,128). Los IBP tienen la ventaja de prevenir lesiones mejor que los antagonistas H2129.
Los ensayos clínicos que han investigado el misoprostol han evidenciado de manera uniforme que este fármaco produce tasas elevadas de efectos adversos gastrointestinales y de abandono del tratamiento3,44,45,130. De todo ello se infiere la recomendación de elegir un antisecre-tor131.
Recomendación 3: los coxibs inducen menos síntomas dispépticos que los AINE clásicos.
Categoría de evidencia Ib.
La frecuencia con que se observan síntomas gastrointestinales altos durante el tratamiento antiinflamatorio es significativa, tiene un efecto negativo para el paciente e induce abandono del tratamiento. En un estudio prospectivo observacional de cohortes132, con un seguimiento largo (2,5 años), se registraron síntomas gastrointestinales altos en el 29%. La frecuencia varía según los diferentes estudios, y ello se debe en parte a la definición que se haga de dispepsia, pero cualquiera que sea la frecuencia es aproximadamente el doble que con placebo, como se ha evidenciado en un metaanálisis133.
Los ensayos clínicos llevados a cabo con los coxibs disponibles para uso clínico (rofecoxib y celecoxib) han mostrado que la incidencia de síntomas es menor que con los AINE clásicos. Sin embargo, esta reducción es discreta, y los síntomas son más frecuentes con coxibs que con placebo16,78,80,134-137. Por ello, si la dispepsia se presenta durante el tratamiento con un AINE no selectivo es racional considerar el cambio por un coxib.
Recomendación 4: la endoscopia digestiva alta está indicada cuando la dispepsia no alivia con el tratamiento antisecretor y hay riesgo de úlcera gastroduodenal.
Categoría de evidencia IV.
La asociación de la presencia de síntomas dispépticos con la existencia de lesiones o complicaciones gastrointestinales por AINE es imperfecta. De hecho, muchas lesiones cursan de forma silente y gran parte de las complicaciones se presentan sin síntomas previos132. Por tanto, la presencia de síntomas tiene un valor limitado en la toma de decisiones diagnósticas (indicación de endoscopia en particular) para investigar lesiones, siendo más relevante el perfil de riesgo del paciente para desarrollar úlcera gastroduodenal123.
El riesgo de que se desarrollen lesiones en pacientes con dispepsia no ulcerosa investigada (endoscopia) no es bien conocido. En un estudio reciente138 se han identificado tres factores de riesgo: edad igual o mayor de 60 años (OR: 2,90; IC del 95%: 0,98-8,5), infección por Helicobacter pylori (OR: 3,59; IC del 95%: 1,07-12,5) y consumo de AINE (OR: 4,46; IC del 95%: 1,31-15,17). De los pacientes con los tres factores de riesgo, un 75% desarrolló úlcera: un 36,4% de los que asociaban consumo de AINE e infección por Helicobacter pylori, y un 8,3% cuando el único factor era el consumo de AINE. La incidencia de úlcera sin ninguno de esos tres factores fue del 1,2%.
Dado que el riesgo de lesiones y complicaciones gastrointestinales durante el tratamiento con coxibs es bajo y significativamente inferior al de los AINE no selectivos16,78, la presencia de dispepsia creará distinto grado de incertidumbre según el paciente esté siendo tratado con uno u otro tipo de antiinflamatorio, y ello debe influir en la toma de decisiones clínicas.
REVISIÓN EXTERNA DEL DOCUMENTO
Los revisores externos que han realizado aportaciones al documento son:
Por parte de la SER: Dr. Santiago Muño, Dr. Luis Rodríguez-Arboleya y Dr. Jesús Tornero.
Por parte de la AEG: Dr. Xavier Calvet, Dr. Carlos Martín de Argila y Dr. Eduardo Bajador.