Introducción
La leishmaniasis es una enfermedad parasitaria endémica en nuestro medio, de carácter emergente y oportunista en relación con la infección por el VIH y la inmunosupresión iatrogénica.
La utilización de metotrexato y ciclosporina de forma combinada en el tratamiento de la artritis reumatoide (AR) da lugar a la modificación de los patrones de defensa natural ante parásitos intracelulares, lo que podría incrementar el riesgo de aparición de leishmaniasis visceral (Kala-azar) a pesar de la bajas dosis utilizadas.
Caso clínico
Varón de 58 años de edad, agricultor de profesión, residente en medio rural y dueño de dos perros, con antedentes de enfermedad pulmonar obstructiva crónica (EPOC), poliglobulia secundaria y úlcera pilórica. Historia de AR de 17 años de evolución, poliarticular y simétrica, con factor reumatoide positivo, HLA DR1, no erosiva, con crisis de Raynaud en las manos, crioglubulinas negativas, ANA negativos, sin manifestaciones extraarticulares; la evolución fue continua, con exacerbaciones que obligaron al tratamiento con metotrexato, 7,5 mg a la semana; ciclosporina A, 100 mg en 24 h, y deflazacort, 10 mg en 24 h, con buena tolerancia.
Ingresó en nuestro servicio por un cuadro de astenia progresiva en las últimas semanas, con dolorimiento en la región epigástrica, palidez en la piel y las mucosas, equimosis en la región preauricular derecha, así como en ambas extremidades superiores, y febrícula ocasional. En la exploración destacó la presencia de dolor a la palpación en el epigastrio, con discreta hepatomegalia, dudosa esplenomegalia, hipoventilación generalizada de ambos campos pulmonares y edemas blandos con fóvea en las extremidades inferiores. No se palparon adenomegalias.
Entre los resultados analíticos, destacó la aparición de una pancitopenia con hemoglobina, 6 g/dl; leucocitos, 1.300 µl y plaquetas, 13.000 µl. En la extensión de sangre periférica aparecieron precursores mieloides aislados, eritroblastos circulantes, anisopoiquilocitosis y punteado basófilo ocasional. La VSG fue de 92 mm la primera hora; AST de 82 U/l, ALT de 63 U/l, GGT de 63 U/l y LDH de 720 U/l. La función renal y la coagulación estaban conservadas. Destacó, asimismo, gammaglobulinas del 37% y ferritina sérica de 3.251 ng/dl. En la inmunoelectroforesis se apreció la aparición de una banda monoclonal IgG kappa. El recuento de linfocitos CD4 fue de 400 y el de linfocitos CD8 de 259.
El urocultivo y los hemocultivos seriados practicados fueron todos negativos. La radiografía de tórax mostró un patrón crónico sin evidencia de condensación aguda. Se realizó una ecografía abdominal que evidenció hepatomegalia homogénea de 6 cm y esplenomegalia con eje mayor de unos 17 cm.
Entre las serologías practicadas destacó una serología para Leishmania positiva a títulos de IgG 1/1.260, así como anticuerpos y antígeno VIH negativos.
Ante estos resultados, se practicó punción esternal aspirativa de médula ósea en la que se observó la presencia de abundantes Leishmania extracelulares agrupadas y fagocitadas por los macrófagos. Además, había un síndrome hemofagocítico acompañante con hematopoyesis conservada.
Con el diagnóstico de leishmaniasis visceral, kala-azar, con pancitopenia, y síndrome hematofagocítico con imnunodepresión iatrogénica, el paciente fue trasladado al servicio de infecciosos iniciando tratamiento con antimoniales y transfusión de cuatro concentrados de hematíes. El paciente evolucionó favorablemente del cuadro clínico que motivó su ingreso, y recuperó su inmunidad celular, con cifras de CD4, 2.439 y CD8, 478. El paciente está pendiente en la actualidad de la realización de un nuevo aspirado medular. Tras estos resultados y la reactivación de la actividad de su AR, en colaboración con el servicio de infecciosos, se reinició tratamiento inmunosupresor, sin aparecer recidiva de su infección hasta la fecha.
Figura 1. Leishmania en médula ósea.
Figura 2. Acción de inmunomoduladores en la defensa natural ante la infección por Leishmania. Modificación de los patrones Th1 y Th2.
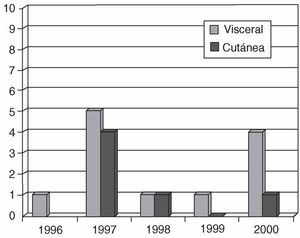
Figura 3. Incidencia de leishmaniasis en la provincia de Zaragoza (1996-2000).
Discusión
La modificación de los mecanismos de defensa natural en la AR, bien por el mismo proceso mórbido o por el uso de inmunosupresores, conlleva un incremento del riesgo de enfermedades infecciosas. Como es lógico, la asociación de inmunosupresores aumentará la incidencia y la gravedad de infecciones habituales y, lo que es más importante, la aparición de infecciones por gérmenes oportunistas1-3.
En una amplia revisión, Boerbooms et al4 concluyen que el tratamiento con metotrexato en la AR incrementa la tasa de infecciones. En este estudio, la evidencia de infecciones oportunistas proviene, sin embargo, de comunicaciones de casos aislados, incluyendo Pneumoscystis carinii, varicela zoster y herpes virus. Otras infecciones oportunistas como criptococosis5, neumonía intersticial por citomegalovirus6,7, histoplasmosis diseminada8, aspergilosis pulmonar9, infección por Listeria monocitogenes10, nocardiosis11,12 y otras13,14 han sido publicadas por diversos autores, en relación con el tratamiento por metotrexato a bajas dosis en pacientes reumáticos.
La situación es diferente en el caso de la ciclosporina, ya que la infección es un problema infrecuente en los pacientes que reciben dosis bajas de este fármaco como tratamiento único para enfermedades autoinmunes15.
Leishmania es un protozoo flagelado que realiza parte de su ciclo en un huésped invertebrado y parte en uno vertebrado. En el primero presenta su forma flagelada o promastigote, que se encuentra en el tubo digestivo del insecto vector, y es aflagelada o amastigote cuando parasita de manera obligada las células del sistema mononuclear fagocítico (macrófagos con preferencia) del huésped vertebrado. Existen dos formas de presentación clásicas, visceral o kala-azar y cutánea. La primera es producida por L. donovani, L. chagasi y L. infantum; esta última es la especie prevalente en la cuenca mediterránea; la forma cutánea del Viejo Mundo está causada por L. tropica, L. major y L. aethiopica, aunque en África y la cuenca del Mediterráneo se observan lesiones cutáneas producidas por L. infantum; L. braziliensis y L. mexicana son las causantes de la forma cutánea del Nuevo Mundo16.
En nuestro país es hipoendémica de transmisión rural y periurbana, y por su ciclo, zoonótica, pues el perro actúa como reservorio principal y padece la infección. El flebotómo, insecto hematófago de la familia Psychodidade, es el encargado de transmitir la infección a otro perro o al hombre17. En los últimos años ha tenido un carácter emergente en nuestro país, por su asociación a la infección por el VIH18,19,20; en la actualidad puede ser considerada dentro del grupo de las infecciones oportunistas que pueden aparecer en los pacientes con inmunosupresión farmacológica21.
La defensa natural ante Leishmania se realiza a través de la activación de la respuesta linfocitaria Th1, que da lugar a su vez a la activación de los macrófagos, que liberan las cantidades de superperóxido, peróxido de hidrógeno y óxido nítrico, necesarias para la destrucción del parásito. La leishmaniasis cutánea difusa y la leishmaniasis visceral se caracterizan por la escasa producción de INF-γ y por el aumento de la expresión de IL-10, la citocina asociada a células Th2, que inhibe la proliferación y el funcionamiento de la células Th122,23. La modificación de estos patrones de respuesta por acción de los inmunosupresores incrementará el riesgo de esta enfermedad parasitaria, sobre todo en zonas endémicas24,25.
En el período comprendido entre 1996 y 2000, se declaró en la provincia de Zaragoza, lugar donde residía nuestro paciente, un total de 18 casos, 12 correspondientes a la forma visceral y 6 a la forma cutánea. Sin embargo, al no estar incluida todavía entre las enfermedades de declaración obligatoria, se supone que el número de casos podría ser mayor26.
Respecto a la aparición de leishmaniais en pacientes con AR, al realizar una revisión bibliográfica a través de Medline, no hemos encontrado la descripción de ningún caso en relación con el metotrexato o la ciclosporina, utilizados a bajas dosis. Existen casos publicados en pacientes receptores de trasplante renal, que utilizan altas dosis de ciclosporina A y glucocorticoides para evitar el rechazo27-29.
Por todo ello, cabe considerar que la asociación de imnmunosupresores, a pesar de las bajas dosis empleadas, puede contribuir a incrementar el riesgo de infecciones oportunistas, como la leishmaniasis, cuyo mecanismo de defensa natural se ve claramente modificado por el tratamiento, en especial en zonas endémicas como la nuestra.
Correspondencia: Dra. M. Loreto Horcada Rubio. Gran Vía, 39, entlo. dcha. 5006 Zaragoza. España.
Manuscrito recibido el 26-2-2002 y aceptado el 27-6-2002.