El cierre temporal de la cavidad abdominal forma parte del tratamiento de situaciones en las que existe riesgo de desarrollo o presencia de un síndrome compartimental abdominal o de infecciones intraabdominales severas, y se utiliza también en la cirugía de control de daños y ante grandes defectos de la pared abdominal. Aunque puede resultar enormemente beneficioso, no está exento de complicaciones, lo que se ha traducido en la búsqueda de técnicas que minimicen o excluyan las consecuencias del abdomen abierto, objetivo aún no alcanzado. En el presente trabajo hemos realizado una revisión de las diferentes indicaciones y métodos utilizados para el cierre temporal y el cierre definitivo de la fascia, con sus posibles ventajas e inconvenientes, mostrando la situación actual en este campo.
As part of the treatment procedure when there is a risk or presence of compartment syndrome or serious intraabdominal infection, the abdominal cavity may need to be temporarily closed. Temporary abdominal closure may also be required during trauma surgery for a large abdominal wall defect or damage control. However, this procedure, although extremely useful, is not without complications and this has prompted the search for a technique that will somehow avoid or minimize the consequences of an open abdomen. In this paper, we review the state of the topic including different indications and methods used for both temporary and definitive closure of the fascia, and discuss their possible benefits or shortcomings.
La restitución anatomofisiológica de la integridad de la pared abdominal ha preocupado a cirujanos de todas las épocas; de hecho, en la actualidad la pared abdominal tiende a considerarse como un órgano con una patología específica.
El cierre primario de la cavidad abdominal restituye la anatomofisiología parietal, protegiendo el contenido intraabdominal y disminuyendo las complicaciones de la herida quirúrgica. Sin embargo, el cierre primario de la pared anterior del abdomen no siempre está indicado, y en ocasiones es necesario realizar un cierre temporal (CT). Las indicaciones más frecuentes para este CT son la cirugía de control de daños, la sepsis de origen abdominal y el síndrome compartimental abdominal1. Así:
- •
La cirugía de control de daños hace referencia a un enfoque sistemático, en tres etapas, del tratamiento del abdomen catastrófico. Su finalidad es interrumpir la cascada mortal de hipotermia, acidosis y coagulopatía que culmina con el fallecimiento del paciente2, realizándose tras la cirugía inicial un CT que facilite una relaparotomía y conserve la integridad de la fascia3.
- •
El manejo quirúrgico de las infecciones intraabdominales requiere reintervenciones programadas mediante técnicas de CT que faciliten la reentrada en la cavidad abdominal sin riesgo de evisceración y sin tensión4–6.
- •
El CT forma parte del tratamiento y/o prevención del síndrome compartimental abdominal7,8, evitando las alteraciones fisiopatológicas que provoca la hiperpresión abdominal en todos los órganos y sistemas9–11.
Cuando se opta por realizar un CT de la cavidad abdominal se pretende:
- 1.
evitar la evisceración,
- 2.
facilitar la reexploración, si fuese necesaria,
- 3.
evitar los efectos nocivos del aumento de la presión intraabdominal,
- 4.
facilitar el cierre definitivo,
- 5.
conseguir un método sencillo de realizar y de fácil manejo para el personal de enfermería.
Llegados a este punto, hay que plantearse qué sucedería si se dejara el abdomen abierto en vez de realizar un CT. La opción de la laparostomía no es novedosa (Ogilvie, en 194012, ya dejó el abdomen abierto en pacientes con heridas abdominales de guerra), si bien no se encuentra exenta de complicaciones considerables, como fístulas intestinales o grandes hernias incisionales13,14. Por ello, para disminuir el grado de complicaciones asociado a la laparostomía, es necesario aplicar métodos de CT.
Si son numerosas las circunstancias clínicas en las que está indicado realizar un CT, no son menos numerosos los métodos propuestos para llevarlo a cabo, sin que dispongamos de estudios comparativos que establezcan la existencia de un método ideal. La heterogeneidad de pacientes y enfermedades, la diversidad de técnicas, las variaciones realizadas por los diferentes grupos y la existencia de series pequeñas hacen compleja una comparación de los distintos métodos utilizados, así como de sus resultados y consecuencias15. Tradicionalmente se han utilizado towel clips, sistemas de cremallera, la bolsa de Bogotá y sistemas vacuum. Actualmente, los más utilizados son los biomateriales y los sistemas de terapia negativa1.
Towel clipsEl método más sencillo de CT son las pinzas de campo quirúrgico (towel clips), aproximando los bordes cutáneos de la pared abdominal y dejando los planos subyacentes sin suturar. Las towel clips se recubren con un apósito quirúrgico y una lámina adhesiva estéril16,17 y se retiran una vez que desaparece el edema visceral o retroperitoneal (generalmente, en 48-76h).
Es un método de CT rápido y fácil de realizar, pero tiene como inconvenientes el posible daño en los bordes cutáneos, la retracción de planos musculofasciales y que, en ocasiones, el propio síndrome compartimental abdominal no se puede controlar adecuadamente, por lo que se debe recurrir a otras técnicas para conseguir el cierre en una segunda fase18. Es un método en desuso.
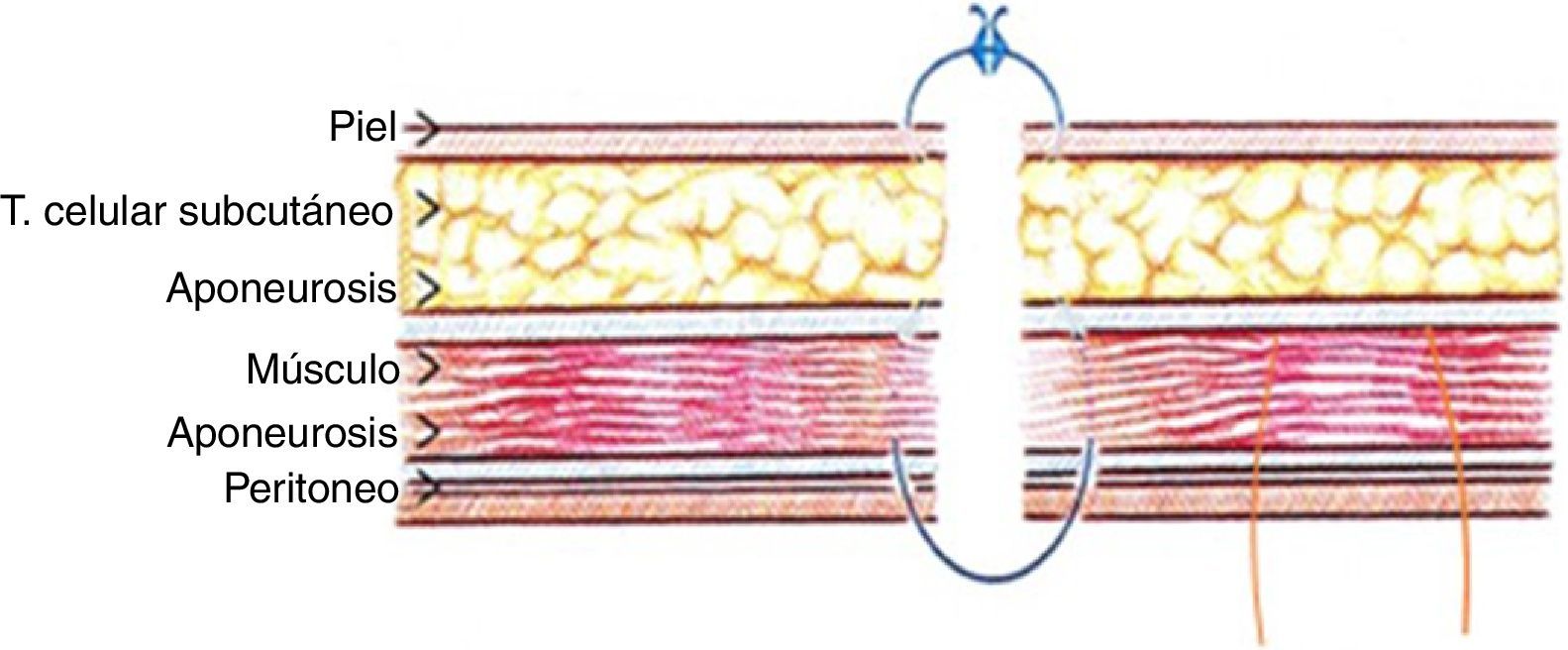
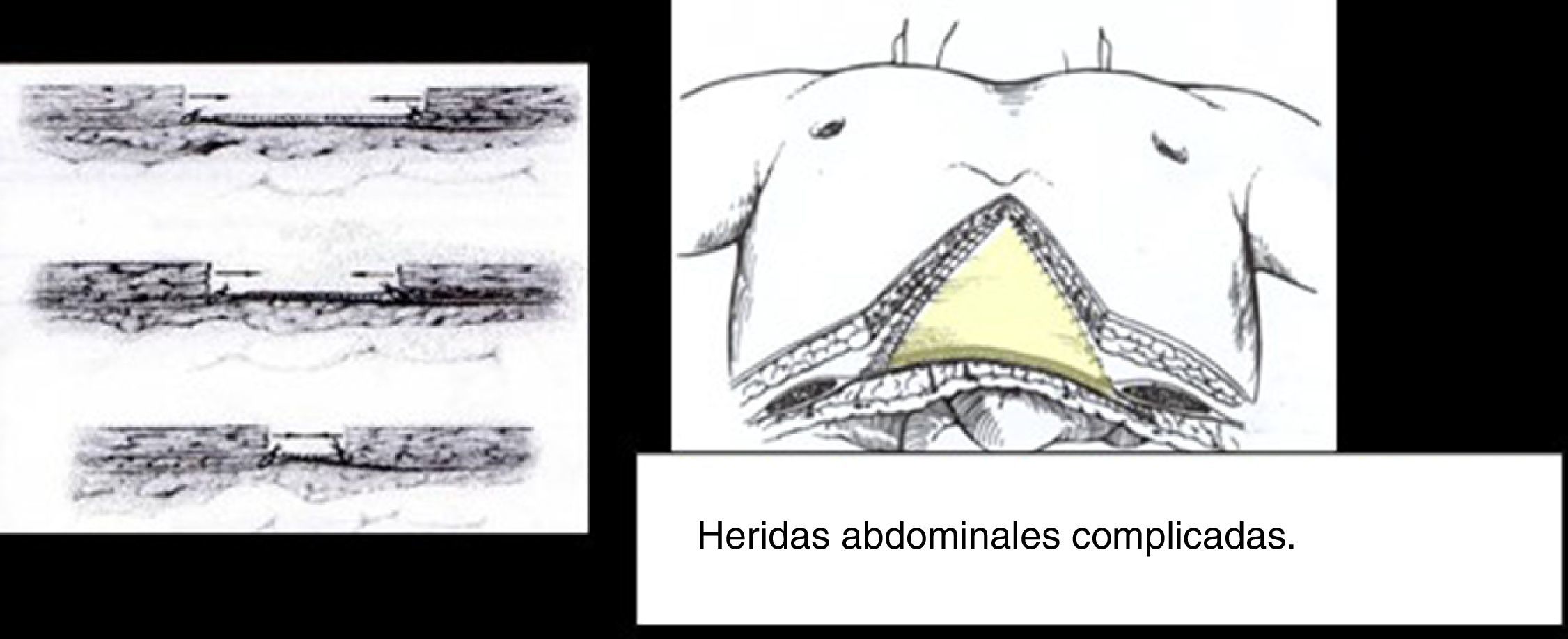
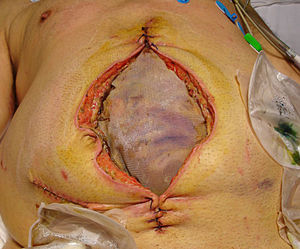
Suturas de retenciónFueron introducidas por Reid et al.19 para evitar la evisceración, pero generan diferentes problemas. Cuando las suturas son demasiado atirantadas pueden producir necrosis de la herida por isquemia de la pared abdominal; en tal caso, retienen el contenido abdominal, pero pueden exacerbar un síndrome compartimental abdominal y/o verse implicadas en el desarrollo de fístulas enterocutáneas, incluso cuando se ha tenido cuidado de colocarlas extraperitonealmente20 (fig. 1).
Sistema abdominal re-aproximation anchor systemA fin de evitar las complicaciones anteriores se han empleado nuevos métodos, como el sistema abdominal re-aproximation anchor system (ABRA)21,22. Este método se basa en una continua y progresiva tensión que posibilita la reaproximación progresiva de los bordes fasciales mediante suturas elásticas transfasciales combinadas con sistema VAC®22,23.
Otros autores, como Goodman et al., han realizado una tracción continua sin suturas elásticas, denominada sistema frequent assessment temporary abdominal closure (FASTAC)24. Utilizan como CT una lámina plástica asegurada a la fascia, que se extiende en cada lado hasta la gotiera parietocólica y se sutura el exceso al nivel de la línea media; conforme disminuye la tensión abdominal, puede ser cortada y resuturada en dicha línea media. Los autores utilizan esta técnica en pacientes en los que se prevé que será necesario mantener el abdomen abierto largo tiempo, lo que permite un cierre progresivo que evita la retracción de los músculos de la pared. Además, al ser transparente, permite el control del contenido intraabdominal (sangrado, infección, etc.) y admite reversibilidad si surge un nuevo pico de presión intraabdominal. Al colocarse por debajo del peritoneo parietal, previene las adherencias de las vísceras a la pared lateral, lo que disminuye la lesión intestinal. Hay que tener en cuenta que las series publicadas son pequeñas, y que aunque es un método económico, no elimina el riesgo de fístula enterocutánea.
Sistemas de cremalleraLos sistemas de cremallera se han utilizado con objeto de poder revisar la cavidad peritoneal cuantas veces sea necesario. Se insertan en los bordes de la piel dejando la aponeurosis sin cerrar, reservando su integridad para posponer el cierre abdominal definitivo una vez que el proceso intraabdominal ha sido controlado. También pueden situarse cremalleras en el centro de una malla para reducir la tensión, con lo que se disminuye así la necrosis fascial que complicaría el cierre definitivo.
La utilización de sistemas de cremallera fue popularizada por Lequit25 para facilitar la reentrada en la cavidad abdominal en casos de necrosis intestinal secundaria a isquemia mesentérica. Posteriormente, han sido utilizados por otros cirujanos en pancreatitis necrohemorrágicas y sepsis intraabdominales26–28, con el fin de garantizar el completo drenaje del foco séptico. La incidencia de fistulas en relación con la colocación de mallas no absorbibles ha limitado la utilización de esta técnica.
Bolsa de Bogotá29Utilizada a partir de los años ochenta, consiste en una bolsa estéril, similar a las usadas para la administración de fluidos intravenosos o irrigaciones urológicas, que se sutura de forma continua a los límites de la vaina del recto o a los márgenes de la herida, siempre sin tensión, y que al ser transparente permite la vigilancia del interior de la cavidad, por lo que resulta muy útil en caso de isquemia o necrosis intestinal.
En cada reintervención planificada la bolsa puede ser sustituida por otra nueva. Cuando el tejido de granulación es lo suficientemente amplio como para prevenir la evisceración, puede ser necesaria la realización de injertos de piel o la utilización de prótesis para la reparación definitiva de la pared.
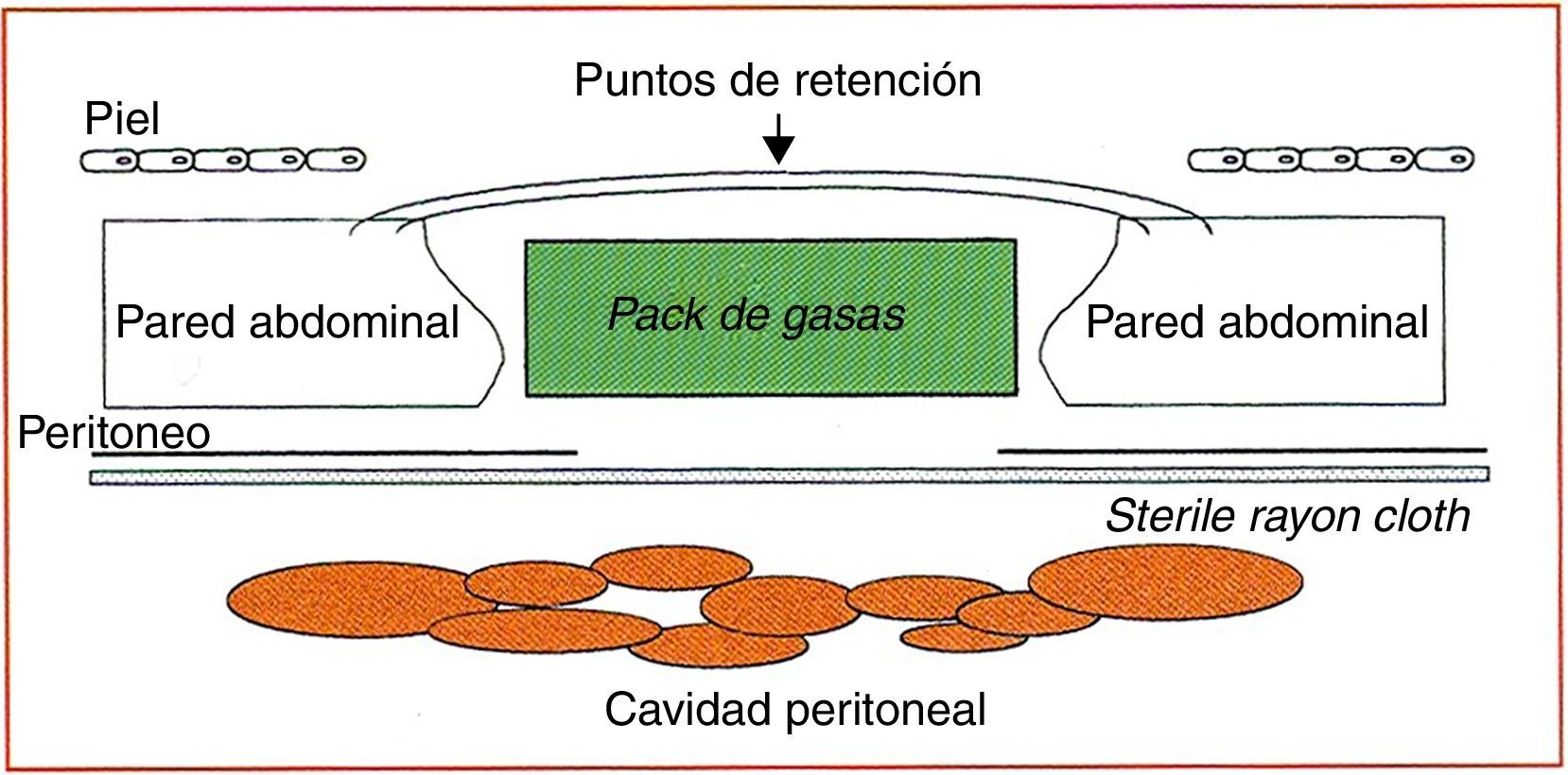
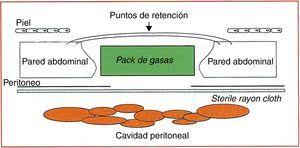
Visceral packingDescrito por Bender et al. (fig. 2), consiste en una lámina que cubre el intestino, sobre la que se sitúa un pack con gasas sobre el que a su vez se sitúan 4 o 5 suturas de retención30. Una vez estabilizado (generalmente, en 48-72h) el paciente es reintervenido, y si el edema visceral se ha resuelto, se procede al cierre fascial.
Cierre temporal de tipo visceral packing. Tomada de Bender et al.30.
Koniaris et al.31 emplearon una técnica semejante: colocaron un amplio vendaje oclusivo por encima de la línea media y, bajo este, un drenaje aspirativo.
Aunque supuso un avance en el control del abdomen abierto, con este método se controla mal la pérdida de fluidos, el pack requiere cambios frecuentes y las suturas de retención pueden erosionar la piel. Además, en caso de edema refractario, se forma un tejido de granulación sobre el intestino, por lo que es necesaria la utilización de biomateriales para conseguir el cierre definitivo.
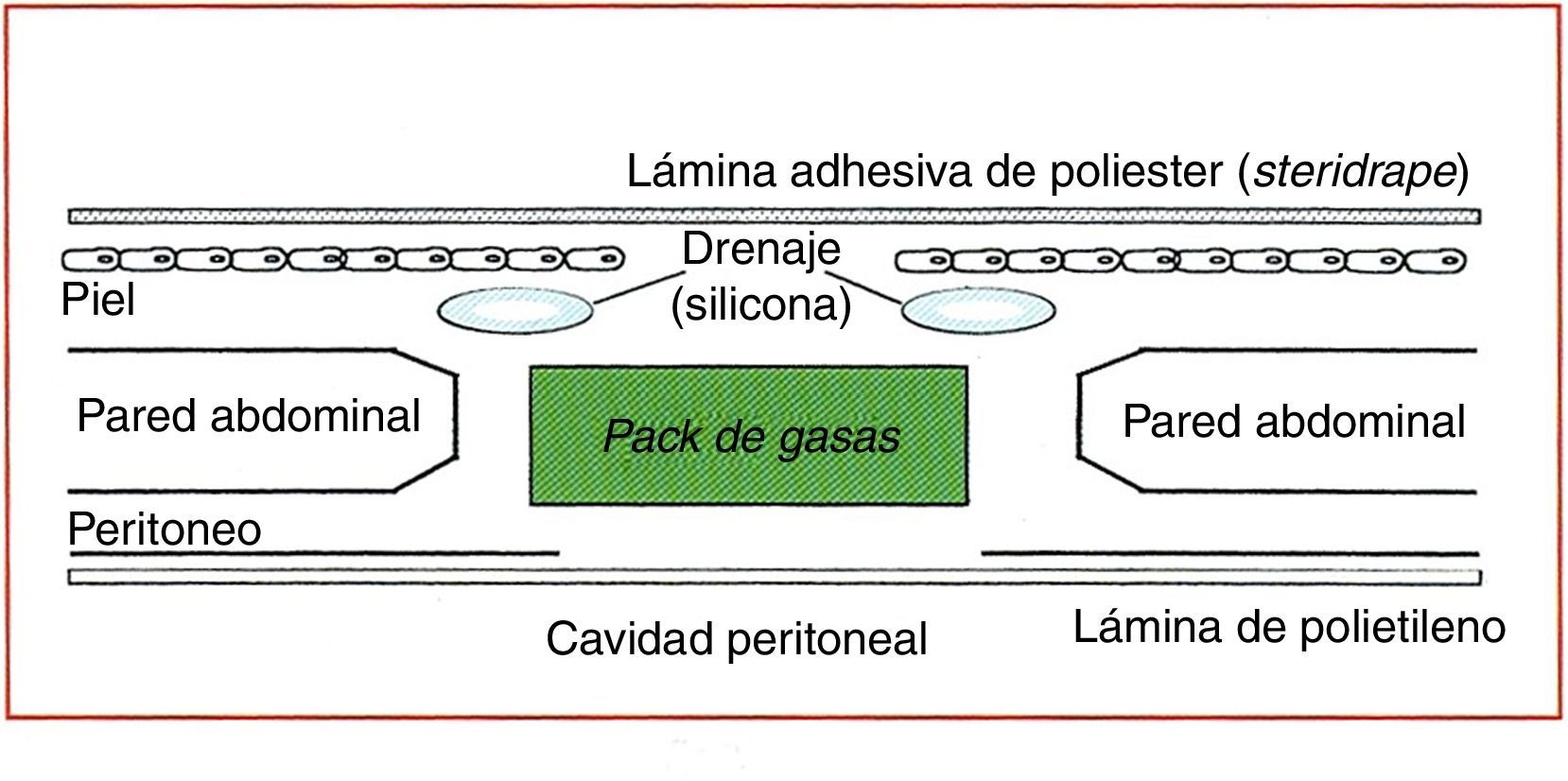
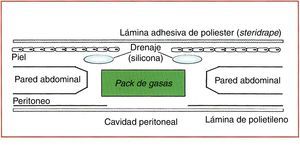
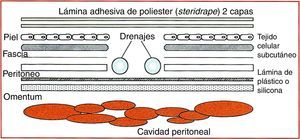
Vacuum packDescrito por Brock et al.32 en 1995 (fig. 3), consiste en la colocación de una lámina fenestrada de polietileno en contacto con el peritoneo visceral, sobre la que se sitúa un apósito quirúrgico (surgical towell). Sobre este, a su vez, se añaden unos drenajes aspirativos exteriorizados a 3-5cm de los bordes de la herida. Los planos de peritoneo parietal, fascial y cutáneo se mantienen abiertos, y se coloca una lámina adhesiva (Steridrape®) que sella la periferia de la apertura cutánea sin utilizar suturas. El paciente es conducido a la UCI, y cuando el contenido abdominal lo permite, se reaproximan los planos. El cierre definitivo de la pared abdominal puede realizarse recurriendo a procedimientos de autoplastia o biomateriales, pero si la lámina adherente se despega, el resultado es una evisceración; por otra parte, los bordes fasciales pueden sufrir cierta distracción.
Cierre temporal de tipo vacuum pack. Tomada de Brock et al.32.
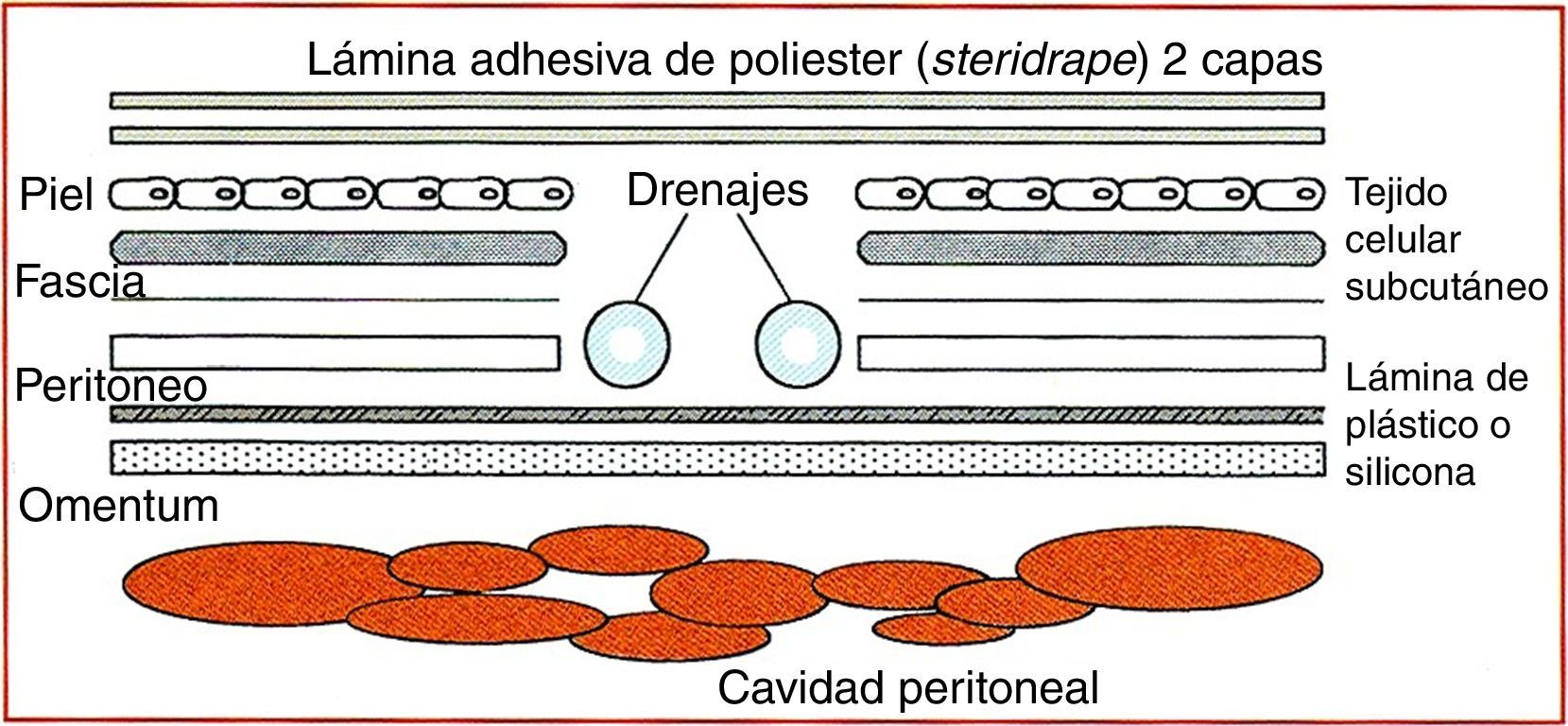
Sherck et al.33 propusieron en 1998 un método semejante al descrito por Brock et al., consistente en utilizar una lámina de silicona o plástico (fig. 4) situada inmediatamente encima del peritoneo visceral y colocar sobre ella unos drenajes. Los planos de peritoneo parietal, fascial y cutáneo se mantienen abiertos, colocando un plástico adhesivo que sella la periferia de la apertura cutánea sin utilizar suturas. Cuando el contenido abdominal lo permite, se reaproximan los planos, empleándose en ocasiones suturas de retención.
Cierre temporal de tipo vacuum pack modificado. Tomada de Sherck et al.33.
La terapia de vacío o presión negativa (TPN) consiste en el uso de un drenaje asistido por vacío para eliminar la sangre o líquidos serosos de una herida o lecho quirúrgico. En los años noventa, Argenta y Morykwas34,35 desarrollaron una espuma de poliuretano de poro abierto, que se sitúa sobre el lecho de la herida que se va a tratar, cubierta por un apósito semioclusivo conectado por un tubo a una fuente de vacío. En 1996, Kinetic Concepts Inc. inició la comercialización del uso de la TPN bajo la denominación vacuum-assisted closure (VAC®), lo que ha supuesto un avance en las técnicas de CT tras su predecesor, el vacuum pack de Barker.
Los fundamentos36 de la TPN se basan principalmente en cuatro efectos:
Cambios en el flujo sanguíneoBorgquist et al.37 estudiaron con doppler los efectos de la TPN sobre el flujo sanguíneo, y demostraron una disminución del flujo en los bordes de la herida y un aumento del flujo en los tejidos circundantes. El mecanismo por el que se incrementa el flujo sanguíneo no es totalmente conocido, pero podría estar mediado por la hipoxia. El flujo es dependiente de la presión aplicada, de la distancia entre los bordes de la herida y del tipo de tejido, y se incrementa con la liberación del vacuum, lo que sugiere que la aplicación de una presión negativa intermitente iría unida a un aumento del flujo sanguíneo38,39.
MacrodeformaciónLa presión negativa contrae el apósito en las tres dimensiones, aproximando los bordes de la herida y disminuyendo la tensión en estos. La consecuencia es que la herida se adapta al apósito, disminuyendo la superficie del defecto.
Microdeformación a nivel celularFavorece la proliferación celular mediante la estimulación y división de nuevos fibroblastos, lo que provoca una formación más rápida de tejido de granulación40 y aumento de la angiogénesis local41.
Eliminación de fluidos en el lecho de la herida42Favorece la disminución de carga bacteriana, edema, aumento de la perfusión y mantenimiento de la humedad adecuada para la cicatrización.
La TPN ha sido utilizada en el tratamiento de heridas complejas43: úlceras por presión, úlceras en el pie diabético, heridas traumáticas en las extremidades inferiores, heridas complejas torácicas o abdomen abierto. La presencia de escaras o tejido necrótico impide que la TPN sea efectiva, ya que esta no tiene como objetivo reemplazar al desbridamiento eficaz.
En la aplicación de la TPN en el abdomen abierto, la esponja de poliuretano del sistema VAC® con capa antiadherente se coloca directamente en contacto con el omento o sobre los órganos internos expuestos. La segunda capa de esponja (que distribuye la presión negativa sobre el abdomen) se coloca sobre la capa antiadherente, y se recorta un centímetro más ancha que los bordes de la pared abdominal.
Después se coloca una lámina transparente adhesiva sobre la esponja y la piel sana circundante, y se realiza un corte de aproximadamente 2cm para permitir la aplicación de la ventosa con el drenaje, que se conecta a la unidad de vacío del sistema VAC®, y se programa para producir una presión negativa de 100-150mmHg de manera intermitente.
Una vez conectado el vacío, la evacuación del aire mismo a través de los poros de la esponja produce su colapso y una distracción mecánica o estiramiento de los tejidos blandos. Además, se controla la secreción de fluido intraabdominal y se preserva la fascia para el cierre de la pared abdominal. El fluido de la herida se extrae a través de la esponja.
Este método:
- •
elimina activamente líquidos, lo que reduce el edema y elimina materiales infecciosos,
- •
proporciona tensión medial, lo que ayuda a minimizar la retracción de la fascia,
- •
ayuda a aislar las vísceras y contenidos abdominales,
- •
proporciona separación entre la pared abdominal y las vísceras,
- •
permite un rápido acceso para la reapertura (si fuera necesaria), y
- •
no requiere suturas para su colocación, lo que ayuda a prevenir el daño fascial.
El sistema VAC® ha sido utilizado por diversos grupos, y con él se ha conseguido un alto porcentaje de cierre fascial en casos de abdomen traumático44–48.
El grupo de Boele van Hensbroek et al.49 publicó en 2009 un estudio en el que se analizaron 57 series y utilizaban diferentes métodos de CT (VAC®, vacuum pack, sistemas de cremallera, suturas de retención y packing). En los pacientes con vacuum pack consiguieron en un 52% de casos el cierre fascial, con una mortalidad del 27%; mejores resultados se obtuvieron en las series en las que se optó por VAC® como método de CT.
Cheatham et al.50 publicaron en 2013 los resultados de un estudio prospectivo en el que compararon el sistema Barker's vaccumm-packing y la terapia VAC ABThera® (NPWT) en pacientes que requirieron un CT. Concluyeron que en el grupo de pacientes en el que se aplicó TPN se consiguió un aumento significativo de cierre fascial y una disminución en los requerimientos de fluidos durante la resucitación y estabilización. A pesar de ser pacientes con una severidad semejante en sus lesiones, en el grupo en el que se aplicó el Barker's vaccumm-packing se dio el doble de casos de fallo multiorgánico.
En situaciones como la persistencia de infección intraabdominal, ISS mayor de 15 o fallo renal agudo, que obligan a mantener el abdomen abierto por largo tiempo, disminuyen las probabilidades de conseguir un cierre fascial primario51. En estos casos aumentan las adherencias entre las asas intestinales y entre el intestino y la pared (con el desarrollo de fístulas enterocutáneas), y se produce en esta una lateralización que impide el cierre primario fascial, lo que desarrolla grandes hernias ventrales.
Para evitar estos efectos, Petersson et al.52 y Rasilainen et al.53 proponen una doble estrategia: la utilización de terapia VAC® junto con una malla de Prolene® suturada a los bordes fasciales. En los cambios de esponja (cada 2-3 días), la malla se recorta en su línea media y se resutura, de modo que va traccionando progresivamente hasta que los bordes fasciales (conforme va disminuyendo el edema intestinal) alcanzan la línea media y se recupera la fisiología. En ese momento ya se puede retirar la malla y realizar el cierre de la pared. A pesar de los buenos resultados, ambos grupos reconocen la necesidad de nuevos estudios que ratifiquen los resultados obtenidos.
Biomateriales (tabla 1)La utilización de biomateriales en el CT es una práctica habitual en cirugía desde que Ogilvie12, en 1940, utilizara materiales protésicos para el cierre de la pared abdominal cuando los límites de la herida no podían aproximarse.
Es un método efectivo para el CT de la pared abdominal que facilita su reconstrucción, la reentrada a través de la apertura de la malla54 y el drenaje y valoración del fluido intraabdominal. Además, resuelto el proceso, la prótesis puede permanecer en el lugar del implante, quedando incorporada al tejido de granulación formado sirviendo de soporte para el cierre definitivo.
Existe una gran variedad de prótesis en el mercado. Tradicionalmente se ha utilizado la clasificación de Amid55, pero la aparición de nuevos biomateriales con modificaciones en su estructura ha hecho necesario elaborar una nueva clasificación56 que relacione estructura y comportamiento al ser utilizadas en diferentes situaciones.
Ha quedado demostrado en numerosos trabajos que las prótesis de polipropileno, en contacto con el peritoneo visceral, crean adherencias firmes que originan fístulas entéricas57–59 e incluso la migración del biomaterial al interior de órganos cavitarios60. Por ello se ha descartado como biomaterial para ser utilizado en los casos en los que deba quedar en contacto directo con los órganos intraabdominales.
La utilización de prótesis de politetrafluoroetileno expandido (e-PTFE) puede proporcionar un sustrato apropiado para realizar un CT. El e-PTFE es un material químicamente inerte, biocompatible y que provoca escasa respuesta a cuerpo extraño por parte del huésped, y a partir de este se han desarrollado diferentes tipos de prótesis: Soft Tissue Patch® (prótesis microporosa), Mycromesh® (que presenta una estructura microporosa e incorpora perforaciones macroporosas espaciadas con regularidad para facilitar una integración más rápida entre el tejido y la prótesis) y Dualmesh® (con una superficie lisa no porosa destinada a evitar adherencias y otra superficie rugosa con una porosidad de entre 30-60μm). Diversos estudios experimentales han demostrado un comportamiento adecuado de las prótesis de PTFE en contacto con el peritoneo visceral61–63, con formación de mínimas adherencias con los órganos abdominales, laxas y fáciles de eliminar. En contacto directo con los órganos intraabdominales, promueven la formación de un peritoneo lineal organizado, aunque presentan como inconveniente una integración deficitaria y baja resistencia mecánica64.
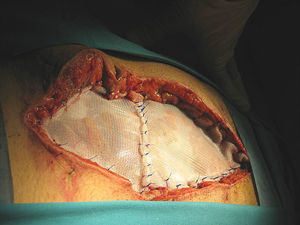
Vertrees et al.65,66 informaron de los resultados obtenidos con la utilización de Dualmesh® en el CT (fig. 5). En un estudio retrospectivo incluyeron 84 casos de pacientes en los que durante los conflictos de Irak y Afganistán fue necesario utilizar técnicas de CT. En la propia zona de operaciones se les realizó una cirugía de control de daños que precisó dejar el abdomen abierto, para lo que emplearon una prótesis de Dualmesh® anclada a los bordes fasciales, situando sobre ella un sistema VAC®. Al ir disminuyendo la presión intraabdominal y el edema, la malla se recortaba cada 3-5 días hasta retirarse y poder realizar el cierre fascial. En estos casos el cierre definitivo se llevó a cabo colocando una nueva malla, de polipropileno (62%) o biológica (AlloDerm® Life Cell, 31%). En otros pudieron realizar el cierre sin retirar la malla de Dualmesh®.
Esquema de cierre temporal según Vertrees et al.66.
Para conseguir un comportamiento óptimo, lo ideal sería disponer de una prótesis en la que funcionalmente concurrieran las propiedades de las prótesis reticulares y laminares, es decir, generar una prótesis compuesta (composite). El componente laminar sería el encargado de modular la formación de adherencias (mejorando el comportamiento de la prótesis al quedar en contacto con el peritoneo visceral), y el componente reticular proporcionaría una adecuada integración con los tejidos receptores y una apropiada resistencia biomecánica, evitando la retracción lateral de la pared abdominal. Estas prótesis se confeccionan empleando diferentes tipos de biomateriales, como polipropileno y PTFE, polipropileno y ácido hialurónico o poliéster y poliláctico. Algunos composites de última generación han incorporado el quitosano.
Bellón et al.67,68 diseñaron una prótesis composite (PL-PU99) formada por tres componentes: uno, reticular, de polipropileno de 1mm de poro, una lámina de poliuretano de un espesor de 26μm y pegamento acrílico que permite su unión. Estudiaron esta prótesis en contacto directo con el peritoneo visceral, y concluyeron que presenta un comportamiento óptimo en la interfase peritoneo/prótesis, lo que permite su utilización en el CT (figs. 6.1, 6.2 y 6.3).
1 Composición del biomaterial PL-PU, formado por polipropileno (PL) y una lámina de poliuretano (PU) unidas por un pegamento de cianoacrilato. Fuente: Bellón et al.68. 2 Cierre temporal con PL-PU en un paciente con abdomen traumático. 3 Cierre temporal con PL-PU (caso anterior) después de revisión de cavidad peritoneal. La prótesis se ha abierto y luego se ha vuelto a suturar.
En situaciones de contaminación e infección también se ha propuesto la utilización de prótesis biológicas, debido a su buena integración con el tejido receptor y a una mayor tolerancia a la infección. El gran inconveniente que presentan es que al ser material reabsorbible puede expandirse bajo tensión y originar grandes eventraciones, lo que unido a su gran coste hace necesarios nuevos y controlados estudios que evidencien el beneficio de su empleo respecto al menor índice de infección en comparación con otros biomateriales69–72.
Cierre abdominal finalUna vez corregidos los problemas por los que se decidió optar por un CT, se debe decidir si es conveniente el cierre definitivo de la pared abdominal durante el mismo ingreso o si es preferible diferirlo (meses después) hasta que el paciente se encuentre en mejores condiciones nutricionales, fisiológicas y mentales, y reparar en ese momento la «hernia ventral planeada».
El momento óptimo para el cierre abdominal después de un CT es cuando el paciente se encuentra estable, su estado nutricional es bueno y la distancia entre los bordes fasciales es 3-7cm73.
En pacientes en los que se realizó un CT por traumatismo se consigue un cierre de la pared abdominal durante el ingreso en un 60% de los casos, siempre y cuando se efectúe durante los 8 días siguientes a la primera cirugía. En los casos en los que se realizó el CT por sepsis intraabdominal, solo se consiguió realizar este cierre en un 30% de los casos74.
En los pacientes con abdomen abierto tratados durante varios días la anatomía se modifica, y los planos musculares se encuentran deprimidos por la inflamación y retracción lateral. Si no se hace una corrección quirúrgica a corto plazo puede desarrollarse una hernia gigante o con pérdida de domicilio, y si además coexiste un trayecto fistuloso, el tratamiento será un gran reto quirúrgico. La hernia ventral planeada hace referencia al manejo del paciente en el que la capa fascial de la pared abdominal no ha sido cerrada y el contenido abdominal es cubierto solo por la piel original o injerto de piel, por lo que se procede a la reparación de la hernia ventral meses después.
Cuando no es posible realizar el cierre fascial directamente, es necesario utilizar diversas técnicas que requieren la utilización de materiales protésicos o tejidos autógenos. Incluso en el supuesto de cierre primario de la fascia hay autores que refuerzan el cierre con la utilización de una malla, para prevenir la formación de hernia incisional75. La mayoría de los pacientes con defectos de pared abdominal de tipo i (cobertura adecuada de piel)76 pueden ser tratados con la colocación de una malla, realizándose una separación de componentes o combinación. En el abdomen abierto (defectos de pared de tipo ii) con defectos de piel puede ser necesario, además, utilizar otras técnicas, como la realización de colgajos microvasculares del tensor de la fascia lata77,78.
La separación anatómica de componentes fue publicada por primera vez por Ramírez et al.79. La clave es la creación de un componente abdominal musculofascial que pueda llevarse a la línea media desde la zona lateralizada, para proporcionar un cierre adecuado del defecto de la pared y reestablecer la dinámica de la pared abdominal. Se basa en la disección subcutánea lateral, una fasciotomía sobre la aponeurosis del músculo oblicuo mayor (aproximadamente a 2cm, lateral al músculo recto anterior) y la disección roma entre los músculos oblicuos externos, que permiten el deslizamiento de las capas/fascias musculares hacia la línea media.
Defectos de hasta 10-15cm pueden cubrirse con la desinserción de los músculos oblicuos externos de ambos lados (nivel i). En defectos mayores puede ser necesario, además, la liberación de la cara posterior de ambos músculos rectos (nivel ii)80.
En un intento de disminuir la disección y las recidivas, se han ido describiendo diversas modificaciones.
En defectos gigantes, Fabian et al. incluyen una división adicional del componente del músculo oblicuo menor y de los rectos abdominales, lo que permite una movilización adicional de los bordes para realizar un cierre completo y sin tensión81; además, para reforzar este cierre debe considerarse el uso del material protésico82,83.
Carbonell Tatay et al.84 realizaron una separación de componentes y la colocación de una malla de polipropileno. Si se trata de un nivel i, se coloca una malla de polipropileno que se fija al ángulo interno de los colgajos musculares del oblicuo mayor disecados, a los rebordes costales y al pubis, que queda situada por debajo de los colgajos musculares en sus extremos laterales y en su centro apoyada sobre el cierre aponeurótico. Si se trata de un nivel ii, después de disecar la aponeurosis posterior de ambos músculos rectos se coloca una malla por encima del peritoneo, alojada debajo de los músculos rectos, y otra malla por encima alojada bajo los dos colgajos del oblicuo mayor.
Zielinski et al.85 proponen la utilización de toxina botulínica A (TXBA) para ayudar a conseguir un cierre primario fascial. Denominaron a su técnica Chemical components separation with botulinum toxin A, la cual evitaba la disección tan amplia que se realiza en la técnica de separación de componentes de Ramírez, especialmente en presencia de contaminación o infección. Sostienen que se facilitaría el cierre primario fascial si con una técnica mínimamente invasiva se consiguiera contrarrestar la retracción lateral de la pared abdominal que se produce en pacientes con abdomen abierto en los que se ha anulado la estructura anatómica normal de la pared abdominal.
La TXBA bloquea diferentes proteínas de las terminaciones nerviosas colinérgicas86, lo que produce un bloqueo de las sinapsis neuromusculares y autonómicas colinérgicas y provoca una parálisis flácida de la musculatura. Sus efectos se aprecian al tercer día de la aplicación, y alcanzan su máximo efecto a las 2 semanas. La función nerviosa se recupera a los 3-6 meses. Se conocían los efectos de la TXBA en la pared abdominal, pero no se había utilizado en pacientes con abdomen abierto hasta la publicación del trabajo de Zielinski et al.85 quienes demostraron en un modelo animal que la inyección de TXBA en la pared abdominal disminuye la presión intraabdominal y aumenta el volumen intraabdominal. Ibarra-Hurtado et al.87 informaron de una disminución de la retracción lateral de la pared abdominal en 10 pacientes que habían presentado un abdomen abierto; con la inyección de TXBA consiguieron reducir en 5cm el diámetro de la hernia ventral. Tras 9 meses de seguimiento, no había recidivas.
Zielinski et al.85 aplicaron TXBA en 6 puntos de la pared (zona subcostal derecha e izquierda, línea axilar media derecha e izquierda y cuadrantes inferiores derecho e izquierdo), guiados por ecografía. Empezaron la inyección por el músculo transverso e inyectaron en ambos oblicuos. Se aplica tras la cirugía de control de daños y una vez estabilizado el paciente. Utilizando esta técnica en combinación con otras que minimicen la retracción lateral (presión negativa, parche de Wittmann), se consiguen buenos resultados en el cierre fascial primario. Se aplicó a 9 pacientes dentro de las primeras 24h de abdomen abierto, y se consiguió un 89% de cierres, aunque será necesaria una mayor experiencia para poder definir el papel de la TXBA en el cierre del abdomen abierto.
ConclusionesEl desarrollo del CT de la pared abdominal ha supuesto la disminución de la mortalidad en casos de abdomen catastrófico, pero su manejo es complejo.
La búsqueda de una técnica que evite las adherencias entre la pared y el intestino y que al mismo tiempo evite la distracción de la pared (a fin de evitar complicaciones como la presencia de fístulas enterocutáneas y grandes eventraciones) continúa abierta. Por ello, el cirujano debe analizar en cada caso las ventajas e inconvenientes de los procedimientos descritos, a fin de adoptar la decisión que considere más adecuada. El empleo de biomateriales puede ser una alternativa muy interesante, y dentro de la gran variedad de biomateriales existente, las prótesis compuestas combinan las ventajas de las reticulares y las laminares.
Sin perjuicio de las anteriores consideraciones, la utilización de terapias combinadas (y en especial el uso de biomateriales junto a terapia negativa) parece ser la opción que en términos generales y en mayor medida minimiza los efectos negativos del abdomen abierto en los casos en los que es previsible un CT prolongado.
El cierre definitivo fascial puede conseguirse con la combinación de diferentes técnicas, aunque la separación de componentes (combinada con la utilización de material protésico) es la tendencia actual para conseguir la recuperación anatómica y funcional de la pared abdominal (si bien es necesario un mayor número de ensayos controlados que ratifique los resultados hoy por hoy disponibles).
Conflicto de interesesNo existe conflicto alguno de intereses.