Los tumores que afectan a la pared abdominal pueden tener su origen en diversas estructuras anatómicas o tejidos de la pared. En el presente artículo de revisión se describen los hallazgos macroscópicos, histopatológicos e inmunohistoquímicos de las lesiones que con más frecuencia asientan en la pared abdominal. Se propone un algoritmo diagnóstico que combina las características clínicas y morfológicas que permiten clasificar cada uno de los procesos localizados en pared abdominal.
Tumors involving the abdominal wall arise from a large number of etiologies. This review article describe a diagnostic approach with macroscopic, histopathological and immunohistochemical features of the most common causes of abdominal wall masses. We propose a diagnostic algorithm for abdominal wall tumors which combines clinical data and morphologic appearances to classify each lesion.
La pared abdominal está anatómicamente constituida por piel, grasa, músculos, fascia transversal y peritoneo parietal. Las lesiones ocupantes de espacio pueden afectar u originarse en cualquiera de estas estructuras1–5. Estas lesiones pueden formar una masa tumoral o deformidades a nivel de la pared abdominal que pueden ser tumorales y no tumorales5. Revisamos los procesos patológicos más frecuentes que pueden asentar en la pared abdominal, describiendo fundamentalmente las características anatomopatológicas más significativas de cada entidad, así como la visión del patólogo en el diagnóstico de estas enfermedades1–5. En las tablas 1–3 se describe la clasificación de las lesiones ocupantes de espacio de pared abdominal no herniarias, que subdividimos en dos grupos principales: enfermedades no neoplásicas (tabla 1) y enfermedades neoplásicas (tablas 2 y 3).
Clasificación de las lesiones ocupantes de espacio de pared abdominal no herniarias
| 1. Enfermedades no neoplásicas |
| 1.1. No neoplásicas, infecciosas: celulitis y abscesos (bacterias, incluyendo actinomicosis, hongos, parásitos) |
| 1.2. No neoplásicas, no infecciosas (traumáticas, metabólicas/hormonales, endometriosis, inmunológicas) |
| - Hematoma |
| - Granuloma de sutura (tumor de Schloffer) |
| - Quiste de inclusión epidérmica |
| - Endometriosis y endometriomas |
| - Fascitis nodular y mesenteritis esclerosante intraabdominal (enfermedad relacionada con IgG4) |
Clasificación de las lesiones ocupantes de espacio de pared abdominal no herniarias
| 2. Enfermedades neoplásicas |
| 2.1. Neoplásicas (tumores primarios benignos) |
| 2.1.1. Tumores benignos |
| - Lipomas |
| - Tumores vasculares |
| - Leiomiomas |
| - Neurofibromas y schwanomas |
| - Fibromas e histiocitoma fibroso benigno |
| - Lesiones pigmentadas benignas |
| 2.1.2. Tres tipos especiales de los que, aunque son generalmente benignos, hay variantes atípicas o malignas |
| - Tumor fibroso solitario |
| - Tumores de células granulares |
| - Tumor miofibroblástico/seudotumor inflamatorio |
| 2.1.3. Tumores benignos pero potencialmente agresivos |
| - Fibromatosis y tumor desmoide |
Clasificación de las lesiones ocupantes de espacio de pared abdominal no herniarias
| 2. Enfermedades neoplásicas (continuación) |
| 2.2. Neoplásicas. Tumores primarios de pared abdominal malignos (piel y tejidos blandos) |
| - Carcinoma mioepitelial |
| - Neoplasia uracal maligna (adenocarcinoma) |
| - Sarcomas de tejidos blandos: dermatofibroma protuberans, otros sarcomas primarios (liposarcomas, leiomiosarcomas, sarcoma pleomórfico [antiguo histiocitoma fibroso maligno], sarcoma de Ewing de pared abdominal, sarcoma sinovial, sarcoma fibromixoide de bajo grado) |
| - Melanomas, linfomas primarios de pared abdominal (piel y tejidos blandos son muy raros) |
| 2.3. Tumores metastásicos o secundarios: recidiva local, infiltración por contigüidad, implantación (cicatriz, drenaje, puerto de laparoscopia) |
| 2.3.1. Carcinoma (tracto digestivo, páncreas, hígado, ginecológico, pulmón, riñón), nódulo de la hermana María José (Sister Mary Joseph's nodule) |
| 2.3.2. Sarcomas (intraabdominales, retroperitoneales, extremidades), diagnóstico diferencial con GIST metastásicos |
| 2.3.3. Melanoma |
| 2.3.4. Linfomas/leucemias |
Los abscesos aparecen frecuentemente secundarios a una cirugía previa o de manera espontánea en pacientes diabéticos, inmunocomprometidos o en el curso de enfermedad de Crohn, diverticulitis o tuberculosis6,7. La actinomicosis se ha reportado en pacientes con neoplasias hematológicas y puede ocasionar lesiones ocupantes de espacio en la pared abdominal7. Ocasionalmente recibimos en el laboratorio de anatomía patológica material de biopsia procedente de estas lesiones infecciosas. Mediante el estudio con la técnica convencional de hematoxilina y eosina (HyE) y sobre todo con la ayuda de las técnicas histoquímicas especiales para PAS, plata, Zhiel, Neelsen o Gram se puede determinar la probable etiología del proceso infeccioso; de hecho, algunas alteraciones histológicas pueden indicar un posible agente etiológico (granulomas caseificantes y células gigantes tipo Langhans/tuberculosis). No obstante, el diagnóstico final de las enfermedades infecciosas requiere un estudio microbiológico que en ocasiones lleva implícitas técnicas de cultivos especiales y PCR para determinar qué tipo de agente infeccioso es el causante de la infección, por lo que se requiere el envío de muestras en fresco al laboratorio de microbiología.
No neoplásicas, no infecciosasHematomaGeneralmente, el diagnóstico de estas lesiones es clínico y/o radiológico y, habitualmente, no recibimos muestras en el laboratorio de patología, aunque ocasionalmente se envía material obtenido por punción con aspiración en caso de lesión dudosa de malignidad (neoplasias con hemorragia extensa)5.
Granuloma de sutura (tumor de Schloffer)Se trata de una lesión inflamatoria granulomatosa que se da tras una intervención quirúrgica donde se ha empleado sutura no absorbible u otro material tipo cuerpo extraño1–5,8. En la mayoría de las cicatrices de laparotomías previas encontramos este tipo de lesión, donde se observan abundantes células gigantes tipo cuerpo extraño, restos de material de sutura con histiocitos, fibrosis, hemorragia y necrosis. Es una de las lesiones histológicas más frecuentes que se encuentran en las biopsias de pacientes con cirugía abdominal previa.
Endometriosis y endometriomasLa endometriosis se define como un crecimiento ectópico del endometrio, y puede ser pelviana o extrapelviana. Aunque se puede localizar de manera espontánea sobre la pared abdominal intacta, lo más frecuente es su aparición sobre cicatrices quirúrgicas. El estudio histopatológico muestra glándulas o células epiteliales entremezcladas con células fusiformes o estromales, histiocitos cargados de hemosiderina y células inflamatorias como consecuencia de la hemorragia. La presencia de dos de los tres componentes (glándulas endometriales, células estromales o macrófagos cargados de hemosiderina) es diagnóstica de endometriosis5. Raramente puede observarse la transformación maligna de una endometriosis, que es muy difícil de diferenciar de una metástasis por adenocarcinoma en pared abdominal, al menos desde el punto de vista patológico. El diagnóstico diferencial se debe realizar con las fibromatosis, reacción granulomatosa con hemorragia, necrosis grasa, fascitis nodular (FN) y metástasis por adenocarcinoma de origen ginecológico o intestinal1–8.
De forma ocasional nos puede llegar al Departamento de Patología una pieza quirúrgica de resección intestinal con sospecha de neoplasia maligna, y el diagnóstico final puede ser de endometriosis intestinal. Es importante conocer que este diagnóstico se debe realizar, sobre todo, tras el examen de la muestra en parafina, pues mediante una biopsia por congelación se pueden cometer errores diagnósticos, ya que es muy fácil confundir una endometriosis de pared intestinal con adenocarcinomas bien diferenciados.
Fascitis nodularLa FN se presenta como una masa dolorosa de crecimiento lento, generalmente exofítica. Puede aparecer en cualquier región anatómica excepto las vísceras, aunque tiene predilección por las extremidades y el tronco9–14. La FN debe incluirse en el diagnóstico diferencial, especialmente en pacientes con una lesión en partes blandas de rápido crecimiento o con una historia reciente de traumatismo. La FN se caracteriza histológicamente por una proliferación de fibroblastos y miofibroblastos asociados generalmente a un estroma mixoide. Las células no exhiben atipia citológica ni mitosis atípicas9–14. El estudio inmunohistoquímico (IHQ) muestra positividad para actina de músculo liso, vimentina y CD68; sin embargo, los resultados son negativos para citoqueratinas, S100 y desmina12–14. El diagnóstico diferencial es, sobre todo, con sarcomas fusocelulares de bajo grado de malignidad.
Mesenteritis esclerosante intraabdominalEsta patología puede afectar secundariamente a la pared abdominal, y actualmente está incluida en el espectro de enfermedades relacionadas con IgG4. Desde el punto de vista histológico, se caracteriza por fibrosis y esclerosis entremezclada con plasmocitos y eosinófilos9. El diagnóstico diferencial, con el seudotumor inflamatorio y las fibromatosis, es difícil, y muchas veces el estudio IHQ para ALK, IgG4 y β-catenina permite llegar a conclusiones diagnósticas. El ALK positivo es frecuente en los tumores miofibroblásticos inflamatorios/seudotumor inflamatorio. La tinción positiva en plasmocitos para IgG4 favorece el diagnóstico de mesenteritis esclerosante, y la positividad nuclear para β-catenina es típica de la fibromatosis/tumor desmoide9.
Enfermedades neoplásicasNeoplásicas/tumores primarios benignosTumores benignosLa cantidad de tumores benignos que pueden aparecer en la pared abdominal es muy amplia, e incluye todas aquellas neoplasias benignas originadas en cualquier estructura histológica de la piel, la grasa y los músculos de la pared abdominal10–14. Los más frecuentes son los originados en el tejido graso (lipomas) (fig. 1A), vasculares (hemangiomas), de músculo liso (leiomiomas), tejido nervioso (schwanomas, neurofibromas), quistes de inclusión epidérmica o sebáceos, fibromas, histiocitoma fibroso benigno y lesiones pigmentadas benignas (nevus)10–14. El aspecto macroscópico de la mayoría de estos tumores es de lesión benigna, con ciertos rasgos que definen algunos tipos histológicos específicos. Por ejemplo, los lipomas son de color amarillo y casi indistinguibles del color de la grasa normal; los tumores vasculares, generalmente, de color violáceo o rojizo; los fibromas, leiomiomas y tumores neurales son muy parecidos macroscópicamente y, generalmente, muestran color blanquecino-amarillento o grisáceo, con zonas ocasionales de hemorragia o degeneración quística5,10–14.
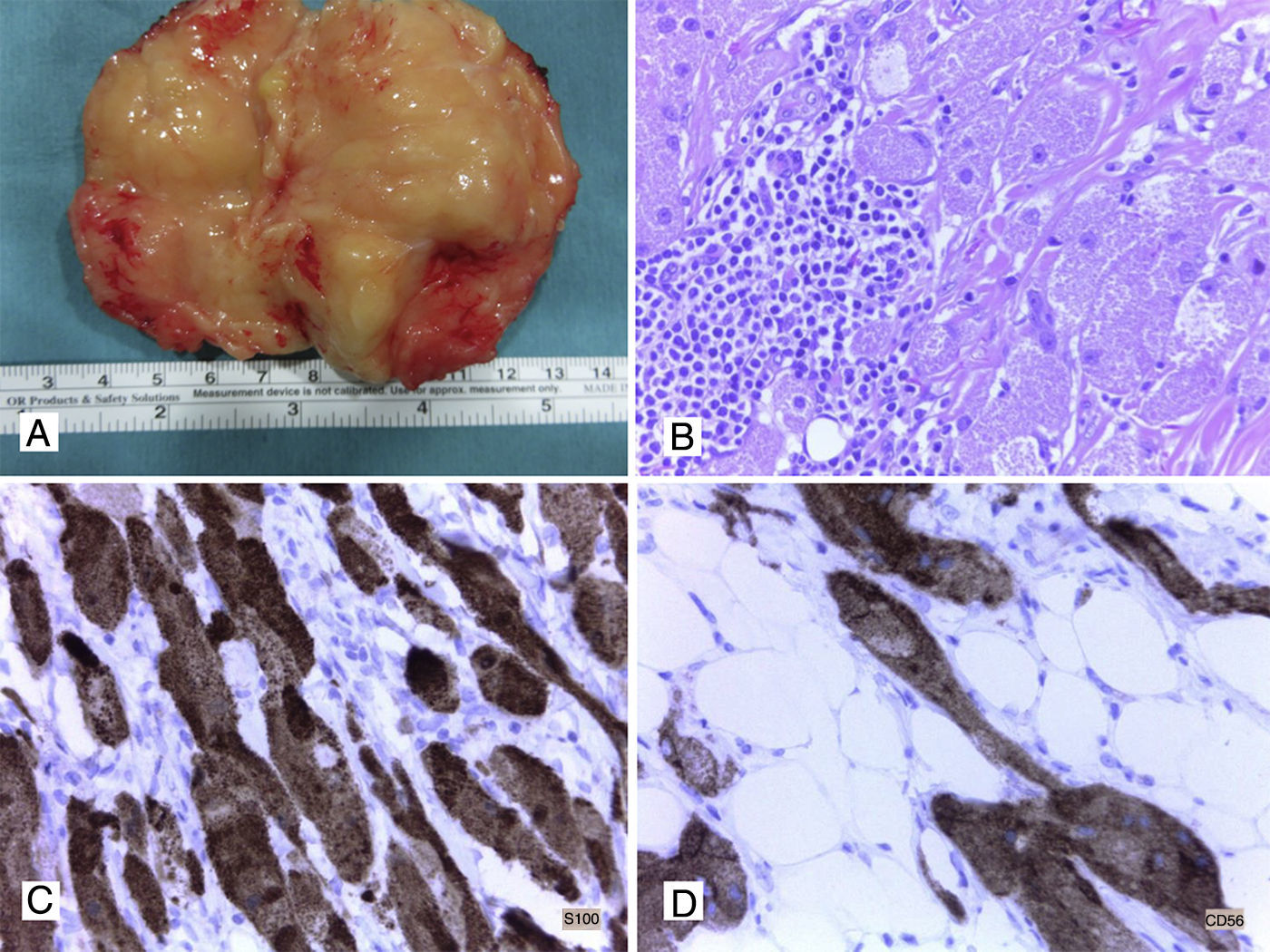
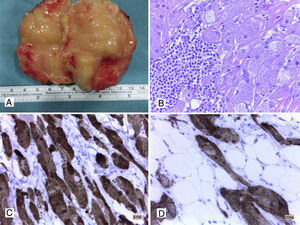
A. Lipoma de pared (aspecto macroscópico). B. Tumor de células granulares benigno, hematoxilina y eosina (HyE) (40x). C. Tinción inmunohistoquímica (IHQ) positiva +++ para S100 en tumor de células granulares (40x). D. CD56 intensamente positivo en tumor de células granulares (40x).
El diagnóstico de estos tumores se puede hacer mediante biopsia por aspiración con aguja fina, pero siempre teniendo en cuenta que el análisis histológico de la lesión completa es fundamental, sobre todo en los casos donde aparezcan atipias citológicas que impidan realizar un diagnóstico diferencial de manera segura, especialmente con los sarcomas de bajo grado.
En el análisis histológico de la resección del tumor es fundamental describir el estado de los márgenes de resección, porque alguno de estos tumores puede presentar recurrencias cuando son incompletamente resecados, sin ser sinónimo o sugestivo de malignidad. El índice de proliferación celular en estas neoplasias es casi siempre muy bajo (menor del 5%) y en caso de dudas con el examen histopatológico se puede acudir a las técnicas de IHQ para el diagnóstico diferencial entre ellos, sobre todo, cuando haya duda entre origen muscular (actina de músculo liso, desmina y H-caldesmon positivos), neural (S100, NF, CD56 positivos) o fibroblástica (vimentina positiva y negatividad para marcadores musculares o neurales)11–14.
Hay tres tipos especiales de tumores que, aunque son generalmente benignos, pueden tener variantes atípicas o incluso malignas: tumor fibroso solitario, tumores de células granulares (TCG) y tumores miofibroblásticos/seudotumor inflamatorio.
Tumor fibroso solitarioEl diagnóstico de tumor fibroso solitario (TFS) se realiza generalmente mediante la observación microscópica con HyE, y se caracteriza por una proliferación de células fusocelulares y redondas con patrón de crecimiento hemangiopericítico y un estroma rico en colágeno12–15. La IHQ confirma el diagnóstico por la positividad para CD34, CD99 y Bcl-2 que muestran estos tumores. Recientemente se ha descrito que la gran mayoría de los TFS son positivos para STAT6 o GRIA2 utilizando la IHQ; además, en muchos de estos tumores se ha detectado el gen de fusión NAB2-STAT612–15. La mayoría de los TFS son benignos, pero existen casos malignos caracterizados por ser lesiones muy hipercelulares que muestran al menos focalmente evidente atipia citológica, necrosis tumoral, aumento del número de mitosis (≥4 mitosis por 10 campos de gran aumento) y/o márgenes de crecimiento infiltrativos14. Evidentemente, esta variante maligna tiene potencial metastásico y hay que tenerla en cuenta para implementar un tratamiento oncológico si procede, cuando el patólogo informe criterios de malignidad.
Tumor miofibroblástico inflamatorioEl tumor miofibroblástico (TMI), también conocido como seudotumor inflamatorio, se describió inicialmente en pulmón, aunque puede aparecer en cualquier localización12–14,16. A pesar de que la mayoría de los artículos se inclinan a favor de la naturaleza neoplásica de esta lesión, todavía no está claro si es una lesión benigna o maligna. Considerando que dicha lesión tiene un potencial de recurrencia local e incluso puede producir metástasis a distancia, se ha clasificado como una neoplasia de comportamiento incierto o de potencial biológico intermedio en cuanto a malignidad. El aspecto macroscópico es variable e indistinguible de otras neoplasias, como por ejemplo del TFS. En su examen histológico se observa una proliferación de células fusiformes miofibroblásticas entremezcladas con un infiltrado inflamatorio constituido por plasmocitos, linfocitos y eosinófilos. Histológicamente, se han reportado tres patrones de crecimiento en estos tumores que incluyen patrón mixoide vascular, lo que recuerda una FN, patrón fusiforme y patrón hipocelular colagenizado y simula un tumor desmoide12–14,16. El estudio IHQ ayuda en algunos casos, sobre todo la expresión citoplasmática difusa para ALK que se observa en alrededor del 50% de estos tumores. La actina de músculo liso, vimentina y CD34 son positivas, y el CD30, CD15 y marcadores epiteliales, negativos14,16. En casos dudosos se pueden realizar estudios de biología molecular para confirmación diagnóstica de estos tumores. Aproximadamente en el 50% de estos podemos encontrar reordenamiento del gen ALK. Sin embargo, hay muchos casos donde no se detecta esta anomalía genética (TMI ALK negativos)12,14,16. Recientemente, se ha descrito que varios casos con diagnóstico de TMI ALK negativos pueden mostrar reordenamiento del gen ROS1, siendo positivos por IHQ para ROS116. En estos tumores con reordenamiento ROS1 se han encontrado genes de fusión YWHAE-ROS1 y TFG-ROS116.
Tumores de células granularesLos TCG o tumores de Abrikossoff pueden aparecer en pared abdominal sobre todo después de una cirugía o de manera esporádica (fig. 1B). Son lesiones generalmente benignas, aunque se describen formas malignas poco comunes. El único criterio bien definido de malignidad para estos tumores es la presencia de metástasis ganglionares o a distancia; sin embargo, se han descrito una serie de criterios histológicos e IHQ asociados con riesgo de malignidad en estos tumores. Nasser et al.10,12-14 describieron seis criterios histológicos (necrosis, patrón fusiforme, núcleos vesiculares con nucléolo prominente, elevada actividad mitótica, alto índice nuclear/citoplasmático y pleomorfismo), y propusieron que cuando al menos tres de ellos estuvieran presentes en un TCG se debería plantear la posibilidad de un TCG maligno10,12–14.Estos criterios han sido cuestionados posteriormente ya que se han encontrado algunos TCG que no tenían ninguno de estos criterios y sin embargo habían desarrollado metástasis, y por el contrario, se han dado también otros casos con varios de estos criterios y con comportamiento benigno. Posteriormente, Nasser et al.10,12–14 propusieron que la presencia de necrosis y mitosis, así como un Ki-67 superior al 10%, se asociaba frecuentemente a comportamiento maligno; no obstante, la presencia de metástasis persiste como el único criterio de malignidad en estos tumores. La característica histológica fundamental de los TCG son las células con citoplasma abundante eosinofílico de apariencia granular, que recuerda a los histiocitos o macrófagos. Estas células son positivas por IHQ para S100 (fig. 1C), CD56 (fig. 1D), CD68, CD10, PGP9.5, α-inhibina, calretinina, GFAP y nestina, y menos frecuentemente para TFE-3 y CD11710,12–14. El diagnóstico diferencial se debe realizar con todos los procesos neoplásicos (sarcomas con células granulares/leiomiosarcomas, sarcomas neurales, angiosarcomas, etc.) y no neoplásicos (enfermedad de Gaucher, etc.) que presenten células con una morfología similar a la de los TCG.
Tumores benignos pero potencialmente agresivosFibromatosis/tumor desmoideLos tumores desmoides representan una proliferación fibroblástica y miofibroblástica agresiva con variable producción de colágeno que, frecuentemente, aparece en la pared abdominal anterior17–35. Estas lesiones se caracterizan por tener un crecimiento infiltrativo, ausencia de evidente atipia nuclear y bajo índice mitótico. Estos tumores infiltran localmente y presentan recurrencias frecuentemente, pero no producen metástasis. Además, no es infrecuente la presencia de márgenes quirúrgicos afectos en las piezas de resección, hecho que favorece la recurrencia local. En la tabla 4 se describe la clasificación de las fibromatosis.
Clasificación de las fibromatosis (según su localización)
| 1. Abdominales: afectan a la pared abdominal anterior |
| 2. Intraabdominales (profundas o agresivas): se localizan en el mesenterio/omento o pelvis (intraperitoneales o retroperitoneales) |
| 3. Extraabdominales: cuando aparecen en tórax, extremidades y región de cabeza y cuello |
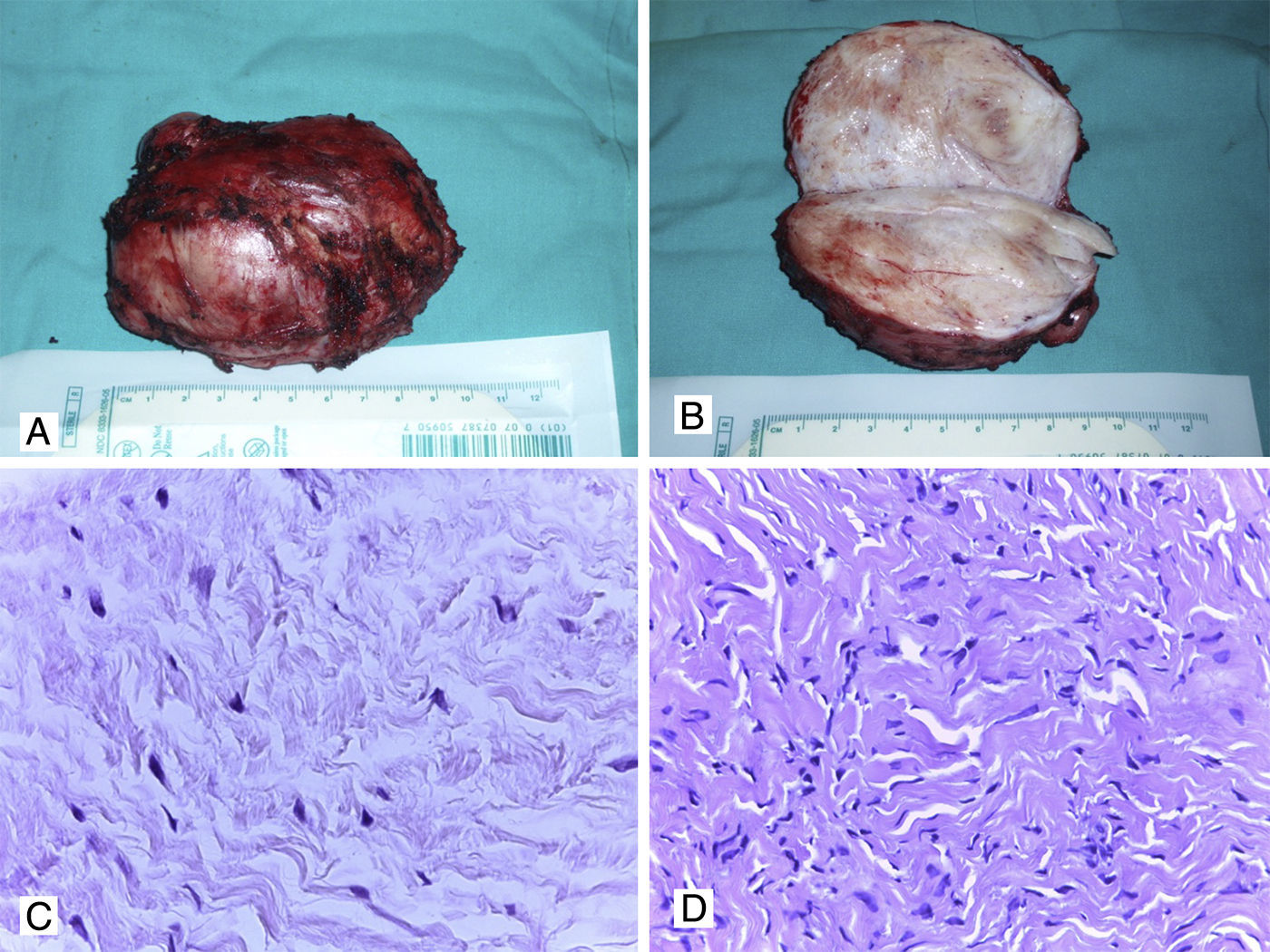
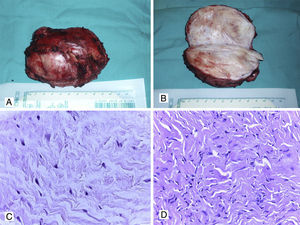
Macroscópicamente los tumores desmoides pueden tener forma redondeada o irregular (debido a la escisión incompleta de algunos casos12). La superficie de corte es dura y de un color blanquecino grisáceo, sin necrosis ni hemorragia (fig. 2A y 2B). Histológicamente, consisten en una proliferación de células fusiformes de apariencia benigna separadas por fibras gruesas de colágeno (fig. 2C y 2D)12,13,17–25. Las células neoplásicas tienen núcleos pequeños y de contornos regulares, donde las mitosis son muy infrecuentes y no se observa necrosis (lo que apoya la naturaleza benigna de la lesión). Ocasionalmente puede observarse degeneración mixoide, por lo que se pueden confundir con tumores mixoides o con FN12,13,18–30. La IHQ de estos tumores muestra positividad para vimentina, actina de músculo liso y β-catenina (tinción nuclear). Los tumores desmoides son negativos para desmina, citoqueratinas y S100, lo que excluye otros tumores con patrón fusocelular de apariencia benigna o maligna de bajo grado12,13,18–35.
Aproximadamente, en el 98% de los tumores desmoides esporádicos se encuentran mutaciones somáticas en la β-catenina (CTNNB1), y ciertos tipos de mutaciones específicas de este gen, como S45-F, incrementan el riesgo de recurrencia significativamente24,32.
El diagnóstico diferencial de las fibromatosis con patrón convencional fusocelular se debe realizar con todas aquellas proliferaciones fibroblásticas y/o miofibroblásticas reactivas (queloide, mesenteritis esclerosante, FN, pólipo fibroide inflamatorio) o neoplásicas (fibroma, neurofibroma, GIST, fibrosarcoma, mixofibrosarcoma y otros sarcomas fusocelulares de bajo grado de malignidad)12–14,17–30. Aunque la morfología permite distinguir generalmente la fibromatosis de otros procesos, en ocasiones –debido a escasez de tejido, artefacto etc.– es necesario acudir a la clínica y al estudio IHQ con β-catenina. La tinción nuclear positiva para β-catenina es un marcador que actualmente se considera como primordial en la distinción entre los tumores desmoides y otros tumores con morfología similar17–35.
El diagnóstico diferencial es particularmente difícil cuando las fibromatosis de tipo desmoide tienen un patrón de crecimiento con áreas mixoides en las que se deben diferenciar de lesiones mixoides benignas y malignas. El diagnóstico diferencial se debe realizar con otros tumores o lesiones seudotumorales que muestren áreas mixoides, sobre todo FN, tumores del estroma gastrointestinal (GIST), TFS, leiomiosarcomas, sarcomas neurales, histiocitoma fibroso maligno mixoide, condrosarcomas mixoides y neurofibromas12–14,18,33.
Los GIST expresan usualmente CD117 y DOG-1, que no se expresan habitualmente en la fibromatosis. Los leiomiomas y leiomiosarcomas son tumores que expresan marcadores de músculo liso (actina de músculo liso, desmina y H-caldesmon) y son negativos para la β-catenina. Los tumores neurales malignos expresan marcadores IHQ, generalmente no expresados en las fibromatosis, como el S100, PGP9.5, CD56 y, además, tienen un índice de proliferación celular Ki-67 elevado12–14,18,33. El Ki-67 en las fibromatosis es muy bajo, raramente superior al 5%.
Neoplásicas. Tumores primarios de pared abdominal malignos (piel y tejidos blandos: carcinomas, sarcomas y otros)Carcinoma mioepitelialEl carcinoma mioepitelial o mioepitelioma maligno es una neoplasia antiguamente denominada paracordoma o tumor mixto, que puede aparecer en tejidos blandos de cualquier localización, incluyendo la pared abdominal. Histológicamente se caracteriza por nidos de células tumorales que crecen en cordones en un fondo mixoide. Ocasionalmente pueden tener una morfología rabdoide con citoplasma abundante y eosinofílico12–14. Las células neoplásicas expresan marcadores epiteliales (citoqueratinas, EMA) y musculares (actina de músculo liso), y hasta el 50% de estas neoplasias muestran reordenamiento en el gen EWSR1. El diagnóstico diferencial se debe realizar con metástasis por adenocarcinoma en pared abdominal, condrosarcoma mixoide y sarcoma epitelioide12–14,36–43.
Neoplasia uracal maligna (adenocarcinoma)Los tumores del ligamento uracal son extremadamente raros y representan el 0.2% de todos los cánceres de vejiga. Aparecen frecuentemente en hombres de entre 40 y 70 años de edad como una masa supravesical en la línea media12,13,36–43. El adenocarcinoma es el tipo histológico más común (90%), y su variante entérica/mucinosa es la más frecuente. El diagnóstico diferencial fundamental es con las metástasis por adenocarcinoma de tipo intestinal con primario en tracto digestivo, páncreas, vía biliar, ovárico o pulmonar. En estos casos, como el resultado IHQ es muy parecido (CDX2 positivo), es muy importante la correlación con los hallazgos clínicos y radiológicos.
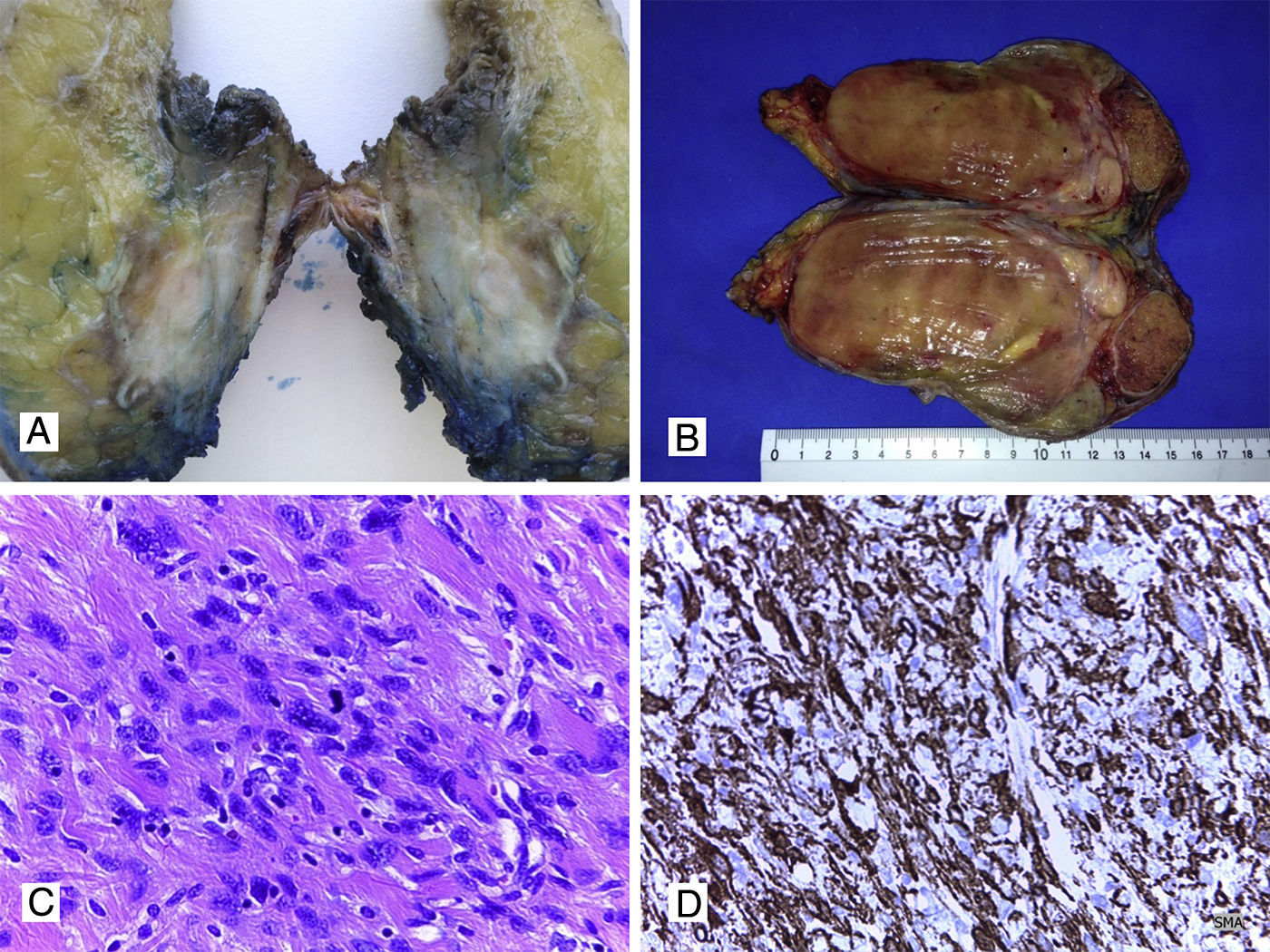
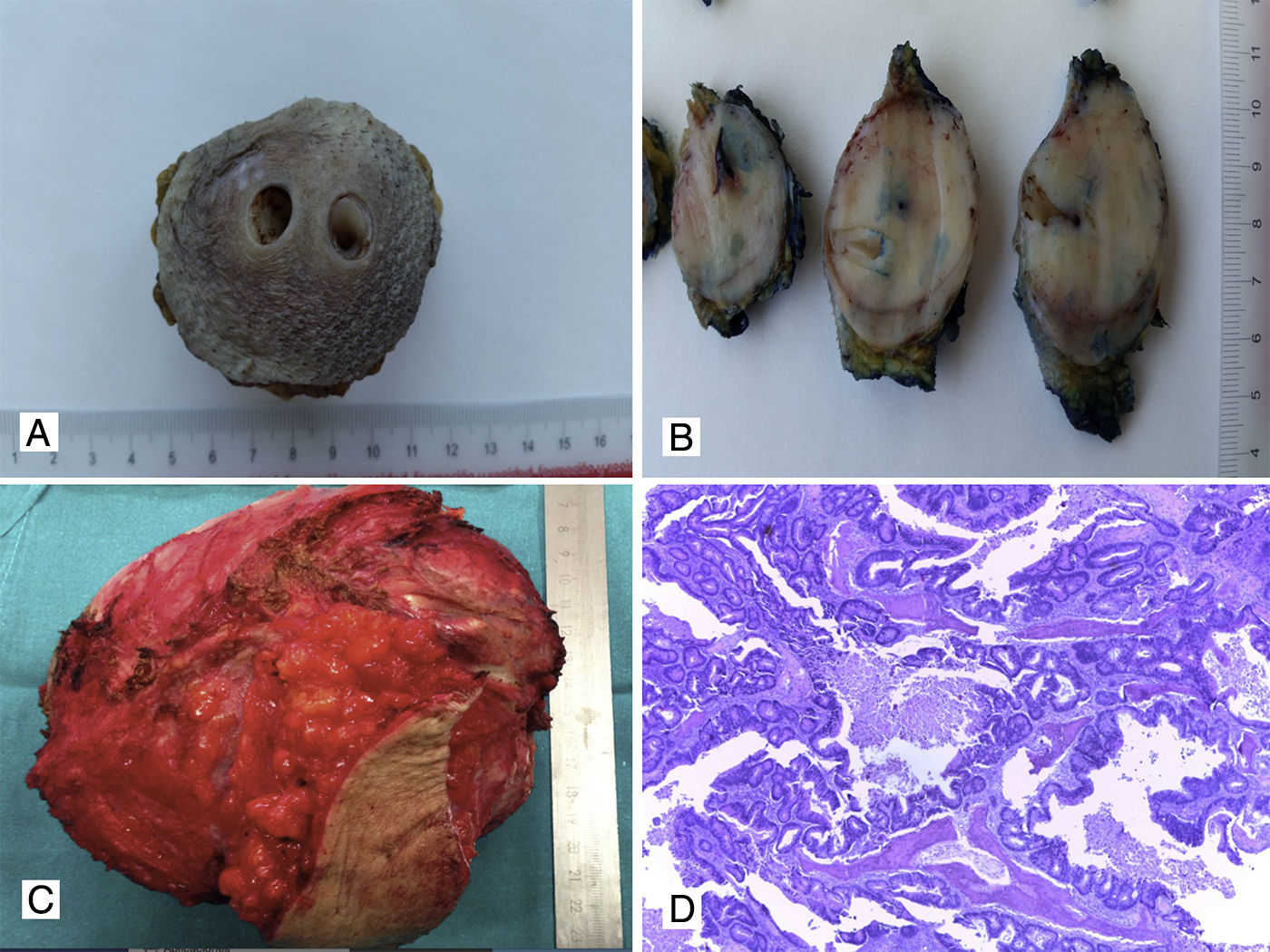
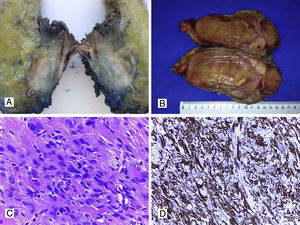
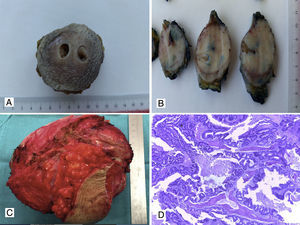
Sarcomas de tejidos blandosLos sarcomas de partes blandas constituyen una proliferación mesenquimal maligna que pueden originarse en músculo, grasa, vasos sanguíneos, sistema nervioso periférico y tejido fibroso. La afectación de pared abdominal se da entre el 1% y el 3% de los casos, y puede ser primaria o metastásica. El tipo histológico más habitual es el sarcoma pleomórfico, antiguamente denominado histiocitoma fibroso maligno, seguido de leiomiosarcoma (fig. 3A, 3B y 3C), liposarcoma (fig. 3B), fibrosarcoma, dermatofibrosarcoma (fig. 4A y 4B), sarcoma fibromixoide de bajo grado y rabdomiosarcoma12–16,44–47. Estos tumores tienen una alta incidencia de recidiva local (25%) y metástasis a distancia, con excepción de los dermatofibrosarcomas, que tienden a presentar recurrencias localmente pero no a distancia. Los SPB invaden generalmente los tejidos próximos por contigüidad, pero es raro que produzcan metástasis ganglionares, aunque hay algunos tipos histológicos que sí pueden producir metástasis nodales, como los rabdomiosarcomas, sarcoma de Ewing, angiosarcomas, sarcoma sinovial, sarcoma de células claras y sarcomas indiferenciados Ewing-like12–16,44–47. Las metástasis a distancia pueden aparecer preferentemente en el pulmón, y con menor incidencia, en hígado y huesos.
A. Leiomiosarcoma de pared (aspecto macroscópico). B. Liposarcoma con zonas de color amarillento similares a tejido graso normal y otras zonas con aspecto sarcomatoso. C. Corte histológico con HyE de un leiomiosarcoma con presencia de células fusiformes y presencia de mitosis (40x); D. Tinción IHQ positiva para actina de músculo liso en leiomiosarcoma de pared (40x).
El diagnóstico histológico preoperatorio puede basarse en la biopsia incisional, la biopsia con aguja gruesa (tru-cut) o la punción aspirativa con aguja fina (PAAF)5,12–16. La PAAF a menudo no es concluyente en el grado ni subtipo histológico porque, habitualmente, lo que diagnóstica son patrones citológicos que pueden ser comunes a diferentes sarcomas (fusocelular, células redondas, epitelioide, pleomórfico), por lo que tiene más utilidad en el diagnóstico de recurrencias que en el inicial.
La biopsia por tru-cut puede facilitar el diagnostico inicial, ya que facilita la observación del patrón histológico y además permite realizar estudio IHQ y molecular adicional5,12–14. De cualquier manera, una limitación fundamental es la heterogeneidad que pueden tener estos tumores, lo que puede inducir a resultados falsos negativos o positivos o a diagnósticos inadecuados cuando se examina solo una parte del tumor. En ocasiones el material que envían al laboratorio de patología no es abundante, y en otras ocasiones gran parte de la biopsia muestra necrosis o tejido no tumoral. La biopsia escisional, aunque permite una evaluación completa de la lesión, incluidos los márgenes de resección quirúrgicos, parece ser que está relacionada con la diseminación local en algunos casos, por lo que hay una tendencia a no usarla, a no ser que sean lesiones pequeñas.
El estudio histopatológico de estos tumores debe aportar datos de gran importancia para el clínico que ayuden a tomar decisiones futuras en cuanto al tratamiento. Estos datos incluyen tamaño del tumor, tipo histológico, grado tumoral (grado de diferenciación, número de mitosis y porcentaje de necrosis tumoral) y estado de los márgenes de resección quirúrgica12–14.
Muy frecuentemente, los SPB muestran patrones histológicos similares y el estudio IHQ es esencial para poder llegar a un diagnóstico definitivo. La IHQ permite definir si el tumor muestra diferenciación muscular, neural, epitelial, etc., lo que orienta en cierta medida al subtipo específico de sarcoma12–14. En ocasiones incluso con un extenso estudio IHQ y un análisis profundo de la histología es imposible definir correctamente el tipo exacto de sarcoma y tenemos que recurrir a los métodos de biología molecular para poder llegar al diagnóstico final. Algunos sarcomas tienen translocaciones cromosómicas que pueden detectarse mediante métodos moleculares, como la hibridación in situ fluorescente o las técnicas de reacción en cadena de la polimerasa (RT-PCR). Mediante la hibridación in situ fluorescente podemos demostrar la presencia de reordenamiento EWSR1 que caracteriza algunos sarcomas como el sarcoma de Ewing, entre otros. La RT-PCR es de gran utilidad para detectar algunos genes de fusión que caracterizan ciertos sarcomas de partes blandas, como por ejemplo COL1A1-PDGFB en dermatofibrosarcoma protuberans, EWSR1/FLI1 en sarcoma de Ewing, SYT/SSX en sarcoma sinovial, PAX3/7-FOXO1 en rabdomiosarcomas y CIC/DUX4, BCOR/CCNB3 o CIC/FOXO4 en sarcomas raros. La presencia de algunas mutaciones o amplificaciones también facilitan la confirmación del diagnóstico en algunos tumores, como los GIST, donde se describen mutaciones en CKIT o PDGFRα, la amplificación en MDM2 en los liposarcomas y la del MYC en los angiosarcomas12–14,48,49.
Melanomas, linfomas primarios de pared abdominal (piel y tejidos blandos son muy raros)Tanto los melanomas como las neoplasias linfoides sobre todo linfomas T cutáneos, tipo micosis fungoide, pueden aparecer raramente en la pared abdominal como tumores primarios o como consecuencia de una diseminación a distancia. Su aspecto morfológico no difiere de las formas de presentación en otros sitios y siempre hay que considerarlos en el diagnóstico diferencial12,13.
Tumores metastásicos en pared abdominalEn la pared abdominal se puede desarrollar un tumor metastásico, como resultado de una implantación local o de una diseminación hematógena. De hecho, las metástasis son los tumores malignos más frecuentes en pared abdominal. Estas lesiones se pueden subclasificar en tumores metastásicos en pared abdominal (diseminación hematógena o linfática) o infiltración de la pared abdominal (lesiones secundarias), que incluyen las relacionadas con recidivas locales, infiltración por contigüidad e implantes en cicatriz, drenajes y puerto de laparoscopia12,13,50–56.
Carcinomas (fig. 4C y 4D), sarcomas, GIST, melanomas y neoplasias hemolinfopoyéticas pueden ser la causa de metástasis o implantes en la pared abdominal50–62. Dentro del grupo de los carcinomas, las metástasis cutáneas, subcutáneas o en tejidos blandos de pared han sido reportadas en pacientes con antecedentes de cáncer de mama, tracto genitourinario, colon, estómago, riñón, carcinoma hepatocelular, vesícula biliar, cáncer ginecológico, esófago, tiroides y pulmón5,12,13,50–56.
No es frecuente encontrar metástasis a distancia por carcinomas de vesícula biliar, colorrectal y otros órganos del aparato digestivo en tejido subcutáneo de pared, distantes al sitio de incisión de la laparoscopia50–56.
Cuando las metástasis ocurren cerca del ombligo se debe excluir como primera posibilidad el «nódulo de la hermana María José» (Sister Mary Joseph's nodule). Este tipo de lesión se presenta como un nódulo en el ombligo que puede ulcerarse o tener necrosis, hemorragia o contenido mucinoso, seroso o purulento50. Este tipo de metástasis umbilical aparece en el 1-3% de los pacientes con cáncer gastrointestinal o genitourinario, incluyendo el cáncer de endometrio.
Cualquier tipo de sarcoma puede afectar de manera metastásica a la pared abdominal; el antecedente de sarcoma en otra localización con una morfología similar a la observada en la metástasis permite generalmente excluir que no se trate de un sarcoma primario de la pared abdominal.
Infiltración secundaria de la pared abdominal. Tumores metastásicos secundariosRecidiva local, infiltración por contigüidad, implantación (cicatriz, drenaje, puerto de laparoscopia)5,60–62.
Estos tumores asociados a implantación local pueden estar asociados a ciertos procedimientos quirúrgicos como son las laparoscopias o la PAAF.
Implantes relacionados con laparoscopiaLos implantes tumorales en los orificios de drenaje y sobre las cicatrices de laparotomía se conocen desde siempre, y tras la generalización de la laparoscopia se ha descrito la aparición de implantes tumorales en los orificios de introducción de los trocares con diseminación peritoneal después de la manipulación de tumores malignos (preferentemente en neoplasias de vías biliares y ováricas)5,60,61. En relación con las neoplasia colorrectales se han descrito recidivas tumorales asociadas a una excesiva manipulación tumoral, rotura del tumor y cambios de trocares.
Varios autores recomiendan que cuando se realice una cirugía de tumores ováricos de gran tamaño con sospecha de tumor mucinoso se debe extraer el tumor evitando su rotura y salida del contenido mucinoso, para prevenir la metástasis en el puerto de la laparoscopia, aunque la incidencia es muy baja.
Implantes tumorales asociados a punción aspirativa con aguja finaLos implantes tumorales en pared tras PAAF de masas intraabdominales son raros62. La diseminación de células malignas a la pared abdominal es una complicación que se ha descrito como posterior a la aplicación de procederes diagnósticos en pacientes con sospecha de carcinoma hepatocelular. Además, en algunos centros persiste la PAAF como proceder diagnóstico en las neoplasias ováricas, y en el caso de tumores mucinosos ováricos el riesgo de implantes en el trayecto de la aguja, incluyendo la pared abdominal, no es despreciable.
El papel del patólogo en el diagnóstico de estas lesiones consiste en confirmar la presencia de una lesión tumoral metastásica y valorar los márgenes quirúrgicos de resección. En caso de dudas con la HyE se puede indicar un estudio IHQ para confirmar la histogénesis de la metástasis, sobre todo en caso de tumor metastásico en pared con origen desconocido. El estudio IHQ inicial, cuando la morfología no permite definir si se trata de un carcinoma, sarcoma, melanoma o linfoma, debe incluir al menos citoqueratina, vimentina y CD45 y, dependiendo de los resultados, se puede ampliar el estudio con nuevos marcadores. Por ejemplo, si se concluye que se trata de un carcinoma, se intenta definir el probable origen (en tracto digestivo, ginecológico, pulmón, vía biliar, etc.). Son fundamentales, obviamente, los datos clínicos que incluyan no solo la edad o sexo del paciente en el volante de solicitud de biopsia, sino también los antecedentes de alguna neoplasia diagnosticada, cirugías previas, etc., así como todos los datos que puedan aportar los cirujanos, radiólogos u oncólogos, porque facilitan que el patólogo se oriente adecuadamente y no utilice recursos de manera innecesaria cuando desconoce la información clínica.
Conflicto de interesesNo existe conflicto de intereses en el presente estudio.