La presentación clínica y la exploración física de las tumoraciones de la pared abdominal permiten diagnosticar entidades como hernias, abscesos, hematomas y disrupciones posquirúrgicas. Sin embargo, en numerosas ocasiones se necesita la imagen para establecer un diagnóstico y un manejo adecuado del paciente. La radiología permite con frecuencia establecer un diagnóstico de certeza del origen y la causa de la tumoración, planificar el mejor abordaje y tratamiento, y controlar la eficacia de la terapia y el estado de la pared en los seguimientos de imagen posteriores. En este artículo se analizarán los tumores de la pared abdominal en función de sus componentes principales (grasa, agua, fibrosis, sangre, vasos) para llegar a un diagnóstico fiable. También se esbozarán las posibilidades del intervencionismo radiológico (tanto percutáneo como intravascular) en estas entidades.
The clinical presentation and physical examination of patients with abdominal wall masses allow diagnosing cases such as hernias, abscesses, hematomas and postsurgical wall disruptions. However, on many occasions, imaging is needed to establish a lesion diagnosis and patient management. Radiology frequently allows establishing an accurate diagnosis of the origin and cause of the tumour, planning the best treatment approach, and monitoring the effect of therapy and the follow-up changes. In this chapter, tumours of the abdominal wall will be evaluated in terms of their principal components (fat, water, fibrosis, hemorrhage, blood vessels) to reach a reliable diagnosis. Also, the different radiological interventional aspects will be outlined, with both percutaneous and endovascular approaches, in these entities.
Las tumoraciones de la pared abdominal suelen detectarse cuando el paciente acude a consulta por notarse una lesión en la palpación. En general, la presentación clínica y la exploración física permiten al médico descartar inicialmente una serie de entidades como las hernias (por su localización típica, consistencia y borborigmos), los abscesos (por su calor, color y dolor) y los hematomas (por el antecedente de traumatismo previo o existencia de una discrasia sanguínea). Por otro lado, las lesiones secundarias a disrupciones quirúrgicas de la integridad de la pared son de fácil diagnóstico.
Sin embargo, en otras ocasiones puede ser imposible centrar un diagnóstico y manejo adecuado del paciente, ya que se desconoce la naturaleza y pronóstico de la tumoración. También es frecuente que el médico necesite una confirmación, dada la relevancia del hallazgo (como en pacientes oncológicos) y la necesidad de tomar una actitud terapéutica (como la resección quirúrgica).
En todas estas situaciones, la radiología permite con frecuencia establecer un diagnóstico de certeza del origen y la causa de la tumoración, planificar el mejor abordaje y tratamiento, y controlar la eficacia de la terapia y el estado de la pared en los seguimientos de imagen posteriores. Para contribuir en estos aspectos, las diversas técnicas de imagen deben permitir detectar la lesión, localizarla y tipificarla según sus componentes principales. Tanto la ecografía como la tomografía computarizada (TC) y la resonancia magnética (RM) son capaces de establecer, de forma aislada o en combinación, estas características de los tumores de la pared abdominal. En este trabajo se analizarán los tumores de la pared abdominal en función de sus componentes principales (grasa, agua, fibrosis, sangre, vasos) para llegar a un diagnóstico fiable mediante la integración de estas características con su localización, perfusión y entorno clínico.
Grasa como constituyente principalLa grasa es el integrante principal de los lipomas, lipoblastomas, hibernomas y liposarcomas. Debe considerarse que está presente cuando en ecografía se observen áreas hiperecogénicas. Debe confirmarse esta naturaleza, dado que no es específica en ecografía, al detectar áreas de muy baja atenuación en TC (con valores sobre los -30 a -80 unidades Hounsfield). La RM permite también un diagnóstico de certeza del componente graso, al observar áreas hiperintensas en todas las secuencias, que se anulan cuando se utilizan bien técnicas de supresión grasa (como los que emplean la distinta frecuencia de precesión de los átomos del agua y la grasa), bien pulsos de inversión específicos (como en las imágenes STIR). Si existen componentes de agua y grasa mezclados en el interior de un mismo pixel (elemento más pequeño de volumen que contribuye a formar una imagen), se observará una pérdida de la señal en las imágenes obtenidas con secuencias eco de gradiente, utilizando un tiempo de eco en fase opuesta con respecto a aquellas imágenes obtenidas con un tiempo de eco en fase (técnica de desplazamiento químico).
Cuando una lesión esté constituida exclusivamente por grasa, se tratará de un lipoma. Estas lesiones son frecuentes en el tejido celular subcutáneo, y con frecuencia son reactivas a microtraumatismos. Están bien definidas y presentan una encapsulación periférica limitante. En ocasiones pueden presentar calcificaciones y septos finos. Los lipomas suelen tener una localización intramuscular en la pared anterior del abdomen, estar bien delimitados, ser de crecimiento lento y, generalmente, asintomáticos.
Si en una lesión con grasa existe un componente sólido no graso, debe administrarse contraste intravenoso o analizar la presencia de estructuras microvasculares internas. En estos casos debe considerarse la existencia una proliferación neoplásica tipo liposarcoma, primario o metastásico, y es necesario un estudio de estadificación con RM. El realce tras la administración del contraste permite confirmar y conocer la extensión del componente sólido. El patrón de captación puede, además, ayudar a tipificar la agresividad de la lesión, ya que los tumores con captación mayor y más precoz son los más agresivos. Estas áreas son las que deben biopsiarse en caso de necesitarse una confirmación.
Algunas lesiones benignas mesenquimales, como los angiomas y los schwannomas, pueden tener raramente un componente sólido mezclado con otro graso. Otros patrones de señal y la captación de contraste permiten con frecuencia su caracterización.
Agua como constituyente principalLas lesiones quísticas suelen representar secuelas quirúrgicas (seromas) o traumáticas (hematomas evolucionados). Estas lesiones son anecoicas, con refuerzo posterior en ecografía, sin registro Doppler interno, y están bien delimitadas. En TC tienen atenuaciones bajas (próximas a 0 unidades Hounsfield) y no presentan realce tras la administración de contraste. En RM son hipointensas en las imágenes potenciadas T1, pero muy hiperintensas en T2 y sin captación de contraste. Sus paredes sueles ser finas y, en el caso de los hematomas evolucionados, de baja señal en las imágenes T2, por el depósito periférico de hemosiderina.
Existen quistes parasitarios, como el quiste hidatídico, que pueden presentarse en la musculatura de la pared, tanto uniloculares como con vesículas hijas y membranas colapsadas internas. Su apariencia encapsulada (periquística) y su contenido (matriz hidatídica con vesículas y endoquiste separado de la pared) es muy característica.
Hay tumores de apariencia quística, como los mixomas, que se caracterizan por presentar una matriz extracelular mucoide con alto contenido de agua, que le da una apariencia similar al líquido en ecografía, TC y RM, pero con captación de contraste, dada su naturaleza sólida. La presencia de edema periférico y márgenes mal definidos obliga a descartar que se trate de neoplasias malignas, principalmente metástasis, con una gran necrosis central. En estos casos es obligado plantear la resección quirúrgica o la biopsia dirigida a la zona de mayor captación.
Las lesiones del uraco suelen ser de predominio quístico, y están localizadas en la línea media por debajo del ombligo. Los carcinomas del uraco son masas quísticas complejas que presentan en la ecografía un contenido ecogénico, y en TC, una apariencia mixta con paredes engrosadas, atenuaciones heterogéneas y calcificaciones dispersas1. En RM presentan un incremento de señal en las imágenes potenciadas en T2 por la presencia de mucina2, dándoles una apariencia seudoquística si no se administra contraste intravenoso.
Fibrosis como constituyente principalExisten tumores de pared en los que la fibrosis es dominante. Dado el predominio de colágeno y matriz extracelular con muy escaso componente de agua, la fibrosis presenta unas características típicas en imagen. La ecografía es muy inespecífica, ya que suelen presentar ecogenicidad aumentada y escasa vascularización en el estudio Doppler, al igual que otras numerosas entidades. En TC, la fibrosis aumenta muy discretamente la atenuación del tejido, y puede presentar un realce tardío del contraste. La imagen de RM es más característica, ya que este componente es isointenso en las imágenes potenciadas en T1, pero muy hipointenso en T2, está mal definido en sus contornos y presenta una captación mantenida por la afinidad del contraste hacia la fibrosis.
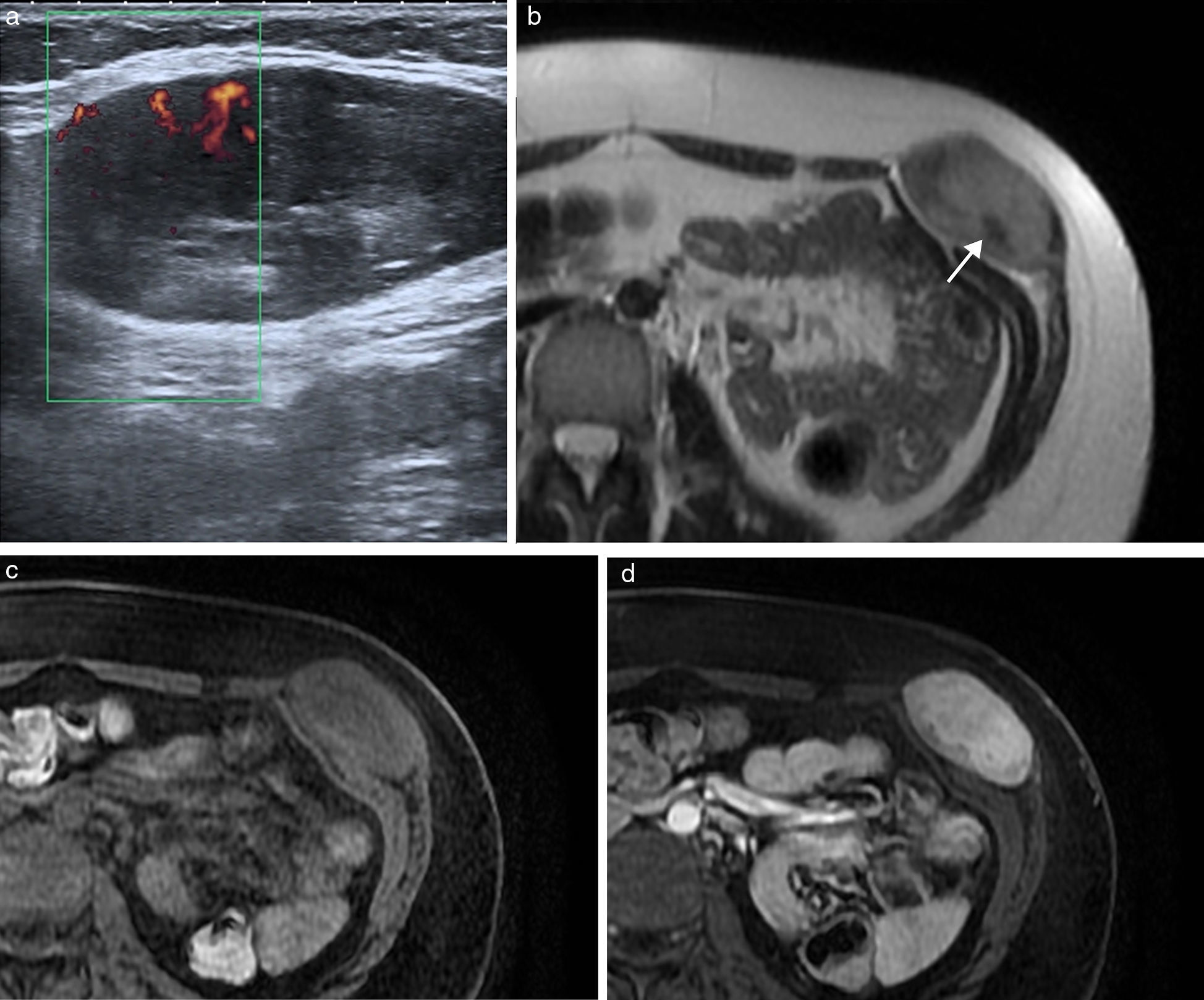
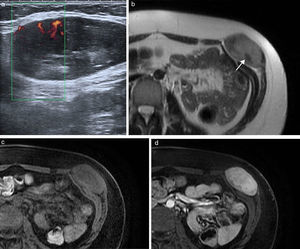
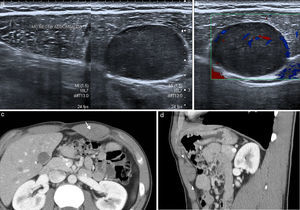
Los tumores desmoides3, también conocidos como fibromatosis agresiva, son tumores benignos frecuentes en la pared abdominal que proceden del tejido conectivo, carentes de potencial metastásico pero con una alta tendencia a la invasión local y la recidiva4. Frecuentemente están asociados a trauma o lesión quirúrgica previa, aunque también se han relacionado con tratamientos con estrógenos o embarazo y algunos ocurren en el contexto genético de síndromes familiares, como la poliposis adenomatosa familiar y el síndrome de Gardner5,6. Se localizan con mayor frecuencia en el músculo recto anterior, y su apariencia depende de la cantidad y proliferación de fibroblastos, fibrosis, contenido colágeno y vascularización. Se presentan en la ecografía como una masa sólida de predominio hipoecoico y vascularización discreta (fig. 1). En TC se observa una masa sólida de densidad variable, con márgenes mal definidos por infiltración de las estructuras adyacentes, que realza con la inyección de contraste7. En RM presentan una intensidad de señal y captación heterogéneas por la distribución de las células fusiformes, colágeno y matriz mixoide (fig. 1). Su intensidad de señal es baja en las imágenes potenciadas en T1 e intermedia en las potenciadas en T2, a veces con bandas hipointensas correspondientes a haces de colágeno. Con el tiempo se hacen más hipointensos por el incremento del colágeno y la disminución de la celularidad, mientras que en las recidivas o en los tumores con crecimiento activo tienden a presentar una mayor intensidad de señal en T2 por el efecto contrario. En los estudios de PET-TC presentan avidez por la 18F-FDG con un valor de SUVmáx alto (sobre 4, rango 1-8). Dado el potencial de recidiva, se recomienda seguimiento con RM cada 3-6 meses tras cirugía, o de 6-12 meses si se ha tratado con quimioterapia y radioterapia6.
Tumor desmoide en pared abdominal anterolateral en mujer de 36 años. (a) La ecografía muestra una masa de bordes bien definidos y ecogenicidad heterogénea con discreta vascularización power-Doppler. (b) La imagen de RM transversal potenciada en T2 demuestra la tumoración localizada en el músculo oblicuo externo izquierdo, con intensidad de señal intermedia y bandas de baja señal en su interior correspondientes a fibrosis (flecha). Las imágenes transversales T1 con supresión grasa sin contraste (c) y con contraste intravenoso (d) muestran la captación intensa de la tumoración.
La fascitis nodular, también conocida como fascitis infiltrativa, fibromatosis o fascitis seudosarcomatosa, es un proceso reactivo autolimitado con proliferación de fibroblastos en un estroma mixoide. Ecográficamente son hipoecoicos con ecogenicidad mixta. En la RM sus características dependen de si la lesión es predominantemente fibrosa (hipointensa en T2), celular o mixoide (hiperintensas en T2). Las lesiones hipercelulares son isointensas respecto al músculo en imágenes potenciadas en T1, y las fascitis nodulares muy fibrosas son hipointensas en todas las secuencias. Con contraste hay un realce homogéneo, en ocasiones en anillo o irregular, dependiendo de la celularidad7.
La mesenteritis esclerosante es un raro proceso inflamatorio crónico con predilección especial por el mesenterio del intestino delgado que raramente afecta a la pared abdominal. Su presentación es variable, desde pequeños nódulos a una masa sólida, planteando el diagnóstico diferencial con el seudotumor inflamatorio y las fibromatosis. No presenta características diagnósticas.
El tumor de células granulares es una entidad infrecuente cuya localización más típica es en la cabeza, cuello, pared torácica y brazos. Generalmente son tumores pequeños, pobremente delimitados, indoloros y ulcerados. La recidiva es infrecuente, y solo un 2% maligniza. Ecográficamente se ve como una masa hipoecoica, y en TC, sólida y homogénea. En la RM, los tumores benignos son hipo- o isointensos en las imágenes potenciadas en T1, e isointesos o ligeramente hiperintensos en las potenciadas en T2, mientras que los malignos suelen tener una intensidad de señal intermedia en las potenciaciones T2, con pobre diferenciación de los márgenes8.
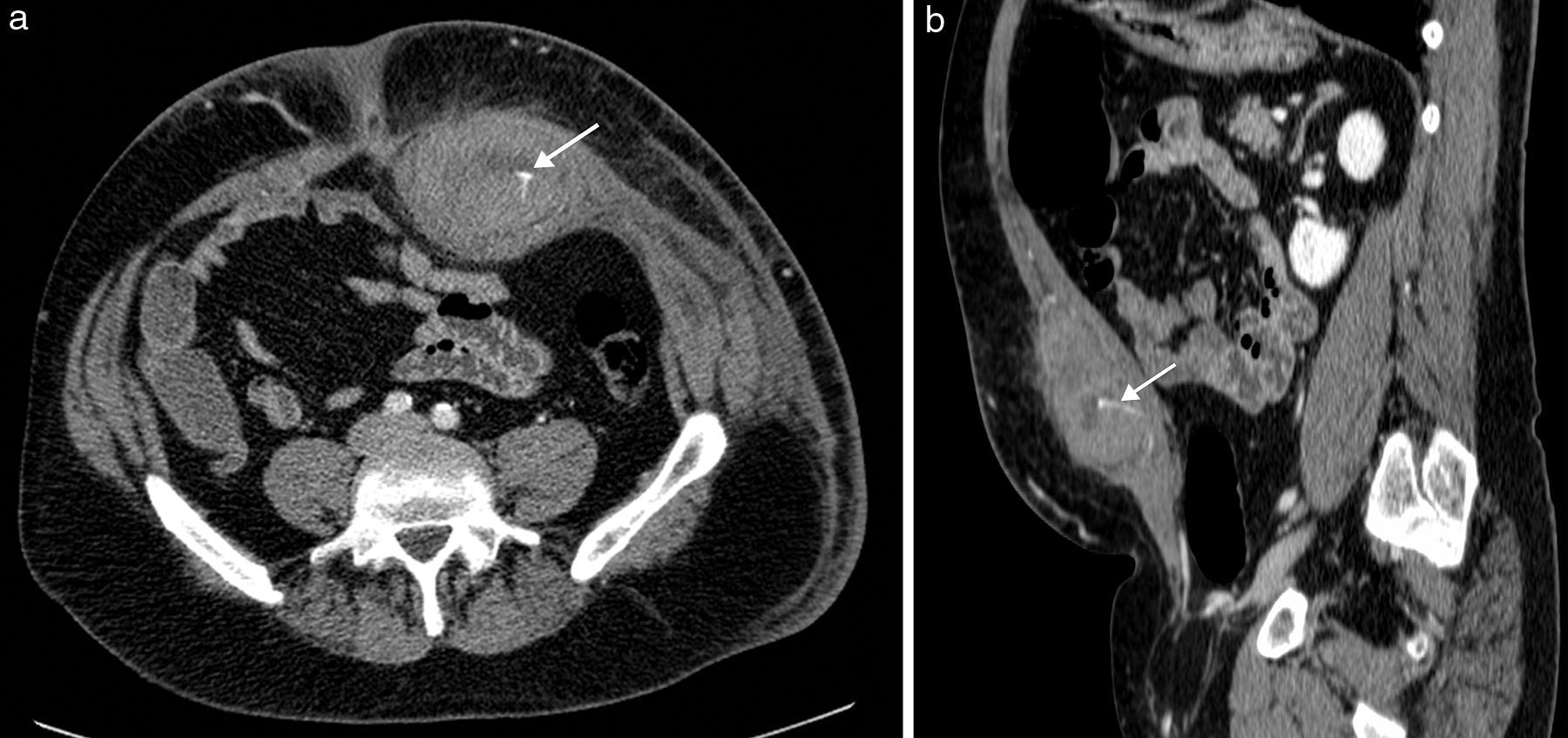
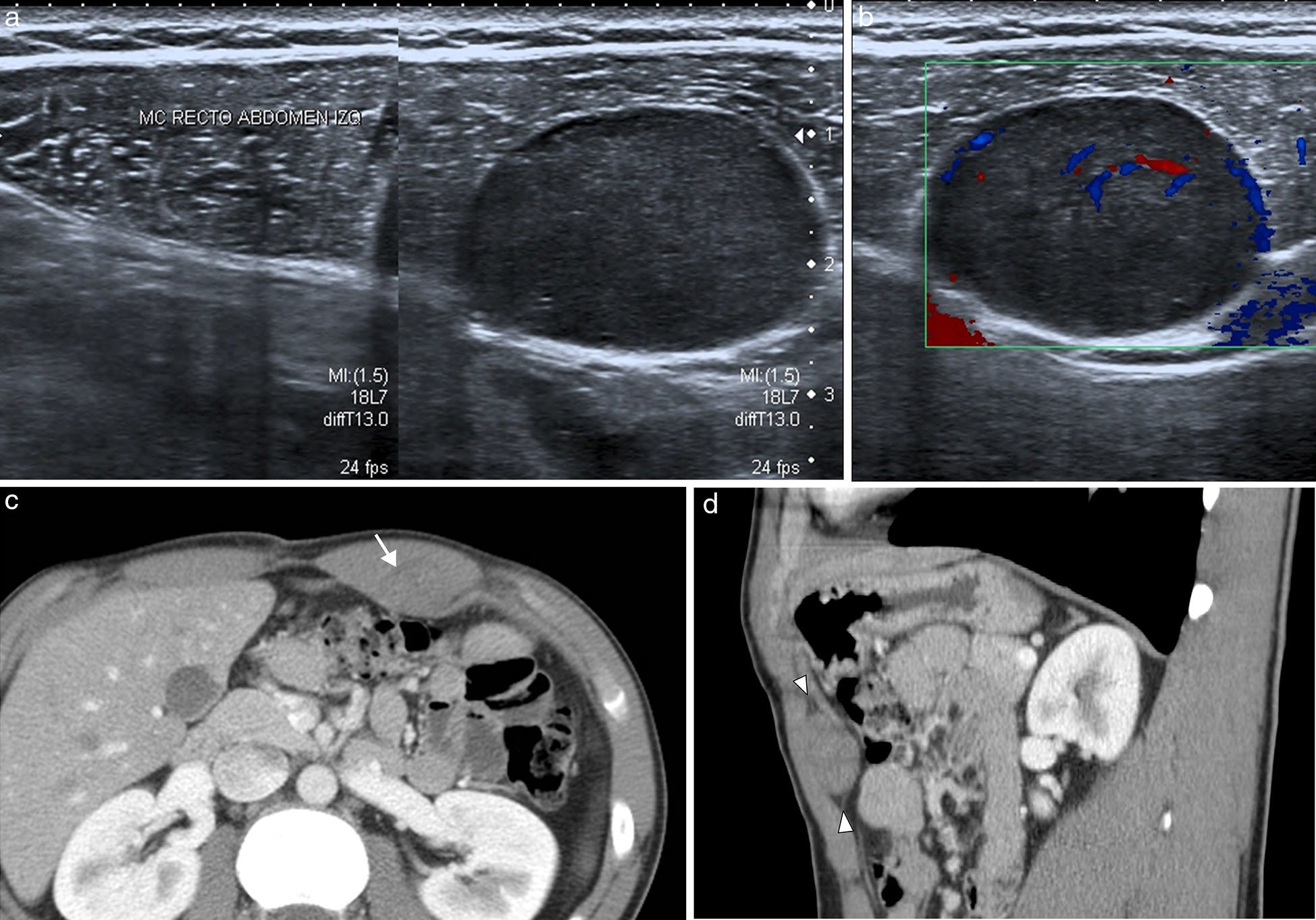
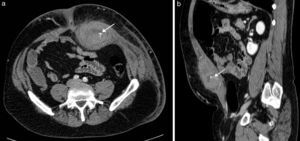
Sangre como constituyente principalLa sangre es muy heterogénea en imagen, ya que su degradación en el tiempo produce diversos componentes con propiedades diferenciadas. Tanto el suero (líquido) como el coágulo (sólido) presentan, en grado variable, estos productos de degradación de la hemoglobina (principalmente metahemoglobina y ferritina). La sangre reciente es hiperecogénica en ecografía e hiperdensa en TC, lo que permite confirmar la extensión de los hematomas en los momentos iniciales (fig. 2). Posteriormente evolucionan, si no hay resangrado, hacia una apariencia más hipoecoica e hipoatenuada que los hace menos reconocibles. Cuando domina la metahemoglobina, en las fases subagudas, la RM es muy específica, al demostrar lesiones con hiperintensidad tanto en las imágenes potenciadas en T1 como el T2, muy brillantes si además se adquieren las imágenes con supresión de la grasa. Cuando hay suficiente ferritina, al cronificarse, la hiperintensidad en T2 se convierte progresivamente en hipointensidad local por la alta concentración de hierro tisular. Estos hematomas evolucionados presentan una pared periférica en la que la ferritina es dominante, observándose por lo tanto muy hipointensa en las imágenes T2. Aunque los hematomas son avasculares, excepto cuando hay sangrado activo interno, su pared de contención realza por su componente inflamatorio y fibroso de la seudocápsula.
Hematoma espontáneo en la vaina de los rectos en varón de 53 años en tratamiento anticoagulante. La TC con contraste intravenoso en fase arterial (a) y con reformateo sagital (b) muestra una colección hiperdensa con nivel hemático en la pared abdominal anterior izquierda, con extravasación de contraste que indica sangrado activo (flechas) por lesión de la arteria epigástrica inferior.
Estos sangrados pueden presentarse sobre los tejidos normales (hematomas) o sobre lesiones previamente existentes (necrosis hemorrágica). El principal papel de la imagen en los hematomas es definir si hay sangrado activo, localizarlo y planificar la mejor opción terapéutica (fig. 2). Además, debe precisarse si el sangrado se ha presentado sobre una lesión preexistente y, en ese caso, tipificar su naturaleza y orientar su tratamiento.
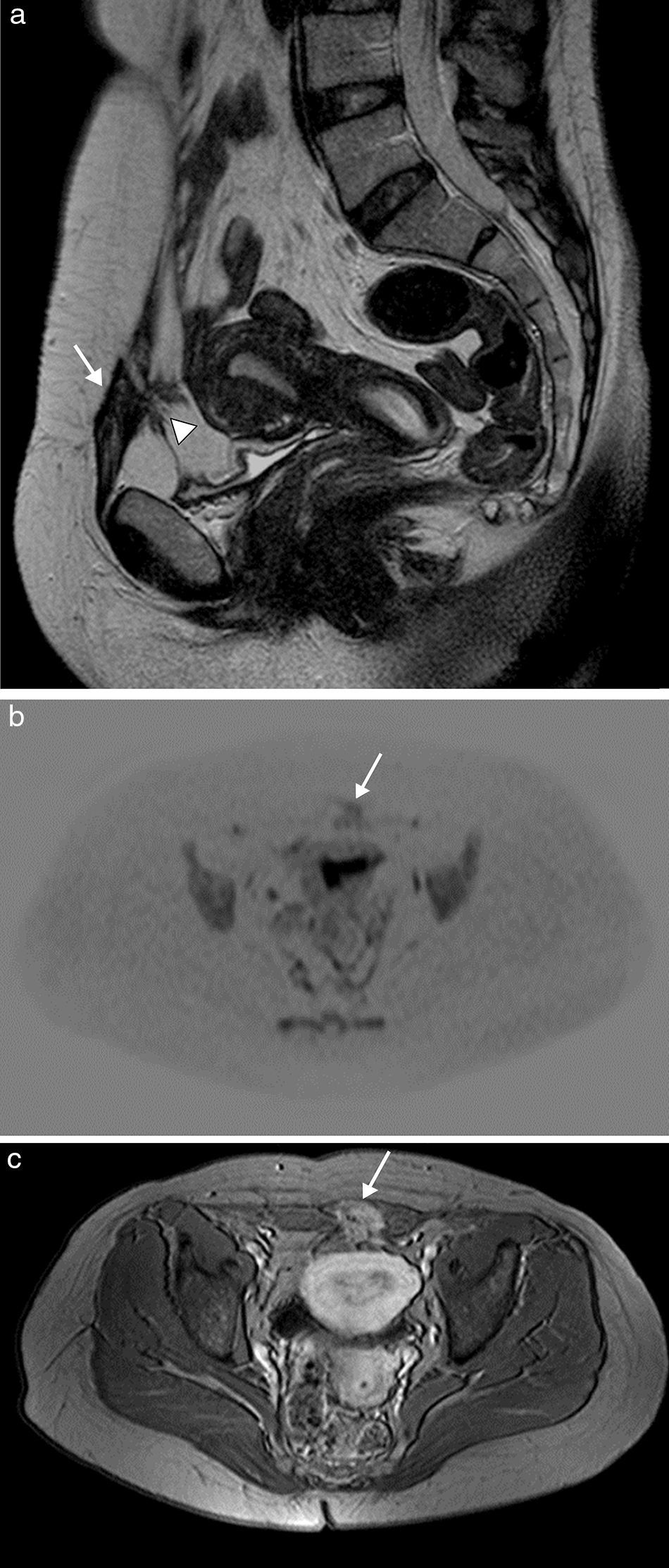
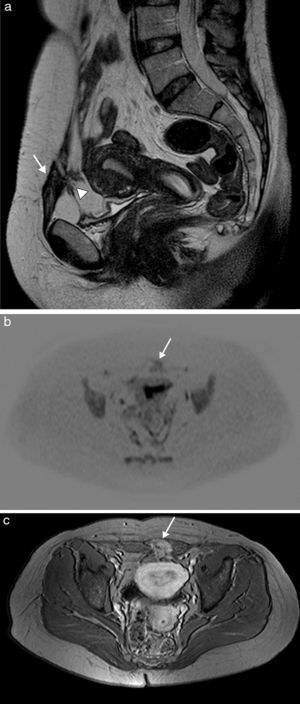
La endometriosis es la presencia de glándulas y estroma endometrial fuera de la cavidad uterina. Los implantes endometriales en la pared abdominal son una localización extrapélvica frecuente, y están usualmente en relación con la existencia de cicatrices quirúrgicas. Estos implantes se presentan como lesiones principalmente quísticas, por el sangrado, pero con componentes sólidos remanentes, por el implante. Ecográficamente, son nódulos mixtos, hipoecoicos, con un componente sólido vascularizado y márgenes espiculados infiltrando el tejido adyacente9. En TC aparecen como una masa de tejidos blandos asociada directamente con un área de cicatriz quirúrgica de hiperatenuación variable, comparada con el músculo adyacente, que se realza de forma moderada tras la inyección de contraste intravenoso. La RM facilita el diagnóstico, principalmente en lesiones de mayor tamaño, y define mejor la relación con las estructuras vecinas (fig. 3). Normalmente, la endometriosis se presenta en RM como nódulos heterogéneos e hiperintensos con un ligero realce tras el contraste. La punción con aguja fina puede ayudar a establecer el diagnóstico en aquellos casos en los que la imagen no permita excluir malignidad. Si esta no fuera concluyente, debe considerarse la punción con aguja gruesa. Como este procedimiento puede aumentar el riesgo de nuevos implantes en el trayecto de la aguja10, la resección posterior debe incluir el trayecto de esta9.
Endometriosis de pared abdominal anterior en mujer de 38 años con antecedente de cesárea. La imagen de RM sagital potenciada en T2 (a) muestra una masa de bordes irregulares y espiculados en la cicatriz quirúrgica de la pared abdominal anterior izquierda (flecha), de baja señal y heterogénea, con pequeños focos hiperintensos en su interior, asociando bandas hipointensas en la grasa prevesical adyacente correspondientes a adherencias fibrosas (cabeza de flecha). Presenta restricción en la imagen de difusión (b) y captación intensa en la imagen potenciada en T1 tras la administración de contraste intravenoso (c).
Los vasos macroscópicos se observan como estructuras tubulares hipoecoicas en ecografía, que presentan una alta señal Doppler debido a su flujo. Los vasos muestran un marcado realce tubular de los ovillos vasculares en TC tras la administración de contraste, y una señal en RM muy dependiente de la secuencia de pulso, pero similar a otros vasos anatómicos normales que sirven de referencia. Así, las estructuras vasculares suelen presentar hipointensidad en las imágenes espín eco (independientemente del tren de ecos) e hiperseñal en las eco de gradiente, independientemente de su potenciación, debido al artefacto de vacío de señal y al fenómeno de entrada, respectivamente. Las imágenes obtenidas con secuencias eco de gradiente en estado estacionario muestran siempre la sangre blanca. Tras administrar el contraste intravenoso, las imágenes potenciadas en T1, especialmente si se adquieren con supresión de la señal grasa, permiten reconocer estos tubos y ovillos vasculares, así como sus aportes arteriales y los drenajes venosos.
Existen dos grupos de anomalías vasculares: los tumores vasculares (que incluyen al hemangioma infantil como el más frecuente) y las malformaciones vasculares, que se subdividen en malformaciones de bajo flujo (venosa, linfática, capilar y mixta) y de alto flujo (malformaciones arteriovenosas y fístulas arteriovenosas)11,12.
El hemangioma infantil es un tumor vascular benigno de la infancia en el que existe hiperplasia y proliferación celular y que clínicamente se caracteriza por presentar una fase temprana rápidamente proliferativa que ocurre en las primeras semanas de vida, y una fase tardía involutiva con regresión completa tumoral a los 7-10 años de edad. En la fase proliferativa, los hemangiomas se presentan como masas bien definidas, lobuladas, que muestran en ecografía Doppler alta densidad de vasos, con flujo venoso y arterial de baja resistencia. En la RM tienen una baja intensidad de señal en las imágenes potenciadas en T1 y una señal muy alta en las potenciadas en T2, con vacíos de flujo en las secuencias espín eco. La captación de contraste es temprana y homogénea, paralela a la de los vasos normales. En la fase involutiva se produce un reemplazo graso interno que presenta una señal alta en secuencias T1, con disminución progresiva de la captación de contraste en la RM y reducción de la densidad vascular en ecografía Doppler.
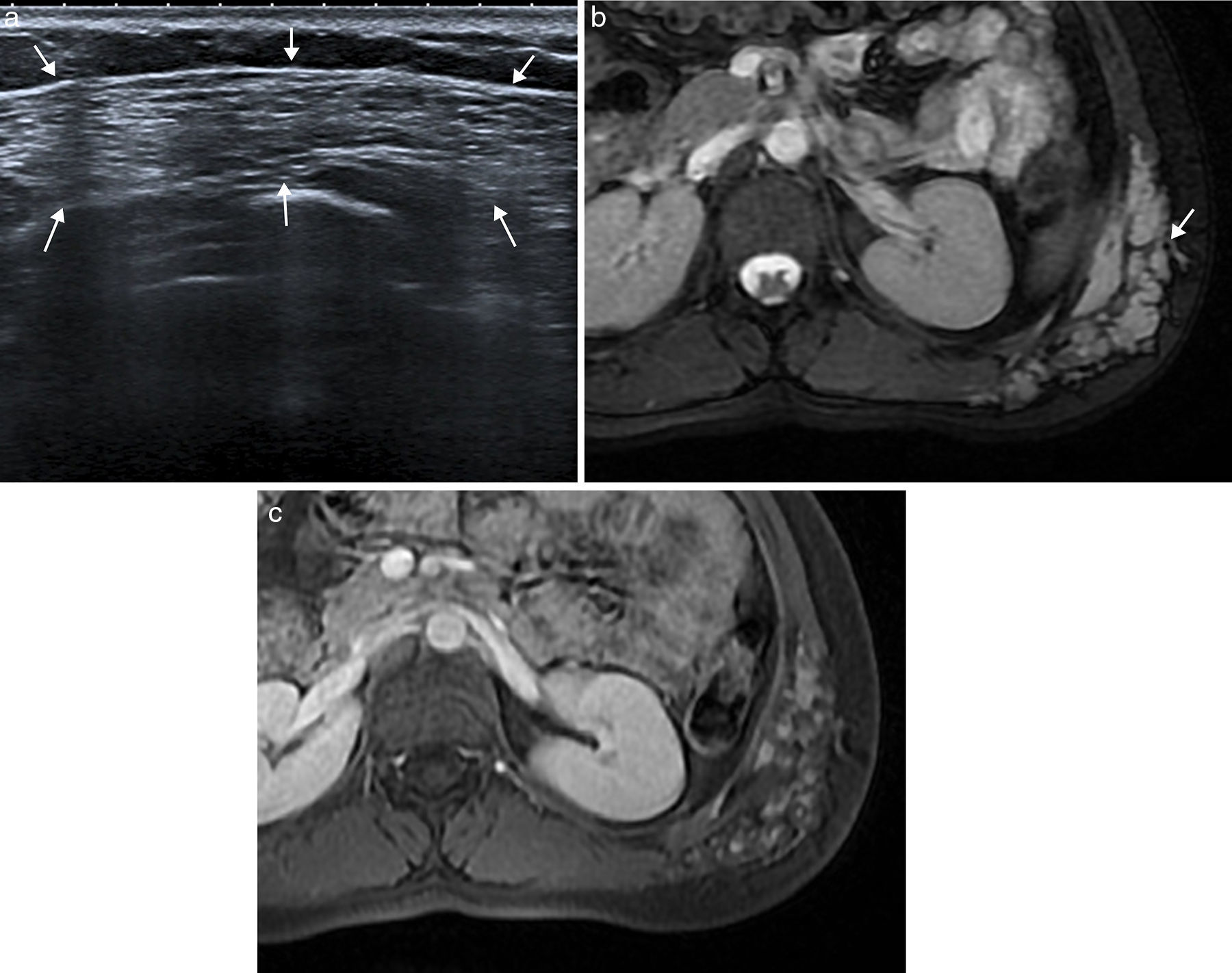
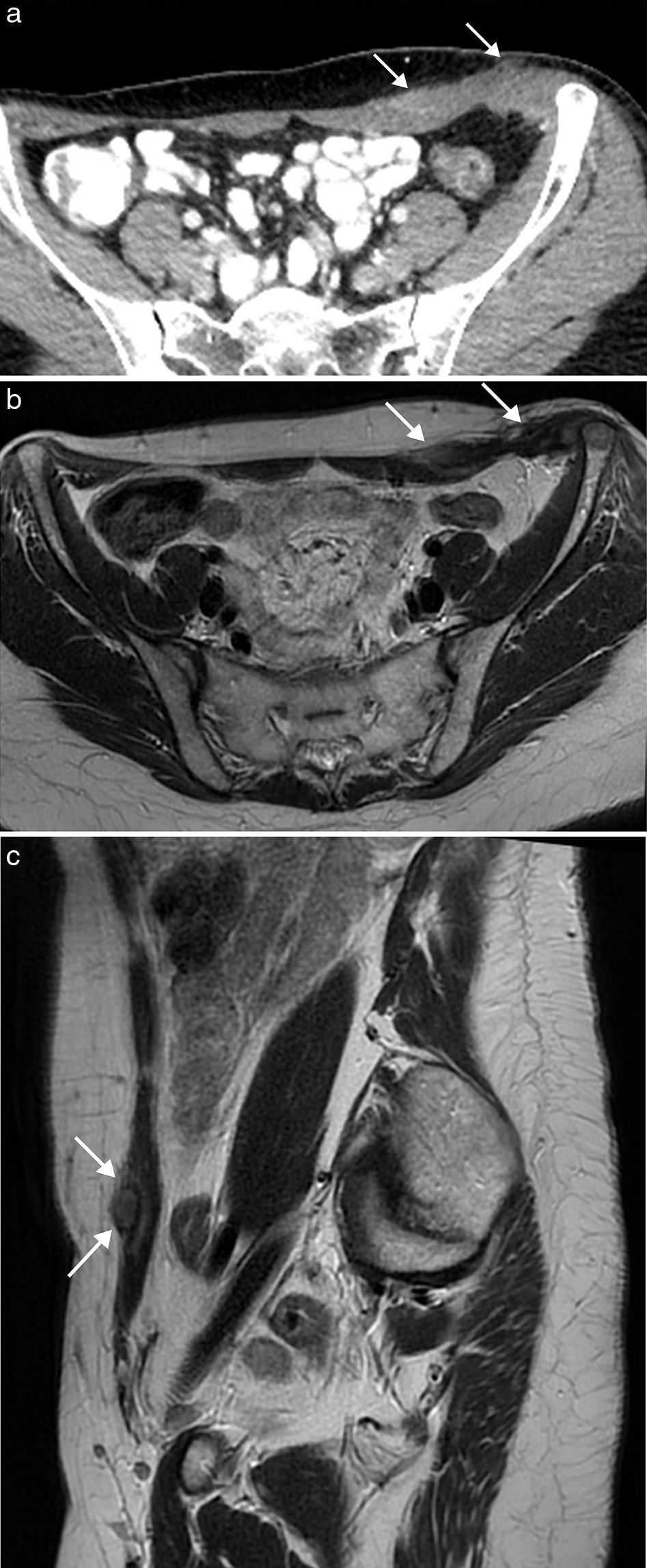
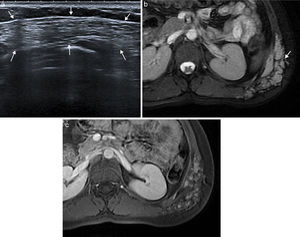
Las malformaciones vasculares son anomalías congénitas presentes desde el nacimiento, que crecen con el niño y no regresan espontáneamente. Se originan a partir de canales vasculares displásicos que tienen un recambio celular normal, sin capacidad de proliferación. Las malformaciones venosas se presentan en ecografía (fig. 4) como una colección de canales vasculares anecoicos dilatados y compresibles, en ocasiones con flebolitos. Cuando los canales son pequeños, se observan como masas ecogénicas menos compresibles. Con el estudio Doppler la densidad de flujos es baja y presentan un flujo ausente o monofásico. En la RM aparecen como masas lobuladas y septadas con flebolitos (de baja señal en todas las secuencias), con niveles líquido-líquido, baja intensidad de señal en secuencias potenciadas en T1 y alta en T2, sin vacíos de flujo en secuencias espín eco, y en el estudio dinámico tras la administración de contraste muestran ausencia de flujo arterial, con captación lenta y progresiva (fig. 4).
Malformación vascular de bajo flujo en pared abdominal posterolateral en mujer de 21 años. La ecografía (a) puso de manifiesto una masa ecogénica heterogénea compresible de bordes imprecisos (flechas). La imagen de RM transversal potenciada en T2 con supresión de la grasa (b) muestra la extensión de la malformación venosa en el tejido celular subcutáneo y los músculos de la pared abdominal posterolateral izquierda. Se observa el aspecto típico con alta intensidad de señal, bordes lobulados, múltiples septos y vacíos de señal que representan flebolitos (flecha). La imagen potenciada en T1 con supresión grasa y con contraste intravenoso en fase tardía (c) muestra la captación nodular de la malformación.
Las malformaciones linfáticas o linfangiomas, infrecuentes en la pared abdominal, tienen tendencia a localizarse en las regiones inguinales. Se presentan con márgenes bien definidos y múltiples tabiques internos que representan las dilataciones linfáticas anormales. En ecografía no presentan flujo Doppler interno, a diferencia de los hemangiomas y malformaciones venosas. Dependiendo del grado de dilatación de los linfáticos, su apariencia en TC es variable, aunque de predominio hipodenso. En la RM su comportamiento es quístico, con baja intensidad en T1 y muy alta en T2. Tras la administración de gadolinio, se observa un realce homogéneo (lento y tardío) de los septos.
Las malformaciones arteriovenosas se comportan como masas mal definidas que infiltran los planos tisulares, con arterias nutricias y venas de drenaje dilatadas. En ecografía Doppler la densidad de flujo es alta, con flujos arteriales de baja resistencia y con arterialización de las venas de drenaje. En la RM se detectan vacíos de flujo en las secuencias espín eco y en el estudio dinámico con contraste se demuestra captación precoz de las arterias de drenaje y del nidus, con captación precoz de venas de drenaje.
Un hallazgo común es la presencia de varices por recanalización de las venas para y periumbilicales en el contexto de hipertensión portal. En TC y RM se ven como estructuras tubulares que se realzan en fase venosa y con señal venosa en los estudios Doppler.
Constituyente principal sólidoExisten diversas situaciones en las que el componente principal de la tumoración es sólido, sin presencia significativa de grasa, sangre, fibrosis, agua ni vasos macroscópicos.
Estos tumores suelen originarse en el músculo o en la vaina nerviosa. Cuando se originan en el músculo liso o estriado pueden ser benignos (leiomiomas y rabdomiomas) o malignos (leiomiosarcoma y rabdomiosarcoma). Cuando su origen es el nervio periférico, también pueden ser benignos (neurofibroma y schwannoma) o malignos (tumor maligno de la vaina nerviosa periférica, incluyendo al schwannoma maligno o neurofibrosarcoma).
Los leiomiomas extrauterinos son muy poco frecuentes, y cuando aparecen en la pared abdominal se asocian generalmente a diseminación de tejido uterino por cirugía ginecológica previa13. De forma similar al leiomioma uterino, estos tumores suelen ser hipoecoicos en la ecografía y mostrar en la RM una señal isointensa al músculo en T1 y señal variable en T2.
Los tumores de la vaina nerviosa periférica se presentan como masas bien definidas de morfología fusiforme con su eje mayor orientado al nervio del que se originan. En ocasiones es posible visualizar el nervio que entra y sale de la tumoración. En la ecografía son hipoecoicos y pueden mostrar refuerzo acústico posterior que los confunde con lesiones quísticas (fig. 5). En TC son lesiones hipodensas debido al alto contenido lipídico de las células de Schwann y presentan variable captación de contraste (fig. 5). Normalmente en la RM tienen alta señal en secuencias T2, de forma homogénea o mostrando el signo la diana, que consiste en alta señal en la periferia del tumor y baja señal en su región central, reflejando su contenido mixoide periférico y fibroso central. Las características de imagen de los schwannomas y neurofibromas son con frecuencia similares, y en muchos casos no es posible su diferenciación. Sin embargo, la localización excéntrica del tumor respecto al nervio es más sugestiva de schwannoma que de neurofibroma (que presentan una localización central), mientras que la heterogeneidad tumoral con áreas de degeneración quística y las calcificaciones en tumores de larga evolución son características más frecuentes de los schwannomas que de los neurofibromas14.
Schwannoma de pared abdominal anterior en varón de 22 años. La ecografía (a) revela una tumoración en la vertiente posterior del músculo recto anterior del abdomen de bordes bien definidos, hipoecoica y homogénea, con refuerzo acústico posterior. En ecografía Doppler (b) presenta vascularización discreta. En TC, con contraste intravenoso (c) y reformateo sagital (d), la tumoración tiene densidad discretamente heterogénea similar al músculo (flecha) y se detecta un anillo de grasa en los bordes proximal y distal, que indica una localización preperitoneal del tumor (cabezas de flecha).
Los tumores malignos de la vaina nerviosa periférica están asociados con frecuencia a neurofibromatosis tipo 1 (aproximadamente en un 50%) y suelen tener mayor tamaño, bordes mal definidos, infiltran los tejidos adyacentes, asocian edema peritumoral y presentan una captación de contraste más heterogénea y nodular periférica14,15.
Los sarcomas de partes blandas son neoplasias mesenquimales que pueden afectar a la pared abdominal, con una alta tasa de recurrencia local y de diseminación a distancia. El dermatofibrosarcoma protuberans es el más frecuente de la pared abdominal, y son menos frecuentes el sarcoma pleomórfico indiferenciado (anteriormente conocido como «histiocitoma fibroso maligno»), el fibrosarcoma, el sarcoma sinovial, el liposarcoma, el rabdomiosarcoma y el tumor neuroectodérmico primitivo periférico. En ecografía se presentan como masas sólidas infiltrantes de ecogenicidad variable. Estas masas sólidas están mal definidas y presentan en la TC y la RM un patrón infiltrativo con realce variable tras la administración de contraste. Los sarcomas tienen una captación variable de 18F-FDG en los estudios de PET-TC.
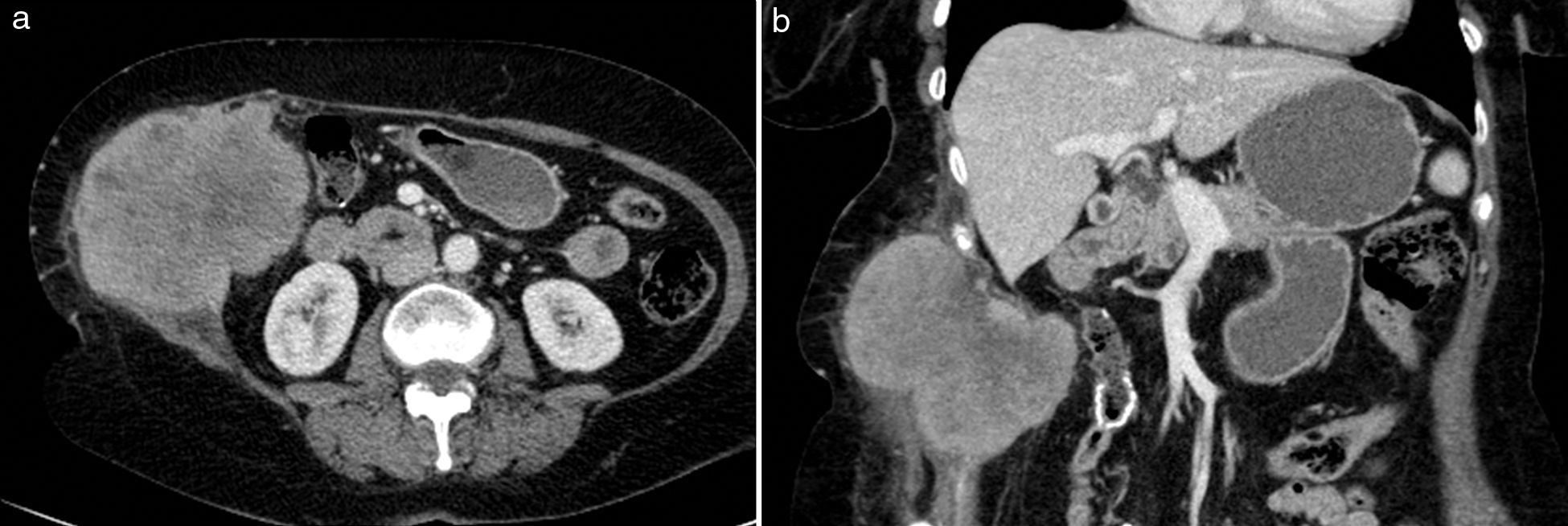
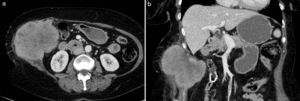
Las metástasis hematógenas son los tumores malignos más frecuentes de la pared abdominal4,16. Se localizan normalmente en el vientre muscular, aunque también pueden presentarse en la grasa subcutánea, y se han asociado a un amplio rango de tumores (principalmente melanoma, gastrointestinal, de pulmón, renal, de ovario, de mama y de endometrio) (fig. 6). Raramente se producen por diseminación directa relacionada con procesos laparoscópicos o biopsias percutáneas de estas neoplasias (fig. 7). Las metástasis de tumores de ovario y estómago, cuando afectan a la región umbilical, pueden producir una masa periumbilical conocida como «nódulo de la hermana María José».
Metástasis hematógena en pared abdominal en paciente de 70 años con neoplasia de colon. La TC (a) con contraste intravenoso muestra una gran masa que infiltra la pared abdominal lateral derecha de bordes lobulados y espiculados, con captación heterogénea de contraste y áreas hipodensas de necrosis central. En la imagen coronal de TC (b) se detecta la infiltración del tejido celular subcutáneo y del peritoneo, con el desplazamiento del colon hacia la izquierda y la sutura metálica de la anastomosis ileotransversa.
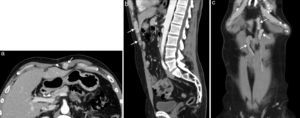
Metástasis en pared abdominal por diseminación directa en el sitio de los puertos de cirugía laparoscópica de carcinoma mucinoso de ovario en una mujer de 57 años. La TC (a) con contraste intravenoso y oral muestra una tumoración mal delimitada en la musculatura de la pared abdominal anteroinferior izquierda, en el sitio de entrada del trocar de laparoscopia. Las imágenes de RM potenciadas en T2 en el plano axial (b) y sagital (c) definen con mayor precisión la tumoración, que presenta una señal heterogénea.
El melanoma es el tumor primario que con más frecuencia metastatiza en la pared abdominal. Se presenta como una lesión sólida, bien definida, localizada en los planos musculares o el tejido celular subcutáneo, de ecogenicidad variable, con realce heterogéneo tras la administración de contraste y con una gran avidez por la 18F-FDG.
La afectación extraganglionar linfomatosa, habitualmente asociada con el linfoma no Hodgkin hasta en un 40% de los casos, es infrecuente en la pared del abdomen. Cuando se presenta, puede producirse por extensión directa desde el hueso o por diseminación hematógena en el músculo, grasa subcutánea o piel17. La TC permite evaluar el hueso. En RM son lesiones de señal intermeia en secuencias potenciadas en T1 e hiperintensas en potenciadas en T2 y con un realce variable tras la administración de contraste.
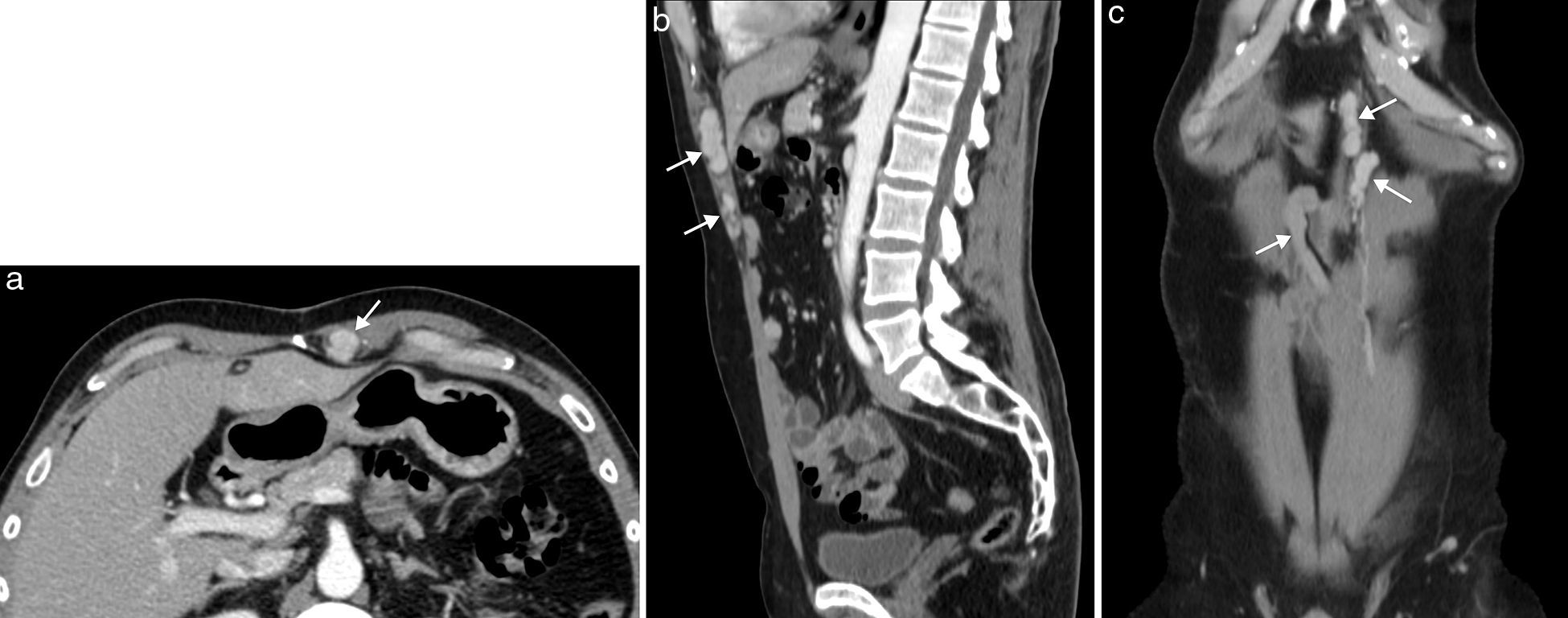
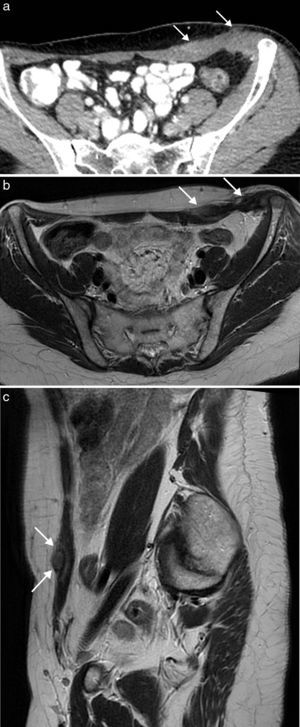
La esplenosis es el autoimplante de tejido esplénico en una localización heterotópica tras un traumatismo o cirugía. La pared abdominal es una localización poco frecuente y siempre está asociada con la herida traumática o la cicatriz quirúrgica de la esplenectomía18. El tejido esplénico recluta aporte vascular local, puede crecer con el tiempo y ser funcionante como el tejido esplénico normal. Es un proceso benigno y su importancia radica en su diferenciación de verdaderos tumores de partes blandas. Con frecuencia son múltiples y se presentan como nódulos bien delimitados, redondeados u ovalados, que muestran en ecografía, TC y RM un aspecto similar al bazo, con captación de contraste heterogénea en fase arterial y homogénea en fase tardía (fig. 8). La gammagrafía selectiva con hematíes desnaturalizados marcados con Tc-99m permite confirmar el diagnóstico y obtener un mapa completo de los distintos focos de esplenosis19.
Esplenosis en pared abdominal anterior en paciente de 63 años con antecedente de esplenectomía. La TC con contraste intravenoso en fase portal (a) con reformateo sagital (b) y coronal (c) muestra el conglomerado de implantes de esplenosis en la musculatura y el espacio preperitoneal de la pared abdominal anterior, de bordes lobulados y bien definidos, con captación homogénea de contraste (flechas).
En los últimos años se han desarrollado técnicas de ablación percutánea, mínimamente invasivas e incruentas, para el tratamiento de tumores benignos y malignos de partes blandas. Esta terapia guiada por imagen actúa de primera línea o como adyuvante a la cirugía, quimioterapia o radioterapia.
Estas técnicas se basan en el depósito local y guiado de energía o compuestos letales para las células tumorales, e incluyen procedimientos como la ablación química (inyección de etanol o ácido acético) y térmica (radiofrecuencia, láser, microondas y crioablación), junto con las más recientes de electroporación irreversible y los ultrasonidos focalizados de alta intensidad20,21.
La ablación percutánea de metástasis aisladas de partes blandas (menos de tres lesiones menores de 3cm) está aceptada como tratamiento curativo e incluso paliativo para reducir o controlar el tamaño tumoral, disminuir el dolor y evitar las complicaciones, como el sangrado y la ulceración22. En los tumores primarios de partes blandas, especialmente los de agresividad intermedia (como los tumores desmoides) y los malignos, la ablación percutánea como terapia adyuvante a la cirugía se emplea en casos de cirugías incompletas o recidivas tumorales, con el objetivo de conseguir el control local del tumor. De entre todas las técnicas de ablación percutánea disponibles, la crioablación ha mostrado mayores ventajas, al permitir una mayor visualización del área de ablación con ecografía y TC, una mejor involución del área de lesión comparada con las técnicas de calor y un control del dolor más rápido y duradero23.
La embolización transarterial de tumores hipervasculares de partes blandas se emplea como tratamiento neoadyuvante a la cirugía, ya que permite reducir la pérdida de sangre en el intra- y posoperatorio, simplificar la cirugía y reducir el tamaño tumoral para conseguir una resección completa24.
En las malformaciones vasculares de partes blandas el tratamiento percutáneo es de elección e incluye la esclerosis percutánea, generalmente con etanol para las malformaciones de bajo flujo (venosas y linfáticas) y la embolización transarterial para las de alto flujo.
Conflicto de interesesNo existe conflicto de intereses en el presente estudio.