La extirpación quirúrgica es el tratamiento de elección en los tumores de la pared abdominal. La radioterapia puede resultar muy útil para reducir el volumen de los tumores y hacerlos accesibles a la cirugía, además de servir como tratamiento adyuvante en casos de tumores de alto riesgo de recidiva o cirugías subóptimas. El tipo de exéresis variará en función del tipo de tumor. Así, en tumores benignos, una exéresis simple será suficiente. En caso de tumores de malignidad intermedia (poca capacidad de metástasis pero con alto riesgo de recaídas locales), la cirugía se irá adaptando a esta, pasando de una cirugía amplia para el tumor desmoide a una cirugía micrográfica de Mohs para el dermatofibrosarcoma protuberans y a una cirugía radical compartimental con reconstrucción de la pared para el sarcoma de partes blandas. Las metástasis en la pared abdominal se tratarán de la misma forma que los sarcomas. En cualquier caso, para el éxito de cualquier intervención es fundamental conseguir unos márgenes quirúrgicos libres de tumor, junto a una estética y funcionalidad aceptables.
Surgical removal is the cornerstone of treatment of tumours of the abdominal wall. Radiation therapy can be very helpful in reducing tumour volume and make them accessible to surgery and adjuvant treatment for tumours at high risk of recurrence or suboptimal surgery. Excision type vary depending on the type of tumour. Thus, a simple excision for benign tumours will suffice. In case of tumours of intermediate malignancy (metastasis but little capacity at high risk of local relapse) surgery will adapt to it; going from a wide desmoid tumour surgery for a Mohs micrographic surgery for dermatofibrosarcoma protuberans and one compartment radical surgery with reconstruction of the wall for soft tissue sarcoma. Metastases in the abdominal wall are treated in the same way as sarcomas. In any case for the success of any intervention it is critical to achieve tumour-free surgical margins, along with acceptable aesthetics and functionality.
La pared abdominal está integrada por piel, tejido celular subcutáneo y musculatura abdominal. Su límite superior es la arcada costal; el inferior, el pubis y ambos ligamentos inguinales. Delimitan su área lateralmente en las líneas axilares posteriores.
Los tumores en la pared abdominal pueden ser benignos o malignos, y primarios o metastásicos. Prácticamente cualquier tipo histológico puede asentarse en la pared abdominal, y la biopsia es fundamental para su diagnóstico. La biopsia debe ser lo menos cruenta posible, para evitar futuras diseminaciones. Por esta misma razón, se aconseja la biopsia con aguja gruesa más que la biopsia quirúrgica. No obstante, en caso de lesiones delimitadas y bien estudiadas con pruebas de imagen, se puede realizar exéresis-biopsia, asegurando siempre que los márgenes quirúrgicos sean negativos. En cualquier caso, para que la biopsia no interfiera la señal, es imperativo realizarla después de las pruebas de imagen.
El tipo de resección quirúrgica dependerá del tipo de tumor, en especial de si este es benigno, maligno o potencialmente maligno. En los tumores benignos, en el caso de que el paciente desee operarse, se practicará una exéresis limitada, mientras que los tumores malignos o potencialmente malignos requerirán una exéresis más amplia (la mayoría de las veces, con la necesidad de colocación de una prótesis de sustitución del defecto, sintética o biológica, dependiendo de los casos).
Desde un punto de vista eminentemente práctico, los tumores malignos o potencialmente malignos de la pared abdominal pueden clasificarse en 3 tipos: tumores desmoides, dermatofibrosarcoma protuberans (DFP) y sarcomas de partes blandas. Todas estas lesiones tienen en común un crecimiento local progresivo, más o menos rápido en función de su biología, así como la posibilidad de metastatizar a distancia (nula en tumores desmoides, rara en el DFP y más frecuente en sarcomas de partes blandas). Otro tipo de tumores malignos lo constituyen las metástasis en la pared abdominal. Cualquier tipo de tumor maligno puede metastatizar en la pared abdominal. Un tipo especial de estas metástasis lo constituyen las metástasis en los puertos de entrada tras la cirugía laparoscópica de enfermedades malignas intraabdominales.
A continuación se revisarán los tratamientos actuales de dichos tumores desde un punto de vista quirúrgico, con especial referencia al tipo de resección que se debe efectuar.
Tumores desmoidesEl tumor desmoide (de desmos, ‘tendón’, ‘ligamento’) se origina en los fibroblastos. La enfermedad fue descrita en 1838 por el anatomista J. Müller. También es conocida como «fibromatosis agresiva» y «fibrosarcoma grado i».
La etiología es desconocida. La mayoría de los tumores desmoides tienen mutaciones en un gen llamado β-catenina (importante marcador diagnóstico). Una minoría de los tumores desmoides también está relacionada con mutaciones del gen FAP (poliposis adenomatosa familiar). Cuando se dan ambas circunstancias (poliposis adenomatosa familiar y tumores desmoides) se denomina «síndrome de Gardner».
Los tumores desmoides pueden surgir en cualquier parte del cuerpo y aparecer a cualquier edad, pero son relativamente frecuentes en mujeres jóvenes. Clínicamente se caracterizan por su crecimiento lento, aunque en raras ocasiones muestran un crecimiento rápido. No producen metástasis. Sin embargo, cuando son intraabdominales y agresivos, pueden causar problemas que amenazan la vida del paciente o incluso terminar con la muerte de este, cuando se comprimen los órganos vitales como los intestinos, riñones, pulmones, vasos sanguíneos, nervios, etc.
Los tumores desmoides superficiales suelen ser menos agresivos que los intraabdominales. Los tumores desmoides superficiales se manifiestan generalmente como un bulto indoloro o ligeramente doloroso, firme, liso y móvil. A menudo se adhieren a las estructuras circundantes. La piel que los cubre suele estar afectada. La presencia de un crecimiento de los tejidos blandos debe alertar al clínico con el fin de que profundice en la historia de la familia, para la evidencia de la poliposis familiar y el síndrome de Gardner.
La evaluación diagnóstica comienza con una prueba de imagen que puede ser una ecografía. Si la masa es sólida, puede emplearse una tomografía computarizada y/o una resonancia magnética para determinar si se adhiere a las estructuras cercanas y si puede extraerse de forma segura. A continuación se debe obtener el tipo histológico tumoral. Puede realizarse preferentemente mediante biopsia con aguja gruesa o por biopsia quirúrgica. En caso de optar por la biopsia quirúrgica, esta puede ser incisional (obteniendo una pequeña cantidad de tumor) o escisional (eliminando todo el tumor visible macroscópicamente). La biopsia escisional corre el riesgo de dejar márgenes microscópicos negativos, por lo que no es aconsejable.
Aunque los tumores desmoides no metastatizan, pueden causar grandes problemas cuando se vuelven localmente agresivos. El control mediante la cirugía y la radiación ha sido tradicionalmente el pilar del tratamiento de estos tumores. Algunos tumores desmoides pueden ser indolentes y tener períodos de estabilidad y de regresión temporal. Estos deben ser vigilados de cerca por los médicos.
Cualquiera que sea el tratamiento, las tasas de recurrencia en las principales series publicadas oscilan del 30-40%1,2. La extirpación quirúrgica amplia es el tratamiento de elección1. La reconstrucción de la pared abdominal puede requerir el uso de mallas de polipropileno o de mallas biológicas. Los márgenes quirúrgicos positivos después de la cirugía reflejan un alto riesgo de recurrencia3–5. El objetivo de la cirugía es eliminar todo el tumor y minimizar el riesgo de recurrencia; para ello es fundamental obtener márgenes libres de tumor, preservando la función y la estética. No obstante, a veces conseguir un margen negativo no es factible, y puede optarse por un seguimiento2.
La radioterapia puede ser eficaz para pacientes que no pueden o no quieren someterse a cirugía, o como complemento de la cirugía o la quimioterapia. La dosis recomendada es de 50-60Gy en 5 a 7 semanas, a 1,8-2Gy por fracción2.
Actualmente no hay ningún tratamiento sistémico validado por ensayos clínicos para el tratamiento de los tumores desmoides2,5. Se ha utilizado el tamoxifeno como agente antiestrógeno a dosis equivalentes a la del cáncer de mama por el supuesto efecto de los estrógenos en el desarrollo del tumor6. Las quimioterapias actuales incluyen comúnmente doxorrubicina, dacarbazina, metotrexato, vinblastina y vinorelbina, y pueden estar indicadas cuando fracasan otros tratamientos, en especial el tamoxifeno y el imatinib7.
Recientemente, los inhibidores de la tirosin-quinasa (imatinib) han demostrado ser beneficiosos en algunos tumores desmoides. El beneficio de estos nuevos agentes es que se pueden administrar de forma oral, y resultan más tolerables que las quimioterapias intravenosas citotóxicas8.
Por lo general, los pacientes serán seguidos por el examen clínico y los estudios radiográficos (en su caso) cada 3-6 meses durante los primeros 2-3 años, cada 12 meses a partir de 3 a 6 años y luego cada 2 años. Directrices basadas en el consenso de la NCCN sugieren una historia y examen físico con imágenes apropiadas cada 3-6 meses durante 2-3 años y luego anualmente9.
Dermatofibrosarcoma protuberansEl dermatofibrosarcoma protuberans (DFP) es una neoplasia de partes blandas relativamente poco común de bajo grado de malignidad. La metástasis ocurre raramente. Por otro lado, es un tumor localmente agresivo con una alta tasa de recurrencia. Descrito por Taylor en 189010, es una neoplasia cutánea que surge de la dermis e invade los tejidos más profundos (grasa, fascia, músculo, hueso).
El origen celular no está claro. La evidencia apoya el origen celular fibroblástico, histiocítico o neuroectodérmico. El DFP manifiesta características parciales de cada tipo celular. Se ha sugerido que el origen de este tumor podrían ser células mesenquimales pluripotenciales al sufrir una translocación de los cromosomas 17 y 22. Esto daría lugar a la activación continua de la proteína tirosin-quinasa, que a su vez promueve el crecimiento de células tumorales10,11.
El DFP es un tumor de crecimiento muy lento, por lo que el diagnóstico a menudo se retrasa meses o años. Puede empezar como una pequeña pápula asintomática y crecer gradualmente, o convertirse en una placa atrófica. Cuando crece rápidamente, es posible –en casos raros– observarse ulceración y hemorragia. Pueden aparecer telangiectasias en la superficie o en la periferia. El tumor es móvil en la palpación; sin embargo, la fijación a las estructuras más profundas (tales como fascia, músculo y hueso) puede producirse en sus etapas avanzadas.
Se diagnostica por biopsia. Dentro de las pruebas de imagen son útiles la tomografía computarizada para descartar posibles metástasis y la resonancia magnética para delimitar la afectación y profundidad de la invasión tumoral en la evaluación preoperatoria y en la recurrencia de la enfermedad.
Debido a su patrón de crecimiento infiltrante, el DFP, por lo general, se extiende más allá de los márgenes; esto explica en parte la alta tasa de recurrencia después de la resección quirúrgica convencional12.
La escisión quirúrgica sigue siendo el pilar del tratamiento para el DFP. Dentro de las técnicas quirúrgicas disponibles están la exéresis simple, la exéresis amplia y la cirugía micrográfica de Mohs, aunque existe cierta controversia entre estas 2 últimas. En la actualidad, independientemente de la técnica que se elija, se recomiendan unos márgenes libres de resección de 2-3cm más allá de los límites macroscópicos visibles del tumor, a veces incluyendo la fascia muscular subyacente13–15. A pesar de las escisiones locales amplias, todavía se observan tasas de recurrencia local próximas al 20%10. Esta alta recurrencia local, junto al hecho de la mayor conservación de tejidos que se consigue con la cirugía de Mohs, ha hecho que esta técnica sea cada vez más aceptada como el tratamiento de elección, sobre todo cuando la lesión se encuentra en la región de la cabeza y el cuello16–19.
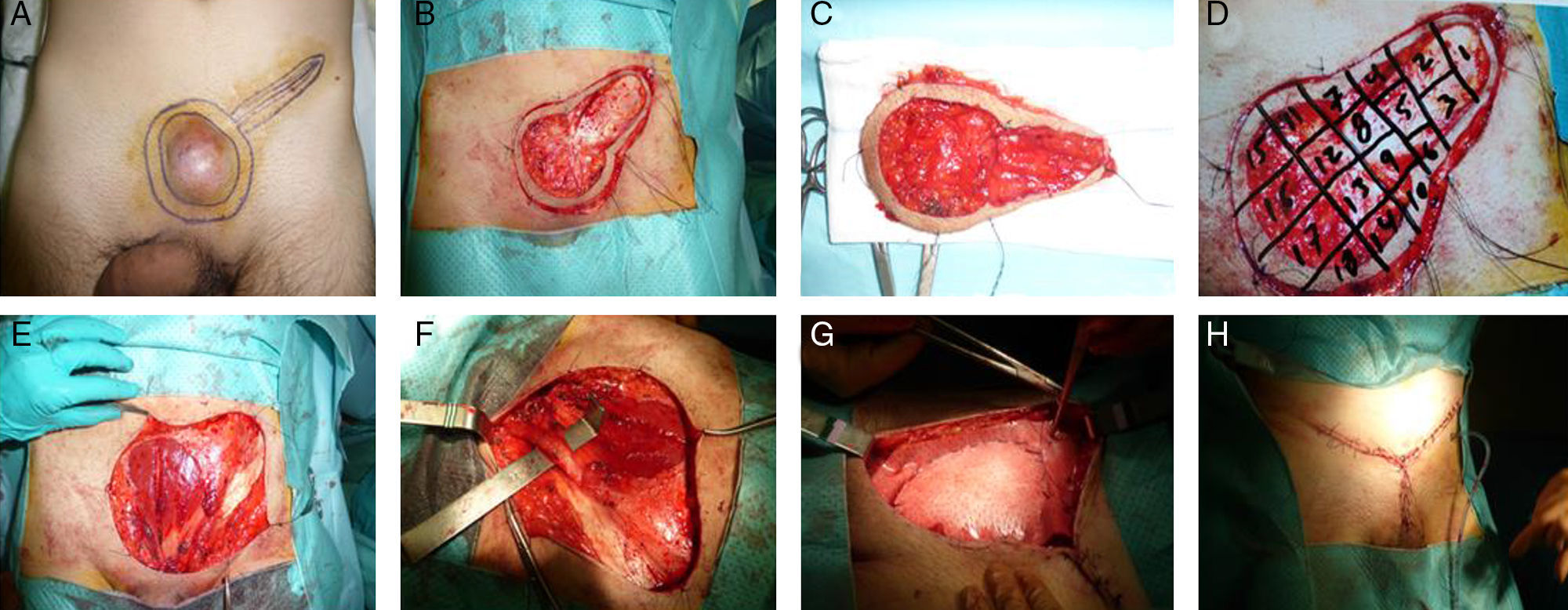
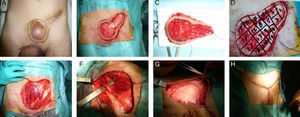
La diferencia fundamental entre la cirugía amplia y la cirugía de Mohs consiste en el procesamiento del tumor para el examen patológico. Por lo general, la muestra de la escisión amplia se procesa de forma convencional, mientras que en la muestra de Mohs se estudian de forma ininterrumpida todos los márgenes de la pieza en 3 dimensiones, informando intraoperatoriamente al cirujano para que vuelva resecar un margen si es necesario. Con la cirugía de Mohs se consigue eliminar menos tejido, lo que permite una evaluación completa de los márgenes, con las ventajas estéticas y funcionales que este ahorro de tejido conlleva. Sin embargo, una desventaja de este procedimiento es que requiere mucho tiempo en caso de tumores grandes, por lo que a veces el resultado se da varios días después (durante los cuales se cubre temporalmente el defecto quirúrgico del paciente) (fig. 1).
Dermatofibrosarcoma protuberans en región suprapúbica en varón de 42 años. Cirugía micrográfica de Mosh.
A.- Marcaje del tumor, de la incisión previa y de la zona de seguridad.
B.- Extirpación del tumor y de la cicatriz.
C y D.- Extirpación del margen de seguridad y referencia de los cuadrantes de la pieza para el estudio anatomopatológico en diferido. El defecto quirúrgico se recubre temporalmente con un apósito.
E y F.- Defecto superficial en la pared aponeurótica anterior del abdomen.
G.- Colocación de malla biológica fijada a la aponeurosis anterior.
H.- Cierre del defecto con colgajos dermocutáneos.
Cuando el tumor invade la fascia, el músculo o el hueso, el defecto creado por la cirugía será grande. Para reconstruirlo se pueden precisar de mallas sintéticas o biológicas, así como el uso de colgajos. Siempre debe optarse por la solución más simple y a la vez efectiva, que consiga además la funcionalidad y el resultado estético mejores.
La radioterapia puede recomendarse si los márgenes de resección son positivos y la cirugía amplia de rescate no puede realizarse porque solo daría lugar a déficits estéticos o funcionales considerables12.
Actualmente se ha propuesto el tratamiento neoadyuvante con imatinib (inhibidor potente y específico de varias proteínas tirosin-quinasas) para DFP no resecables, recurrentes o metastásicos, con el objetivo de reducir tanto la carga tumoral como la extensión de la cirugía11,20.
En resumen, los estudios han demostrado una baja tasa de recurrencia después de la cirugía para DFP si se utiliza un abordaje multidisciplinario, una cirugía adecuada y un estudio cuidadoso del margen quirúrgico de resección21.
El seguimiento de estos pacientes es similar al de los tumores desmoides.
Sarcoma de partes blandasLos sarcomas de partes blandas son un conglomerado de tumores malignos de origen mesenquimal que pueden originarse en el músculo, grasa, vasos sanguíneos, sistema nervioso periférico y tejido fibroso. A pesar de que su incidencia es escasa (alrededor del 10% de todos los sarcomas de partes blandas), su tratamiento es todo un desafío por la alta capacidad de recidiva local y el riesgo de metástasis a distancia que conllevan.
Los tipos histológicos más frecuentes son el histiocitoma fibroso maligno, seguido por el liposarcoma y el leiomiosarcoma. Otros tipos histológicos más esporádicos lo constituyen el sarcoma sinovial, angiosarcoma, schwanoma maligno y rabdomiosarcoma, pero hay descritos más de 50 tipos histológicos diferentes22.
La etiopatogenia, como en otros tantos tipos de tumores, es desconocida. Se han asociado a su origen diversas causas y circunstancias, tales como traumatismos previos, úlceras y cicatrices de larga evolución.
El método estándar para el diagnóstico consiste en múltiples biopsias con aguja gruesa. Sin embargo, la biopsia por escisión puede ser la opción más práctica para lesiones superficiales menores de 5cm. Una biopsia abierta puede ser otra opción en casos seleccionados. La biopsia debe planificarse de tal manera que la vía de acceso y la cicatriz se puedan eliminar de forma segura en la cirugía definitiva. El estudio de imagen con resonancia magnética es fundamental23.
El diagnóstico histológico debe basarse en la clasificación de la Organización Mundial de la Salud24. El grado de malignidad debe ser proporcionado en todos los casos en que ello sea posible sobre la base de los sistemas disponibles. El diagnóstico anatomopatológico se basa en la morfología y la inmunohistoquímica. En los casos raros o dudosos debe realizarse estudio molecular. El tamaño del tumor y su profundidad (con relación a la fascia muscular) deben registrarse, ya que implican un valor pronóstico, junto con el grado de malignidad del tumor.
Antes de iniciar cualquier tratamiento, el estudio de estadificación mediante tomografía toracoabdominopélvica informará de la posible existencia de metástasis a distancia. Del mismo modo, antes de iniciar cualquier tratamiento local es esencial conocer la profundidad y extensión del tumor mediante resonancia magnética. Con estos datos, la planificación del tratamiento requiere obligatoriamente la opinión o el consenso de un comité multidisciplinario (patólogos, radiólogos, cirujanos, radioterapeutas y oncólogos médicos). Esto debe llevarse a cabo en centros de referencia para los sarcomas23–25.
Las resecciones no planificadas están asociadas a una mayor tasa de recidiva local, relacionada con la enfermedad residual, márgenes quirúrgicos positivos y ciertos tipos histológicos más agresivos26.
La cirugía continúa siendo el tratamiento estándar para todos los pacientes con sarcomas de tejidos blandos localizados23,24. El procedimiento quirúrgico estándar es una escisión amplia, complementada con radioterapia en los tumores de grado intermedio-alto, tumores profundos y tumores mayores de 5cm. Esto implica la extirpación del tumor con un borde de tejido normal alrededor. El margen de tejido normal es variable, pero en cualquier caso tiene que estar libre de tumor: es importante tener en cuenta que el margen puede ser mínimo en el caso de las barreras anatómicas resistentes, como fascias musculares, periostio y perineuro.
En general, se practicará una exéresis compartimental cuando sea posible (musculatura rectal anterior) o una cirugía de exéresis amplia. Hay que tener en cuenta que estos tumores se caracterizan por las metástasis en saltos (skip metastases) dentro del compartimento muscular. La reconstrucción de los defectos de la pared musculoaponeurótica abdominal es preferible realizarla con mallas sintéticas o biológicas. Las transposiciones y colgajos musculares no se recomiendan, porque podrían enmascarar una posible recidiva local.
La radioterapia puede utilizarse antes de la cirugía en caso de tumores muy voluminosos, o más frecuentemente, como adyuvante después de la cirugía en tumores de grado intermedio-alto y tumores profundos con un diámetro mayor de 5 cm23. La terapia de radiación debe administrarse después de la operación, con la mejor técnica disponible, a una dosis de 50-60Gy, con fracciones de 1,8-2Gy, posiblemente con aumentos de hasta 66Gy (dependiendo de presentación y la calidad de la cirugía)24.
La quimioterapia se utiliza como tratamiento paliativo en la enfermedad avanzada, y a veces también con un potencial de disminuir el tamaño del tumor y erradicar las micrometástasis, haciendo posible la cirugía22. La quimioterapia adyuvante podría mejorar –o al menos retrasar– la recurrencia a distancia y local en pacientes de alto riesgo. Puede proponerse como una opción para cada paciente de alto riesgo (tumores profundos, mayores de 5cm y con un grado G2-3) 24.
En caso de resecciones R1 y R2, deberá realizarse siempre que sea factible una nueva cirugía de exéresis. En caso de no ser posible, se tratarán con radioterapia, incluso fuera de las indicaciones habituales23,24.
Se estima que después del tratamiento la enfermedad reaparece en alrededor del 40-60% de los pacientes24,25, dependiendo del grado histológico y del subtipo de sarcoma, del tamaño del tumor y del tipo de tratamiento local.
Más del 95% de las recaídas de los sarcomas de partes blandas se dan dentro de los 5 primeros años de seguimiento, y el 70-80% de las recaídas locales ocurren en los primeros 2-3 años después del tratamiento inicial27. También hay tipos histológicos con una propensión a la diseminación metastásica en los ganglios linfáticos (rabdomiosarcoma, sarcoma epiteloide, sarcoma de células claras o sarcoma sinovial). Los pulmones son el lugar de metástasis en el 80% de los casos27.
El seguimiento depende hasta cierto punto del grado histológico. Las recomendaciones actuales para un paciente con un tumor de grado intermedio-alto son revisiones cada 3 meses durante los primeros 2-3 años mediante exploración física (especialmente las cicatrices) y una radiografía de tórax. Luego cada 6 meses hasta el quinto año, y una vez al año a partir de entonces27. La detección temprana de una recaída local resecable puede prolongar la supervivencia del paciente, por lo que el uso de resonancia magnética en caso de sospecha puede ser muy útil27. Para buscar metástasis pulmonares, no se ha demostrado aún que la tomografía computarizada sea beneficiosa o rentable en comparación con la evaluación clínica del sitio primario y la radiografía de tórax23,27. Los pacientes con sarcoma de bajo grado pueden ser revisados cada 4-6 meses, con radiografía de tórax o tomografía computarizada a intervalos más relajados en los primeros 3 a 5 años, y luego anualmente23.
Port-site metastases y metástasis en pared abdominalUn caso particular de los tumores malignos de la pared abdominal lo constituyen las metástasis y los implantes en las puertas de entrada tras cirugía laparoscópica (port-sites metastases). Desde la introducción de la cirugía laparoscópica para el tratamiento de enfermedades malignas abdominales, se han observado de forma rara pero constante la implantación de células tumorales en los puertos de entrada en alrededor del 1-2% de los pacientes28, aunque sin diferencias significativas con los implantes en las heridas quirúrgicas en caso de cirugía abierta29.
Esta situación ha sido asociada a tumores de alto grado y de mal pronóstico y que habitualmente se asocian con recaídas en otras localizaciones1,30. Se ha especulado mucho acerca del mecanismo de producción de estas metástasis, desde implantes de células tumorales favorecidos por el neumoperitoneo a la mala técnica quirúrgica y al efecto inmunosupresor de la laparoscopia. Al parecer, el mecanismo de producción de las metástasis en las puertas de entrada de la pared abdominal es similar al del resto de las metástasis en pared abdominal: diseminación hematógena31. Este tipo de metástasis en la pared abdominal no debe presentarse como contraindicación de la laparoscopia en cirugía del cáncer abdominal32.
La exéresis quirúrgica de estos implantes sigue los mismos principios de cualquier tipo de exéresis tumoral: asegurar márgenes quirúrgicos libres de tumor, a pesar de que para ello a veces sean necesarias cirugías complejas con resecciones viscerales y óseas. En general, este tipo de metástasis se asocia a un mal pronóstico33,34.
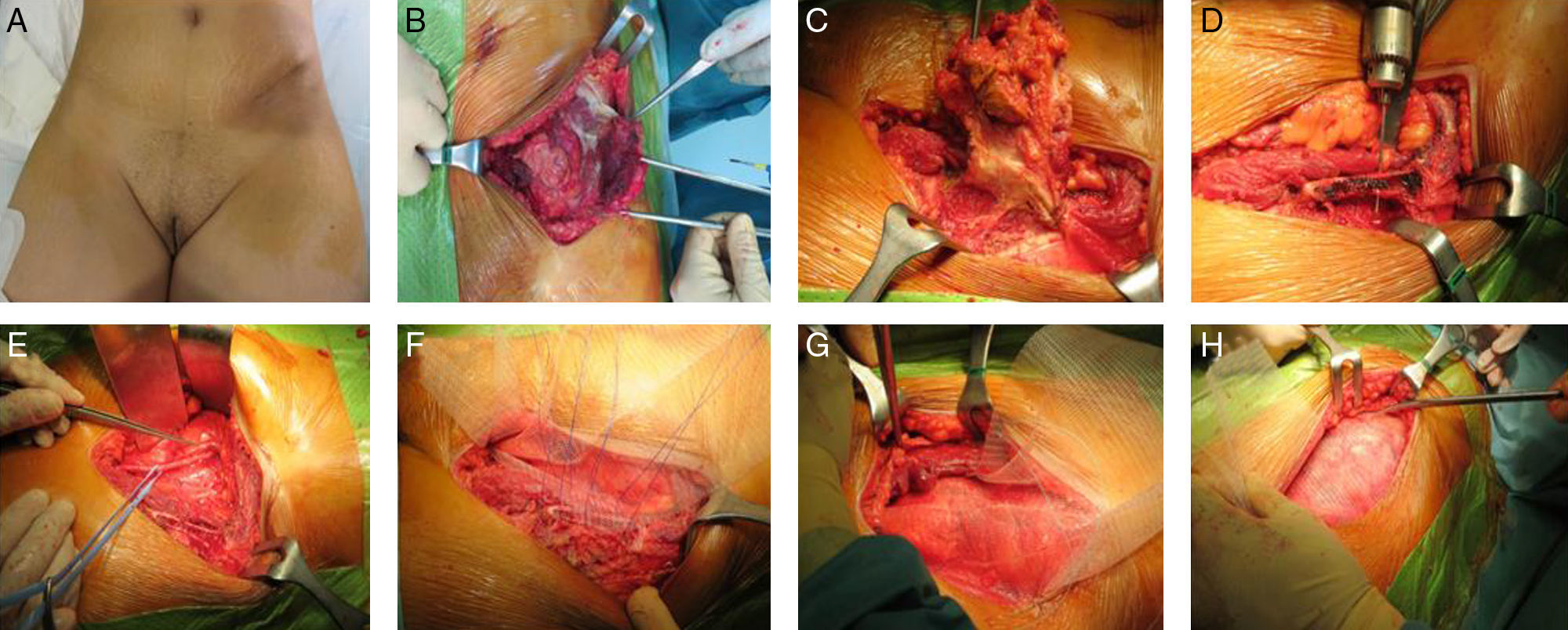
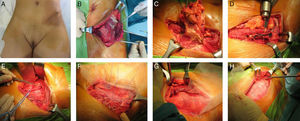
La reconstrucción de la pared abdominal se realizará como ya se ha comentado previamente; si fuera necesario, se utilizará una malla biológica o una prótesis sintética (fig. 2).
Mujer de 45 años con antecedentes de cáncer de ovario intervenido por laparoscopia en los años 2011, 2012 y 2013. Se remite a nuestro centro tras la tercera recidiva en el orificio de trocar ilíaco izquierdo. La paciente rechaza inicialmente la cirugía, y es tratada con radioterapia. Ante la progresión de la enfermedad con afectación ósea e inguinal, se realiza cirugía de rescate.
A.- Metástasis en orificio de puerto laparoscópico.
B y C.- Extirpación monobloque del tumor (piel, músculo y espina ilíaca anterosuperior).
D.- Confección de orificios en pala ilíaca para colocación de prótesis.
E.- Linfadenectomía inguinoilíaca.
F.-Anclaje de la malla de doble cara a la pala ilíaca.
G.- Anclaje de la malla de doble cara en situación preperitoneal.
H.- Colocación de la segunda malla en posición subcutánea, para la reconstrucción de la aponeurosis anterior.
A pesar de los avances en el tratamiento sistémico y en el perfeccionamiento de las técnicas de radioterapia, la extirpación quirúrgica continúa siendo la base del tratamiento de los tumores de la pared abdominal.
La radioterapia puede resultar muy útil para reducir el volumen de los tumores y hacerlos accesibles a la cirugía, y como tratamiento adyuvante en casos de tumores de alto riesgo de recidiva o cirugías subóptimas. También puede utilizarse como tratamiento paliativo en diversas circunstancias (hemorragia, dolor, etc.).
Con la aparición del imatinib (inhibidor de la proteína tirosin-quinasa) en el tratamiento del DFP, se ha conseguido un tratamiento sistémico específico. Se utiliza habitualmente como sustituto de la radioterapia en el tratamiento neoadyuvante en casos de grandes tumores inoperables de entrada. Esta situación es rara en tumores localizados en la pared abdominal, pero más frecuente en otras localizaciones donde la resección tiene que ser más económica.
Finalmente, la exéresis quirúrgica será el tratamiento principal. El tipo de exéresis variará en función del tipo de tumor. Así, en tumores benignos una exéresis simple será suficiente. En caso de tumores de malignidad progresiva, la cirugía se irá adaptando a esta, pasando de una cirugía amplia para el tumor desmoide a una cirugía micrográfica de Mohs para el DFP y a una cirugía radical compartimental con reconstrucción de la pared para el sarcoma de partes blandas. Las metástasis en la pared abdominal se tratarán de la misma forma que los sarcomas.
En cualquier caso, para el éxito de cualquier intervención es fundamental conseguir unos márgenes quirúrgicos libres de tumor, además de la mejor funcionalidad de la zona y un buen resultado estético.
Conflicto de interesesNo existe conflicto de intereses en el presente estudio.