Los materiales protésicos destinados a la reparación de grandes defectos herniarios de la pared abdominal tienen que quedar en muchas ocasiones colocados en contacto con el contenido de la cavidad peritoneal. Para evitar la aparición de complicaciones es necesario emplear prótesis tipo compuesto que muestren un buen comportamiento en todas las interfaces. El objetivo del presente trabajo fue llevar a cabo la elaboración de una prótesis compuesta formada por polipropileno y poliuretano, con el fin de obtener una buena integración tisular y un óptimo comportamiento en la interfaz peritoneal.
Material y métodosSe recubrieron por inmersión mallas de polipropileno con poliuretano-acrilato hidrofílico (PH) o poliuretano biorresistente terapéutico, y se probaron in vitro mediante ensayos de citotoxicidad, adhesión y proliferación celular. Los implantes in vivo fueron efectuados en 30 conejos blancos de Nueva Zelanda. A los 15, 45 y 90 días después del implante se analizó la integración de la malla y la formación adherencial, empleando microscopia óptica y microscopia electrónica de barrido. El estudio estadístico se realizó con los test de distribución χ2 de Pearson y ANOVA.
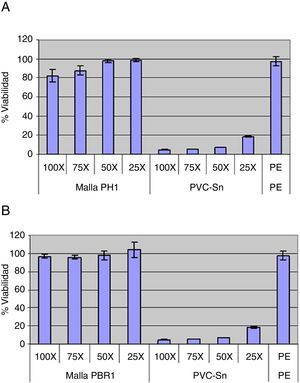
ResultadosEl ensayo de citotoxicidad reveló la viabilidad celular en presencia de las prótesis recubiertas con PH o poliuretano biorresistente terapéutico. Sin embargo, los ensayos de adhesión y proliferación celular mostraron una mayor eficacia en presencia de las prótesis de PH. En el estudio in vivo, la formación adherencial se situó mayoritariamente en los bordes del implante de las prótesis. A los 15 días existía una mesotelización casi completa, y la integración en la vertiente parietal fue correcta.
ConclusionesTanto in vitro como in vivo, la prótesis de PH muestra un excelente comportamiento, con escasa formación adherencial en la vertiente peritoneal. Además, su coste de producción es realmente bajo, lo que permite que esta prótesis sea muy competitiva desde el punto de vista de la producción industrial.
Prosthetic materials used in abdominal hernia repair frequently must be placed in contact with the abdominal cavity content. To avoid postoperative complications, it is mandatory to use composite meshes, with an adequate behavior both at the visceral and the parietal interfaces. This study was aimed to elaborate a composite polypropylene / polyurethane mesh, in order to obtain a good tissular integration and a satisfactory behavior at the peritoneal interface.
Materials and methodsSamples of a standard polypropylene mesh were coated with a thin layer of hydrophilic polyurethane (PH) or bioresistant therapeutic polyurethane (PBR), and were tested in vitro by cytotoxicity, cellular adhesion and proliferation assays. Then they were implanted in 30 New Zealand white rabbits. Mesh tissular integration and adhesion formation were tested at 15, 45 and 90 days after the implant, using optic and scanning electron microscopy. Statistical study was performed using Pearson's chi-square test and ANOVA.
ResultsCytotoxicity assay revealed the cellular viability of the extracts obtained from the mesh coated with PH and PBR. Adhesion and proliferation studies demonstrated a most relevant antiproliferative capacity in PH-coated meshes. In the in vivo study, the adhesions were localized prevalently on the mesh edges. After 15 days, the neoperitonization was almost complete, and the integration with the abdominal wall adequate. Both in vitro and in vivo, PH-coated meshes exhibit an excellent behavior, with scarce adhesion formation on the visceral side. Furthermore, their production cost is very low.
El uso en la práctica clínica de las técnicas quirúrgicas laparoscópicas con el fin de reparar defectos herniarios de pared abdominal ha estimulado los debates y las investigaciones sobre los materiales protésicos que se pueden utilizar en estos procedimientos quirúrgicos. El implante intraperitoneal, en un porcentaje de casos que varía según el tipo de prótesis utilizada, genera formación de adherencias víscero-protésicas1, cuya consistencia varía según el tipo de malla utilizada2–4. También la formación de neoperitoneo es importante en la interfaz peritoneal, y depende del tipo de prótesis usada5. Son bien conocidas las complicaciones de obstrucción intestinal y fístulas enterocutáneas en la morbilidad posoperatoria de implantes intraperitoneales de prótesis6–11.
Por todo ello, la prótesis ideal debería prevenir la formación de adherencias e integrarse bien en la pared abdominal12. También debería ir provista de una barrera en la vertiente visceral que no provoque erosiones, que resista a las infecciones y sea antiadhesiva, y que mantenga todas estas características por lo menos durante una semana (periodo crítico para la génesis de adherencias que, como se ha demostrado, comienzan a formarse ya en las primeras 48h tras haberse realizado un implante13–16). Una solución deseable sería que la misma prótesis que actúa como reparadora de la pared posea, al mismo tiempo, actividad antiadhesiogénica.
Nuestro estudio parte de la hipótesis de que recubriendo una prótesis de polipropileno con un estrato muy fino de material antiadhesiogénico la probabilidad de que se formen las adherencias que normalmente dicho material provoca disminuya de forma sensible, y que al mismo tiempo se mantengan las características de resistencia mecánica de las prótesis de polipropileno4,17–21.
Tras un análisis de las necesidades antes precisadas, y tras la revisión de la literatura, hemos elegido el poliuretano, por sus características físico-químicas y biomédicas. No son muchos, pero sí muy interesantes, los datos publicados hasta la fecha en relación con este biomaterial, con el fin de emplearse como prótesis para la reparación de defectos herniarios.
En un trabajo de 2005, Bellón et al.22 estudiaron el comportamiento de diferentes prótesis compuestas en cuanto a la formación de adherencias, implantando intraperitonealmente 4 tipos diferentes de biomateriales (polipropileno-ePTFE; polipropileno-poliuretano, poliéster-glicol polietilénico-glicerol y polipropileno-ácido hialurónico). Analizando la formación de adherencias 14 días después del implante, concluyeron que el mejor comportamiento era el de las prótesis compuestas de polipropileno y poliuretano.
En un estudio a largo plazo, Sodji et al.23 investigaron la formación de adherencias a los 4, 9 y 13 meses tras implantar intraperitonealmente una prótesis de polietilentereftalato y poliuretano en conejo. La formación de adherencias, sin evidencia de obstrucción intestinal, fue del 18%.
Con estos antecedentes sería correcto suponer que una malla compuesta de polipropileno y una capa de poliuretano biocompatible pueda, por un lado, inducir una escasa formación adherencial, y por otro, favorecer la formación de un buen neoperitoneo (por su acción de andamiaje). Con el objetivo de minimizar la cantidad de cuerpo extraño que implantar, nuestro diseño ha consistido en el recubrimiento de los filamentos de polipropileno empleando una técnica de dipping o inmersión de la prótesis en la correspondiente solución de poliuretano.
Material y métodosDiseño del material protésicoPara el recubrimiento de la malla de polipropileno (Ataylar Medical, Ankara, Turquía; con un peso de 70g/m2) se recurrió a la familia de los poliuretanos. Se seleccionaron 2 tipos diferentes: poliuretano-acrilato hidrofílico (PH) y poliuretano biorresistente terapéutico (PBR).
En la elaboración del PH, para el proceso de recubrimiento se utilizó una técnica de inmersión con una solución de recubrimiento hidrófilo de poliuretano-acrilato. La solución empleada incluyó etanol como disolvente y polivinilpirrolidona. Tras el proceso de inmersión se realizó un tratamiento con radiación UV. Al final del proceso, sobre la malla de polipropileno se obtuvo un recubrimiento de poliuretano de un gramaje medio de 2.6g/m2.
En la elaboración del PRB, las prótesis de polipropileno se recubrieron aplicando una solución de un polímero de poliuretano biorresistente terapéutico. El agente terapéutico, en particular, es un compuesto antiinflamatorio incluido en las cadenas del poliuretano base. En este caso se obtuvo sobre la malla de polipropileno un recubrimiento de un gramaje medio de 1.5g/m2.
La caracterización microestructural de las prótesis recubiertas se realizó mediante microscopia electrónica de barrido (JEOL JSM-5910 LV field-emission scanning electron microscope) (fig. 1). La capa obtenida del recubrimiento de la muestra de PH era de aproximadamente 2μm de espesor, mientras que la de la muestra PBR era más fina, con un espesor de aproximadamente 0.7μm y que, además, parecía más porosa.
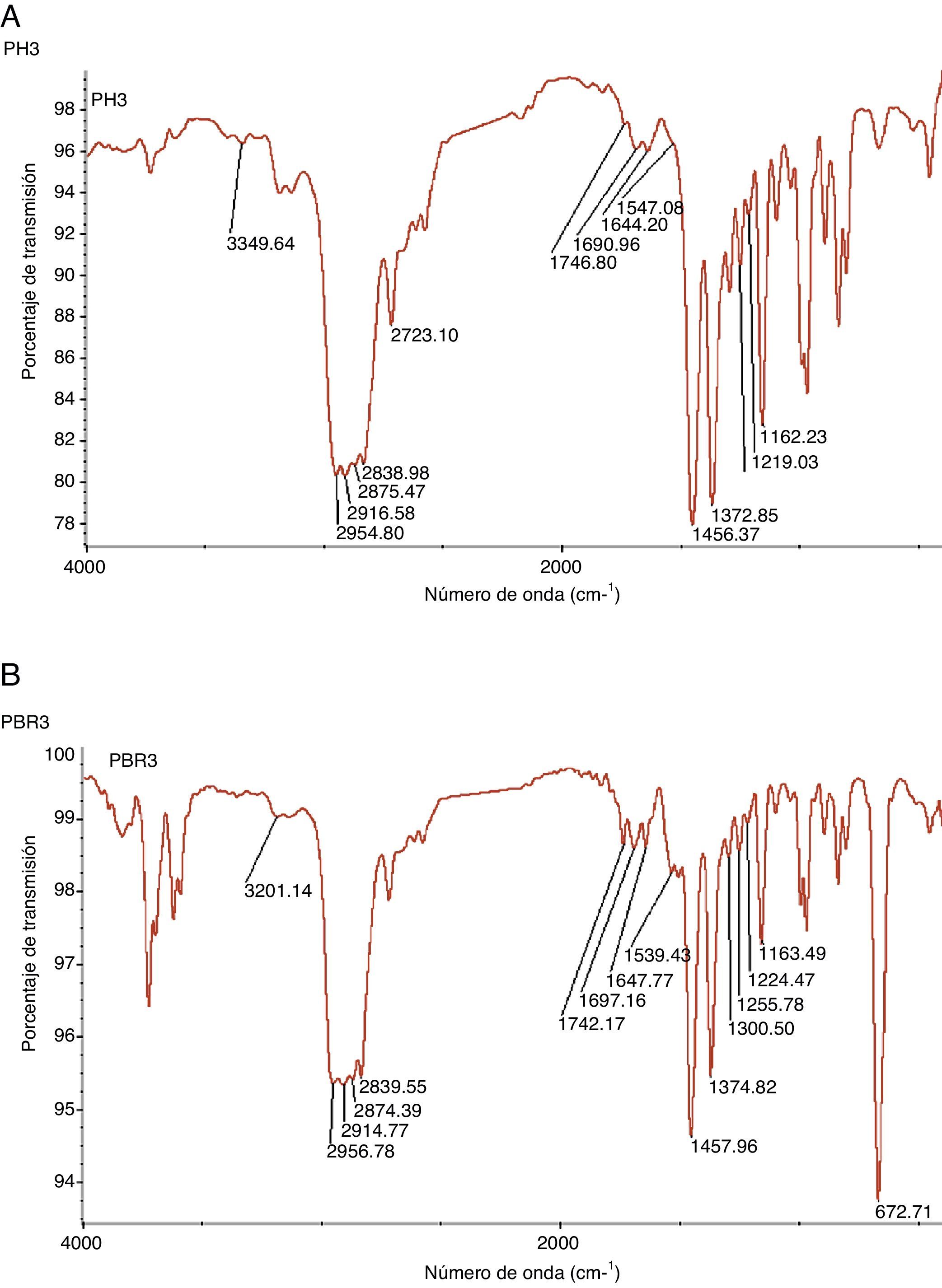
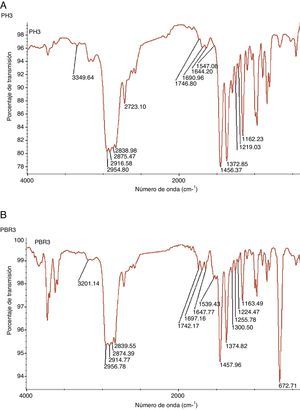
La composición final de las mallas se controló a través del análisis Fourier Transform Infrared Spectroscopy (FTIR). Este ensayo permite identificar un compuesto e investigar su composición. Se utilizó un espectrómetro Magna-IR 750 de Nicolet con una fuente de infrarrojo monocromática (Ever-Glotm mid.IR) situada enfrente del detector. Se calibró utilizando patrones de poliestireno de 1.5 y 3mm. En este caso, dado el tipo de muestra en forma de malla, los espectros se realizaban sobre las muestras directamente, y después se obtenía una fina capa (film) a partir de las muestras mediante la tecnología «Hot-Press» (fig. 2).
Ensayo de citotoxicidadPara la valoración del carácter citotóxico de las muestras se realizó un ensayo de toxicidad celular in vitro según el procedimiento operativo de Tecnalia (San Sebastián, España) «Citotoxicidad celular in vitro 35-0-102», basado en la norma ISO 10993-5:2000, para comprobar que el uso del producto no causase efectos tóxicos a nivel celular.
Para la obtención de los extractos se siguieron las recomendaciones de la norma UNE-EN ISO 10993-12 (Evaluación biológica de productos sanitarios. Preparación de muestras y materiales de referencia). Esta norma establece las condiciones de extracción y las ratios de masa o superficie del material respecto al volumen del líquido extractor. Dado que las muestras PH y PBR no eran estériles, se irradiaron mediante UV durante 15min antes de la extracción.
Como control positivo de materiales se utilizó el cloruro de polivinilo con elementos organoestánicos estabilizados (PVC-Sn), y como control negativo de citotoxicidad, el polietileno de alta densidad. Como blanco del ensayo se utilizó medio de cultivo EMEM completo (suplementado con un 10% de FBS).
Se utilizó la línea celular CCL-171 (ATCC) cultivada en medio de cultivo EMEM (Sigma, M5650, San Luis, Misuri, EE.UU.) suplementada con un 10% de suero fetal bovino (FBS, Sigma, F9665, San Luis, Misuri, EE.UU.) y un 1% de antibiótico penicilina/estreptomicina (Sigma, P4333, San Luis, Misuri, EE.UU.), mantenidas a 37±2°C y en atmósfera de 5% de CO2 hasta obtener una monocapa confluente. El día anterior al ensayo se sembraron 1×104 células CCL-171 en medio EMEM completo por cada pocillo necesario, y se incubaron a 37°C y 5% de CO2. Posteriormente, se retiró el medio de las células y se añadió cada concentración del extracto (100X, 75X, 50X y 25X) de la muestra, los controles y blanco, y se incubaron a 37°C y 5% de CO2 durante 24h, tras las cuales se realizó una evaluación cualitativa y cuantitativa del cultivo celular.
En la evaluación cualitativa se analizaron los cambios de la morfología general, la vacuolización, los desprendimientos, la lisis y la membrana celular. La evaluación cuantitativa se determinó valorando la viabilidad celular mediante el ensayo WST-1 (sales hidrosolubles de tetrazolio/formazán). Se trata de un método colorimétrico que detecta la actividad mitocondrial de las células. Las sales de tetrazolio se rompen mediante las enzimas celulares con formazán. El incremento del número de células viables supone un aumento en la actividad de las deshidrogenasas mitocondriales de la muestra, y por tanto, un aumento en la cantidad de formazán formado, que es directamente proporcional al número de células metabólicamente activas del cultivo. La cuantificación del colorante formazán producido por las células metabólicamente activas se realiza en un lector de ELISA mediante la lectura de la absorbancia a una longitud de onda de 450nm.
Ensayo de adhesión y proliferación celularSe realizaron sobre las mallas tratadas con ambos recubrimientos con el objetivo de seleccionar uno de ellos para llevar a cabo el implante de las prótesis en el animal de experimentación. El ensayo tenía como objeto evaluar biológicamente la capacidad antiproliferativa de los recubrimientos desarrollados sobre una malla polimérica. La base de estos experimentos consistió en depositar un número conocido de células sobre el material y contar el número de células adheridas a las 24 y 72h y a los 7días. Se utilizó la línea celular CCL-171 (ATCC) cultivada en medio de cultivo EMEM suplementado con un 10% de suero fetal bovino (FBS, Sigma F9665) y un 1% de antibiótico penicilina/estreptomicina (Sigma, P4333, San Luis, Misuri, EE.UU.), mantenidas a 37±2°C y en atmósfera de 5% de CO2 hasta obtener una monocapa confluente. Se obtuvo una suspensión celular y se sembraron 1×104 células sobre cada malla en las muestras a estudio y en los pocillos de poliestireno correspondientes al control de las células. En el ensayo, y para cada tiempo, se empleó una de las réplicas de cada muestra como «blanco» (medio de cultivo sin células). Se incubaron las placas durante 24, 72h y 7 días a 37°C y 5% CO2. Transcurridos esos tiempos, se realizó la medida del número de células/muestra mediante el ensayo por MTT (ensayo de reducción del bromuro [4,5 dimetil-2-tiazoil-2,5-difeniltetrazólico]). En aquellas placas, cuya incubación es superior a 24horas, el medio de cultivo de los pocillos se remplazó cada 2-3 días hasta su medida. El ensayo MTT es un método colorimétrico que detecta la actividad mitocondrial de las células vivas, del mismo modo que la técnica WST-1 descrita en el apartado anterior. En este caso, la medida de absorbancia se realizó a una longitud de onda de 570nm.
Estudio in vivo: implante de las prótesisEl modelo experimental utilizado es el mismo que se describe en la gran mayoría de los estudios publicados sobre la formación de adherencias4,24–31. La técnica utilizada fue la misma que se usa en clínica en las reparaciones intraperitoneales de las eventraciones y de las hernias abdominales.
Animal de experimentaciónSe utilizaron 30 conejos blancos de Nueva Zelanda, de un peso comprendido entre 4 y 5kg, estabulados antes y después de las cirugías en el animalario del Instituto Biodonostia de San Sebastián (Guipúzcoa, España), en condiciones estándar y con libre acceso a líquidos y alimentos.
Los procedimientos quirúrgicos se realizaron en los quirófanos del animalario del Instituto Biodonostia. Para la analgesia se administró buprenorfina (0.01-0.05mg/kg) (Buprex®, Schering-Plough S. A.) por vía subcutánea, media hora antes del procedimiento quirúrgico. La sedación se realizó con una mezcla de ketamina (35mg/kg) (Ketolar® 50, Parke-Davis, España), xilacina (5mg/kg) (Rompún® 2%, Bayer, España) y atropina (0.8-1mg/kg) (Braun, España). El mantenimiento anestésico se efectuó mediante la administración inhalatoria de sevoflurano (Sevorane® 250ml) al 3% con un flujo de oxígeno al 100% a 2×200ml/kg/min y aspiración simultánea de gas sobrante para la protección del cirujano.
Tras el rasurado y el lavado con povidona yodada jabonosa (Betadine®) y clorhexidina alcohólica al 5%, se realizó una laparotomía xifopúbica. Las prótesis (3×3cm), se colocaron en el flanco izquierdo de los animales, en contacto directo con el peritoneo, a 1cm al menos de la incisión de pared, suturadas con 4 puntos de poliglactina 910 de 3-0. Para inducir una reacción más intensa entre las asas intestinales y las mallas, se realizó una ligera abrasión superficial del peritoneo visceral con una gasa húmeda32–34. El cierre de la pared abdominal se efectuó en 2 planos: 1) seromuscular, con poliglactina 910 de 2-0, y 2) cutáneo, mediante sutura intradérmica de polipropileno 3-0. El tiempo operatorio, en todos los casos, fue de 20-30min.
La recuperación anestésica tuvo lugar mediante la administración inhalatoria de oxígeno al 100% a 2×200ml/kg/min 2-3 minutos, tras los cuales se trasladó al animal a la jaula de inducción-reanimación hasta la recuperación de todos los reflejos.
La analgesia posoperatoria se realizó mediante meloxicam (Metacan® Esteve, España) 0.3-0.6mg/kg durante los 5 días posteriores a la cirugía.
Para la eutanasia se empleó T61® (MSD, Intervet). Tras la realización de una laparotomía media, se observó el área de colocación de la malla y las adherencias existentes, que se valoraron con la escala de Zühlke et al.32 (tabla 1). Por último, se procedió a la extracción de la malla con bordes de pared abdominal de al menos 1cm. Cada muestra se dividió en 2 partes: una para análisis con microscopia electrónica de barrido y otra para histología convencional.
Clasificación macroscópica de las adherencias según Zühlke et al. (grado, tipo de adherencia)
| 0 | Ausencia de adherencias |
| I | Adherencias transparentes y bien disecables por disección roma |
| II | Disección roma a veces posible. Es necesario a veces cortar la adherencia, que empieza a mostrar una organización vascular |
| III | Adhesiolisis posible solo cortando las adherencias. Se evidencia una clara vascularización de estas |
| IV | Adhesiolisis posible solo cortando las adherencias. Vísceras abdominales firmemente pegadas a las adherencias. Daño visceral difícilmente prevenible |
Fuente: Zühlke et al.32.
Se diseñaron 3 grupos de estudio, cada uno de los cuales comprendía 10 animales. Los tiempos de sacrificio fueron de 15, 45 y 90días.
Análisis estadísticoEn el estudio in vitro se empleó la t de Student para el análisis de los datos. Para el estudio in vivo se utilizaron los test estadísticos de distribución χ2 de Pearson y ANOVA.
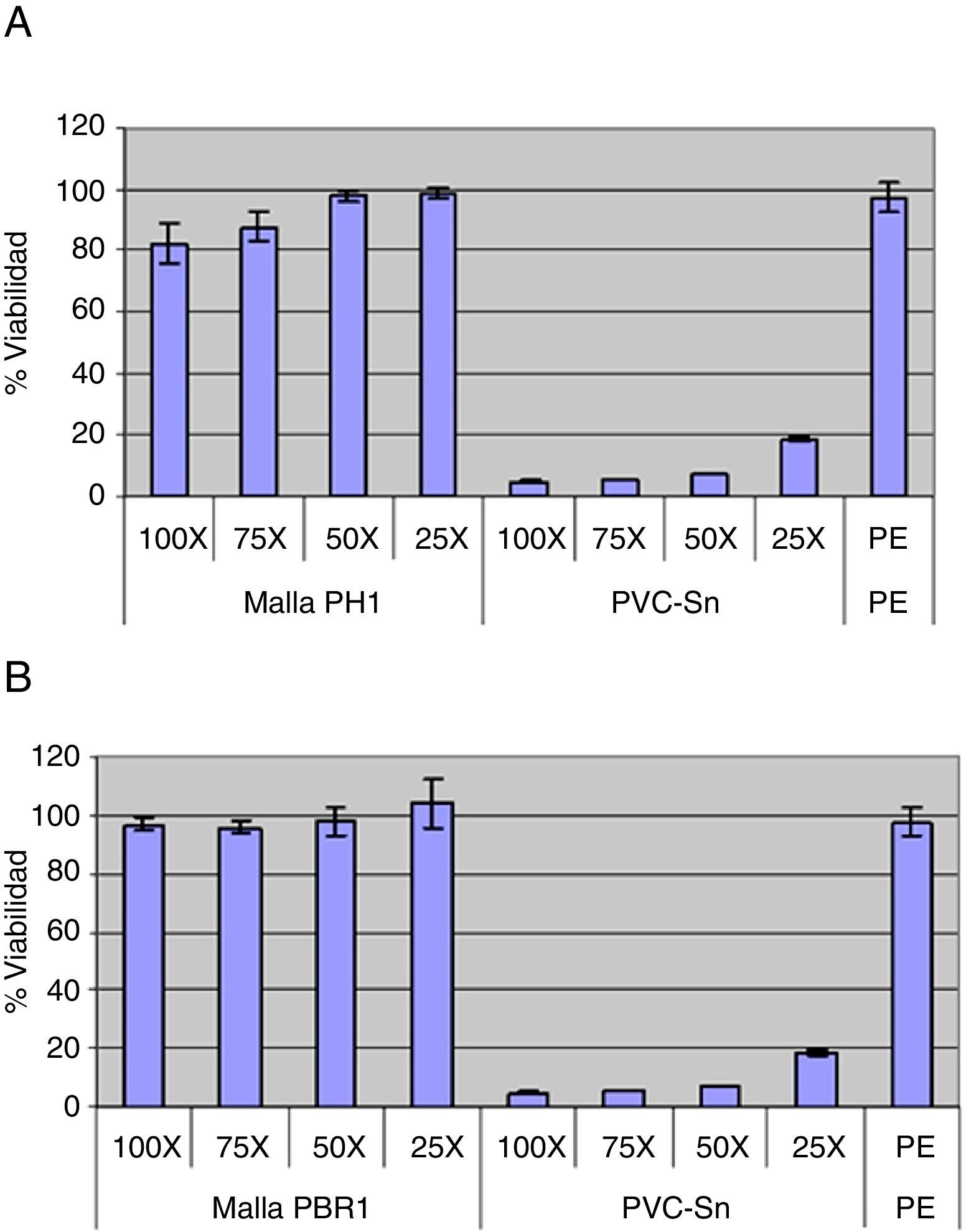
ResultadosEnsayo de citotoxicidad (fig. 3)-Evaluación cualitativa. Las células que estuvieron en contacto con el extracto obtenido a partir del control positivo de citotoxicidad (PVC-Sn) presentaron anomalías estructurales muy severas, y su aspecto redondeado implicaba muerte celular. Sin embargo, la morfología de las células en contacto con el extracto obtenido a partir del control negativo de citotoxicidad fue similar a la conseguida en el blanco, donde no se apreciaron alteraciones morfológicas. Las células en contacto con el extracto de la muestra de PH no presentaron diferencias morfológicas con respecto a las células en contacto con el blanco. Las células CCL-171 en contacto con las distintas concentraciones del extracto obtenido a partir de la malla de PBR tampoco mostraron diferencias morfológicas con las células en contacto con medio completo EMEM. Con estos datos, el ensayo de citotoxicidad se consideró apto.
-Evaluación cuantitativa. El control positivo de citotoxicidad (PVC-Sn) fue letal en todas las concentraciones, mientras que el control negativo de citotoxicidad (polietileno) presentaba una viabilidad similar al blanco (100% de viabilidad). Según establece la norma UNE-EN ISO 10993-5:2009, la muestra del ensayo tiene potencial citotóxico si la viabilidad se reduce por debajo del 70% respecto al blanco, por lo que los extractos obtenidos a partir de la malla de PH y de PBR no resultaron citotóxicos en ninguna de sus diluciones.
Ensayo de adhesión y proliferación celularLas células CCL-171 cultivadas sobre el poliestireno que se habían adherido al cabo de 24h proliferaban tanto a 72h como a 7días. Si se calcula el tiempo que tardan en duplicar las células CCL-171, se obtiene que esta línea celular cultivada sobre un sustrato adherente duplicaba su población cada 54h. En las muestras de PH y de PBR recortadas en forma de disco a los 7 días la desviación estándar obtenida para la cantidad de células adheridas en ambas muestras era muy elevada, dato que sugiere que la manipulación con tijeras afecta al recubrimiento y que este no era homogéneo en los discos ensayados. Sin embargo, aunque inicialmente se adherían un porcentaje mínimo respecto a la densidad celular sembrada, las células adheridas sí eran capaces de proliferar sobre estas muestras. No obstante, existen diferencias significativas entre el número de células que han proliferado al cabo de una semana sobre PH y PBR, y el PH es el recubrimiento con más capacidad antiproliferativa. En los valores del número de células adheridas a las muestras de PH y de PBR cortadas en forma de cuadrado, también la desviación estándar a 72h de PH y a 72h y 7días de PBR era muy alta, lo que sugiere que el recubrimiento no era del todo homogéneo en los discos. No obstante, el número de células obtenidas al cabo de una semana de incubación sobre ambos recubrimientos era menor que en las muestras de PH y de PBR manipuladas en forma de disco. Además, entre el valor de 72h y 7días, la población celular no era capaz de duplicarse sobre PH ni sobre PBR. En este sentido, aunque un porcentaje mínimo de células CCL-171 respecto al sembrado era capaz de adherirse a las 24h, su proliferación se veía ralentizada en el tiempo, y esta población era incapaz de proliferar a partir de los 3días de cultivo en ambos tratamientos.
Bajo las condiciones descritas y según la evaluación cuantitativa:
- 1)
Las células CCL-171 que se adherían al cabo de 24h sobre las muestras de PH y de PBR, recortadas en forma de disco, eran capaces de proliferar a los 3 y 7días.
- 2)
La línea celular fibroblástica CCL-171 era capaz de adherirse sobre las muestras de PH y de PBR, cortadas sin excesiva manipulación en forma de cuadrado. Sin embargo, a partir del tercer día, la tasa de proliferación de las células se ralentizaba significativamente, lo que conseguía que la línea celular fuera incapaz de duplicarse y proliferar.
El polímero que demostró mayor capacidad antiproliferativa es el recubrimiento de PH. Debido a este comportamiento in vitro, para el recubrimiento de las mallas de polipropileno y posterior implante de estas en el animal de experimentación, se eligió el PH.
Estudio in vivo: implante de las prótesisTodos los animales presentaron un comportamiento posoperatorio normal y llegaron en buenas condiciones al día del sacrificio.
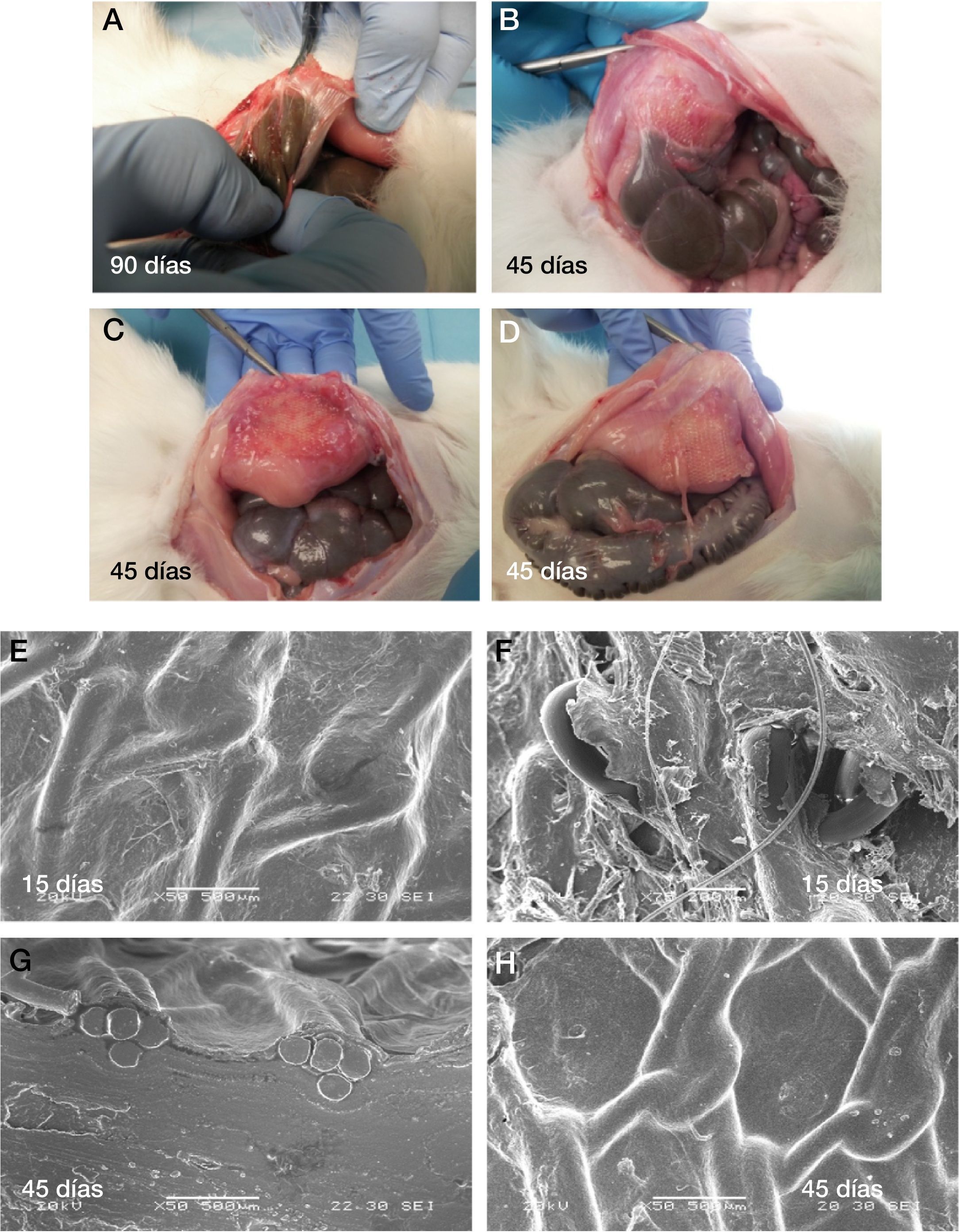
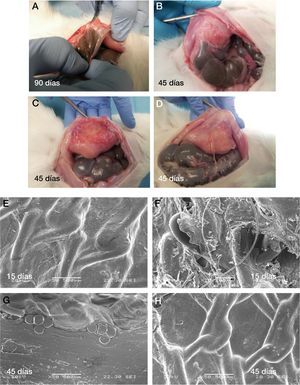
Los resultados macroscópicos de la formación adherencial en los 3 grupos de estudio están detallados en la tabla 2. Casi la totalidad de las adherencias se encontraron situadas en los bordes de la malla y/o cerca de la cicatriz laparotómica (fig. 4A).
Resultados macroscópicos globales de los diferentes implantes
| Animal | Sacrificio | Clasificación adherencias (Zühlke et al.32) y peritoneización de la malla | Notas |
| 1U | 15 días | Grado II en el borde en proximidad con la cicatriz laparotómica, 0 en el resto de la malla. Peritoneización parcial | Adherencias de grado iv en la cicatriz de laparotómica, que han determinado la lesión del colon en el momento del acceso a la cavidad peritoneal. La malla se encontraba cerca de la cicatriz laparotomía. No se han evidenciado zonas de retracción de la malla |
| 2U | 15 días | Grado II en el borde en proximidad con la cicatriz laparotómica, 0 en el resto de la malla. Peritoneización completa | Adherencias de grado iv en la cicatriz laparotómica. La malla se encontraba cerca de la cicatriz laparotómica. No se han evidenciado zonas de retracción de la malla |
| 3U | 15 días | Grado I en el borde en proximidad con la cicatriz laparotómica, 0 en el resto. Peritoneización completa | Adherencias de grado i en la cicatriz laparotómica. La malla se encontraba cerca de la cicatriz laparotómica. No se han evidenciado zonas de retracción de la malla |
| 4U | 15 días | Grado 0. Peritoneización completa | La malla se encontraba lejos de la cicatriz laparotómica. No se han evidenciado zonas de retracción de la malla |
| 5U | 15 días | Grado 0. Peritoneización completa | Adherencias de grado ii en la cicatriz laparotómica y de grado i entre asas y peritoneo parietal. La malla se encontraba lejos de la cicatriz laparotómica. No se han evidenciado zonas de retracción de la malla |
| 6U | 15 días | Grados I y II. Peritoneización parcial | Adherencias de grado i entre malla y peritoneo visceral y de grado ii entre peritoneo visceral y los bordes de la malla. La malla se encontraba cerca de la cicatriz de laparotomía. No se han evidenciado zonas de retracción de la malla |
| 7U | 15 días | Grado II en un borde. Grado 0/I en el resto de la malla. Peritoneización parcial | Adherencias de grado i entre asas y peritoneo parietal. La malla se encontraba cerca de la cicatriz laparotómica. No se han evidenciado zonas de retracción de la malla |
| 8U | 15 días | Grado 0. Peritoneización parcial | Adherencias de grado ii en la cicatriz laparotómica. La malla se encontraba lejos de la cicatriz laparotómica. No se han evidenciado zonas de retracción de la malla |
| 9U | 15 días | Grado 0. Peritoneización completa | La malla se encontraba lejos de la cicatriz laparotómica. No se han evidenciado zonas de retracción de la malla |
| 10U | 15 días | Grados I y II con el borde de la malla en proximidad con la cicatriz laparotómica, 0 en el resto de la malla. Peritoneización parcial | El borde superior de la malla se encontraba en proximidad con la cicatriz laparotómica. No se han evidenciado zonas de retracción de la malla |
| 1K | 45 días | Grado 0. Peritoneización completa | No se han evidenciado zonas de retracción de la malla |
| 2K | 45 días | Grados I y II. Peritoneización completa | Las adherencias se concentraban en la zona de los bordes de la malla. No se han evidenciado zonas de retracción |
| 3K | 45 días | Grado 0. Peritoneización completa | No se han evidenciado zonas de retracción de la malla |
| 4K | 45 días | Grado 0. Peritoneización completa | La malla se encontraba cerca de la cicatriz laparotómica. No se han evidenciado zonas de retracción de la malla |
| 5K | 45 días | Grado 0. Peritoneización completa | La malla se encontraba cerca de la cicatriz laparotómica. No se han evidenciado zonas de retracción de la malla |
| 6K | 45 días | Grados II y III. Peritoneización completa | Las adherencias estaban concentradas en la zona de los bordes de la malla. La malla se encontraba cerca de la cicatriz laparotómica. No se han evidenciado zonas de retracción de la malla |
| 7K | 45 días | Grado 0. Peritoneización completa | No se han evidenciado zonas de retracción de la malla |
| 8K | 45 días | Grado 0. Peritoneización completa | No se han evidenciado zonas de retracción de la malla |
| 9K | 45 días | Grado 0, i en proximidad de la cicatriz laparotómica. Peritoneización completa | No se han evidenciado zonas de retracción de la malla |
| 10K | 45 días | Grado 0. Peritoneización completa | No se han evidenciado zonas de retracción de la malla |
| 1W | 90 días | Grado 0. Peritoneización completa | La malla se encontraba cerca de la cicatriz laparotómica. No se han evidenciado zonas de retracción de la malla |
| 2W | 90 días | Grado 0. Peritoneización completa | La malla se encontraba cerca de la cicatriz laparotómica. No se han evidenciado zonas de retracción de la malla |
| 3W | 90 días | Grado i en el borde en proximidad con la cicatriz laparotómica, 0 en el resto de la malla. Peritoneización completa | Adherencias de grado ii en la cicatriz laparotómica. La malla se encontraba lejos de la cicatriz laparotómica. No se han evidenciado zonas de retracción de la malla |
| 4W | 90 días | Grados I y II en el borde de la malla en proximidad con la cicatriz laparotómica. Grado 0 en el resto de la malla. Peritoneización completa | Adherencias de grado ii en la cicatriz laparotómica. La malla se encontraba cerca de la cicatriz laparotómica. No se han evidenciado zonas de retracción de la malla |
| 5W | 90 días | Grado I en el borde en proximidad con la cicatriz laparotómica, 0 en el resto de la malla. Peritoneización completa | La malla se encontraba cerca de la cicatriz laparotómica. No se han evidenciado zonas de retracción de la malla |
| 6W | 90 días | Grado I en el borde en proximidad con la cicatriz laparotómica, 0 en el resto de la malla. Peritoneización completa | Adherencias de grado i en la cicatriz laparotómica. La malla se encontraba cerca de la cicatriz laparotómica. No se han evidenciado zonas de retracción de la malla |
| 7W | 90 días | Grados I y II en el borde en proximidad con la cicatriz laparotómica. Grado 0/I en el resto de la malla. Peritoneización completa | Adherencias de grado ii en la cicatriz laparotómica. La malla se encontraba cerca de la cicatriz laparotómica. No se han evidenciado zonas de retracción de la malla |
| 8W | 90 días | Grados I y II en el borde en proximidad con la cicatriz laparotómica. Grado 0/I en el resto de la malla. Peritoneización completa | Adherencias de grado ii en la cicatriz laparotómica. La malla se encontraba cerca de la cicatriz laparotómica. No se han evidenciado zonas de retracción de la malla |
| 9W | 90 días | Grado 0. Peritoneización completa | La malla se encontraba cerca de la cicatriz laparotómica. No se han evidenciado zonas de retracción de la malla |
| 10W | 90 días | Grado 0. Peritoneización completa | La malla se encontraba cerca de la cicatriz laparotómica. No se han evidenciado zonas de retracción de la malla |
A) Resultados macroscópicos de la formación adherencial en diferentes tiempos de estudio. B) Vertiente peritoneal e integración tisular en la microscopia electrónica de barrido a los 15 y 45 días del implante. C) Sacrificio 45 días. D) Sacrificio 45 días. E), G) y H) Imágenes de microscopia de barrido de mallas explantadas en conejos sacrificados a 45 días. F) Imagen de malla explantada en conejo sacrificado a 15 días.
El estudio histológico con hematoxilina-eosina mostró, en las muestras extraídas a los 15 días y en la interfaz malla/pared abdominal, la presencia de tejido fibroso laxo, con considerable neovascularización y con celularidad variable, según los campos observados. Los principales tipos celulares observados fueron linfocitos, polimorfonucleares neutrófilos y eosinófilos. A los 3 meses se observó tejido fibroso denso, con escasa neovascularización y predominio de células mononucleadas, pero en escasa cantidad. En la vertiente peritoneal, a los 15días del implante, pudo observarse revestimiento mesotelial.
En el análisis con microscopia electrónica de barrido se observó una completa y uniforme reperitoneización de las prótesis ya en los animales sacrificados a los 15días. La presencia de tejido fibroso irregular y desordenado se observó en la vertiente parietal de los implantes, donde estos se habían fijado (fig. 4B).
Análisis estadísticoPara el análisis estadístico, primeramente se valoró el porcentaje de superficie ocupado por adherencias en cada malla extraída. Al comparar la variable grupo (15, 45 y 90días) con la variable ninguna adherencia (sí, no), el test χ2 de Pearson no fue significativo (χ2=2.4; p>0.05), de forma que el grado y la cantidad de adherencias no cambian en los distintos grupos.
Para establecer a qué grupo se había asociado la mayor superficie de adherencias (en términos de porcentaje) se utilizó una ANOVA a una vía (F ANOVA de Fischer). El test no fue significativo (F=2.79; p>0.05), con lo que se puede considerar que no existen diferencias estadísticamente significativas entre los promedios de superficie de no adherencia medidos en los diferentes grupos estudiados.
DiscusiónEl incremento de los procedimientos laparoscópicos en la reparación de los defectos de pared abdominal y la necesidad de disponer de materiales protésicos que al mismo tiempo puedan ser colocados en contacto directo con las vísceras abdominales y posean características mecánicas adecuadas (bajo peso, memoria elástica, etc.) han impulsado notablemente las investigaciones en las últimos años sobre nuevos biomateriales.
Nuestro grupo ha polarizado su atención en la combinación polipropileno-poliuretano por varios motivos: a) una anterior experiencia con el poliuretano, en una forma biodegradable, implantado intraperitoneal como prótesis vascular, que había demostrado claramente sus funciones de andamiaje y la escasa tendencia a inducir la formación de adherencias24,25; b) el análisis de la literatura y en particular de los estudios de Bellón et al.22 y de Sodji et al.23, que habían demostrado cómo, en prótesis compuestas de polipropileno-poliuretano, el comportamiento en la interfaz peritoneo-poliuretano se acercaba al modelo ideal de prótesis (características mecánicas adecuadas, prevención de formación de adherencias, función de andamiaje en la neoperitoneización de la prótesis, ausencia de toxicidad, etc.). En particular, los trabajos de Bellón et al.3,22,33 habían demostrado la mayor eficacia antiadhesiogénica de la interfaz poliuretano-peritoneo respecto a otras prótesis compuestas disponibles en el mercado.
Nuestro objetivo en el presente trabajo ha sido desarrollar una prótesis con las características de una convencional de polipropileno, pero a la vez con propiedades antiadhesiogénicas y de andamiaje para conseguir con ambas propiedades una buena mesotelización y un buen neoperitoneo. Otro objetivo fue elaborar una prótesis con suficiente memoria elástica para que al ser introducida por los trocares de laparoscopia pudiera recuperar su forma original una vez que estuviera ubicada en la cavidad peritoneal. Ello facilitaría su manipulación en el transcurso de la reparación quirúrgica.
Para conseguir estos objetivos, hemos recubierto una prótesis de polipropileno con una capa de poliuretano de espesor micrométrico, de forma que el peso y el espesor totales del poliuretano utilizado sean irrelevantes respeto a la masa final de la prótesis, pero suficientes para garantizar las funciones antiadhesiogénicas y de andamiaje.
Se ha puesto especial atención en el control cuantitativo y cualitativo de la composición de la prótesis. Los ensayos in vitro de citotoxicidad, de adhesión y de proliferación celular nos han demostrado que el recubrimiento con PH posee las mejores capacidades antiproliferativas, por lo que hemos elegido esta variante para realizar el prototipo. La caracterización microestructural de las prótesis realizada en la microscopia electrónica de barrido demostró que el recubrimiento con PH de aproximadamente 2μm de espesor nos permitía considerar la cantidad de poliuretano como insignificante respeto a la composición total de la prótesis. Por tanto, la caracterización óptima de la prótesis generada (PH) tras los estudios in vitro nos permitieron abordar los estudios in vivo.
El implante de las mallas en los animales de experimentación mostró un buen comportamiento en la interfaz peritoneal, pues existía una buena mesotelización a los 15días de los implantes. De acuerdo con otros autores34, consideramos que los primeros 7días después del implante son claves en la formación adherencial. A partir de la segunda semana, dicho proceso se estabiliza35. En nuestro modelo, la formación adherencial se objetivó en las zonas periféricas de los implantes, y no en la parte central de estos.
A partir de los resultados obtenidos, podemos afirmar que la prótesis que hemos ensayado posee las mismas características de manejabilidad que una prótesis de polipropileno, pero con el valor añadido de que al poseer un recubrimiento de poliuretano tiene propiedades que le permiten ser colocada en una interfaz peritoneal.
Finalmente, otro apartado que consideramos de relevancia son los costes de elaboración y fabricación de esta prótesis, ya que son significativamente más reducidos que los de otras prótesis tipo compuesto.
En conclusión, podemos afirmar que después de los estudios realizados tanto in vitro como in vivo la prótesis diseñada muestra un comportamiento óptimo en cuanto a biocompatibilidad, manejabilidad y respuesta tisular, lo que la hace óptima para implantarse en situación intraperitoneal.
FinanciaciónEste trabajo fue financiado bajo el Programa Red de Ciencia, Tecnología e Innovación de la Diputación Foral de Guipúzcoa (España) para el periodo 2009-2011.
El trabajo ha tenido el soporte financiero de Caja Navarra.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.