Estudio de la prótesis autoadhesiva Parietene Progrip® de Covidien en la vía posterior preperitoneal abierta tipo Nyhus modificado, usando una técnica personal.
Material y métodoEstudio prospectivo observacional descriptivo y analítico unicéntrico (de febrero de 2009 a diciembre de 2012) de 331 pacientes operados, consecutivamente y sin selección, de todos los tipos de hernias. Se registran las complicaciones y el dolor posoperatorio por escala visual-analógica al alta, durante la primera semana, al 15.o día, 1.er, 3.er, 6.o mes y anual.
ResultadosSe practicaron 355 reparaciones en 331 pacientes, con una edad media de 44 años (14-87). Las hernias primarias y las programadas fueron las más frecuentes (89 y 93.5%); las recidivadas y urgentes supusieron el 11 y el 6.5%, mientras que el 7% fueron reparaciones bilaterales. El 28% de la serie tenía un IMC de 27kg/m2, y el 7% un IMC>35kg/m2. El tiempo medio operatorio fue de 13.7± 3.3min (4-93min) y la estancia media de 15±3h (12-20h). Las complicaciones fueron seroma (6%), retención urinaria (2%), hematoma (2.4%) e infección de herida (0.3%). Se presentó morbilidad tardía (primer año) en un caso de dolor testicular leve y bilateral tras reparación bilateral al primer mes (paciente «sensible»), además de una recidiva de hernia oblicua externa (0.3%). El dolor promedio (los 3 primeros días) fue de 19.7±4.4mm. El seguimiento (mediana de 28 meses) fue completo en 315 revisados (95.4%) sin dolor inguinal crónico ni recidivas.
ConclusionesEl abordaje preperitoneal abierto tipo Nyhus modificado con prótesis autoadhesiva Parietene Progrip® es, en nuestra experiencia, fácil, rápido y efectivo. Los pacientes no tienen dolor inguinal crónico y solo hubo una recidiva.
This study examines the behavior of the adhesive Parietene Progrip® mesh by Covidien in open posterior preperitoneal inguinal hernia repair using a personally modified Nyhus technique.
Material and methodIn a prospective, single center, descriptive and observational analytical study, we consecutively examined all patients undergoing elective or emergency surgery for a primary or recurrent inguinal hernia over the period between February 2009 and December 2012. Postoperative pain was assessed using the visual (color) and analogical (millimeters) scale. Complications and pain were determined upon hospital discharge and at weeks 1 and 2; one, 3 and 6 months and one year after surgery. Pain was also assessed daily during the first postoperative week.
ResultsThree hundred fifty-five inguinal hernia repair surgeries were performed in 331 patients of mean age 44 years (14-87 years). Surgeries were of primary repair, scheduled repair, recurrent and emergency kind (89, 93.5, 11 and 6.5%, respectively). BMIs were 27kg/m2 in 28% of the patients, and>35kg/m2 in 7%. Mean surgery length was: 13.7±3.3min (4–93min) and mean hospital stay was 15±3h (12-20h). Complications were: seroma (6%), urinary retention (2%), hematoma (2.4%), and surgical wound infection (0.3%). No patient reported persistent groin pain. As of late morbidities, one patient suffered mild testicular pain following bilateral surgery during the first postoperative month and there was one hernia recurrence (0.3%). The mean pain score for the first 3 postoperative days was 19.7±4.4mm. Follow-up (median: 28 months) was complete in 315 patients (95.4%). There were no reports of chronic inguinal pain.
ConclusionsSurgical access and mesh placement has, based upon our experience, proved easy, rapid and effective. Patients suffered no chronic pain and there was only one hernia recurrence.
La elección de una técnica para el tratamiento de las hernias del área inguinocrural resulta controvertida por la variabilidad de abordajes y opciones técnicas, sin que hasta el momento exista consenso en el empleo de una sola de ellas que se muestre capaz de reparar, de forma eficiente y efectiva, todos los tipos de hernias. Por ello, cada abordaje tiene sus adeptos, fundamentalmente para el abordaje inguinal anterior (IA), y en menor número para el posterior preperitoneal abierto (PPA), endoscópico totalmente extraperitoneal (TEP), laparoscópico transabdominal preperitoneal (TAPP) o transabdominal intraperitoneal, este último casi en desuso1–4. Todos ellos justifican un mismo principio técnico: alojar la prótesis junto a la fascia transversalis, por delante o detrás de ella (preperitoneal), para disminuir la tensión en la reparación y la probabilidad de una recidiva herniaria.
La era de las prótesis sintéticas comenzó, sin duda, con Zagdoun5 y Usher6 en 1959, quienes las implantaron por la vía IA, siguiendo el «viejo» concepto y término «sin tensión» de Halsted7 (1893) tras la conocida publicación de Bassini8 y defendido por Acquaviva9 (1944). Fue Nyhus10 quien, por primera vez (en 1975), las implantó en hernias primarias por la vía PPA, por lo que las reparaciones anatómicas fueron abandonadas progresivamente por las protésicas, cuyo empleo se consolidó en los años ochenta del siglo pasado tras evidenciar que reducen o anulan la tensión en la sutura, disminuyen el dolor inguinal, mejoran la confortabilidad posoperatoria y bajan la (hasta entonces) importante tasa de recidivas a un segundo plano por la prevalencia y relevancia clínica del, hasta aquel momento, infravalorado dolor inguinal crónico posoperatorio (DICP)11–13, complicación que pocos relacionan con el «técnico»14 pero sí con la técnica, debido a la tensión en la sutura o a las lesiones nerviosas, o por el uso de prótesis densas microporosas o por sus medios de fijación (tipo de hilo, técnica de sutura, grapados, etc., implicados también en su aparición)15. Con el pretendido fin de reducir o anular esta complicación, esos medios habituales de fijación son sustituidos por otros realmente inocuos, como son los pegamentos acrílicos polimerizados, las colas biológicas16,17 y, más recientemente, las prótesis autoadhesivas de polipropileno Parietene Progrip® de Covidien, utilizadas por primera vez en la vía IA por Chastan18 y empleadas para el trabajo que nos ocupa.
Nuestro grupo inició la vía PPA con la técnica de Nyhus19 en 1986 y, a partir de 1988, con una original modificación de la técnica que resulta más sencilla, práctica, rápida y menos lesiva, en la que se acumula una notable experiencia: 3 millares de reparaciones con prótesis fijadas con distintos medios según etapas (puntos, grapas –de acero, helicoidales de titanio y reabsorbibles– o pegamentos20), utilizando en los últimos 4 años –como innovación y primicia técnica– este nuevo tipo de prótesis autofijable (Parietene Progrip®) con el fin de comprobar su comportamiento a través de la vía PPA, hasta el momento sin referencia bibliográfica alguna por esta vía y menos aún con nuestra modificación personal a la técnica de Nyhus21, con la que, desde hace 26 años, venimos reparando todos los tipos de hernias inguinocrurales por su versatilidad y polivalencia, y ahora con el empleo de la citada prótesis sobre la pared posterior de la ingle. El manejo, la experiencia clínica y la aportación bibliográfica de esta innovación y primicia técnica (por dicha vía y con la mencionada prótesis) constituyen los objetivos del presente trabajo.
Material y métodoEntre febrero de 2009 y diciembre de 2012 se realizó un estudio prospectivo observacional descriptivo y analítico de 331 pacientes consecutivos, intervenidos de hernia en la región inguinocrural. Fueron operados en 2 hospitales, uno público (Hospital General Universitario) y otro privado (Hospital 9 de Octubre), por el mismo cirujano con distintos equipos, pero siempre con las mismas indicaciones y técnica quirúrgica: abordaje PPA con la modificación personal a la técnica de Nyhus, y con la prótesis autoadhesiva Parietene Progrip® de Covidien empleada en el periodo señalado.
Se registraron los habituales parámetros demográficos, antecedentes patológicos (comorbilidades), índice de masa corporal (IMC=kg/altura2=kg/m2 de superficie corporal) y parámetros quirúrgicos, así como los tipos anatómicos de las hernias siguiendo la clasificación de Nyhus (I, II, IIIA, IIIB, IIIC y IV)10 y la clásica2. El riesgo anestésico preoperatorio se evaluó por niveles ASA (Sociedad Americana de Anestesiólogos) y, para el registro del dolor inguinal posoperatorio, se proporcionó a los pacientes una gráfica con una escala visual analógica (EVA), para anotar la intensidad y el consumo de analgésicos orales domiciliarios, por intervalos de tiempo. Todos los pacientes fueron informados de los riesgos y beneficios y firmaron el consentimiento informado.
Criterios de inclusión y exclusiónSe incluyó a los pacientes con límites de edad ampliados por defecto hasta los 14 años en jóvenes obesos o somáticamente desarrollados y, por exceso, limitada solo por el estado biológico del paciente, evaluado este por su estado físico, las comorbilidades y la constatación objetiva y subjetiva del cirujano de poseer (el paciente) una esperanza de vida aceptable y susceptible de beneficiarse de esta cirugía. Fueron incluidos todos los tipos anatómicos de hernia (independientemente del tamaño, bilateralidad, recidiva o multirrecidiva, complejidad o complicación urgente) y no hubo selección por riesgos, salvo entre pacientes terminales o con enfermedad aguda grave asociada a la hernia o relacionada con esta, pero que precisaran una laparotomía añadida (peritonitis, íleo evolucionado, etc.).
Procedimiento preoperatorioA todos se les administró profilaxis antimicrobiana durante la inducción anestésica, dosis repetible cada 8h durante, al menos, 24h en cirugía contaminada sin o con resección visceral. La profilaxis antitrombótica con heparina de bajo peso molecular solo se utilizó en pacientes con niveles de riesgo definidos por protocolo, salvo en casos de urgencia. La anestesia regional fue mayoritaria, reservando la general para hernias con posibilidad de manipulación o resección intestinal y en las complejas, mientras que la anestesia local más sedación general y mascarilla laríngea se practicó en los que prefirieron un alta precoz. El alta hospitalaria se les dio, casi siempre, entre las 12 y 20h del posoperatorio (salvo en las urgencias complicadas), en algunas hernias complejas o en aquellos pacientes cuyo estado físico aconsejaba prolongarla más de 24h.
Técnica quirúrgicaAbordajeLa vía y la técnica están fundamentadas en la técnica de Nyhus19–22 con modificaciones personales23–26, como se indica a continuación:
- 1)
Incisión suprainguinal transversa de la piel y tejido celular subcutáneo (de unos 4-6cm y a unos 3cm sobre el pubis) e incisión, en el mismo sentido horizontal, de la hoja anterior de la fascia del músculo recto, justo hasta su borde lateral, pararrectal (sin prolongarla a la musculatura plana).
- 2)
Elevación del borde caudal de la incisión con un separador de Mathieu e incisión longitudinal de la fascia transversalis, siguiendo exactamente el diedro entre esta y el borde externo del músculo recto, hasta el pubis. Se consigue un «hiato» original de acceso al espacio de Bogros por el que protruye la grasa preperitoneal («más amarilla»), que es disecada y rechazada, junto con el músculo recto, en sentido cráneo-medial con una valva maleable.
- 3)
Finalmente se identifica, por palpación y visión directa, el ligamento de Cooper, liberándolo de la grasa y electrocoagulando cualquier pequeño vaso venoso, si existe.
- a)
Saco directo: Se identifica fácilmente su fascia transversalis, se le separa de ella por tracción de su contenido (casi siempre graso) y se le abandona en el espacio preperitoneal, con lo que queda expuesto el orificio «directo» en la pared posterior.
- b)
Saco indirecto: Produce un abultamiento en la pared posterior (fascia transversalis) por el contenido herniado (grasa, lipoma, saco peritoneal con o sin víscera) que penetra en el conducto inguinal desde el orificio inguinal profundo, ubicado lateralmente entre la pared posterior y la grasa preperitoneal, justo por encima de los vasos ilíacos y de la cintilla iliopúbica de Thomson. Se explora el conducto inguinal, liberando simultáneamente el cordón espermático y separándolo del saco herniario y del probable lipoma.
- c)
Saco crural: Se identifica, palpa y reduce fácilmente traccionándolo, y si está incarcerado, añadiendo cierta vigorosidad o dilatando el orificio crural entre el saco y el ligamento de Gimbernat u, ocasionalmente, seccionando este con tijera. Una vez extraído y revisado, se lo abandona. Una lesión de la corona mortis por esta vía es hemostasiada con electrocoagulación de forma directa, rápida y segura. La proximidad de la vena ilíaca supone un mínimo riesgo teórico siguiendo la pauta de disección indicada.
Cuando se precisa, se hace una incisión en el saco inguinal o crural transversalmente hasta 8-10cm, lo suficiente para explorar el asa, su posible exéresis y anastomosis. Si hubo contaminación o sepsis local, se realizan lavados con solución fisiológica y, tras el cierre del ojal peritoneal, se continuarán estos en el espacio preperitoneal con 5-10l de solución fisiológica23,24.
Prótesis autoadhesiva Parietene Progrip®Para la reconstrucción se utilizó este tipo de prótesis de estructura reticular, de poro ancho, de 60g/m2 que, al mes de implantada disminuye su densidad a 40 g/m2 por la reabsorción de la capa de ácido poliláctico «erizada» de minianzuelos de 1 mm para su autoadherencia al tejido. Esta prótesis fue concebida y diseñada en su estructura fisicoquímica, morfología, sistemas de microfijación y solapas para el cordón espermático, para ser insertada por la vía IA18. El tamaño habitual utilizado es el de 12×8 o 15×9cm, pero si las dimensiones pélvicas son notables o la pared inguinal posterior está deteriorada, empleamos el de 15×15cm. Su manejo por esta vía es sorprendentemente simple, fácil y muy rápido25,26, tal como se observa en las secuencias de la figura 1.
- a)
El sobre estéril no se abre, sino que se recorta a 1cm del borde protésico. El papel del sobre se desecha y el plástico (lámina transparente del sobre) se superpone a la superficie de minianzuelos para evitar que estos se adhieran al tejido durante la maniobra de colocación.
- b)
La prótesis se sujeta sobre la palma y los dedos de la mano contralateral a la hernia, pinzándola con el pulgar sobre la lámina plástica y quedando esta orientada hacia la pared inguinal posterior, a la que se adherirá.
- c)
Ahora, el ayudante eleva el borde caudal aponeurótico con el separador de Mathieu, y separa con la valva maleable la grasa preperitoneal y el músculo recto en sentido cráneo-medial, abriendo así el «hiato» pararrectal de acceso al espacio preperitoneal por el que, a continuación, se introducirá la prótesis hasta rebasar distalmente unos 3cm por debajo del ligamento de Cooper. Comprobada la posición correcta, se retira el plástico, manteniendo presionada la prótesis contra la pared inguinal posterior.
- d)
En las hernias oblicuas externas el cordón queda parietalizado, y el orificio inguinal profundo cubierto por la prótesis. Si este es amplio, se puede añadir un pequeño tapón o cilindro corto de polipropileno, al que también recubrirá la prótesis sin utilizar las solapas. No suturamos el orificio porque suele ser un tejido debilitado a simple vista y, en nuestra experiencia «histórica», ello supuso más dolor y más recidivas. El orificio directo y el crural quedan siempre cubiertos.
- e)
Se ha de comprobar siempre que el borde inferior protésico rebase el ligamento de Cooper y que la grasa preperitoneal no se introduzca por debajo de él, pues podría despegarla parcialmente (lo que favorece la recidiva).
- f)
La porción proximal de la prótesis sobresale de la herida y se extiende sobre el músculo recto (premuscular-retrofascial), quedando por debajo de ambos bordes aponeuróticos, que no se suturan entre sí sino a la prótesis con monofilamento 3/0 reabsorbible, iniciándola por el ángulo medial de la incisión, continuando luego por el borde superior hasta el ángulo lateral para que quede «colgada» y retornando por el borde inferior aponeurótico, para «fijarla» hasta el punto de inicio, donde acaba la sutura. Ambos bordes o suturas quedan separados unos 2cm, procurando que los puntos no penetren más de 10-15mm desde el borde fascial, para evitar atrapamientos de algún filete nervioso secundario del nervio iliohipogástrico (fig. 2a).
Figura 2.Incisión fascial del músculo recto para el abordaje. Prótesis suturada a los bordes de la misma para finalizar la intervención (2a). Esquema de cómo queda la prótesis extendida desde el ligamento de Cooper hasta la incisión fascial (2b). Visión habitual de cómo la prótesis cubre totalmente toda el «área» de Fruchaud. Se observa el ligamento de Cooper a través de la prótesis (2c).
(0.49MB). - g)
En un corte sagital de la ingle, la prótesis adquiere y mantiene un perfil en S (fig. 2b), extendida por debajo del ligamento de Cooper, desde donde asciende y cubre el «área» de Fruchaud (fig. 2c) hasta su extremo proximal, alojado en la superficie premuscular retrofascial (fig. 2a). La intervención finaliza con el cierre del tejido celular subcutáneo y la piel (intradérmica) con suturas continuas reabsorbibles de 3/0.
Todos los pacientes recibieron la misma pauta analgésica: perfusión continua (con bomba o Dial Flow®) de metamizol 6g, dexketoprofeno 150mg y petidina 25mg, en 500ml de glucosalino (10 a 40ml/h) a demanda subjetiva del paciente. A los 12 alérgicos a pirazolonas/AINE se les administró tramadol (2 ampollas de 100mg) y paracetamol (1g/8h iv). Tras el alta, entre las 12 y 20h, continuarán la analgesia domiciliaria con metamizol 575mg/8h, dexketoprofeno 25mg/8h y paracetamol 500mg/6h durante los 2 primeros días, y a demanda en los posteriores.
Los 200 últimos pacientes anotaron el nivel de dolor o malestar posoperatorio en la hoja de registro (EVA), puntuando el nivel a las 6h, a las 12h tras la deambulación y la tolerancia alimentaria, a las 24h en el domicilio y, diariamente, durante la primera semana. En la visita, al 15.o día, se evaluaron las posibles incidencias clínicas, el consumo diario de analgésicos precisado y la evolución del nivel de dolor o molestias en las 2 primeras semanas. Los siguientes controles fueron al 1.er, 3.er, 6.o y 12.o mes, y el seguimiento posterior, al menos una vez al año, por entrevista personal en consulta, excepcionalmente por teléfono y nunca por carta.
Análisis estadísticoLos parámetros epidemiológicos, clinicoquirúrgicos y evolutivos se registraron en una ficha informatizada a través del programa SPSS Statistics v21.0.0 para Mac OS X, que agilizó la inclusión de datos, la evaluación, la obtención de resultados y el análisis estadístico descriptivo básico para este trabajo. Los datos cualitativos vienen expresados en número y porcentaje; los cuantitativos, por la media aritmética, desviación típica y límites mínimo y máximo de la amplitud de datos, y la mediana, para expresar el centro de la distribución del tiempo (en meses) en el control del seguimiento.
ResultadosDe 2009 a 2012 fueron intervenidos consecutivamente 331 pacientes y realizadas 355 reparaciones herniarias. La edad media del grupo fue de 44 años, con límites entre 14 y 87 años. En esta serie (tabla 1) hubo una mayoría de varones (289, un 87%) y un predominio de hernias del lado izquierdo (178, un 58%); en 24 casos de la serie (7%) eran bilaterales. El tiempo promedio de evolución clínica fue de 31 meses (de un mes a 34 años). Las inguinales primarias fueron las más frecuentes (316, un 89%), frente a las recidivas (39, un 11%). Semejante proporcionalidad apareció entre hernias programadas y urgentes (en 332 y 23 casos; el 93.5% y 6.5%, respectivamente) o entre hernias inguinales (346, el 97.4%) y crurales (9, el 3.6%), una de ellas con resección intestinal segmentaria por estrangulación. Seguimos la clasificación de Nyhus, y los tipos más frecuentes fueron el IIIA y IIIB, con 242 reparaciones (68%), y el menos frecuente, el tipo i (7 casos, un 1.9%), todos sintomáticos (3 deportistas profesionales y 4 trabajadores con sobreesfuerzos laborales). En el transcurso de las intervenciones se hallaron 25 hernias mixtas (7%).
Datos demográficos y tipos anatomoclínicos de hernias
| Núm. de pacientes | 331 |
| Núm. de reparaciones | 355 |
| Edad media y límites | 44.1±7.7 (14-87) |
| Hombres | 289 (87%) |
| Mujeres | 42 (13%) |
| Lateralidad (izquierda/derecha) | 178/129 (1.3:1) |
| Bilaterales | 24 (7%) |
| Tiempo de evolución clínica (meses) | 31±14 (un mes-34 años) |
| Hernias primarias | 316 (89%) |
| Hernias recidivadas | 39 (11%) |
| Reparaciones programadas | 332 (93.5%) |
| Inguinales | 328 |
| Crurales | 4 |
| Reparaciones urgentes | 23 (6.5%) |
| Inguinales | 18 |
| Crurales | 5 (una resección intestinal) |
| Nyhus I | 7 (1.9%) |
| Nyhus II | 58 (16.3%) |
| Nyhus IIIA | 123 (34.6%) |
| Nyhus IIIB | 119 (33.5%) |
| Nyhus IIIC | 9 (2.5%) |
| Nyhus IV | 39 (10.9%) |
| Mixtas (oblicuas externas+directas) | 23 |
| Mixtas (directas+crurales) | 2 |
La comorbilidad asociada o relacionada con la «aparición» de la hernia se observa en la tabla 2. Entre los factores más frecuentes encontramos estreñimiento (207, el 62%), consumo de más de 10 cigarrillos al día (198, el 59%) y enfermedad arterial hipertensiva (33, el 40%). Eran diabéticos 89 (26%) y sufrían prostatismo 62 (18.7%). De ellos, 87 (26%) estaban operados de la hernia contralateral y 53 (16%), apendicectomizados. El IMC medio fue de 25.1kg/m2 (16-44kg/m2), superando los 35kg/m2 23 pacientes obesos mórbidos (28.4%) (tabla 3). El nivel de riesgo ASA fue i+ii en 299 (90.3%) y del iii+iv en 32 (9.6%). La mayoría fueron anestesiados con epidural. En 11 pacientes (3.3%) se practicó la anestesia local y mascarilla laríngea para cirugía ambulatoria con alta en unas 6h, y en 17 (5.1%) se realizó anestesia general, por tratarse de hernias complejas, urgencias con mayor riesgo o por decisión del propio paciente. A todos se les administró monodosis de amoxicilina-clavulánico 2g/iv como profilaxis antimicrobiana, salvo en estrangulaciones reversibles o en la resección intestinal, cuya profilaxis se les prolongó de 24 a 48h. A los 19 alérgicos a penicilinas se les administró una monodosis de ciprofloxacino. La profilaxis antitrombótica se empleó en 81 pacientes (24.5%); 31 de ellos estaban previamente anticoagulados o antiagregados. A todos se les administró heparina de bajo peso molecular a criterio de hematología.
Patología medicoquirúrgica asociada
| Estreñimiento | 207 (62.5%) |
| Tabaquismo | 198 (59.8%) |
| HTA | 133 (40.1%) |
| Sobrepeso/obesidad | 94 (28.4%) |
| Diabetes | 89 (26.8%) |
| Prostatismo | 62 (18.7%) |
| Alergia respiratoria | 51 (15.4%) |
| EPOC | 38 (11.4%) |
| Corticoides | 31 (9.3%) |
| Miocardiopatía dilatada | 26 (7.8%) |
| Fibrilación auricular | 23 (6.9%) |
| Enfermedad coronaria | 19 (5.7%) |
| Valvulopatía/prótesis | 11 (3.3%) |
| Neoplasia | 9 (2.7%) |
| Cirrosis | 6 (1.8%) |
| Insuficiencia renal crónica | 2 (0.6%) |
| Hernioplastia heterolateral | 87 (26.2%) |
| Apendicectomía | 53 (16.0%) |
| Recidiva herniaria | 39 (11.8%) |
| Eventración infraumbilical | 16 (4.8%) |
| Prostatectomía hipogástrica previa | 13 (3.9%) |
EPOC: enfermedad pulmonar obstructiva crónica; HTA: hipertensión arterial.
Índice de masa corporal, riesgo ASA y tiempos operatorios
| <27kg/m2 | 237 (71.6%) |
| 27-25kg/m2 | 71 (21.4%) |
| >35kg/m2 | 23 (7%) |
| Sobrepeso (>27kg/m2) | 94 (28.4) |
| ASA I | 226 (68.2%) |
| ASA II | 73 (22%) |
| ASA III | 29 (8.7%) |
| ASA IV | 3 (0.9%) |
| ASA I+II | 299 (90.3%) |
| ASA II+III+IV | 105 (31.7%) |
| ASA III+IV | 32 (9.6%) |
| Hernias indirectas (H/M), n=138a | 15±3/11±2min |
| Hernias directas (H/M), n=57 | 11±3/9±1min |
| Hernias crurales (H/M), n=5bTiempo medio (n=200) | /8±2min13.7±3.3min (4-93min) |
ASA: Sociedad Americana de Anestesiólogos; H/M: hombre/mujer; IMC: índice de masa corporal.
La duración media de la operación (diéresis/síntesis) se contabilizó en los últimos 200 pacientes de esta serie. Fue de 13.7±3.3min (4-93min) y resultó más corta en las mujeres (anecdóticamente, 4min en una de ellas) que en los hombres, como también lo fueron las hernias directas respecto de las oblicuas externas en ambos sexos. No hubo ninguna exclusión de pacientes en este estudio.
La estancia fue menor de 24h en 307 pacientes (92.7%), y el intervalo mayoritario estuvo entre las 12 y las 20h, con una media global de 15±3h, sin contabilizar la más prolongada, y única, de 8días, por parte de la paciente con resección intestinal. A todos se les programó una habitual dinámica corporal posoperatoria: en las primeras 48h, andar y subir escaleras; a partir del 5.o día, la conducción del vehículo. Si el trabajo exigía cargas, movimientos repetitivos de cierta intensidad o si eran deportistas, previa revisión personal iniciaban, progresivamente, sus actividades a partir del primer mes. El tiempo para la reincorporación laboral no ha sido contabilizable porque grupos como empresarios o autónomos en general iniciaron su actividad en la primera o segunda semana, mientras que los trabajadores por cuenta ajena, salvo excepciones, prolongaron la baja de 3 a 6 semanas; incluso algunos, mucho más, por razones «ajenas» a la cirugía.
Tampoco se realizó un estudio de costes con esta prótesis, cuyo precio fue de 140€, superior al valor promedio de las prótesis de polipropileno simples, que precisan otros medios para su fijación, pero inferior al de otras con similares dimensiones, y que también los precisan para inmovilizarlas.
En la tabla 4 se indican las complicaciones precoces surgidas. La única durante la estancia (en las primeras 12h) fue la retención urinaria en 7 pacientes (2%), resuelta con un único sondaje (6 eran mayores de 60 años y el otro tenía 37 años, sin antecedentes de patología vesicoprostática). El resto de las complicaciones aparecieron durante la primera semana, y fueron registradas en la primera revisión clínica a la 2.a semana: 21 seromas, no drenados y resueltos a lo largo del 1.er mes. Los 6 hematomas inguinoescrotales se desarrollaron en hernias voluminosas, complejas (2 deslizadas) y en un operado por recidiva de vía anterior: casi todos desaparecieron durante el primer mes, sin orquitis pero con infiltración e induración del trayecto inguinoescrotal del cordón. Todos los hematomas «extensos» aparecieron en pacientes con sobrepeso, anticoagulados y preventivamente tratados con heparina de bajo peso molecular. El hematoma inguinolumbar fue de extensión desproporcionada (el paciente también era obeso y estaba anticoagulado), aunque no precisó drenaje ni tuvo repercusión hemodinámica, pero sí clínica, por extensión al área púbica, escrotal y prepucial, lo que le dificultó la micción durante 2 semanas. La única infección registrada fue de herida superficial secundaria a un seroma drenado ambulatoriamente por «supuesta» infección; le mechaban la herida cada 48h y le apareció de novo un exudado purulento, motivo de la consulta, en cuyo cultivo y antibiograma se identificó Staphilococcus hominis sensible, entre otros, a ciprofloxacino, que le fue administrado durante una semana, además de la limpieza diaria de la herida con una solución antiséptica, y se le resuturó al 16.o día, continuando asintomático al 2.o año.
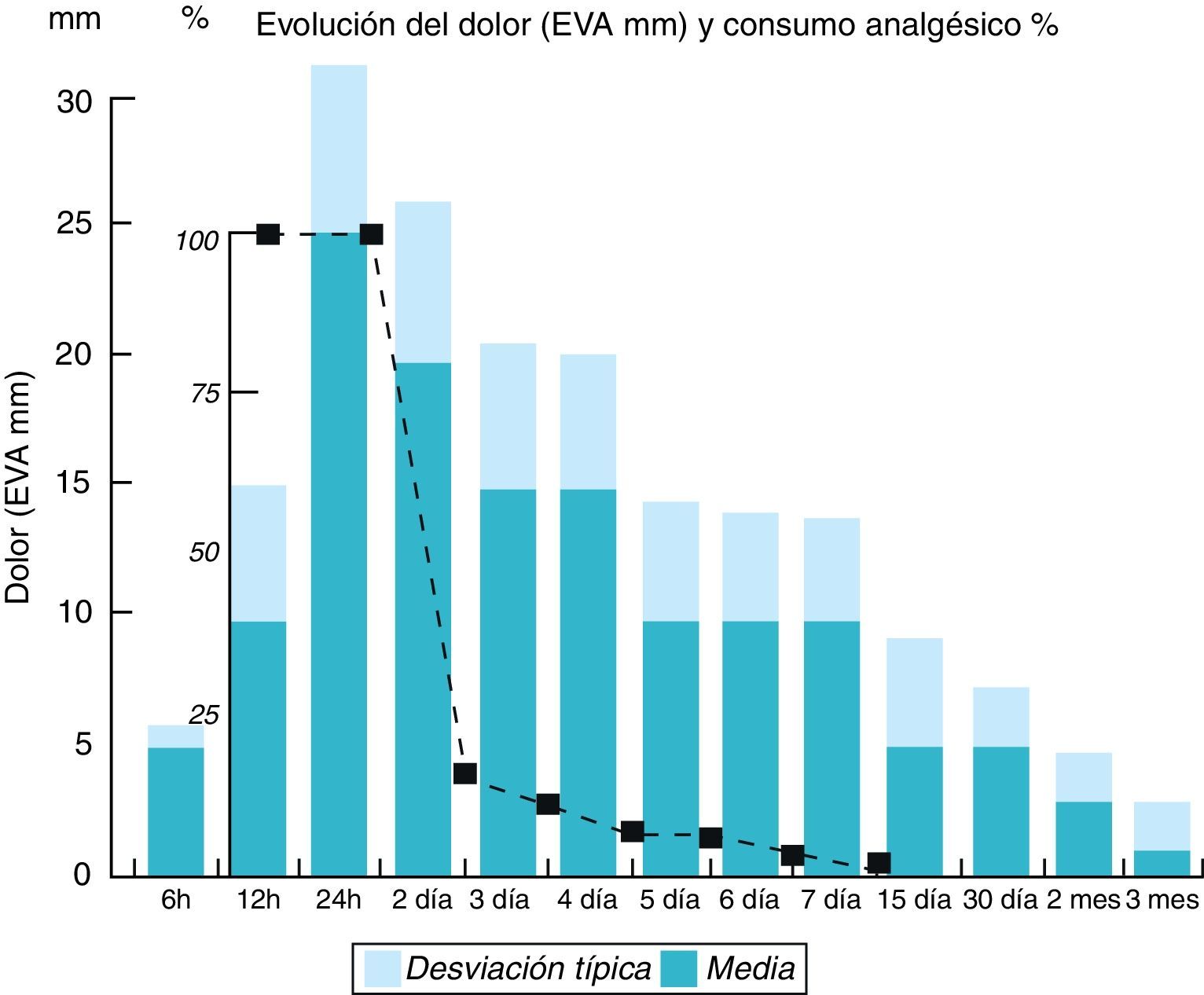
El dolor inguinal posoperatorio fue evaluado en los últimos 200 pacientes operados, cuyo nivel promedio durante los primeros 3 días fue de 19.7±4.4mm, y en la primera semana, de 16.6±4.1mm (3-40mm). Durante las 12 primeras horas de posoperatorio (fig. 3), la inmensa mayoría de los pacientes no presentaron dolor, debido a la perfusión permanente de la analgesia iv; solo expresaron molestias o sensación de «tensión» en la herida en el momento de levantarse o al acostarse. En su domicilio continuaron ese primer y segundo día con la triple analgesia oral, y a partir de entonces, a demanda del nivel de molestias. Entre el 2.o y el 4.o día disminuyó la percepción de dolor y molestias y, paralelamente, el número de analgésicos consumidos (media de 12±4 comprimidos hasta el 3.er día), y solo algún caso sobrepasó, excepcionalmente, los 7 días de analgesia frente a 52 pacientes (26%) que no precisaron analgésico alguno en su domicilio. También se observó que el dolor inguinal registrado en los pacientes operados de urgencia fue similar al de los programados.
En 46 pacientes (14%) aparecieron náuseas sin vómito en las primeras horas, que cedieron con octeótrido (iv), lo que permitió la tolerancia de la dieta semiblanda en las siguientes 6h. No hubo fiebre ni sangrado de herida, así como tampoco ningún reingreso ni asistencia posoperatoria en urgencias, aunque sí consultaron por teléfono 6 pacientes, vistos después en consulta: 2 por hematoma escrotal, otro por «hinchazón» de herida (seroma o serohematoma local) y otros 2 por la aparición de un rahs cutáneo relacionado, a posteriori, con un probable efecto secundario de la analgesia.
El control evolutivo fue de 46 meses, con una mediana de 28 meses y rango de 40 meses. Un paciente de 89 años falleció al 27.o mes por una supuesta cardiopatía, sin recidiva. Superaron el 3.er año del posoperatorio 288 pacientes (87%), y 315 (95.1%) fueron revisados por entrevista personal. No fueron localizados en la última revisión 15 pacientes, todos revisados al menos en 4 ocasiones entre los 17 y 29 meses tras la operación, sin recidivas ni secuelas. En los revisados (tabla 5) no se ha detectado ningún DICP (más de 3 meses), ni siquiera inguinodinias persistentes; solo insistiendo en el interrogatorio 96 pacientes (30%) notaban la herida, pero sin molestias; algunos, una leve tirantez durante hiperextensiones del tronco y, con cierta frecuencia, una banal hipoestesia cutánea un par de centímetros en el labio inferior de la cicatriz. No hubo hidrocele, orquitis, atrofia o molestia testicular subjetiva ni objetiva en la exploración física, salvo en un paciente de carácter muy «sensible» con una reparación bilateral que mantuvo orquialgias durante el coito o tras largas caminatas, durante el 1.er mes. Tampoco hubo molestias coitales (salvo el caso citado) o diseyaculatorias, tras preguntarlo a 112 pacientes (34%) con actividad sexual normal. La recidiva herniaria registrada se produjo al 2.o mes en un paciente de 61 años (178cm, 93kg; IMC=29) operado de una hernia oblicua externa tipo Nyhus IIIB, reparada con una prótesis de 12×8cm y reoperada por la misma vía PPA, en el que se encontró el lipoma preperitoneal abandonado de nuevo en el conducto inguinal por una deficiente cobertura protésica al orificio inguinal profundo. Se resolvió con la extirpación y un tapón Pro Loop «M» Atrium® en el citado orificio, sin malla; actualmente, al 31.er mes de posoperatorio, sigue asintomático.
Morbilidad posoperatoria tardía
| Dolor crónico>3 meses | 0 |
| Orquitis/atrofia/dolor testicular* | 1 |
| Hidrocele | 0 |
| Diseyaculación | 0 |
| Infección/rechazo de malla | 0 |
| Recidiva | 1 (0.3%) |
El tratamiento de las hernias de la ingle es, sin duda, un capítulo inacabado, pues pocos en cirugía han acaparado tal variedad de técnicas sin que, hasta hoy, se haya consensuado qué opción resolvería todos los tipos de hernia con la mayor eficiencia y efectividad. De acuerdo con Nyhus27, «el último capítulo en la historia de la anatomía de la ingle y en la reparación de los defectos todavía no se ha escrito». Con este trabajo pretendemos aportar nuestra modificación personal a la técnica de Nyhus23–25 junto con una inédita, pionera e innovadora forma de reconstrucción por esta vía: con la prótesis autoadhesiva Parietene Progrip® de Covidien. La técnica de Nyhus es bastante conocida y admitida conceptualmente, pero ha sido insuficientemente enseñada, empleada y divulgada si la comparamos con algunas técnicas de la vía IA1,28. En el estudio hemos mantenido los mismos fundamentos manejados desde 1986: prospectivo de casos consecutivos con amplios criterios de inclusión y escasos de exclusión, aplicándola a todos los tipos de hernias, argumento diferente al más selectivo en muchas publicaciones29–32. Por las peculiaridades de nuestro procedimiento y por el escaso parecido con los demás abordajes preperitoneales abiertos33–35, no podemos establecer comparaciones metodológicamente rigurosas con estos o con los demás abordajes, salvo en aquellos parámetros análogos, concordantes o discordantes, de los nuestros. Aún así, la extensa difusión de algunas opciones de la vía IA1,14,17, apoyadas por alguna injustificada, desafortunada y engañosa opinión36 para los desconocedores o interesados en el espacio preperitoneal y sus abordajes posteriores (como que «requiere la innecesaria disección de este espacio altamente complejo que puede inducir a lesiones de estructuras pélvicas como grandes vasos sanguíneos, instestino y la vejiga»), desvirtúa la realidad, e incluso la continúa al resaltar en el apartado «open preperitoneal repair»36 las inguinodinias producidas por la técnica de Kugel, eludiendo al DICP, mayoritario por la vía IA, concretamente con «su» técnica, y lejos de «su» 1%14,36–38. Por cierto, en casi todas esas y otras publicaciones se usa incorrectamente el epónimo «Lichtenstein»5,6,9 y el término «sin tensión», publicados muchos años antes6,7,9.
El abordaje PPA fue iniciado por Annandale39 en 1873, con lo que se adelantó 14 años a la «revolucionaria» publicación de Bassini8 en 1887 por la vía IA. Sin embargo, con la prótesis sintética ocurrió lo contrario: las primeras fueron implantadas en la vía IA por Acquaviva en 1944 (año de la 1.a operación) y 1948 (año de la publicación), Zagdoun5 y Usher6 (1959) y, tras un retraso de 16 años, las inició Nyhus10 por la vía PPA de forma selectiva pero más con la certidumbre de la maestría y el arte de la herniorrafia que por la «nueva» moda protésica40. Desde entonces, se acepta que el espacio preperitoneal es el sitio donde la prótesis se muestra más efectiva por aprovechar el efecto presivo favorable (principio de Pascal40–45), más protector de la recidiva y donde reduce o evita la tensión, con lo que se mejora la confortabilidad posoperatoria.
En la última década se ha producido un cambio en la ponderación clínica de algunas complicaciones tras la reparación herniaria. Así, la recidiva ha sido desplazada por el DICP. Independientemente del tipo de abordaje y de la técnica empleada, al dolor se le relaciona con la tensión en la sutura (si es que existe) y se le asocia con la edad, el IMC, el hematoma, el tipo de sutura, la prótesis de alta densidad y con los medios de fijación utilizados (puntos, grapas de acero, helicoidales de titanio, reabsorbibles, etc.15,46,47). La notable prevalencia del DICP, en ocasiones excesiva con hasta el 63% en un metaanálisis, o el 18% en más de 1 300 pacientes revisados a largo plazo tras reparaciones por la vía IA16,37, ha propiciado el estudio y empleo de otros medios de fijación como son los pegamentos biológicos17, los acrílicos polimerizados16 y, más reciente, las prótesis intrínsecamente autoadhesivas Parietene Progrip® de Covidien18,30–32, diseñadas exclusivamente para la vía IA aunque, poco más tarde, tras estudios experimentales por vía laparoscópica48, se inició su empleo por la vía TEP49 y la TAPP50. Sin embargo, y curiosamente, no hay ninguna referencia bibliográfica sobre la utilización de esta prótesis por la vía PPA, iniciada por nuestro grupo y con nuestra técnica original e innovadora desde febrero de 2009.
En las variables demográficas señaladas en las tablas 1–3 destaca que más de la cuarta parte de los pacientes (28.4%) tenían un IMC superior a 27kg/m2 y que 23 de ellos (7%) eran obesos mórbidos, porcentaje que duplica al citado por algunos51. El resto de las comorbilidades fue semejante al de otras publicaciones. También se incluyó a 32 pacientes (10%) ASA III y IV, y a 13 pacientes (3.9%) prostatectomizados por vía hipogástrica, cuyos abordajes no fueron ni peligrosos ni contraindicados36, pues incluso se reparan por vía TEP52. Y, a la inversa, otros53 realizan la prostatectomía radical por vía hipogástrica en pacientes operados de hernia inguinal por laparoscopia; críticas que traducen el desconocimiento o la inexperiencia tecnicoquirúrgica en el espacio retroinguinal.
La anestesia espinal fue la que más empleamos; incluso otros54 la aplican selectivamente en hernias complejas y de alto riesgo, reparadas con las técnicas de Nyhus o de Stoppa, con buenos resultados. Nosotros utilizamos la anestesia general solo en casos complejos, algunas urgencias o por elección del paciente, mientras que para otros es norma32. La estancia media fue de 15±3h (10-20h), similar a la de otras publicaciones con pacientes seleccionados29,55, aunque algunos, con el abordaje PPA56,57, tienen estancias medias superiores a 2 y 3 días.
En cuanto a nuestra modificación técnica, respecto a la original de Nyhus, esta supone:
- 1)
Una herida cutánea más baja, de menor longitud, más estética y menos molesta.
- 2)
Incisión solo de la hoja anterior del músculo recto, para evitar lesiones de ramas nerviosas durante la apertura o el cierre musculoaponeurótico, o la posibilidad de una eventración a ese nivel2 y que permita un acceso al espacio preperitoneal a través del «hiato» resultante al abrir longitudinalmente la fascia transversalis hasta el pubis.
- 3)
La prótesis, Parietene Progrip®, se coloca y se adhiere a la pared posterior de la ingle en cuestión de segundos, parietalizando al cordón espermático. Su extremo proximal es suturado a los bordes de la incisión (fig. 2a), anulando la tensión aponeurótica que otros55 en circunstancias técnicas parecidas no hacen y que, en nuestra opinión, originó tensión y dolor en sus pacientes durante las 2 primeras semanas, desaprovechando el efecto relajador de la incisión fascial, análoga a la de Lampe58. También se evitan atrapamientos nerviosos y la improbable hernia intersticial, o eventración, a través de ese «hiato», pues queda protegido por las cuatro quintas partes del músculo recto y por la prótesis, lo que nos ofrece más sencillez y seguridad frente a otros abordajes posteriores2,41.
- 4)
El tiempo operatorio con nuestra técnica (diéresis-síntesis) es de 15min de media (4-93min), notablemente menor que los 40min (30-70min) consumidos por la técnica de Nyhus59, los 32min por la vía IA con la Parietex Progrip® en la técnica «Lichtenstein»60 o los 22min (14-37min) con las técnicas minimalistas de Ugahary o de Kugel61.
- 5)
Una vez colocada, la prótesis mantiene un perfil en S extendida, cubriendo el «área» de Fruchaud, el «hiato» del acceso preperitoneal y la incisión fascial de descarga del músculo recto, sin puntos musculofasciales transfixivos2,41, y que se beneficia de su disposición mixta, posterior y anterior (fig. 2a,b,c).
No podemos concluir cuánto dolor reduce esta prótesis, porque no se ha comparado con otra serie propia o ajena. Hay pocos estudios que la utilicen por la vía TEP49 o por la TAPP50, pero ya son numerosos los que la emplean por la vía IA30–32,48. Subrayamos que el dolor posoperatorio precoz en nuestra serie es, por lo general, bajo desde las primeras 24h, como se observa en la curva EVA (fig. 3), similar al mostrado durante el primer día, incluso durante la primera semana, en las reparaciones con esta prótesis por la vía IA28–30,62–64, o en la técnica de Kugel, aunque en esta el consumo de analgésicos fue más prolongado y elevado61,64,65. También es similar al registrado en la vía TEP66 y en la TAPP67, pero sin alcanzar la baja cota que produce la vía TEP por puerto único: 26mm (0-40) al alta y de 1.3mm (1-10) al 15.o día68, justificable por la escasa disección que, en contrapartida, exige una gran experiencia. Pensamos que el bajo nivel de dolor posoperatorio precoz en nuestra serie está relacionado con el abordaje PPA, con la prótesis autoadhesiva Parietene Progrip® y con la analgesia protocolizada hasta las primeras 48h domiciliarias.
La morbilidad posoperatoria precoz de nuestra serie es similar a la de otros abordajes PPA, endolaparoscópicos o IA30–32,36,38,43,47, y el seroma y el hematoma son los más frecuentes, aunque con una trascendencia clínica casi nula. No hubo ninguna complicación intraoperatoria grave ni relevante, salvo algún pequeño sangrado puntual controlado que contrasta con las pérdidas de sangre intraoperatorias referidas por otros55, «aunque no suele exceder de 100ml». No se produjo ninguna infección primaria de herida ni de prótesis (ni siquiera en las hernias estranguladas, como ocurrió en otras series69,70), pero sí hubo una infección secundaria de herida superficial tras curas ambulatorias de un seroma, mal interpretado como «infección». En síntesis, la morbilidad posoperatoria del abordaje preperitoneal en general, y del nuestro en particular, es notablemente baja, como señalan otros71 tras el estudio de los factores de riesgo de complicaciones posoperatorias durante el primer mes, en más de 150 000 hernias del Registro Nacional de Suecia, tomando como referencia la vía IA con prótesis: la odds ratio fue de 1.35 para las vías TAPP, y de 1.31 para las reparadas por la vía PPA, proporción equiparable al resto de las técnicas analizadas.
La prevalencia y repercusión clínica del DICP ha superado desde hace algunos años a la recidiva herniaria y es motivo de frecuentes debates. En nuestra serie, ningún paciente tuvo dolor calificable como DICP, aunque para algunos72, en el 7.2% de sus reparaciones es calificado como «no inhabilitante para su trabajo habitual», mientras que para otros12,13 esta secuela, en operados por la vía IA, alcanza porcentajes demasiado altos y poco habituales37; incluso tras registros a través de encuesta postal o telefónica73 al 6.o mes de ser operados por la misma vía IA, lo perciben el 12.7% aunque lo constatan solo el 1.9% de encuestados. En un metaanálisis74 entre la vía IA, la TEP y la TAPP, la presencia del DICP es algo superior, entre el 4% y el 16%. Incluso en una serie no aleatorizada de hernias inguinales en mujeres, tratadas con abordaje TEP frente a la vía IA con prótesis75, encuentran a los 2 años que el dolor persiste con intensidad de moderada a severa en el 6.5% y el 21.7% respectivamente. Como resultado de esta secuela emergente aumentan las publicaciones que apoyan el tratamiento intensivo del DICP mediante la neurectomía quirúrgica de necesidad: hasta 43 pacientes en 5 años contabilizan los autores76. Sin embargo, en la vía IA76,77, una mayoría realiza disecciones y suturas protésicas previa identificación y respeto de los 3 nervios, aunque algunos78,79 optan por disecarlos y seccionarlos «preventivamente» para evitar tan problemática secuela.
Otra de las secuelas emergentes es la disfunción en el área sexual (dolor coital, disfunción eyaculatoria, etc.). En nuestra serie se preguntó a 112 pacientes, pero ninguno tuvo percepción de ello (complicaciones que la bibliografía relata, mayoritariamente, después de las reparaciones inguinales por la IA77). En una serie encuestada73 aparece en el 8.9% de los operados por la vía IA, mientras que en el abordaje PPA es infrecuente por la ventaja de la disección inguinal «por detrás», pues ni se ven ni se manipulan nervios que podrían generar tales disfunciones sexuales. No obstante, aún no está aclarada la génesis de esta secuela, ya que algunos80 demuestran que la hernioplastia protésica por vía IA mejora la perfusión sanguínea al testículo y mejora también la función sexual; lo mismo ocurre por la vía PPA con la técnica de Stoppa y la TEP en hernias bilaterales, donde la prótesis cubre ampliamente la pared posterior y los vasos ilíacos, sin alterarles la velocidad del flujo sanguíneo81, como también ocurre tras las reparaciones protésicas por la vía IA82.
Entre los abordajes PPA hay una clara tendencia por la técnica de Nyhus para tratar las hernias primarias y recidivadas, por los buenos resultados: 2.1% de recidivas posherniorrafia, y 1.2-1% tras hernioplastia10,33–35,83. Cuando la recidiva de vía anterior es tratada con las técnicas de Wantz o de Stoppa, la re-recidiva es del 1%45, bastante inferior a la señalada por Rutkow84 (4% tras reoperar por segunda vez y 13% después de la tercera reparación). Por otra parte, Kugel35 y Ugahary34 también registran el 1% o menos de recidivas, pero otros no alcanzan esos porcentajes, pues con la primera85 tienen el 7.7% de recidivas y el 27.7% después de re-reoperarlas; y con la segunda86, el 6.5% de recidivas al 2.o año. Esto contrasta con otros autores54 que, operando hernias solo de alto riesgo (unilaterales con la técnica de Nyhus y bilaterales con la de Stoppa) señalan el 0.8% de recidivas. En nuestro estudio, sin selección de pacientes ni de hernias, solo hubo una recidiva (0.3%), tras un tipo Nyhus IIIB con IMC de 29kg/m2, reparada por la misma vía preperitoneal, detectando que el orificio inguinal profundo estaba mal cubierto por la prótesis; porcentaje de recidivas que otros56 consiguen (0.57%) con la técnica de Nyhus adaptándole una prótesis recortada en M.
Por lo expuesto, es evidente que el abordaje PPA con prótesis es una opción adecuada para tratar cualquier hernia primaria, pero aún lo es más para cualquier hernia recidivada o multirrecidivada frente a las re-reoperaciones por la vía IA42 en las que, casi todas, llevan una prótesis laminar o un tapón y prótesis laminar que, en ocasiones, distorsionan seriamente la anatomía inguinal, argumento por el que Rutkow84 apoya la vía PPA para estos casos, aunque también son opciones válidas la TAPP, y sobre todo la TEP, solo para cirujanos expertos, pues cuanto más complicada es la hernia mayor es la complejidad técnica de estos abordajes87; la vía anterior transinguinal preperitoneal de Rives88 es un escape idóneo para los inexpertos en abordajes posteriores.
La bibliografía sobre la PPA con prótesis es clara al respecto. Es un abordaje que ofrece ventajas, como demuestra el estudio aleatorizado entre vía anterior y posterior44, donde el porcentaje de re-recidiva fue similar pero con notables diferencias significativas por la menor morbilidad (17.6% frente al 3%, respectivamente, explicable por las mejores condiciones anatomoquirúrgicas2,89,90). En otro estudio aleatorizado91 entre la vía IA frente a la vía PPA hallan una mayor efectividad de la segunda en cuanto a recidiva (6.2% frente a 3.3% respectivamente), aunque en otro no aleatorizado entre el Nyhus clásico frente a la vía TEP57, o frente a otras técnicas92, no encuentran diferencias estadísticamente significativas en las recidivas en ambos grupos (1.8% frente a 1.3% respectivamente), pero sí, y paradójicamente, tienen una estancia media de 1.2 días en la vía TEP, con anestesia general, frente a los casi 4 días de media en la técnica de Nyhus, estancia muy alejada de nuestras 15h de media. En otro estudio comparativo entre la técnica de Nyhus y la vía TAPP93 señalan que no hubo ninguna recidiva en ambos grupos, pero sí más DICP en la primera (7.4%) que en la segunda (4.4%), sin diferencia estadísticamente significativa. En el Registro Nacional de Suecia94, en más de 174 000 hernias operadas y sobre unas 19 000 reoperadas, analizaron (retrospectivamente) 5 565 recidivas y, tomando como referencia la reparación endoscópica, observan una odds ratio de 2.55 para la herniorrafia simple, 2.31 para las técnicas de reparación con tapón, 1.53 después de la técnica de Lichtenstein y 1.36 para la vía PPA con prótesis, con lo que concluyen que el menor riesgo de recidiva lo consiguen la vía laparoscópica y la vía PPA. Cuando aleatorizan hernias crurales unilaterales95 por vía IA con tapón y malla frente a vía PPA con malla, encuentran el 10 y el 0% de recidivas, respectivamente. Y, por último, un interesante estudio96 demuestra que la herniorrafia clásica de Nyhus sin prótesis en 94 hernias crurales es una excelente opción, pues el 50% comenzó con obstrucción intestinal y 40 de ellos acabaron con una resección intestinal, sin mortalidad ni recidiva.
Aunque en nuestra serie solo hubo una recidiva, en la global acumulamos una veintena de recidivas reoperadas por la misma vía PPA, pues las prótesis utilizadas están ajustadas al «área» de Fruchaud y permiten el reabordaje por la misma vía, situación distinta cuando la recidiva es de otros abordajes preperitoneales abiertos o no, por la extensa disección subyacente y la amplia cobertura protésica, con frecuencia, hasta el espacio retropúbico de Retzius97, que desaconsejarían la misma vía.
Como conclusión, nuestra técnica (una modificación notable, simplificada, menos lesiva y bastante más rápida que la popularizada por Nyhus) estaría para nosotros en el fiel de la balanza entre los abordajes preperitoneales abiertos (por un lado, las minimalistas técnicas de Ugahary y Kugel y, por otro, las maximalistas técnicas de Wantz y Stoppa), beneficiándose de las virtudes de todas ellas: desde la limitada disección y colocación de la prótesis bajo visión directa respecto de las primeras, hasta unos resultados, al menos equiparables, o mejores, con menor morbilidad18–20,22–25, respecto de las segundas, con menos del 1% de recidivas y ausencia de DICP que, junto a su versatilidad y polivalencia, sin selección de pacientes ni de hernias durante 26 años nos justifica su empleo como «técnica única» y, más aún, tras la notable sencillez, rapidez y efectividad aportada por la prótesis autoadhesiva Parietene Progrip® de Covidien, empleada en los últimos 4 años.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
Parte de este trabajo fue presentado como comunicación oral titulada Prótesis autoadhesiva en la técnica de Nyhus modificada: análisis de 355 reparaciones consecutivas en el XII Congreso Nacional de Cirugía de la Pared Abdominal, AEC, celebrado en el hotel Avenida Palace de Barcelona entre el 22-24 de mayo de 2013.