Se realizó la colecta de hongos (rdas.) en troncos caídos con diferentes estados de descomposición en un bosque subandino (la reserva natural La Montaña del Ocaso) y se evaluó su actividad ligninolítica. Se cultivaron en Agar extracto de malta y se realizaron pruebas semicuantitativas de actividad lacasa utilizando como inductor enzimático el ácido 2,2’azino-bis-[3-etilbenzotiazolin-6-sulfónico] y el 2,6-diclorofenolindofenol para la celobiosa deshidrogenasa (CDH). Se seleccionaron los hongos con mayor actividad enzimática de troncos con diferente grado de descomposición: Cookeina sulcipes (de estado 1), un hongo de la familia Corticiaceae (de estado 2), Xylaria polymorpha (de estado 3) y Earliella sp. (de estado 4). La fermentación se realizó a 28°C durante 11 días, a 150r.p.m., con mediciones diarias para biomasa, glucosa, actividad lacasa, actividad CDH y proteínas. Los hongos de los troncos con estados de descomposición 1 a 3 presentaron mayor actividad lacasa, a medida que aumentaba el estado de descomposición. Hubo un aumento en la actividad CDH a medida que se incrementó el estado de descomposición de los troncos. Hubo una relación positiva entre la producción de las 2 enzimas. Earliella sp. fue el hongo con mayor producción de biomasa (1.140,19g/l), actividad lacasa (157Ul−1) y CDH (43,50Ul−1). Este trabajo es el primer reporte de actividad lacasa y CDH en C. sulcipes y Earliella sp. Además, sienta las bases para la utilización de estos hongos nativos en aplicaciones biotecnológicas y se adentra en el conocimiento de su función dentro del proceso de descomposición de la madera en bosques.
White rot fungi (Ascomycota and Basidiomycota) were collected on fallen trunks with different decay stages, in a subandean forest (La Montaña del Ocaso nature reserve), and it was evaluated their ligninolitic activity. They were cultured on malt extract agar. Then it was performed semiquantitative tests for laccase and cellobiose dehydrogenase (CDH) activity using ABTS and DCPIP as enzymatic inducers. Based on the results of these tests, the fungi with higher activities from trunks with different decay stages were selected: Cookeina sulcipes (for stage 1), a fungus from the family Corticiaceae (for stage 2), Xylaria polymorpha (for stage 3) and Earliella sp. (for stage 4). A fermentation was performed at 28°C, during 11 days, in a rotatory shaker at 150rpm. Biomass, glucose, proteins and enzyme activities measurements were performed daily. The fungi that were in the trunks with decay states from 1 to 3, showed higher laccase activity as the state of decay increased. A higher DCH activity was also associated with a higher. Also, there was a positive relationship between both enzymes' activities. Erliella was the fungus which presented the highest biomass production (1140,19g/l), laccase activity (157UL−1) and CDH activity (43,50UL−1). This work is the first report of laccase and CDH activity for Cookeina sulcipes and Earliella sp. Moreover, it gives basis for the use of these native fungi in biotechnological applications and the acknowledgment of their function in the wood decay process in native forest.
Los hongos de la pudrición blanca, tanto Ascomycota como Basidiomycota, desempeñan un papel importante en los bosques por ser los únicos organismos capaces de descomponer los componentes de la madera hasta su total mineralización4, lo que llega finalmente a la formación de capas de humus en el suelo. El proceso de descomposición de la madera que desarrollan los hongos es complejo y responde a aspectos fisicoquímicos y bioquímicos. El hongo, al establecerse en la madera, desarrolla hifas de 1 a 2μm de diámetro, coloniza rápidamente las paredes y lúmenes celulares y produce una transformación bioquímica con proyección física21. Esto causa un menor porcentaje de lignina en el tronco, una lignina que se modifica cualitativamente y una madera más porosa42.
La actividad enzimática de los hongos descomponedores de madera es de gran importancia, tanto en lo ecológico como en lo industrial, ya que su complejo enzimático especializado de peroxidasas, lacasas y celulasas, como la celobiosa deshidrogenasa (CDH), participa dentro del ciclo del carbono11. Por otra parte, pueden causar grandes perjuicios a nivel económico en la industria maderera, ya que al alterar los componentes celulares cambian las propiedades físicas y químicas de la madera42. Debido a su inespecificidad, la actividad enzimática de los hongos de la pudrición blanca presenta una gran variedad de aplicaciones biotecnológicas en la industria del papel, de textiles y tintes, de alimentos y en procesos de detoxificación5.
Aunque la tasa de descomposición depende parcialmente del contenido de lignina, celulosa y hemicelulosa del tronco32, la actividad enzimática determina el estado de descomposición de éste11. Sin embargo, no se conoce claramente cómo influyen enzimas como la lacasa y la CDH en el grado de pudrición de la madera. Se han realizado muy pocos estudios de los hongos de la pudrición, así como sobre las posibilidades de utilizarlos biotecnológicamente. Por tal razón, los objetivos de este trabajo fueron aislar hongos que colonizan troncos caídos en el bosque subandino, evaluar su actividad enzimática (lacasa y CDH) y establecer su relación con el estado de descomposición de los troncos en la reserva natural La Montaña del Ocaso, Quimbaya (Quindío).
Materiales y métodosÁrea de estudio. Se ubicó en 2 áreas del bosque subandino (Ocaso y Veraguas), localizadas en la reserva natural La Montaña del Ocaso, municipio de Quimbaya (Quindío, Colombia), entre 975 y 1.100m de altitud. La precipitación media es de 1.691mm/año y la temperatura promedio es de 24°C1.
Recolección de ejemplares. Se tomaron muestras de los hongos presentes en troncos caídos de latifoliadas, siempre verdes con predominio de las familias Lauraceae, Meliaceae, Moraceae, Sapindaceae y Anacardiaceae. En cada área de bosque subandino de la reserva La Montaña del Ocaso se delimitaron 30 parcelas de 20×5m, paralelas entre sí, desde el borde del bosque hasta aproximadamente 100m hacia el interior, en las que se realizaron 3 muestreos en el año 2005, que incluyeron tanto época de lluvias como época seca. Se seleccionaron los hongos que se encontraron con mayor frecuencia en troncos con diferentes estados de descomposición y se registraron sus características macroscópicas. En el laboratorio se les realizaron cortes para determinar las características microscópicas13 y se identificaron mediante el uso de claves taxonómicas6,9,16,19,34–36,41. El estado de descomposición se determinó introduciendo una varilla de 25cm de largo en los troncos colonizados17,22. Se usaron 5 estados de acuerdo con la penetración de la varilla y estado del tronco, como se ha descrito previamente para estudios ecológicos22,38. Estado 1: la varilla penetra unos pocos milímetros el tronco y la madera permanece intacta. Estado 2: la varilla penetra 1cm el tronco y menos del 50% del tronco se presenta descompuesto. Estado 3: la varilla penetra de 1 a 4cm el tronco, y más del 50% del tronco está descompuesto. Estado 4: la varilla penetra de 5 a 10cm, madera con alto grado de descomposición y algunas partes del tronco se quiebran con facilidad. Estado 5: la varilla penetra más de 10cm el tronco, la madera está totalmente descompuesta y en ocasiones se desintegra.
Aislamiento. Se realizó una desinfección al carpóforo con hipoclorito de sodio (5%), alcohol etílico (70%) y agua destilada estéril, y se sembró un trozo de éste en agar extracto de malta al 2% (p/v) suplementado con extracto de levadura al 0,4% (p/v). Se incubaron a 25°C durante 8 días y se mantuvieron a 4°C en este mismo medio26.
Determinación semicuantitativa de actividad enzimática. Se tomó un disco de los hongos aislados en el medio extracto de malta y se colocó en forma de sándwich sobre placas de agar con el medio descrito por Ghahfarokhi et al, y cuya composición (p/v) fue del 1% de celulosa, 0,5% de peptona, 0,2% de extracto de levadura, 0,0075% de MnSO4·H2O, 0,01% de CuSO4·7H2O y el 2% de agar-agar, disuelto en una solución de extracto de salvado de trigo, previamente preparado por extracción inmediata de 175g de salvado de trigo con 1.000ml de agua destilada a 25°C, y cuya composición fue de 9,4mg/l de amonio, 628,6mg/l de potasio, 12,3mg/l de calcio, 69,6mg/l de magnesio, 8,9mg/l de sodio, 8,6mg/l de nitratos, 189,4mg/l de fósforo, 85,3mg/l de azufre, 607,6mg/l de bicarbonato de sodio, 140,2mg/l de cloro. La relación C:N del medio fue de 394:119. El pH se ajustó a 6,0 y se esterilizó a 15 lb de presión y 121°C durante 15min, tras lo que se añadieron al medio 0,2g de ABTS (ácido 2,2’acino-bis-[3-etilbenzotiazolin-6-sulfónico]) como sustrato e inductor enzimático, para la selección de los hongos con actividad lacasa, y 1mM de 2,6-diclorofenolindofenol (DCPIP) como sustrato e inductor enzimático en el caso de la CDH. Las cajas se incubaron a 25°C y la actividad enzimática se cuantificó por triplicado, con mediciones diarias del diámetro del halo durante 8 días14,20.
Cuantificación de actividad enzimática. Se realizó de acuerdo a lo reportado7,15; se tomaron 3 discos de Agar de 0,5cm de diámetro de los hongos que presentaron mayor actividad enzimática lacasa y CDH en el ensayo anterior (uno por cada estado de descomposición). Cada disco se inoculó en 100ml de medio extracto de salvado de trigo. El pH se ajustó a 6,0±0,27. Las fermentaciones se realizaron por triplicado durante 10 días, en agitación continua a 150rpm y a 29±1°C15. Se tomaron muestras de 2ml cada 24h, que se centrifugaron a 10.000rpm durante 25min, cuantificando en el sobrenadante la actividad enzimática lacasa y CDH, el consumo del sustrato celulosa por liberación de glucosa al medio y las proteínas extracelulares. El pellet se utilizó para la determinación de biomasa mediante la cuantificación de proteínas miceliares12,28. Todas las mediciones se realizaron por triplicado.
La determinación de las actividades enzimáticas se realizó espectrofotométricamente a partir de 100μl del sobrenadante en cada caso, a las temperaturas óptimas de actividad establecidas previamente12. La cuantificación de lacasa se realizó de acuerdo con estudios previos, usando 0,5mm de ABTS como sustrato en tampón acetato de sodio pH 527,28. Se determinó la absorbancia a 420nm a 30°C, (π420=36M−1cm−1)12,28. Una unidad de actividad lacasa se definió como moles de producto/min.l12. La cuantificación de CDH se realizó mediante la medición de la cantidad de DCPIP reducido24,40. Se tomaron 150μl de DCPIP 2 mM (inductor) en 50mM de tampón acetato de sodio a pH 4,5, que contenía 1.700μl de celobiosa 2,5mM (sustrato). Como inhibidor de la actividad lacasa se utilizó fluoruro de sodio 4mM (100μl), ya que la lacasa es capaz de oxidar el DCPIP y alterar su color y, por tanto, la absorbancia2. Se realizó la lectura a 600nm y 37°C (π420=1,85*104M−1cm−1). Una unidad de actividad CDH se definió como la cantidad de enzima necesaria para reducir 1mmol de DCPIP/min.l12.
Para la determinación de glucosa se utilizó la técnica de DNS o ácido 3,5 dinitrosalicílico25, a partir de muestras tomadas diariamente. Las mediciones se realizaron determinando la absorbancia a 540nm29. La cantidad de proteína extracelular se cuantificó mediante la técnica de Bradford3, centrifugando 2ml de la muestra tomada diariamente a 10.000rpm Después, se añadieron 0,1ml del sobrenadante a 5ml del reactivo de Bradford. El blanco contenía el reactivo y 0,1ml de cloruro de sodio 0,15M y las mediciones se hicieron a 595nm. La determinación de biomasa se realizó a partir de 50mg de micelio seco homogeneizado después de una hidrólisis alcalina con 1ml de hidróxido de sodio 1N. Se dejó en baño maría, a 100°C durante 30min. Se centrifugó y se cuantificó la cantidad de proteínas miceliares con la técnica de Bradford3. Los resultados se expresaron como μg de proteínas/g de micelio12.
Análisis estadísticos. El análisis de las pruebas cualitativas se realizó mediante un análisis de covariancia. Se utilizó la correlación de Spearman para establecer la relación entre la actividad lacasa y CDH de los hongos, con el estado de descomposición de los troncos y todas las variables de la fermentación. Se usó la prueba de Friedman para conocer las diferencias entre los hongos evaluados durante la fermentación para cada variable. El análisis de los resultados se llevó a cabo con un nivel de significación de 0,05 y se utilizó el programa Statistica 6.0.
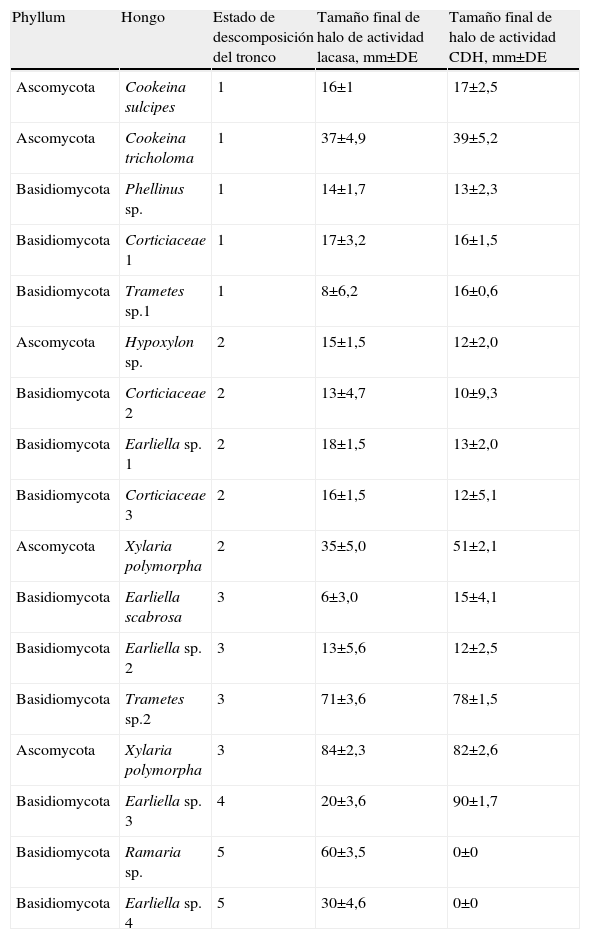
ResultadosSe seleccionaron carpóforos de 37 hongos. Los que tuvieron mayor actividad lacasa y CDH en las pruebas cualitativas en medio de cultivo fueron Trametes sp. y Xylaria polymorpha, encontrados en troncos en el estado 3 de descomposición, y Earliella sp. 3, que se encontraba en troncos en el estado 4 de descomposición (tabla 1). La mayoría de estos hongos se han descrito como causantes de pudrición blanca10,31,39, a excepción del género Cookeina y Ramaria.
Actividad lacasa y celobiosa deshidrogenasa de los hongos más frecuentes encontrados en troncos caídos, en el medio extracto de salvado de trigo con ácido 2,2’azino-bis-[3-etilbenzotiazolin-6-sulfónico] y 2,6-diclorofenolindofenol como inductores, a una temperatura de 28°C, durante 8 días
| Phyllum | Hongo | Estado de descomposición del tronco | Tamaño final de halo de actividad lacasa, mm±DE | Tamaño final de halo de actividad CDH, mm±DE |
| Ascomycota | Cookeina sulcipes | 1 | 16±1 | 17±2,5 |
| Ascomycota | Cookeina tricholoma | 1 | 37±4,9 | 39±5,2 |
| Basidiomycota | Phellinus sp. | 1 | 14±1,7 | 13±2,3 |
| Basidiomycota | Corticiaceae 1 | 1 | 17±3,2 | 16±1,5 |
| Basidiomycota | Trametes sp.1 | 1 | 8±6,2 | 16±0,6 |
| Ascomycota | Hypoxylon sp. | 2 | 15±1,5 | 12±2,0 |
| Basidiomycota | Corticiaceae 2 | 2 | 13±4,7 | 10±9,3 |
| Basidiomycota | Earliella sp. 1 | 2 | 18±1,5 | 13±2,0 |
| Basidiomycota | Corticiaceae 3 | 2 | 16±1,5 | 12±5,1 |
| Ascomycota | Xylaria polymorpha | 2 | 35±5,0 | 51±2,1 |
| Basidiomycota | Earliella scabrosa | 3 | 6±3,0 | 15±4,1 |
| Basidiomycota | Earliella sp. 2 | 3 | 13±5,6 | 12±2,5 |
| Basidiomycota | Trametes sp.2 | 3 | 71±3,6 | 78±1,5 |
| Ascomycota | Xylaria polymorpha | 3 | 84±2,3 | 82±2,6 |
| Basidiomycota | Earliella sp. 3 | 4 | 20±3,6 | 90±1,7 |
| Basidiomycota | Ramaria sp. | 5 | 60±3,5 | 0±0 |
| Basidiomycota | Earliella sp. 4 | 5 | 30±4,6 | 0±0 |
DE: desviación estándar.
No se encontró un patrón definido en la respuesta de la actividad enzimática lacasa y CDH de los hongos pertenecientes a troncos en el mismo estado de descomposición (tabla 1), así como tampoco lo hubo para el mismo género de hongo encontrado en troncos con diferente estado de descomposición. Lo mismo sucedió al evaluar el comportamiento de la tasa de actividad enzimática de acuerdo al Phylum (rda.). Por ejemplo, X. polymorpha, encontrada en troncos con estado de descomposición 2, presentó una tasa de actividad lacasa de 4,50mm ABTS oxidado/día, mientras que en troncos con estado 3 de descomposición esta tasa fue distinta (q=10,23, p<0,05) y 2,5 veces mayor (11,42mm ABTS oxidado/día). Con respecto a la tasa de actividad CDH, X. polymorpha también tuvo un comportamiento diferente en cada estado de descomposición del tronco. En troncos con estado 2 de descomposición fue de 3,35mm DCPIP reducido/día y, en troncos con estado 3 aumentó a un poco más del triple (10,94mm DCPIP reducido/día [q=22,05, p<0,05]). Trametes sp. en troncos con estado 1 de descomposición presentó un comportamiento parecido, y mostró una tasa de actividad lacasa de 1,60mm ABTS oxidado/día, mientras que en troncos con estado 3 aumentó 6,5 veces y fue de 10,38mm de ABTS oxidado/día (q=21,42, p<0,05). En cuanto a la actividad CDH de este mismo género en troncos con estado 1 de descomposición, la tasa de actividad fue de 1,33mm de DCPIP reducido/día, mientras que en troncos con estado 3 de descomposición presentó una tasa de 10,17mm de DCPIP reducido/día, 7,6 veces mayor (q=38,13, p<0,05).
Sólo se encontró una baja relación positiva para la actividad lacasa con el estado de descomposición de los troncos (rs=0,34, p<0,05, n=42) en las pruebas semicuantitativas de actividad. En troncos con estado 4 de descomposición se encontró un menor diámetro de halo de actividad lacasa (20mm), determinado por el comportamiento de Earliella sp. 3, el único encontrado en este estado de descomposición. En los estados 3 y 4 de descomposición se encontraron los hongos que presentaron los mayores diámetros de actividad CDH, mientras que en los hongos encontrados en troncos en estado 5 de descomposición, ésta no se detectó, aunque sí presentaron actividad lacasa en baja cantidad. En general, se evidenció que al aumentar la actividad lacasa, también lo hizo la actividad CDH de los hongos evaluados (rs=0,70, p<0,05, n=41).
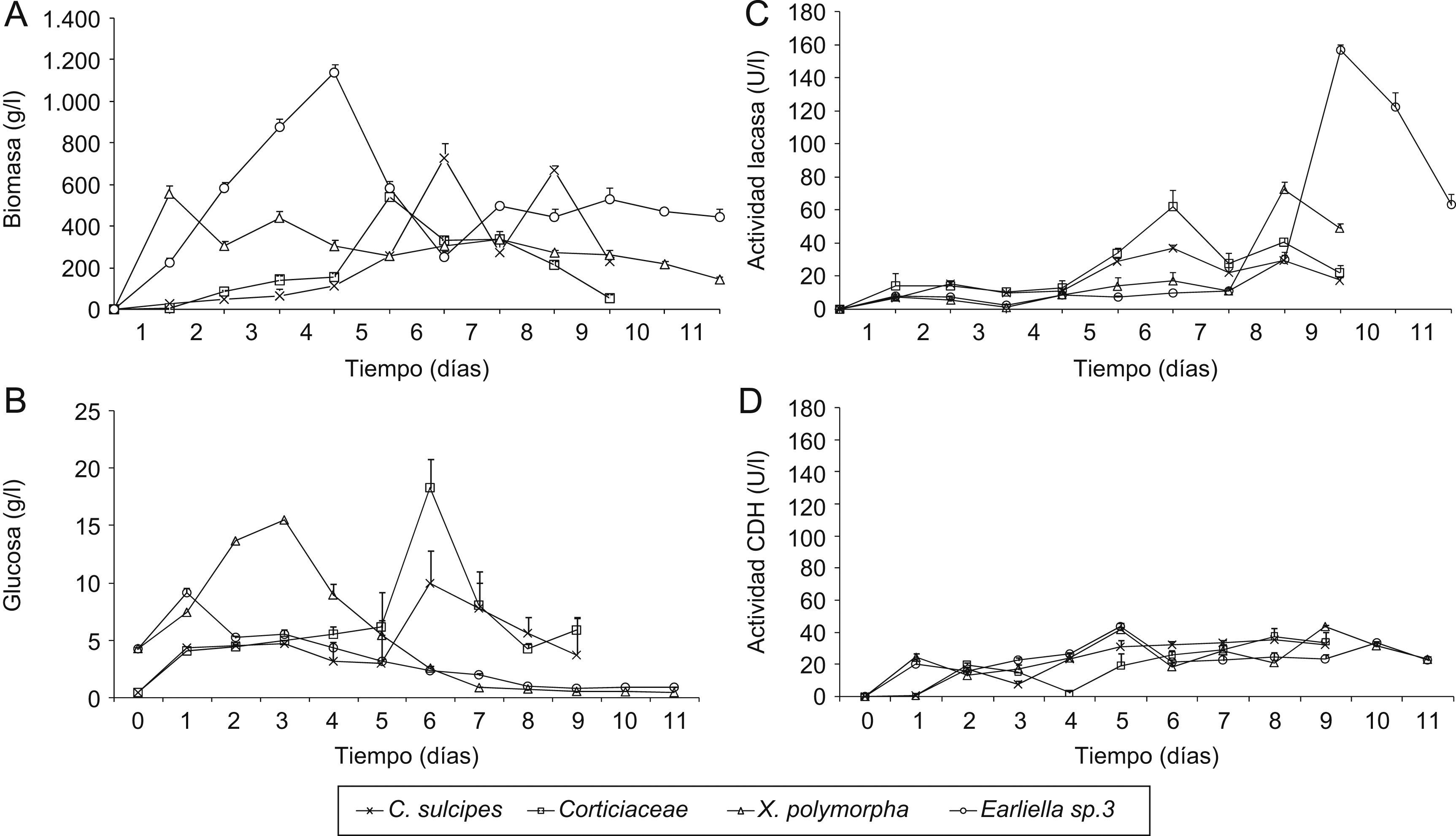
Los hongos de la división Basidiomycota que se hicieron crecer en fermentación presentaron una relación inversa entre la biomasa y la cantidad de glucosa en el medio, mientras que en los hongos de la división Ascomycota el patrón fue distinto: en el momento más alto de cantidad de glucosa se presentó la mayor producción de biomasa (fig. 1A y B). Con respecto a la actividad lacasa se determinaron diferencias significativas entre los hongos, independientemente del estado de descomposición de los troncos (Fr=1, p<0,05), y Earliella fue el que presentó la mayor actividad (157Ul−1), en troncos con estado de descomposición 4. Sin embargo, los hongos en troncos con estados de descomposición 1 y 2 expresaron la enzima con mayor rapidez (a los 6 días) que los hongos en troncos con estados de descomposición 3 y 4 (a los 8 o 9 días) (fig. 1C).
Se observaron 2 patrones de acuerdo con el estado de descomposición de los troncos y la actividad de la lacasa. Uno en el que se presentó la mayor producción de lacasa y concentración de biomasa simultáneamente, como fue el caso de C. sulcipes en tronco con estado de descomposición 1. El segundo fue una baja producción de lacasa y alta producción de biomasa, como en Earliella de troncos con estado de descomposición 4. Estos patrones no se encontraron para la actividad CDH (fig. 1D). Para esta enzima hubo una relación positiva relativamente alta de su actividad con la cantidad de biomasa producida (rs=0,45, p<0,05, n=396). Earliella sp. fue el que presentó mayor actividad CDH y mayor producción de biomasa. Hasta la fecha se desconocen estudios realizados de esta enzima CDH en Colombia, al igual que de la actividad enzimática lacasa; además, este es el primer reporte de actividad CDH en hongos de los géneros Cookeina y Earliella.
Se confirmó lo encontrado en los ensayos semicuantitativos en cuanto a la relación positiva entre la producción de las 2 enzimas (rs=0,53, p<0,05, n=396). La actividad específica de la lacasa y la CDH fue mayor en C. sulcipes (229 y 144U/g de proteína, respectivamente), seguida del hongo de la familia Corticiaceae, (123 y 133U/g de proteína, respectivamente). Earliella sp. presentó una actividad específica de la lacasa de 59U/g y de 94U/g de proteína para la CDH, mientras que en X. polymorpha fue de 22U/g para la lacasa y de 110U/g de proteína para la CDH.
DiscusiónTrametes sp. y X. polymorpha no se encontraron en los troncos más descompuestos, sino en troncos con estado 3 de descomposición, aunque presentaron la mayor actividad lacasa y CDH medida semicuantitativamente. Esto probablemente se reflejó en la ausencia y en una baja relación de la actividad CDH y la actividad de la lacasa con el estado de descomposición de los troncos, respectivamente. Adicionalmente, la tasa de actividad enzimática obtenida de las mediciones diarias no correspondió al estado de descomposición del tronco. Esto indica que el comportamiento de la tasa de actividad enzimática dependería más que del grado de descomposición de los troncos, de la fisiología de cada hongo, no sólo al nivel de género, sino probablemente al nivel de especie. Entonces, para comprender mejor los factores que pueden contribuir a definir el estado de descomposición de los troncos se propone considerar que hay otras características de los troncos no evaluadas en este estudio (contenido de lignina, celulosa, resistencia) o la actividad de otros organismos. Adicionalmente, la existencia de actividad lacasa, mas no de CDH, por parte de los hongos encontrados en los troncos con estado 5 de descomposición pudo deberse a que la enzima lacasa reoxida todos los aceptores de electrones conocidos de la CDH, incluido el DCPIP18 y, por tanto, la lacasa pudo enmascarar la actividad de la CDH. Es difícil comparar los anteriores resultados debido a que no hay estudios reportados acerca de la tasa de actividad lacasa y CDH de los hongos estudiados con respecto al estado de descomposición de los troncos. Sin embargo, el aumento concomitante de la actividad lacasa y de CDH de los hongos evaluados hace presumir que las 2 deben producirse simultáneamente para la degradación de los componentes de la madera, aunque no se conozca claramente la función biológica de la CDH y se sepa que es esencial para la invasión y degradación de la madera8.
En cuanto a la determinación cuantitativa de las actividades de las 2 enzimas, el comportamiento de los hongos rda. examinados podría indicar un patrón de acuerdo con el Phylum, en el que el consumo de glucosa en los hongos rda. es mayor que la actividad celulolítica cuando aumenta la producción de biomasa. Por el contrario, en los hongos del Phylum Ascomycota hay una mayor actividad celulolítica con respecto al consumo de glucosa en su etapa de crecimiento. Sería necesario hacer evaluaciones en otros géneros de hongos con el fin de confirmar este patrón. Aunque el comportamiento de la glucosa es uno de los factores más relacionados con el crecimiento fúngico, no sólo está involucrado el proceso de degradación de glucosa, sino también el proceso enzimático de degradación de celulosa y celobiosa, en el que la celulosa es la principal fuente de carbono disponible en el medio extracto de salvado de trigo y en el hábitat natural de estos hongos8.
La actividad lacasa se ha reportado como alta en Xylaria hypoxylon y X. polymorpha, mediante la técnica de ABTS23, pero no se conocen estudios sobre la actividad lacasa en hongos del género Cookeina ni Earliella. En este sentido, este es el primer reporte de actividad enzimática lacasa para estos 2 géneros en Colombia. Por su parte, la producción más alta de actividad CDH reportada en hongos de la pudrición blanca es de una cepa de Trametes versicolor, con un valor de 270U/l, medida mediante la técnica de clorpromazina33. Aunque es difícil realizar comparaciones en cuanto a la actividad CDH entre hongos debido a las diferencias en los resultados que se obtienen por el uso de distintas técnicas para la cuantificación de esta enzima37, la actividad CDH que registran los hongos en este estudio es baja, y llega a ser incluso un orden de magnitud menor. La relación relativamente alta entre la actividad CDH y la cantidad de biomasa puede explicarse por el incremento de la actividad celulolítica de la CDH mediante varios mecanismos, entre los que se encuentra la oxidación de la celobiosa a celobionolactona, lo que despolimeriza la celulosa y evita la inhibición por producto de las enzimas que hidrolizan la celulosa. Esto trae como consecuencia el aumento de la tasa de degradación de la celulosa a moléculas que el hongo pueda asimilar más fácilmente, lo que se refleja en un incremento en la biomasa4,30. Earliella sp. 3 fue el hongo que presentó mayor actividad CDH y mayor producción de biomasa, lo que sería una ventaja para éste y otros hongos en la colonización y degradación de sustratos de lignocelulosa, ya que los hongos encontrados en troncos en estados iniciales de descomposición (1 y 2) presentaron una mayor actividad específica de CDH que de lacasa. Esto puede indicar que biológicamente la CDH tendría una mayor importancia para los hongos en las etapas iniciales de colonización de troncos, ya que éste se encuentra compacto y, por tal razón, la lignina y la celulosa no estarían disponibles para las demás enzimas que participan en el proceso de degradación de la madera. La relación positiva entre la actividad de las enzimas lacasa y CDH que se evidenció en este estudio también se ha demostrado en sistemas lignolíticos como los encontrados en todas las especies del género Pycnoporus37, ya que la capacidad para degradar la madera depende de la actividad conjunta de la lacasa y la CDH.
Se han realizado muy pocos estudios con el fin de conocer la riqueza de hongos descomponedores de madera de pudrición blanca nativos y de su actividad metabólica. Este trabajo muestra que los hongos nativos recolectados en el bosque subandino tienen potencial enzimático en la degradación de sustratos lignocelulósicos, lo que permite ampliar el conocimiento de la interacción entre las enzimas implicadas y cómo podrían alterar la composición de la madera. Así se dan las bases para futuras investigaciones que evalúen sus posibles aplicaciones no sólo a nivel biotecnológico, sino en el mantenimiento de procesos del ecosistema.
FinanciaciónA la Pontificia Universidad Javeriana (Vicerrectoría Académica) por la financiación del estudio (proyecto N.o 2.097). Al Centro de Investigaciones Biológicas de la Universidad del Quindío (CIBUQ) por permitir la entrada a la reserva. A la Doctora Flavia Forchiassin y su grupo (Laboratorio de Micología Experimental, Universidad de Buenos Aires, Argentina) por su apoyo con las técnicas de cuantificación de actividad enzimática. A Germán Darío Gómez por su asesoramiento y colaboración en la fase de campo, y a Daniel Rodríguez por su colaboración en campo. A los revisores anónimos por sus valiosos aportes para mejorar el manuscrito.