El género Hanseniaspora (Kloeckera es su forma anamórfica) comprende levaduras apiculadas de cuya patogénesis apenas existe documentación. La actual taxonomía5 comprende 10 especies, cuatro de las cuales (H. opuntiae, H. meyeri, H. clermontiae y H. lachancei) fueron incorporadas al género por Cadez et al.1. Hanseniaspora se ha aislado de fuentes ambientales4,6,7. Solo se encuentran dos artículos de 4 casos en el ser humano, con H. uvarum (K. apiculata) implicada en todos los casos. Uno se aisló de lesiones orales que guardaban similitud con las lesiones de la candidiasis oral2. De los otros 3 casos, uno procede de coprocultivo y dos de lesiones ungueales, lo que se interpretó como colonización transitoria, además de sugerirse la ingestión de alimentos marinos como fuente de infección3.
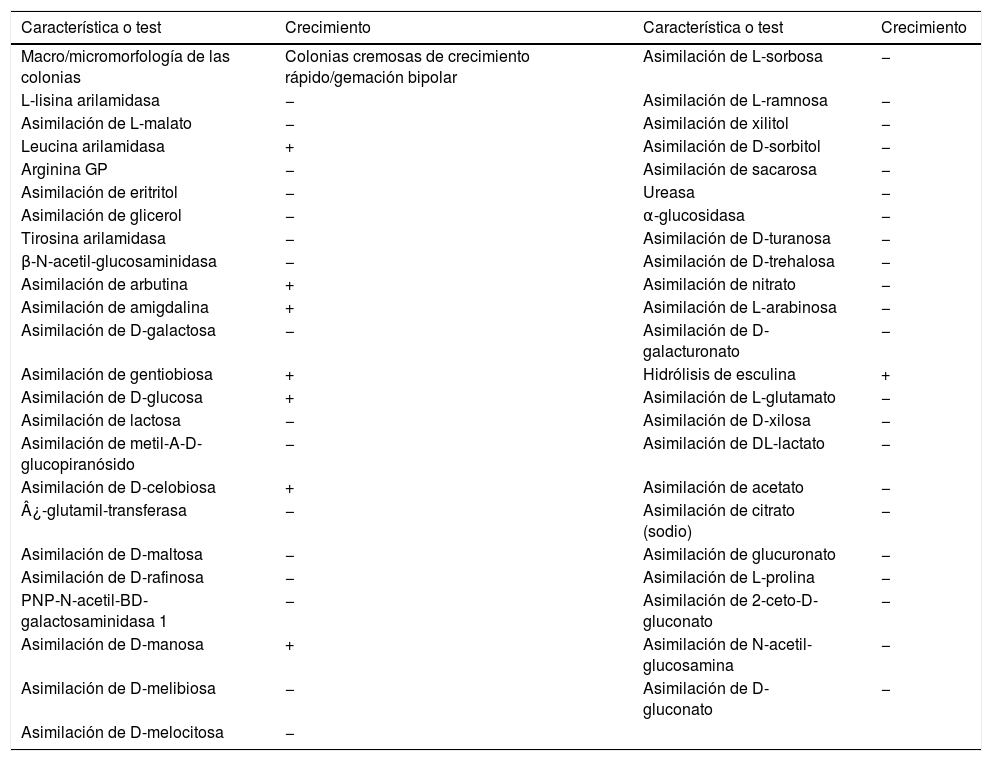
Presentamos el caso de una paciente de 8 años con fiebre de 3 días, tos y mucosidad nasal en los 7 días previos, anorexia y taquipnea. Parámetros analíticos relevantes: hemoglobina 6,5g/dl, leucocitos 41,57×1.000/μl, plaquetas 65×1.000/μl, blastos 21%, protrombina 52%, ácido úrico 11,31mg/dl, bilirrubina total 2,26mg/dl, calcio 7,64mg/dl, LDH 856 U/l, PCR 6,54mg/dl y PCT 1,37ng/m. Por un rápido empeoramiento respiratorio la paciente ingresa en cuidados intensivos con ventilación mecánica no invasiva, y ante la sospecha de neumonía atípica se añadió azitromicina (5mg/kg/día) al tratamiento con cefepime (150mg/kg/día) y vancomicina (40mg/kg/día). El día siguiente a su ingreso se diagnosticó una leucemia mieloide aguda tipo M6 (LMA-M6). A las 48h del diagnóstico se comienza con el primer ciclo de quimioterapia, lo que lleva a un nuevo deterioro respiratorio que requirió ventilación mecánica invasiva. Se comenzó un tratamiento con anfotericina B (3mg/kg/día), cotrimoxazol (5mg/kg/día) y amikacina (30mg/kg/día). La paciente presentó dificultad respiratoria grave y dos neumotórax, por lo que se añadió meropenem (60mg/kg/día) y linezolid (20mg/kg/día) al tratamiento. Por sospecha de una neumonía fúngica se administró voriconazol (16mg/kg/día). Las determinaciones negativas fueron las siguientes: PCR para Aspergillus en aspirado traqueobronquial, PCR para Histoplasma, Cryptococcus y Pneumocystis en suero, cultivos de orina, exudado bronquial, líquido pleural, lavado broncoalveolar (LBA) y heces, estudio de micobacterias en líquido pleural y LBA, y PCR para virus respiratorios en LBA y aspirado nasofaríngeo. Se aisló Staphylococcus aureus sensible a meticilina en un catéter sin bacteriemia asociada y hubo tres determinaciones positivas para herpes virus simple-1 en plasma, lo que llevó a añadir aciclovir (30mg/kg/día). Al mes y medio de su ingreso, una extracción de sangre dio un hemocultivo positivo (única extracción con crecimiento de diecinueve extracciones) al aislarse levaduras cremosas, de gemación bipolar. Las pruebas bioquímicas se detallan en la tabla 1. Se administró anfotericina B a dosis terapéuticas (5mg/kg/día) y micafungina (2mg/kg/día). Mes y medio después del primer ciclo de quimioterapia se comienza un segundo ciclo que provoca en la paciente taquipnea, empeoramiento radiológico y respiratorio, hipotensión e hipoxemia refractarias al tratamiento, lo que lleva a su fallecimiento. Las levaduras aisladas fueron identificadas como Hanseniaspora opuntiae mediante método automatizado (VITEK® 2 Compact, bioMérieux) y espectrometría de masas MALDI-TOF (score 2.3) (Microflex® LT, Bruker Daltonics), si bien la identificación definitiva requiere métodos moleculares.
Características bioquímicas y morfología del aislamiento de Hanseniaspora opuntiae
| Característica o test | Crecimiento | Característica o test | Crecimiento |
|---|---|---|---|
| Macro/micromorfología de las colonias | Colonias cremosas de crecimiento rápido/gemación bipolar | Asimilación de L-sorbosa | − |
| L-lisina arilamidasa | − | Asimilación de L-ramnosa | − |
| Asimilación de L-malato | − | Asimilación de xilitol | − |
| Leucina arilamidasa | + | Asimilación de D-sorbitol | − |
| Arginina GP | − | Asimilación de sacarosa | − |
| Asimilación de eritritol | − | Ureasa | − |
| Asimilación de glicerol | − | α-glucosidasa | − |
| Tirosina arilamidasa | − | Asimilación de D-turanosa | − |
| β-N-acetil-glucosaminidasa | − | Asimilación de D-trehalosa | − |
| Asimilación de arbutina | + | Asimilación de nitrato | − |
| Asimilación de amigdalina | + | Asimilación de L-arabinosa | − |
| Asimilación de D-galactosa | − | Asimilación de D-galacturonato | − |
| Asimilación de gentiobiosa | + | Hidrólisis de esculina | + |
| Asimilación de D-glucosa | + | Asimilación de L-glutamato | − |
| Asimilación de lactosa | − | Asimilación de D-xilosa | − |
| Asimilación de metil-A-D-glucopiranósido | − | Asimilación de DL-lactato | − |
| Asimilación de D-celobiosa | + | Asimilación de acetato | − |
| ¿-glutamil-transferasa | − | Asimilación de citrato (sodio) | − |
| Asimilación de D-maltosa | − | Asimilación de glucuronato | − |
| Asimilación de D-rafinosa | − | Asimilación de L-prolina | − |
| PNP-N-acetil-BD-galactosaminidasa 1 | − | Asimilación de 2-ceto-D-gluconato | − |
| Asimilación de D-manosa | + | Asimilación de N-acetil-glucosamina | − |
| Asimilación de D-melibiosa | − | Asimilación de D-gluconato | − |
| Asimilación de D-melocitosa | − |
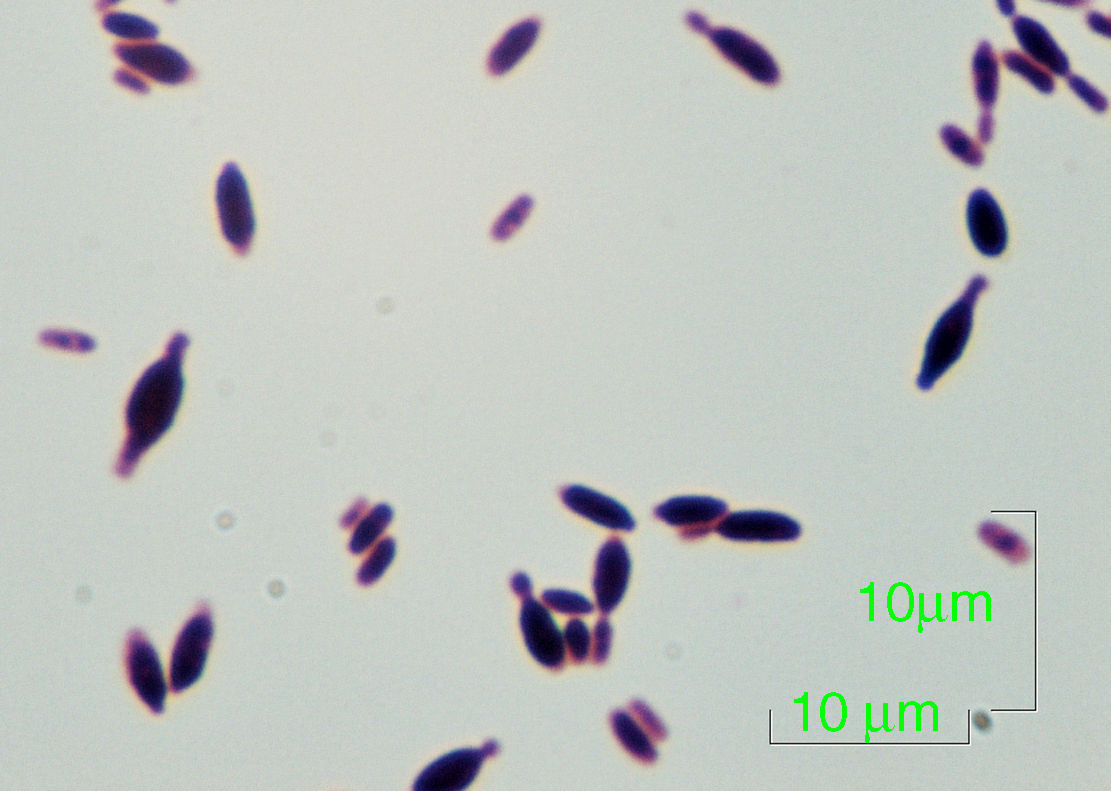
Por el permanente y estricto aislamiento de la paciente la fuente de adquisición de esta levadura es incierta, así como su significación clínica al aislarse de una única muestra de sangre. Dada la poca experiencia con este género de levaduras, como evidencian las escasas publicaciones de su aislamiento clínico, el aspecto más destacable es, desde el punto de vista de laboratorio, su presentación microscópica al ser llamativa y diferencial su morfología bipolar (fig. 1). Este es en nuestro conocimiento, el quinto caso de aislamiento de Hanseniaspora/Kloeckera de una muestra clínica.