Antecedentes: Los receptores de órgano sólido se consideran población de riesgo de aspergilosis invasora, afectándose fundamentalmente el pulmón o el sistema nervioso central.
Objetivos: Describimos el caso de una paciente con aspergilosis cardíaca invasora probada 2 años después de un trasplante cardíaco y revisamos la aspergilosis cardíaca en el paciente trasplantado. Caso clínico: La paciente, de 52 años, recibió un trasplante de corazón. En el posoperatorio surgieron múltiples complicaciones, entre ellas el desarrollo de una aspergilosis invasora en la herida quirúrgica. La paciente reingresó 2 años después por disnea. En la tomografía computarizada toracoabdominal se observaron múltiples tromboem-bolismos pulmonares y una masa en la región retroxifoidea que invadía gran parte de la aurícula derecha y afecta-ba a la válvula tricúspide. En la biopsia de la masa se observaron hifas septadas invasoras, y se aisló posteriormente Aspergillusfumigatus. Las determinaciones de galactomanano sérico resultaron negativas. Se inició tratamiento con voriconazol y a los 2 meses acudió a revisión en buena situación clínica, pero con niveles séricos de voriconazol indetectables, aparentemente debido a la administración concomitante de omeprazol. La paciente está siendo se-guida ambulatoriamente y permanece en tratamiento con voriconazol y asintomática más de un año después. Conclusiones: La aspergilosis invasora con origen en el mediastino puede progresar y afectar al corazón. El uso de omeprazol puede conducir a la presencia de valores indetectables de voriconazol en suero. © 2011 Revista Iberoamericana de Micología. Publicado por Elsevier España, S.L. Todos los derechos reservados.
Background: Solid organ transplant recipients are a population at risk of invasive aspergillosis. The lung and the central nervous system are usually affected.
Objectives: We report the case of a patient with proven cardiac invasive aspergillosis two years after heart transplantation, and perform a review of cardiac aspergillosis in solid organ transplant recipients.
Case reportA 52-year old woman received a heart transplant. Several complications appeared in the post-operative period, including the development of invasive aspergillosis in the surgical wound. She was readmitted two years later with dyspnea. A thoracic CT-scan revealed multiple lung embolisms and a mass in the retroxiphoid, invading the right atrium and the tricuspid valve. Septated hyphae invading this tissue were observed and Aspergillus fumiga-tus was subsequently isolated. Serum galactomannan determinations were negative. Antifungal therapy with vori-conazole was started. Two months later, the patient visited the hospital for a routine check-up control in good clinical condition, but with undetectable voriconazole serum levels. These levels were associated to the concomitant use of omeprazole. One year later, the patient was still receiving voriconazole and remained asymptomatic.
ConclusionsInvasive aspergillosis affecting the mediastinum can progress and affect the heart tissues. The use of omeprazole may be associated with the undetectable voriconazole serum levels.
Los pacientes trasplantados de órgano sólido continúan siendo una población de riesgo para presentar aspergilosis invasora (AI), aunque la incidencia ha disminuido significativamente en la mayor parte de los programas. El pulmón y el sistema nervioso central (SNC) son los órganos afectados de forma más frecuente, aunque la aspergilosis puede involucrar prácticamente cualquier órgano, incluido el injerto trasplantado [16]. Presentamos el caso de una paciente trasplan-tada de corazón que desarrolla aspergilosis cardíaca 2 años después del trasplante.
1Caso clínicoSe trata de una mujer de 52 años con cardiopatía isquémica grave, que tras la cirugía de revascularización coronaria requirió asistencia biventricular y posterior trasplante cardíaco. Durante el período de asistencia biventricular fue diagnosticada de hipogammaglobuline-mia, que requirió tratamiento sustitutivo.
En el posoperatorio present ó varias complicaciones graves:
Disfunción del ventrículo derecho del injerto, que precisó la administración de fármacos inotrópicos durante los primeros días postrasplante.
Ventilación mecánica prolongada complicada con un episodio de neumonía por Pseudomonas aeruginosa y Acinetobacter baumanii.
Rechazo agudo precoz (segunda biopsia), grado IIIA, que se trató con altas dosis de glucocorticoides y daclizumab.
Aspergilosis invasora en el cuarto mes postrasplante, con afec-tación pulmonary de herida de esternotomía. En el estudio radioló-gico mediante tomografía computarizada (TC) toracoabdominal, se observó la presencia de nódulos pulmonares basales bilaterales con zonas de cavitación. Dicho episodio requirió desbridamiento esternal y tratamiento médico con voriconazol (junto con caspofungina en el período de ataque) durante un total de 8 meses.
Episodio de ictericia obstructiva que precisó drenaje biliar 9 meses antes del presente ingreso.
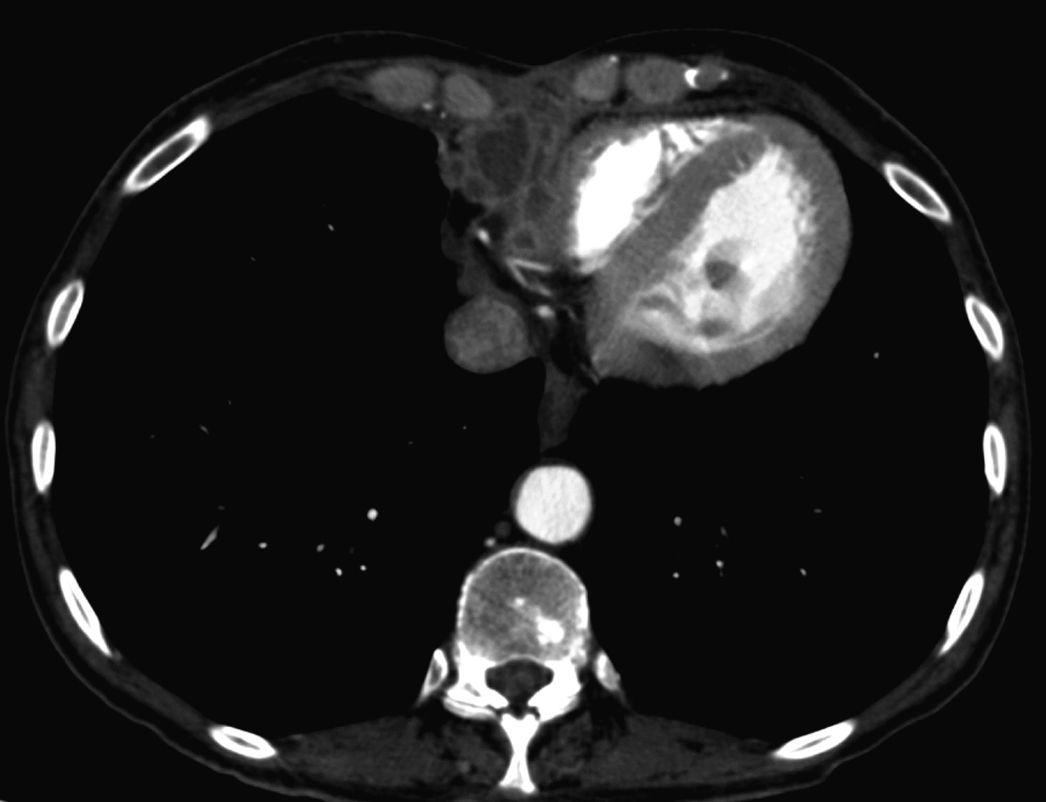
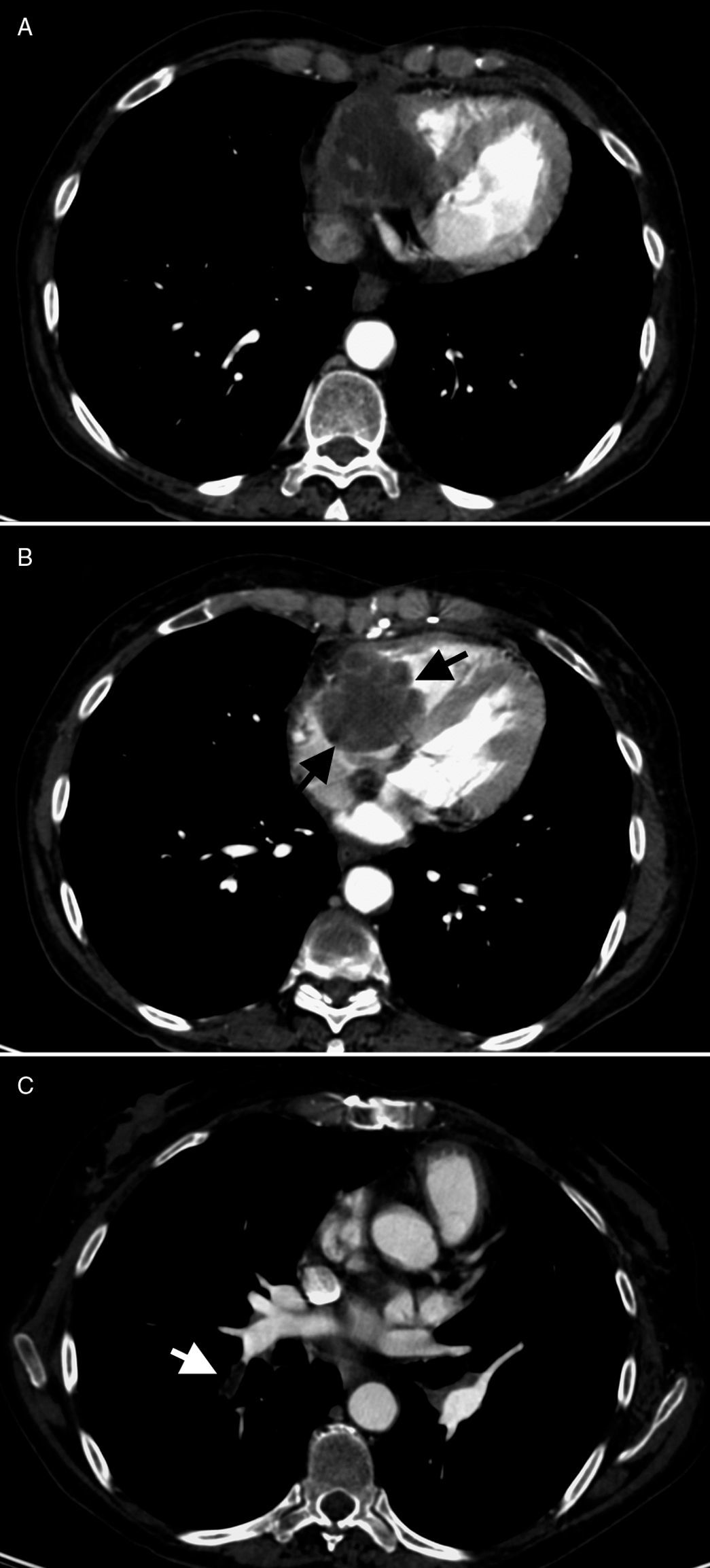
Acude al hospital 2 años después del trasplante por disnea de una semana de duración. En ese momento recibía tacrolimus (7mg/día), micofenolato de mofetilo (750mg/12h) y prednisona (5mg/día) y no relataba ningún antecedente reciente de interés. No refería sufrir tos, dolor torácico, ni fiebre. La radiología de tórax no mostraba con-solidación pulmonar, pero sí una estenosis traqueal superior residual, en relación con intubación previa y pinzamiento pleural bilateral. Serealizó una TC toracoabdominal que mostraba imágenes indicativas de tromboembolia pulmonar bilateral y una masa en la región retroxi-foidea que invadía gran parte de la aurícula derecha y que no estaba presente en las tomografías previas (fig. 1 y fig. 2). La paciente fue hospi-talizada de forma urgente para completar el estudio. En la exploraciónfísica, únicamente destacaba la presencia de roce pericárdico en dos tiempos en foco tricuspídeo. La analítica reveló leucocitosis de 16.200 leucocitos/ml con desviación izquierda (90% de neutrófilos) y creati-nina sérica de 1,28mg/dl, valor previamente conocido.
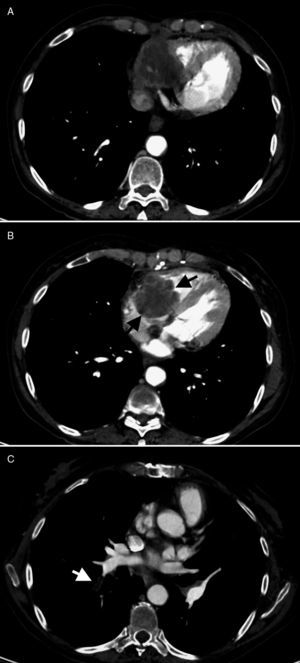
Tomografía computarizada de noviembre de 2009. Aspergilosis semiinvaso-ra mediastínica, con extensión intracardíaca. Crecimiento de la tumoración mediastí-nica anterior, con invasión cardíaca (A) y extensión endocavitaria, donde se observa una lesión redondeada, polilobulada (B: flechas negras), que ocupa la aurícula y el ventrículo derechos. Existen defectos de repleción en la luz de algunas ramas segmen-tarias de la arteria lobar inferior derecha (C: flecha blanca), compatibles con emboli-zación pulmonar de fragmentos desprendidos de la lesión cardíaca.
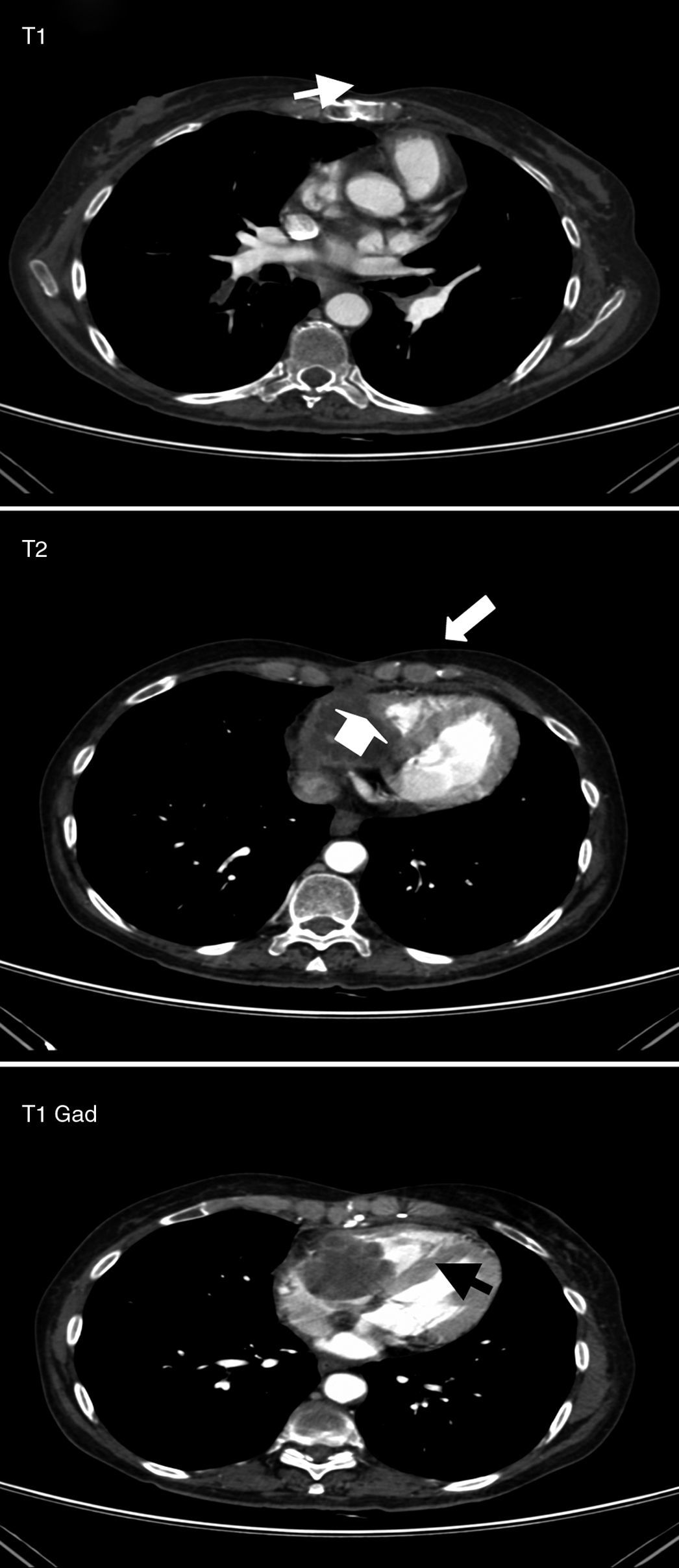
Se realizó un examen ecocardiográfico que confirmó la presencia de la masa intracardíaca, de 19cm2 (50 x 40mm de diámetro en plano apical) que ocupaba la práctica totalidad de la aurícula derecha y la porción más basal del ventrículo derecho. Este hallazgo indicaba la etiología tumoral como primera posibilidad diagnóstica y la etio-logía infecciosa como menos probable. Finalmente se realizó una re-sonancia magnética cardíaca con contraste que mostraba una masa de 47 x 43mm discretamente móvil en la aurícula derecha con base de implantación en el anillo tricuspídeo, cara lateral de la aurícula derecha y zona basal de la pared libre del ventrículo derecho. Tras la administración del contraste se observó la escasa captación de éste, lo que no sugería una etiología tumoral (fig. 3).
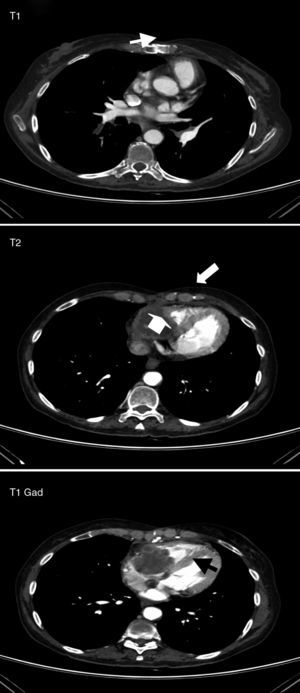
. Resonancia magnética cardíaca de noviembre de 2009. Aspergilosis semiin-vasora con extensión intracardíaca. T1: Masa endocavitaria ventricular derecha, isoin-tensa con el miocardio, que respeta la arteria coronaria derecha (flecha). T2: La lesión es discretamente hiperintensa frente al miocardio (flechas). T1, con gadolinio: Captación periférica, sin realce central, sugerente de necrosis.
Se obtuvieron muestras de sangre, orina y esputo para PCR, tincio-nes y cultivo que fueron negativos, por lo que se decidió la intervención quirúrgica. En el procedimiento se observó que la masa infiltraba la pared de las cavidades derechas, así como la cicatriz de la zona de sutura del injerto cardíaco con la aurícula derecha del receptor, por lo que sólo se pudo realizar una resección parcial de ella. El estudio microbiológico (visualización directa de la muestra con tinción de blanco de calcoflúor, cultivo y PCR en muestra directa) reveló la presencia de Aspergillus fumigatus. Este hallazgo fue corroborado con el estudio anatomopatológico en el que se visualizaron hifas tabicadas y ramificadas en ángulo agudo. Los cultivos y la PCR para Aspergillus de muestras respiratorias y el galactomanano en suero (Platelia®; Bio-Rad, Estados Unidos) fueron negativos.
Se instauró tratamiento antifúngico con voriconazol (400mg/12h) y caspofungina (dosis de carga 70mg/día; a partir del segundo día, 50mg/día). Una semana después de la cirugía se observó en la TC de control la persistencia de la masa en las cavidades derechas, con leve disminución del diámetro mayor (40mm) en relación con el estudio previo. Debido a las complicaciones técnicas, se desestimó una nueva cirugía y el retrasplante cardíaco. Se redujo la inmunosupresión de la paciente bajando las dosis de micofenolato y de tacrolimus (concen-traciones 5-6 ng/ml).
En los días siguientes, la paciente presentó diversas complicaciones infecciosas: neumonía por P. aeruginosa, esofagitis herpética y bacteriemia relacionada con catéter vascular por Staphyloccocus epidermidis que se trató inicialmente con daptomicina. Este tratamiento antibiótico tuvo que suspenderse por la aparición de una erupción cutánea generalizada tras las primeras horas de su administración.
Tras 21 días de tratamiento antifúngico combinado se suspendió la administración de caspofungina y se pasó a voriconazol oral, en prin-cipio con intención de mantenerlo de forma indefinida (200mg/12h). La determinación de los niveles séricos de voriconazol mostró inicialmente valores muy elevados (12μg/ml), que coincidieron con la aparición de alucinaciones visuales, por lo que se redujo la dosis de voriconazol al 50% (100mg/12h). Los niveles séricos se normalizaron y se mantuvieron entre 3,5 y 5μg/ml durante todo el resto del ingre-so. Fue dada de alta tras 50 días de ingreso con el diagnóstico final de AI probada, con afectación de válvula tricúspide, aurícula y ventrículo derechos e infartos sépticos pulmonares bilaterales.
A los 2 meses del alta, acudió a revisión en buena situación clínica, pero los valores séricos de voriconazol eran indetectables a pesar de haber vuelto a una dosis normal del fármaco (200mg/12h). Estos niveles indetectables se confirmaron en la determinación siguien-te. Al examinar cuidadosamente con ella la medicación que tomaba en casa, la paciente relató que había iniciado por iniciativa propia la toma de omeprazol ante la aparición de molestias digestivas. Al suspender la toma de este fármaco los valores se normalizaron.
La paciente está siendo seguida ambulatoriamente y permanece en tratamiento con voriconazol y asintomática más de un año después. Los controles ecocardiográficos que se han realizado desde el alta hospitalaria han mostrado una progresiva reducción del tamaño de la masa intracavitaria que permanece adherida a la cara lateral de la aurícula y el ventrículo derechos, con base de implantación en el plano de la válvula tricúspide, produciendo insuficiencia valvular moderada (grado II/IV).
2DiscusiónLa endocarditis infecciosa (EI) es una entidad clínica con impor-tante morbimortalidad y una incidencia estimada de alrededor de 6 casos/100.000 habitantes/año en la población general. En los pacien-tes inmunodeficientes esta cifra es aún mayor [24]. En concreto, en los receptores de trasplante de órgano sólido se describe una incidencia de endocarditis que alcanza el 1,5-6% en algunas series, y la incidencia estimada es de 186 casos/100.000 habitantes/año [28]. Hace unos años, Paterson et al. [17] publicaron una serie retrospectiva de EI en receptores de trasplante de órgano sólido que mostraba una prevalencia del 1,7% en trasplantados hepáticos y de un 6% en los trasplantes cardíacos.
Además de una mayor incidencia, los receptores de trasplante de órgano sólido muestran importantes diferencias etiológicas res-pecto a la población general, ya que los hongos son los segundos agentes etiológicos por detrás de Staphylococcus aureus. Las micosis son causantes del 15-30% de las endocarditis en estos receptores de trasplantes, y Aspergillus spp. es el principal agente etiológico [17,24]. Se han publicado casos de EI por Aspergillus spp. en trasplantados de pulmón [7,11,19,26,27,29], riñón [29,31], hígado [14] y corazón [13,23,28].
Hay pocas series que analicen las endocarditis por Aspergillus. En una serie reciente se revisó a 61 pacientes, de los que el 67% presen-taba algún tipo de inmunosupresión [8]. El segundo factor de riesgo en importancia es la cirugía cardíaca previa, que está presente en el 40-70% de los casos [1,4,12,20]. Cuando se analizan las endocarditis por Aspergillus en receptores de un trasplante de órgano sólido, son frecuentes los antecedentes de infección previa por citomegalovirus, coloniza-ción/infección de la herida quirúrgica, insuficiencia renal grave que precisa hemofiltración y, en el caso del trasplante cardíaco, un mayor número de biopsias endomiocárdicas realizadas cuando la afectación era en la válvula tricúspide [11,28].
Nuestra paciente presentaba una profunda inmunosupresión tanto celular como humoral y había presentado aspergilosis medias-tínica un año y medio antes. A pesar del largo tiempo transcurrido y el tratamiento adecuado de dicho episodio (cirugía y 8 meses de tratamiento antifúngico) es posible que persistiera algún foco de aspergilosis semiinvasiva de progresión silente y lenta a partir de la colección mediastínica residual. Sin embargo, los exámenes ecocar-diográficos de seguimiento que se realizaron durante el año y medio transcurrido entre ambos episodios no evidenciaron ninguna progresión de la masa residual en mediastino anterior hasta la aparición de las tromboembolias pulmonares que dieron lugar al diagnóstico de aspergilosis cardíaca.
En pacientes inmunodeprimidos, la aspergilosis cardíaca suele aparecer en el seno de una infección diseminada [28]. En otras ocasiones se disemina por vía hematógena a partir de un foco pulmonar [23,27,29], digestivo [31], o desconocido [11]. Un trasplantado pulmonar bilateral pre-sentó endocarditis mitral por Aspergillus a los 4 meses del trasplante y el antecedente más significativo era que se había observado la pre-sencia de aspergilomas en los pulmones explantados [26]. Se han descri-to casos asociados a la infección de un marcapasos [10].
La presentación clínica suele incluir la fiebre (74%) y los fenóme-nos embólicos (69%) que pueden afectar al SNC, extremidades infe-riores o pulmón [11,20,25]. Es especialmente significativa la alta frecuen-cia de endoftalmitis, que suele presentarse con una pérdida súbita de visión (13%) [8,27,28]. La endoftalmitis por Aspergillus se ha descrito especialmente en trasplantes de órgano sólido o pacientes operados de corazón. Predominan las áreas de retinitis/coroiditis y se acom-paña de una mortalidad elevada por la alta frecuencia de afectación simultánea del corazón y del SNC [21]. En trasplantados cardíacos, la endocarditis por Aspergillus afecta sobre todo a la válvula mitral y a la tricúspide [28]. La endocarditis mural es más frecuente en receptores de trasplante y se asocia a menos episodios embólicos que la valvular [8].
El diagnóstico de EI por Aspergillus requiere un alto índice de sospecha. Como hemos visto, las manifestaciones clínicas son ines-pecíficas (fiebre, malestar general, astenia). La frecuencia de com-plicaciones tromboembólicas es elevada. Es recomendable consi-derar la posibilidad de endocarditis por Aspergillus en pacientes inmunodeprimidos u operados de corazón con cultivos negativos y presencia de vegetaciones de gran tamaño (> 35mm) o fenóme-nos embólicos [10]. El examen y cultivo del material embolizado puede establecer el diagnóstico, que desgraciadamente con frecuencia es post mórtem [8]. Los hemocultivos son negativos en el más del 90% de los casos [10]. En general, la aspergilemia es extraordinariamente rara (0,5-2% de las fungemias) y, aunque puede representar invasión ti-sular verdadera, ha de excluirse siempre la posibilidad de contami-nación [18]. Por el contrario, el aislamiento de Aspergillus a partir de cualquier muestra respiratoria o de biopsia de un paciente trasplan-tado ha de ser cuidadosamente considerada, ya que tiene un eleva-dísimo valor predictivo positivo de AI [15]. La determinación de galac-tomanano en suero y la PCR sobre muestra directa son dos pruebas fundamentales y complementarias a la confirmación histológica de EI por Aspergillus. El galactomanano ha sido ampliamente estudiado en el diagnóstico de AI en pacientes neutropénicos con alto riesgo de micosis invasora, pero existen muy pocos datos en el contexto de EI [10]. Las técnicas de detección de ADN de Aspergillus mediante PCR no están implantadas de forma sistemática en los laboratorios y los resultados muestran aún gran variabilidad. En nuestro caso la PCR fue positiva, mientras que el galactomanano sérico permaneció negative AI igual que sucedió en nuestro paciente, con frecuencia es necesario realizar un procedimiento quirúrgico que establezca el diagnóstico, proporcionando el material necesario para los exáme-nes microbiológicos e histológicos [3].
Respecto al tratamiento, se recomienda la cirugía en todos los casos de EI de etiología fúngica [2,8,25], aunque algunos pacientes han sobrevivido con la reducción de la inmunosupresión y el tratamiento antifúngico [13,14,22]. En ocasiones, como sucedió en nuestra paciente, la gran extensión y la localización de la masa intracardíaca hicieron im-posible la resección completa de ella. El voriconazol es el fármaco de elección [32]. En los casos clínicos recientemente publicados sobre EI as-pergilar en pacientes trasplantados, se instauraron diferentes combi-naciones de antifúngicos: voriconazol con caspofungina o anfoterici-na B, o anfotericina B con itraconazol [6,18,25,30]. Es esencial considerar la reducción de la inmunosupresión e individualizar la dosificación del voriconazol en función de los niveles séricos, debido a la gran variabilidad interpersonal e intrapersonal [9]. Se acepta que valores en plasma inferiores a 0,25μg/ml son subterapéuticos y el riesgo de toxicidad aumenta si los valores son superiores a 5,5μg/ml. En pacientes inmunodeprimidos es imprescindible considerar también factores como la disfunción hepática, la absorción del fármaco (episodios de mucositis o diarrea) o el uso concomitante de fármacos inductores del meta-bolismo hepático que utilicen isoenzimas comunes del complejo del citocromo P450, como el caso del omeprazol que inhibe la isoenzima CYPC219 perteneciente al complejo P450, encargada de metaboli-zar el voriconazol [5,9]. En el caso de nuestra paciente, esta interacción produjo inicialmente determinaciones muy elevadas en los niveles de antifúngico. El papel de las candinas en esta situación ha de ser evaluado. La duración del tratamiento no está establecida, pero ha de ser, sin duda, prolongado. Hay algunos autores que recomiendan mantenerlo de por vida [19].
La mortalidad de la aspergilosis cardíaca es muy elevada y oscila entre el 77 y el 80% [13,20,24] y, como hemos mencionado, en muchas ocasiones el diagnóstico sólo se establece post mórtem [24].
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
Este estudio fue financiado parcialmente por el CIBER de Enfer-medades Respiratorias (CIBERES) del Instituto de Salud Carlos III (CB06/06/0058).