Antecedentes: Scedosporium es un género que incluye a las especies Scedosporium prolificans y Scedosporium apiospermum. S. apiospermum es la causa de aproximadamente el 25% de las infecciones por hongos filamento-sos diferentes de Aspergillus en pacientes trasplantados de órgano sólido. Este moho coloniza fácilmente lesio-nes residuales y senos faciales, y se encuentran en riesgo especial los pacientes con fibrosis quística colonizados antes del trasplante y los trasplantados unipulmonares. S. apiospermum es un hongo emergente cuya peculiari-dad es su resistencia inherente a la anfotericina B. Este hecho, unido a la dificultad para realizar su identificación (respecto a otros mohos sensibles a este antifúngico) hace complicado el manejo precoz de las escedosporiasis. Caso clínico: Se presenta un caso de infección diseminada por S. apiospermum en un varón de 56 años con trasplante pulmonar. Un micetoma en la pierna derecha fue el primer hallazgo de la enfermedad diseminada. En la discusión se hace referencia a la experiencia publicada y las pautas de tratamiento actual. El trata-miento debe ser enérgico y de tipo médico-quirúrgico cuando el abordaje sea posible. Conclusiones: Una conclusión a extraer de este caso clínico es que se debe recapacitar sobre el posible desa-rrollo de infecciones por hongos emergentes durante el empleo de profilaxis antifúngica. Como conclusión final hay que resaltar que la colonización por Scedosporium en pacientes trasplantados de pulmón con le-siones anatómicas locales y con inmunosupresión alta se debería manejar con un tratamiento antifúngico agresivo, sobre todo en un receptor de un único pulmón o si el paciente tiene rechazo crónico. © 2011 Revista Iberoamericana de Micología. Publicado por Elsevier España, S.L. Todos los derechos reservados.
Background: Scedosporium spp. are filamentous fungi, and the 2 most important species are Scedosporium prolificans and Scedosporium apiospermum. S. apiospermum accounts for approximately 25% of non-Aspergi-llus filamentous fungi infections in organ transplant recipients. Scedosporium can colonize the sinuses and airways of lung recipients with underlying pulmonary diseases, such as bronchiectasis or cystic fibrosis before transplant, and develop invasive disease after lung transplantation. In fact, invasive diseases caused by S. apiospermum have been reported only rarely, in single lung transplant recipients and cystic fibrosis transplant patients. The treatment of scedosporiasis is complicated due to the difficulty in early diagnosis together with inherent resistance to amphotericin B.
Case report: A case of disseminated S. apiospermum infection after single lung transplant in a patient with pulmonary fibrosis is reported. Leg mycetoma was the initial sign of this disseminated infection. In this case report, current treatment options are discussed, and a review of the literature of previously published cases of lung transplants is made.
Conclusions: One conclusion based on this case is the risk of emergent molds related to antifungal prophylaxis. In addition, colonization by Scedosporium in transplant recipients should not be ignored, and target prophylaxis or suppressive therapy should be considered in all those cases with residual lesions in native lung or chronic rejection in transplanted lungs.
Varón de 56 años diagnosticado de fibrosis pulmonar idiopática 4 años antes del trasplante pulmonar. Presentó una evolución tórpida que motivó un trasplante unipulmonar. Como inmunosupresión de mantenimiento se pautó ciclosporina (CsA), azatioprina y corticoi-des. Las concentraciones valle en el posoperatorio inmediato de CsA se mantuvieron alrededor de 350mg/dl y tras los primeros 6 meses eran de 300mg/dl. Las dosis de corticoides fueron altas inicialmente, pero después se pasó a la pauta estándar de 0,5mg/kg de peso (30mg/día), con una reducción progresiva, y a partir del sexto mes fue de 15mg/día.
Al mes postrasplante se diagnosticó en el pulmón implantado una tuberculosis pulmonar, y se instauró un tratamiento específi-co con tres fármacos (isoniazida, rifampicina y etambutol). Este es-quema terapéutico con rifampicina condicionó un aumento de las dosis de CsA para mantener sus concentraciones en el rango terapéutico. No obstante, debido a una importante hepatotoxicidad y a que los cultivos seriados para micobacterias fueron negativos, se suspendió el tratamiento antituberculoso a los 3 meses. A los 4 meses postrasplante, el paciente presentó un rechazo agudo moderado que se controló con bolus intravenosos de corticoides (3g de metil-prednisolona de dosis total) y un aumento de las concentraciones valle de CsA, según el protocolo. A los 6 meses postrasplante, se de-tectó una replicación asintomática de citomegalovirus que motivó el tratamiento con ganciclovir (5mg/kg/12h) intravenoso durante 21 días. A los 10 meses postrasplante, se observó un deterioro de la función pulmonar con una caída del 20% en el volumen espiratorio máximo en el primer segundo, y se diagnosticó un rechazo crónico de grado 1 que motivó un cambio de inmunosupresión (tacrolimus por ciclosporina), y al mes siguiente de micofenolato mofetilo por azatioprina. Se mantuvieron las dosis de corticoides de 15mg/día y las concentraciones plasmáticas de inmunosupresores en un rango terapéutico alto. Al año postrasplante se practicó una broncoscopia para control del injerto y una actualización bacteriológica. Se aisló en el broncoaspirado Candida parapsilosis. Dado que el paciente es-taba estable en su función pulmonar, ambulatorio y asintomático, se administró una profilaxis nebulizada con anfotericina B desoxicolato en aerosol cada 12h. A los 13 meses postrasplante, se aislaron en cultivo de esputo AspergillusfumigatusyScedosporium apiospermum. Se pautó una profilaxis con itraconazol (200mg/día) y anfotericina B desoxicolato (en aerosol cada 8h).
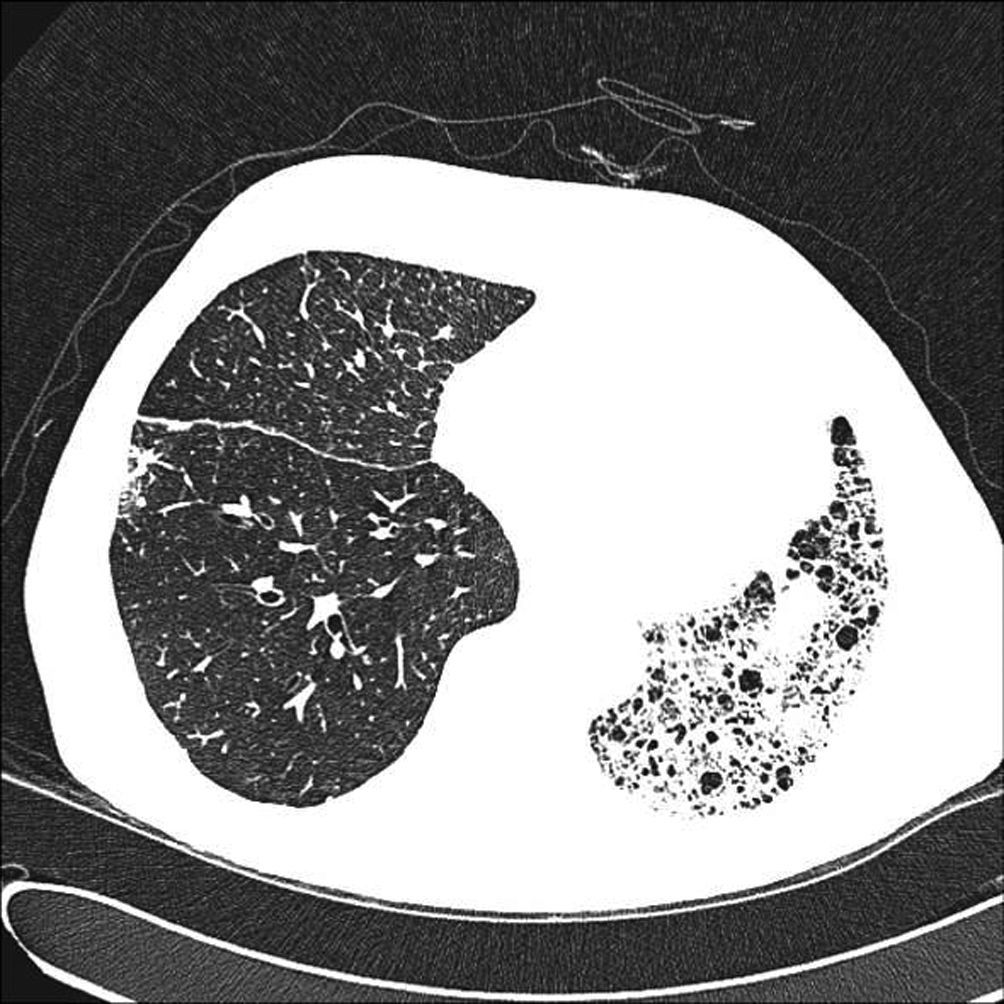
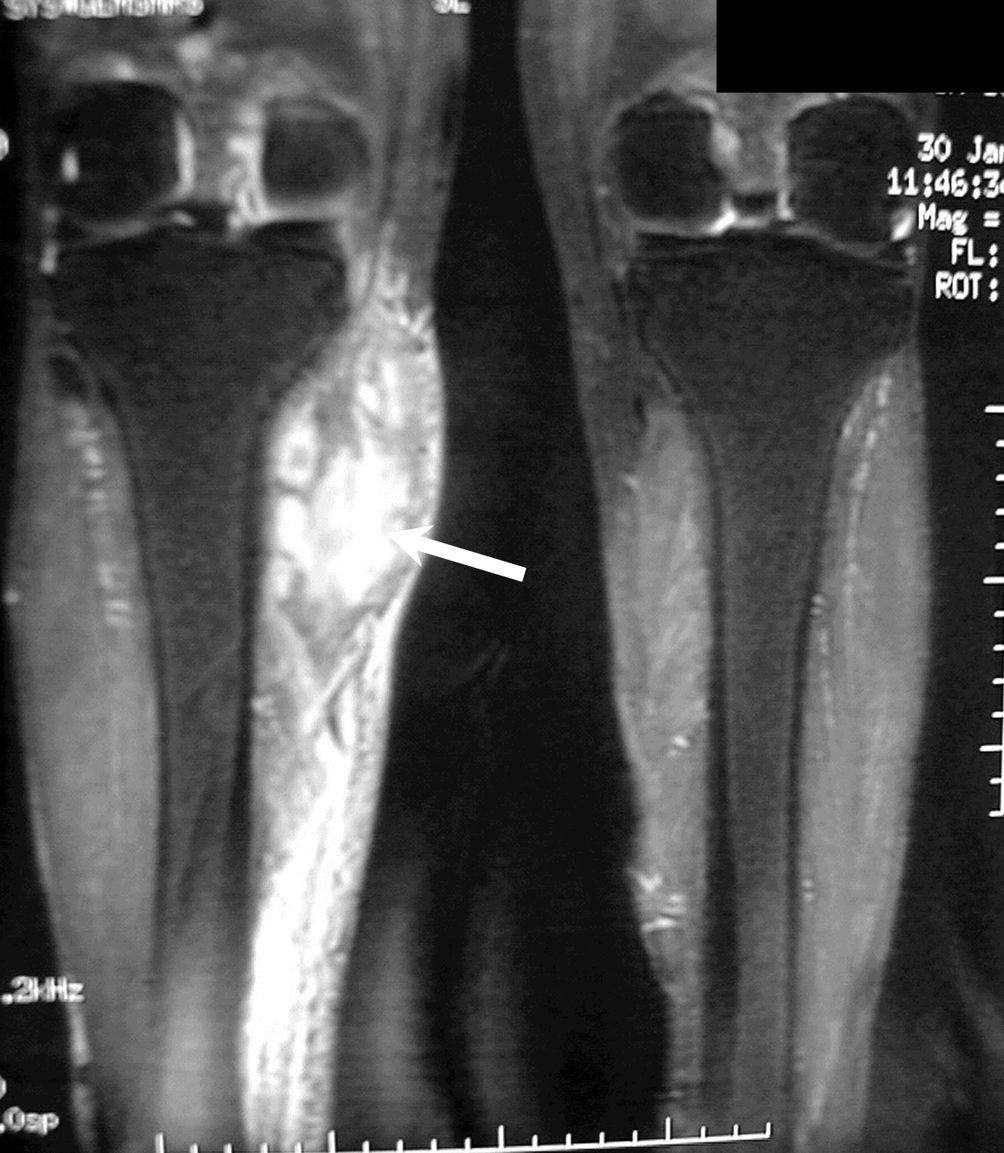
A los 14 meses postrasplante, el paciente acude a consulta por una tumoración (de 2cm x 2cm), en inserción pata de ganso de la pierna derecha, poco dolorosa y sin signos inflamatorios. Al tacto presenta una superficie irregular, está adherida a planos, y tiene una consistencia gomosa. Se ingresa al paciente para ulteriores estudios. Exploración física a su ingreso: talla 168cm, peso 64kg, afebril. Analítica: leucocitos 13.120 (neutrófilos 82%, linfocitos 12%, mono-citos 4,4%); velocidad de sedimentación globular 68; hematocrito 35%; hemoglobina 12g/dl. El resto de los valores estaba dentro de los parámetros normales. Broncoscopia: sutura en buen estado, se-creción serosa. Cultivo lavado broncoalveolar (BAL): Staphylococcus spp. coagulasa negativo, Aspergillusflavus, A. fumigatus y S. apiospermum. Radiografía de tórax y TACAR (tomografía axial computariza-da de alta resolución): pulmón nativo con extensa fibrosis, pero no se observan hallazgos patológicos en el pulmón trasplantado (fig. 1). Ecografía: masa de 3,5 x 5cm en margen interno y proximal de la tibia, de márgenes bien definidos y ecogenicidad heterogé-nea compatible con hematoma. Resonancia magnética: masa de 3 x 7cm compatible con absceso o flemón en el seno de un proceso inflamatorio celulítico adyacente al gemelo interno y próximo a la cara interna la tibia a nivel metafisario (fig. 2). Cultivo del aspirado del nódulo: S. apiospermum. Se instauró tratamiento, con desbrida-miento local y antifúngicos. Se usó una combinación de itraconazol (200mg/12h), terbinafina (250mg/día) y anfotericina lipídica (300mg/24h) durante 40 días. Al no mejorar, se añadió ketoconazol (300mg/12h). El paciente falleció en el 17.° mes postrasplante, por causa de un deterioro clínico progresivo con inicio de diabetes mellitus, insuficiencia renal aguda, infiltrados pulmonares e insuficiencia respiratoria. Se procedió al estudio necrópsico y se observaron abs-cesos subcutáneos en la extremidad inferior derecha, diseminación pulmonar bilateral (difusa en pulmón nativo —izquierdo— y parcial en pulmón derecho) y diseminación renal bilateral.
El género de hongos filamentosos Scedosporium tiene una amplia distribución ambiental. En general son saprofitos, pero son también unos reconocidos patógenos oportunistas. Actualmente son la causa del 25% de las infecciones producidas por mohos diferentes a As-pergillus en los trasplantados pulmonares [8,17,19]. Los casos publicados son anecdóticos y principalmente se observan escedosporiasis en receptores de un trasplante unipulmonar o en pacientes con fibrosis quística [13–15]. Esto se debe a que Scedosporium coloniza fácilmente la vía aérea dañada y las lesiones residuales en el pulmón nativo. Así, en situaciones de aumento de inmunosupresión o de tratamiento con corticoides, es fácil que se pase de una colonización a una en-fermedad invasora. En general, en los pacientes con fibrosis quística son infecciones más precoces y están en relación con colonizacio-nes previas al pretrasplante por estos mohos [13,18]. En los receptores unipulmonares, estas infecciones se asocian con una evolución tórpida del injerto pulmonar que favorece la infección, actuando el pulmón nativo como reservorio de gérmenes. Su presentación clíni-ca va desde formas localizadas pulmonares a diseminadas, siendo el pronóstico peor cuanto mayor es el grado de inmunosupresión del paciente, hay afectación del sistema nervioso central o presencia de fungemia [4,9,18,21].
No hay un tratamiento óptimo para las escedosporiasis. En el año 2002 la Agencia Europea del Medicamento aprobó la inclusión del voriconazol para el tratamiento de las infecciones graves causadas por S. apiospermum (el caso descrito ocurrió en 2001). Además, se recomienda el tratamiento quirúrgico tanto en las formas pulmonares invasoras localizadas, como en infecciones en otras ubicacio-nes accesibles [19]. En el momento actual, se considera al voriconazol como el fármaco de elección para el tratamiento de las infecciones por S. apiospermum[3,13,21]. Se han descrito resultados favorables con voriconazol tanto en las formas localizadas, como en las diseminadas [7,20]. La mayoría de los aislamientos de S. apiospermum tienen ba-jas concentraciones mínimas inhibitorias (CMI) para el voriconazol (entre 0,125 y 2μg/ml), y en general unas CMI mayores para el resto de los antifúngicos. De hecho, aunque las mejores sensibilidades in vitro se han descrito con voriconazol, S. apiospermum es sensible a miconazol, ketoconazol, itraconazol y posaconazol. Respecto a las infecciones producidas por S. prolificans, tanto los valores de CMI como la respuesta clínica observada son peores, dado que este hon-go es resistente in vitro a todos los antifúngicos [3,21]. Se ha observado cierta sinergia entre algunos antifúngicos cuando se usan en com-binación. Así, se ha descrito que la combinación de terbinafina con itraconazol, miconazol o voriconazol resulta sinérgica en un 85% de los aislamientos estudiados, reduciendo las CMI [4,8,10,11,19]. La combinación de voriconazol con anfotericina B y micafungina es sinérgica en el 50% de los casos, tanto para aislamientos de S. prolificans como de S. apiospermum[1,2,4–6,12].
Recientemente se ha publicado la experiencia de varios progra-mas de trasplante pulmonar en infecciones por S. apiospermum[12–14]. Un grupo australiano ha comunicado los primeros dos casos de infección diseminada descritos en la bibliografía, con una buena evolución y con un tratamiento exclusivamente médico con voriconazol de por vida. En ambos se trataba de trasplantes unipulmonares en los cuales el pulmón nativo era el reservorio de S. apiospermum[13]. El grupo de Cleveland, con cinco casos de infección por S. apiospermum en receptores de trasplante pulmonar, concluye que la fibrosis quística colonizada pretrasplante es el principal factor de riesgo para una infección ulterior [15]. Más recientemente se ha publicado otro caso de infección diseminada en un receptor con fibrosis quística con un des-enlace fatal [13]. En algunos de estos trasplantados, ante situaciones de aumento de inmunosupresión o corticoides por un rechazo agudo, el paciente desarrolla una enfermedad fúngica invasora a pesar de llevar una profilaxis antifúngica adecuada, lo que orienta a llevar a cabo una mayor vigilancia en estos casos o ser más agresivos en el tratamiento. En general, la mortalidad es superior al 65%, y ronda casi el 100% en las fungemias o cuando hay afectación del sistema nervio-so central [13,21].
Este caso clínico pone de manifiesto un tema controvertido como es el de la profilaxis antifúngica en el trasplante pulmonar, princi-palmente tras el período inicial de los primeros 3 meses. Además, recientemente se ha apuntado que en las colonizaciones por mohos diferentes de Aspergillus no es rentable la profilaxis antifúngica [16]. En nuestra experiencia, después de 20 años de realizar trasplantes pul-monares, cuando se detecta una colonización por un moho en esputo o muestra respiratoria, y existen factores de riesgo (pulmón nativo o bronquiectasias como resultado del rechazo crónico), se prefiere una profilaxis antifúngica dirigida de forma agresiva durante un largo período.
3ConclusionesEste caso clínico reúne las características típicas de las esce-dosporiasis en receptores de trasplante pulmonar: la existencia de factores de riesgo locales y sistémicos que favorecen la infección, y un diagnóstico de certeza cuando la enfermedad está avanzada. Es posible que la profilaxis inicial con anfotericina B desoxicolato nebulizada y la elevada inmunosupresión del paciente favorecieran la infección por este hongo emergente. En este caso no se solicitó un uso compasivo con voriconazol, que podría haber modificado el desenlace final. Dada la escasez de evidencias en trasplante pulmonar, una conclusión para extraer de este caso es que, ante una colonización respiratoria por Scedosporium, se debe actuar de forma agresiva si existen factores de riesgo, como la presencia de lesiones residuales o bronquiectasias en el pulmón (tanto nativo como tras-plantado), y hay que controlar de forma estricta la evolución del paciente.