El β-(1,3)(1,6)-D-glucano es un compuesto de la pared celular de los hongos que presenta efectos inmunomoduladores y anticancerígenos. La (1,3)-β-glucano sintasa es una de las principales enzimas involucradas en su síntesis.
ObjetivosDiseñar cebadores para amplificar y caracterizar parcialmente el gen correspondiente a la enzima (1,3)-β-glucano sintasa y probarlos en la cepa CP-132 de Ganoderma lucidum.
MétodosLos cebadores fueron diseñados realizando una búsqueda de la secuencia del gen en otros hongos. Después, con la técnica de PCR se probaron los cebadores utilizando ADN extraído de la cepa CP-382 de G. lucidum. Las secuencias obtenidas se compararon con aquellas de la base de datos del GenBank.
ResultadosSe diseñaron 3 pares de cebadores. Todos los pares amplificaron productos de PCR de tamaño esperado. Las secuencias amplificadas con los pares BGS2113UmF y BGS3097UmR, y BGS547UmF y BGS2113UmR correspondieron a un par de secciones del gen de la (1,3)-β-glucano sintasa. Las secuencias deducidas de aminoácidos mostraron una similitud alta con genes homólogos de otros hongos, especialmente con aquellos de la clase Agaricomycetes.
ConclusionesEl diseño de cebadores para amplificar parcialmente el gen de la (1,3)-β-glucano sintasa a partir de secuencias de genes homólogos fue exitoso. Estos cebadores permitirán en un futuro la caracterización de esta importante enzima en un amplio grupo de hongos.
β-(1,3)(1,6)-D-glucan is fungal cell wall component that has demonstrated immunomodulatory and anti-cancer effects. The (1,3)-β-glucan synthase is one of the main enzymes involved in its biosynthesis.
AimsTo design primers to partially amplify and characterize the (1,3)-β-glucan synthase gene and to determine them in Ganoderma lucidum (G. Lucidum) strain CP-132.
MethodsThe primers were designed on the basis of homologous genes in other fungi. Then, using the PCR technique, primers were tested using DNA extracted from the G. lucidum strain CP-382. Amplified sequences were compared with those from the GenBank.
ResultsThree primer pairs were designed; all of them produced amplicons of the expected size. The sequences obtained with primer pairs BGS2113UmF and BGS3097UmR, and BGS547UmF and BGS2113UmR matched with 2 sections of the (1,3)-β-glucan synthase gene. The deduced amino acid sequences showed high similarity with homologous genes from other fungi, particularly with those of the Agaricomycetes class.
ConclusionsThe primer design to partially amplify the (1,3)-β-glucan synthase gene of G. lucidum using sequences from homologous genes was successful. These primers will allow to characterize this important enzyme in a wide group of fungi.
Los glucanos son polímeros de glucosa unidos por enlaces glucosídicos, y dependiendo del tipo de enlace pueden ser α-glucanos o β-glucanos. Estas moléculas tienen diferentes funciones en las células; pueden servir como reserva energética, elementos estructurales de la pared celular, componentes de proteínas, etc.8,16. El β-D-glucano de levaduras y hongos como Ganoderma lucidum posee una cadena de grupos glucopiranosil unidos por enlaces β-(1,3), con diversos grados de ramificación en la posición C6, formando enlaces β-(1,6)20. La ruta metabólica para la síntesis de β-(1,3)-D-glucano (cadena principal de estos glucanos) ha sido propuesta para diversos microorganismos (http://www.genome.jp/kegg/pathway/map/map00500.html); esta ruta es muy similar a la diseñada para G. lucidum21. Las enzimas involucradas en la síntesis del β-(1,3)-D-glucano son la α-glucosidasa, β-fructofuranosidasa, hexocinasa, glucosa-6-fosfato isomerasa, fosfoglucomutasa, UDP-glucosa pirofosforilasa y (1,3)-β-glucano sintasa. El conocimiento de los genes que se encargan de la síntesis de las enzimas participantes en el metabolismo del β-(1,3)-D-glucano es muy escaso. Recientemente, gracias a la secuenciación del genoma de G. lucidum, se ha inferido que su cepa 260125-1 tiene 2 genes de (1,3)-β-glucano sintasa y 7 de proteínas asociadas a la síntesis de moléculas de β-glucano3. Sin embargo, las secuencias anotadas de estos genes aún no están disponibles en las bases de datos del NCBI.
A nivel mundial la producción de estos glucanos a partir de hongos, principalmente de G. lucidum, se realiza mediante la obtención de basidiomas. Dicho proceso podría ser optimizado con el conocimiento de los genes que están involucrados en la síntesis del β-(1,3)-D-glucano, ya que se sentarían las bases para el desarrollo de cepas mejoradas, con un mejor aprovechamiento de los nutrientes y una mayor producción de estos polisacáridos.
En este trabajo se utilizaron las cepas CP-145 y CP-382 de G. lucidum donadas e identificadas por el Centro de Recursos Genéticos de Hongos Comestibles, Funcionales y Medicinales del Colegio de Postgraduados, Campus Puebla, México12, así como la cepa IE-796 donada por el Instituto de Ecología de Xalapa, México. Para verificar la identidad de las cepas, se amplificó la región ITS1-5.8S-ITS2 del ADN ribosomal. Para la reacción de PCR se utilizaron los cebadores ITS1-F e ITS4-B y el programa de PCR reportados por Gardes y Bruns5. Los productos de PCR obtenidos se enviaron a secuenciar a la unidad de secuenciación del Instituto de Biología de la UNAM.
Para el diseño de los cebadores de la (1,3)-β-glucano sintasa se realizó una búsqueda de las secuencias del gen en otros hongos en la base de datos del GenBank (www.ncbi.nlm.nih.gov/genbank). En el momento de diseñar los cebadores, solo estaban disponibles las secuencias del gen de Cryptococcus neoformans-AF10288219, Saccharomyces cerevisiae-AY39569314 y Ustilago maydis-XM_7526932, por lo que fueron estas las que se usaron como molde. Las secuencias se alinearon con el programa «Vector NTI» y, posteriormente, se eligieron las regiones conservadas al inicio en medio y al final de las secuencias. Debido a la distancia filogenética de los organismos usados como molde y a que se pretendía que los cebadores se pudieran usar en una amplia gama de hongos, estos se diseñaron con bases degeneradas. Cada iniciador fue sometido a un proceso de análisis en el que se consideró el porcentaje de GC, la temperatura de alineamiento, la formación de dímeros y horquillas, así como el número de bases degeneradas18.
Una vez sintetizados los cebadores, para conocer las temperaturas óptimas de alineamiento se realizó una PCR usando el ADN extraído de la cepa de CP-382 de G. lucidum. La mezcla maestra para cada una de las amplificaciones se formuló con reactivos de Invitrogen® en reacciones de 20μl manteniendo las concentraciones que se indican a continuación: Taq polimerasa (1U), buffer (1X), MgCl2 (3mM), dNTP (0,2mM), cebadores (0,2μM cada uno) y ADN (70-150ng). El programa de PCR constó de una desnaturalización a 94°C durante 1min, seguida por 35 ciclos de desnaturalización a 94°C durante 30seg, alineamiento con un gradiente de temperaturas durante 30seg, extensión a 72°C durante 90seg y una extensión final a 72°C durante 3min. La calidad de los productos de PCR se evaluó por electroforesis en un gel de agarosa al 1,5%. Una vez establecida la temperatura óptima de alineamiento para cada par de cebadores, se realizaron variaciones en la concentración de MgCl2 con la finalidad de optimizar la reacción de PCR18. Ya con las condiciones óptimas de amplificación para cada par de cebadores se llevaron a cabo reacciones de PCR de 100μL; las reacciones de PCR que produjeron 2 o más bandas fueron separadas en un gel de agarosa al 1,5% con la finalidad de purificar solo el fragmento de peso molecular esperado. Esto se llevó a cabo empleando el kit QIAquick Gel Extraction Kit (QIAGEN, Alemania), siguiendo las instrucciones del fabricante. Una vez purificados los fragmentos del peso molecular esperado, se secuenciaron en el Instituto de Biología de la UNAM.
Las secuencias de ambos sentidos fueron alineadas y editadas con el software Sequencher 4.7. Con estas secuencias, se llevó a cabo la codificación de aminoácidos considerando los 3 diferentes marcos de lectura posibles. Se consideró válido el marco de lectura que no resultara en algún codón de paro en la región intermedia de la secuencia. Las secuencias de nucleótidos se compararon con la base de datos del GenBank mediante el algoritmo «blastn» y las secuencias de aminoácidos se compararon con el algoritmo «blastp»1. Las secuencias de aminoácidos de los fragmentos de la (1,3)-β-glucano sintasa de G. lucidum se alinearon con las secuencias de aminoácidos correspondientes a los genes de los organismos resultantes en el BLAST. Finalmente, con este alineamiento se llevó a cabo un análisis filogenético por medio del método bayesiano en MrBayes 3.1.117. El análisis bayesiano se realizó con 4 cadenas Monte Carlo sobre 1.100.000 generaciones, con muestreo cada 200 generaciones, y valor de temperatura de 0,2. Se guardó el registro de la longitud de las ramas y se calculó su probabilidad posterior.
Las secuencias de ITS de las cepas CP-382 (JX270802) y CP-145 (JX270803) se diferenciaron entre ellas solo por un nucleótido. Ambas cepas mostraron una similitud del 98% con la cepa GI-22 de G. lucidum reportada por Huang et al.7, confirmando la identificación previa12. Los resultados del BLAST para la cepa IE-796 (JX270804) mostraron que esta es en un 99% similar a la cepa DP-107 de Ganoderma resinaceum6. Por lo anterior, se decidió trabajar en el resto de los experimentos con la cepa CP-382.
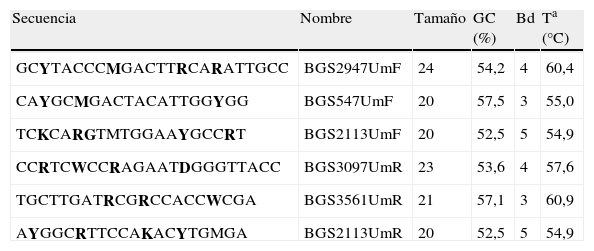
En la tabla 1 se resumen las características de los cebadores diseñados. La temperatura óptima de alineamiento para el par BGS2113UmF y BGS3097UmR fue de 54,4°C, para el par BGS547UmF y BGS2113UmR fue de 57,1°C y para el par BGS2947UmF y BGS3561UmR de 55°C. En general, se obtuvieron fragmentos del peso molecular esperado, que era de 984 pares de bases (pb) para BGS2113UmF y BGS3097UmR, 1.566pb para BGS547UmF y BGS2113UmR y 614pb para BGS2947UmF y BGS3561UmR. Sin embargo, debido a la degeneración de los cebadores, en cada producto de PCR se obtuvo más de una banda. Los fragmentos purificados y enviados a secuenciar fueron los de 1.000, 1.500 y 600pb, respectivamente.
Secuencia y características de los cebadores diseñados
| Secuencia | Nombre | Tamaño | GC (%) | Bd | Ta (°C) |
| GCYTACCCMGACTTRCARATTGCC | BGS2947UmF | 24 | 54,2 | 4 | 60,4 |
| CAYGCMGACTACATTGGYGG | BGS547UmF | 20 | 57,5 | 3 | 55,0 |
| TCKCARGTMTGGAAYGCCRT | BGS2113UmF | 20 | 52,5 | 5 | 54,9 |
| CCRTCWCCRAGAATDGGGTTACC | BGS3097UmR | 23 | 53,6 | 4 | 57,6 |
| TGCTTGATRCGRCCACCWCGA | BGS3561UmR | 21 | 57,1 | 3 | 60,9 |
| AYGGCRTTCCAKACYTGMGA | BGS2113UmR | 20 | 52,5 | 5 | 54,9 |
Bd: número de bases degeneradas; GC (%): porcentaje de guaninas y citosinas; Ta (°C): temperatura de alineamiento teórica en grados centígrados; Tamaño: tamaño del iniciador en nucleótidos. Las bases degeneradas se indican en negrita.
Al realizar la comparación de las 3 secuencias de nucleótidos obtenidas, se encontró que aquella amplificada con los cebadores BGS2947UmF y BGS3561UmR no mostró similitud alguna con el gen de interés. Sin embargo, las secuencias obtenidas con los cebadores BGS547UmF y BGS2113UmR (fragmento 1) y BGS2113UmF y BGS3097UmR (fragmento 2) mostraron similitud con el gen de la (1,3)-β-glucano sintasa de diferentes hongos. La tabla 2 muestra los resultados del alineamiento de nucleótidos y aminoácidos de los 2 fragmentos. Las secuencias de nucleótidos y las de aminoácidos deducidas de la (1,3)-β-glucano sintasa fueron depositadas bajo el número de acceso JX270805. Los resultados anteriores mostraron que existe similitud entre los fragmentos obtenidos y el gen de la (1,3)-β-glucano sintasa de algunos basidiomicetos, estando incluidos los 2 hongos utilizados para el diseño de cebadores de esta enzima, C. neoformans-AF10288219 y U. maydis-XM_7526932.
Análisis de similitud de las secuencias de los genes de la enzima (1,3)-β-glucano sintasa de Ganoderma lucidum con secuencias depositadas en el GenBank
| Fragmento (cebadores) | Organismo | Nucleótidos («blastn») | Aminoácidos («blastp») | ||
| Clave GenBank | % Sim | Clave GenBank | % Sim | ||
| Fragmento 1 (BGS547UmF y BGS2113UmR) | Laccaria bicolor | XM_001875351 | 76 | XP_001875386 | 86 |
| Coprinopsis cinerea | XM_001833221 | 75 | XP_001833273 | 84 | |
| Ustilago maydis | XM_752693 | 79 | XP_757786 | 71 | |
| Cryptococcus neoformans | XM_568719 | 74 | XP_568719 | 76 | |
| Fragmento 2 (BGS2113UmF y BGS3097UmR) | Moniliophthora perniciosa | XM_002392134 | 75 | XP_002392175 | 85 |
| Coprinopsis cinerea | XM_001833221 | 75 | XP_001833273 | 84 | |
| Laccaria bicolor | XM_001875351 | 74 | XP_001875386 | 85 | |
| Ustilago maydis | XM_752693 | 74 | XP_757786 | 77 | |
| Cryptococcus neoformans | XM_568719 | 73 | XP_568719 | 76 | |
% Sim: porcentaje de similitud de nucleótidos y aminoácidos.
El diseño de cebadores con bases degeneradas es una herramienta muy útil cuando se quieren caracterizar genes o regiones de ADN para las cuales hay pocas secuencias en las bases de datos públicas. Aunque aquí usamos hongos filogenéticamente lejanos como molde para diseñar los cebadores de la (1,3)-β-glucano sintasa, estos sí permitieron obtener las secuencias de algunas regiones del gen en G. lucidum. Aunque las bases degeneradas le restan especificidad a los cebadores y se obtuvieron amplificaciones que no pertenecen a la región objetivo, fue posible separar estos fragmentos y obtener las secuencias deseadas. Con las secuencias obtenidas de G. lucidum es posible diseñar cebadores más específicos e incluso cebadores para obtener las regiones aledañas o intermedias a los fragmentos conocidos.
Logramos secuenciar 2 fragmentos de la (1,3)-β-glucano sintasa de G. lucidum, que, en general, mantienen similitudes no mayores al 79% con los genes de otros hongos, para el caso de las secuencias de nucleótidos, mientras que las secuencias deducidas de aminoácidos mostraron similitudes de hasta el 86%. La secuencia deducida de aminoácidos del fragmento 1 también tuvo una similitud con regiones del dominio 1 de la subunidad catalítica FKS1 de la (1,3)-β-glucano sintasa4,15 de ascomicetos, tales como Aspergillus clavatus13 y Candida albicans10. El análisis filogenético que realizamos (fig. 1) demuestra que la evolución de este gen refleja las relaciones filogenéticas al menos a nivel de clases de hongos verdaderos. Como era de esperar, el fragmento 1 del gen de la enzima (1,3)-β-glucano sintasa de G. lucidum mantiene una estrecha relación con los genes de esta enzima correspondientes a los basidiomicetos Coprinopsis cinerea (C. cinerea)-XM 00183322115 y Laccaria bicolor (L. bicolor)-XM 0018753519 (fig. 1), ya que, al igual que G. lucidum, ambos pertenecen a la clase de los Agaricomycetes, mientras que U. maydis y C. neoformans pertenecen a la clase de los Ustilagomycetes y de los Tremellomycetes, respectivamente. De forma similar, el fragmento 2 de la misma enzima fue agrupado con los Agaricomycetes C. cinerea-XM 0018332212, L. bicolor-XM 0018753519 y Moniliophthora perniciosa-XM 00239213411. Es interesante que aunque estos genes son considerablemente diferentes en cuanto a su composición de nucleótidos, la secuencia de aminoácidos es más conservada. El gen de la (1,3)-β-glucano sintasa ha sido caracterizado para muy pocos hongos; sin embargo, las diferencias existentes podrían ser la base de la gran diversidad estructural del (1,3)-β-glucano entre los hongos verdaderos.
Los autores agradecen al Consejo Nacional de Ciencia y Tecnología de México (CONACyT) la beca otorgada a JVGT. Se agradece al Instituto de Ciencia y Tecnología del Distrito Federal (ICyT-México) PIC508-56 y a PAPIIT-UNAM IN218210 su financiamiento a este proyecto.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.