Los tratamientos biológicos para enfermedades inflamatorias crónicas de base inmune, en especial los fármacos inhibidores de citocinas, como los antagonistas del TNF-α (tumor necrosis factor alpha factor de necrosis tumoral alfa), han sido aceptablemente bien tolerados en los ensayos clínicos con pacientes afectados de procesos reumatológicos, dermatológicos y gastrointestinales. Sin embargo, los estudios de farmacovigilancia y el seguimiento a más largo plazo han matizado varios aspectos sobre su seguridad en su uso cotidiano. Los efectos adversos asociados a los inhibidores del TNF-α pueden estar relacionados con la diana (o de clase) o con el agente. Los efectos adversos relacionados con la diana incluyen aquellos potencialmente atribuibles a la inmunosupresión inherente al bloqueo de la citocina principal, lo que incrementa la susceptibilidad a las infecciones y a las neoplasias.
ObjetivosExponer y concienciar acerca del riesgo potencial de causar infecciones graves, oportunistas o no, inherentes al empleo de tratamientos biológicos y, en concreto, de fármacos bloqueadores del TNF-α, a partir de la descripción de un caso de infección fúngica invasiva.
MétodosRevisión de la historia clínica a partir de la selección del caso obtenido en la base de datos de pacientes con enfermedades inflamatorias crónicas de base autoinmune, candidatos o a los que se les realizan nuevos tratamientos biológicos, y estudio de los aislamientos microbiológicos procedentes de las muestras clínicas significativas.
ResultadosSe comunica un caso de infección oportunista dual (nocardiosis y aspergilosis) de difícil diagnóstico y complejo tratamiento en un paciente afectado de enfermedad de Crohn e inmunodeprimido, que se desencadenó tras la administración de infliximab (anticuerpo monoclonal anti-TNF-α).
ConclusionesLas infecciones fúngicas invasivas, bien con presentación clínica aislada o asociadas a otras infecciones oportunistas, están emergiendo en nuevos grupos de riesgo, como son los pacientes receptores de tratamientos biológicos anticitocinas reguladoras de la inflamación y de la inmunidad. Pueden ser potencialmente graves y se precisa un alto índice de sospecha para su diagnóstico precoz. En los pacientes con mayor riesgo de presentarlas deben investigarse las posibles medidas preventivas para evitar su aparición o minimizar su trascendencia.
The biological therapies for chronic inflammatory diseases of autoimmune origin, particularly drugs inhibiting cytokines, such as the antagonists of the tumoral necrosis factor alpha (TNFα), are acceptably well tolerated in patients suffering rheumatologic, dermatologic and gastrointestinal pathologies. Nevertheless, pharmacologic vigilance studies have clarified several aspects of their security in daily clinical use. The adverse effects associated with inhibitors of TNFα can be related to the target (or class) and to the agent. The adverse effects related to the target include those potentially attributable to the inherent immunosuppressive state due to the blockade of the main cytokine, phenomenon that could increase the susceptibility to the infections and cancer.
AimsTo expound the potential risk of serious infections, opportunistic or not, inherent to the use of biological therapies and, specifically, antagonistic drugs of TNFα, from the description of a case of invasive fungal infection.
MethodsRevision of clinical records, obtained from the chronic inflammatory disease of autoimmune origin patient database, candidates or recipients of the new biological therapies, and study of the microbiological isolates.
ResultsConclusions
Invasive fungal infections, with isolated or associated clinical presentation to other opportunistic infections, are emerging in new groups-at-risk as they are the recipients of anti-cytokine biological therapies, regulators of inflammation and immunity. They can be potentially serious in their evolution and a high index of suspicion is needed sometimes for their prompt diagnosis. Possible preventive measures in patients with a high risk of suffering them will have to be investigated.
Los modernos tratamientos con agentes biológicos para la terapia de las enfermedades inflamatorias crónicas de origen inmune han supuesto un cambio muy favorable en la actitud diagnóstico-terapéutica, el curso evolutivo y el pronóstico de estos procesos39. Entre las posibles estrategias de intervención inmunológica destaca el bloqueo de la actividad de las citocinas proinflamatorias. El TNF-α (tumor necrosis factor alpha ‘factor de necrosis tumoral alfa’) se ha configurado en los últimos años como una de las dianas moleculares más interesantes sobre las que actuar para modular su sobreexpresión y controlar la actividad inflamatoria de la enfermedad de base. De entre los nuevos fármacos comercializados para el uso clínico, el infliximab, el adalimumab y el etanercept actúan bloqueando la actividad del TNF-α27. Los 2 primeros son anticuerpos monoclonales (infliximab: 25% murino y 75% humano; adalimumab: 100% humano) y el último (etanercept) es una proteína de fusión dimérica que mimetiza el receptor soluble del TNF-α. Cada fármaco tiene una estructura molecular y un mecanismo intrínseco de acción característico; además, sus propiedades farmacocinéticas y farmacodinámicas también son distintas, por lo que las indicaciones y el perfil de seguridad son diferentes7,18,38.
Sin embargo, la gran eficacia demostrada por estos fármacos se ha visto condicionada por la aparición de efectos adversos derivados del bloqueo de las funciones no sólo proinflamatorias, sino también inmunomoduladoras, de defensa y antitumorales que posee el TNF-α. Entre los efectos secundarios destaca el incremento en el riesgo de presentar infecciones31, tanto por microorganismos convencionales11 como por patógenos oportunistas8, observado en los ensayos clínicos y en los estudios de farmacovigilancia o de seguimiento poscomercialización. De entre estas infecciones oportunistas, muchas de tipo granulomatoso, destacan la tuberculosis, las micobacteriosis atípicas, la listeriosis, la nocardiosis, la rhodococosis, la brucelosis, la leishmaniasis, la neumocistosis y las infecciones por hongos levaduriformes (candidiasis y criptococosis), filamentosos (aspergilosis y cigomicosis) y dimorfos (histoplasmosis). Aunque los pacientes más inmunodeprimidos, como los pacientes infectados por el virus de la inmunodeficiencia humana (VIH) en estadio avanzado de sida y los pacientes trasplantados de órgano sólido o de progenitores hematopoyéticos, tienen mayores probabilidades de presentar más de una infección simultánea por microorganismos oportunistas, este fenómeno de la coinfección temporal por 2 agentes infecciosos granulomatosos no se ha descrito habitualmente en los pacientes que reciben fármacos inhibidores del TNF-α, motivo por el que se comunica el presente caso.
Observación clínicaPaciente de 20 años, natural de Cleveland (Ohio, EE. UU.), diagnosticado 6 años antes de enfermedad de Crohn con afectación ileocólica, alérgico a tetraciclinas y a sulfamidas, que viajó a España para estudiar idiomas. No se le había realizado cirugía digestiva y recibía tratamiento con corticoides (en aquel momento, prednisona en dosis de 15mg/día), mercaptopurina y, en los últimos 2 años, infliximab en infusión intravenosa periódicamente. No había antecedentes de tabaquismo, enolismo ni factores de riesgo, y la prueba de Mantoux había sido negativa antes del inicio de infliximab. Tres semanas antes del episodio motivo del presente artículo, presentó un brote activo de ileopancolitis, por lo que necesitó ingreso hospitalario, incremento de la dosis de corticoides (60mg/día por vía intravenosa) y una nueva administración de infliximab (a dosis doble de 10mg/kg: se había infundido 8 semanas antes en dosis de 5mg/kg). Con esto, pudo controlarse el brote de la enfermedad inflamatoria intestinal y fue dado de alta. Una semana después apareció un cuadro clínico con semiología respiratoria en forma de tos con expectoración mucopurulenta, algún esputo hemoptoico, dolor torácico de características pleuríticas en el hemitórax derecho y sensación de distermia, sin escalofríos, ni síndrome tóxico o consuntivo. En la exploración física destacaba un estado general conservado, presión arterial de 120/80, temperatura de 37,8°C, saturación de oxígeno basal del 98%, sin fétor, boca séptica, lesiones cutáneas ni linfadenopatías. La auscultación cardíaca fue normal y la respiratoria sólo mostró crepitaciones en campos medios. No había masas, organomegalias abdominales ni signos de peritonismo, y el resto de la exploración física general y neurológica fue normal. En las pruebas complementarias, la bioquímica hemática y el sedimento de orina fueron normales, excepto una albúmina de 2,8g/dl. En el hemograma se observó hemoglobina de 10g/dl, volumen corpuscular medio de 105 fl, recuento de leucocitos de 2.700células/ml (el 62% polimorfonucleares) y recuento de plaquetas de 280.000/ml. Los reactantes de fase aguda estaban elevados: velocidad de sedimentación globular de 115mm/h, proteína C reactiva de 261mg/l y fibrinógeno de 703mg/dl. La radiografía simple de tórax mostró unas imágenes alveolares redondeadas, de consolidación parenquimatosa y nodulares, localizadas en los lóbulos pulmonares derechos, algunas de éstas cavitadas (figura 1). Se recogieron esputos seriados en el momento del ingreso y las tinciones directas permitieron observar un bacilo ramificado, arborescente, fino, con disposición en ovillo, tipo actinomicetal, grampositivo y con resistencia parcial al ácido y al alcohol en la tinción de Ziehl modificada. En las preparaciones de blanco de calcoflúor y en las tinciones de plata no se observaron estructuras fúngicas. Las determinaciones de antígenos de Legionella spp. y de neumococo en orina fueron negativas. Los hemocultivos, tras incubación prolongada, también fueron negativos para bacterias, micobacterias y hongos. Las determinaciones de anticuerpos frente al VIH, el virus de la hepatitis B y el virus de la hepatitis C fueron negativas, al igual que una prueba de Mantoux. El antígeno de Cryptococcus y un primer estudio de antígeno galactomanano (Ag-GM) de Aspergillus en sangre fueron negativos (índice de densidad óptica [DO] inferior a 0,5). Había linfopenia de 712células/dl con linfocitos CD4+ de 260células/dl (36%). La ecografía abdominal fue normal y la imagen por tomografía computarizada (TC) torácica mostró múltiples lesiones nodulares bilaterales, de predominio y mayor tamaño en el hemitórax derecho, cavitadas algunas, con adenopatías en el hilio derecho y receso precarinal (figura 2). Por la elevada sospecha de nocardiosis pulmonar, se prescribió tratamiento antibiótico dirigido con imipenem más amikacina (ambas por vía intravenosa). Una semana después persistía la febrícula y el malestar general. Además, el paciente seguía con tos, expectoración más purulenta y hemoptoica y aumento del dolor torácico. Una nueva radiografía de tórax mostró empeoramiento radiológico con aumento en el tamaño y el número de lesiones nodulares bilaterales respecto a la inicial (figura 3). En los cultivos bacterianos de esputo se aislaron colonias blancas, secas, de aspecto tizoso, identificadas como Nocardia brasiliensis. Con la limitación conocida y la falta de estandarización de los métodos de estudio de la resistencia a los antimicrobianos del género Nocardia, el aislamiento de este caso era sensible a imipenem, a aminoglucósidos, a glucopéptidos, a linezolid, a levofloxacino y a moxifloxacino, y era parcial o completamente resistente a tetraciclinas, a cotrimoxazol, al resto de betalactámicos, a macrólidos, a ciprofloxacino y a fosfomicina. Pese a esto y ante la escasa respuesta terapéutica, se realizó un estudio de extensión, en el que se practicó una TC de senos paranasales y cerebral que fueron normales. Poco antes de realizarse una fibrobroncoscopia con lavado broncoalveolar, se recibió el resultado del cultivo de hongos de las muestras iniciales de esputo y de otras posteriores, en las que se aislaban 2 hongos filamentosos identificados como Aspergillus fumigatus y Aspergillus niger. La segunda determinación de Ag-GM de Aspergillus mostró un índice de DO de 0,7. Se inició tratamiento antifúngico con voriconazol intravenoso y el paciente experimentó una rápida y franca mejoría de la semiología respiratoria y del cuadro clínico general: desaparecieron progresivamente la febrícula, la tos, la expectoración, la hemoptisis y el dolor torácico. Posteriormente se lo pudo dar de alta con una combinación, por vía oral, de linezolid más levofloxacino para el tratamiento de la nocardiosis, y de voriconazol para el tratamiento de la aspergilosis pulmonar invasiva. En el seguimiento al mes se constató mejora clínica completa y resolución de los infiltrados radiológicos pulmonares (figura 4). El paciente volvió a su país unas semanas más tarde, por lo que se perdió el seguimiento de éste.
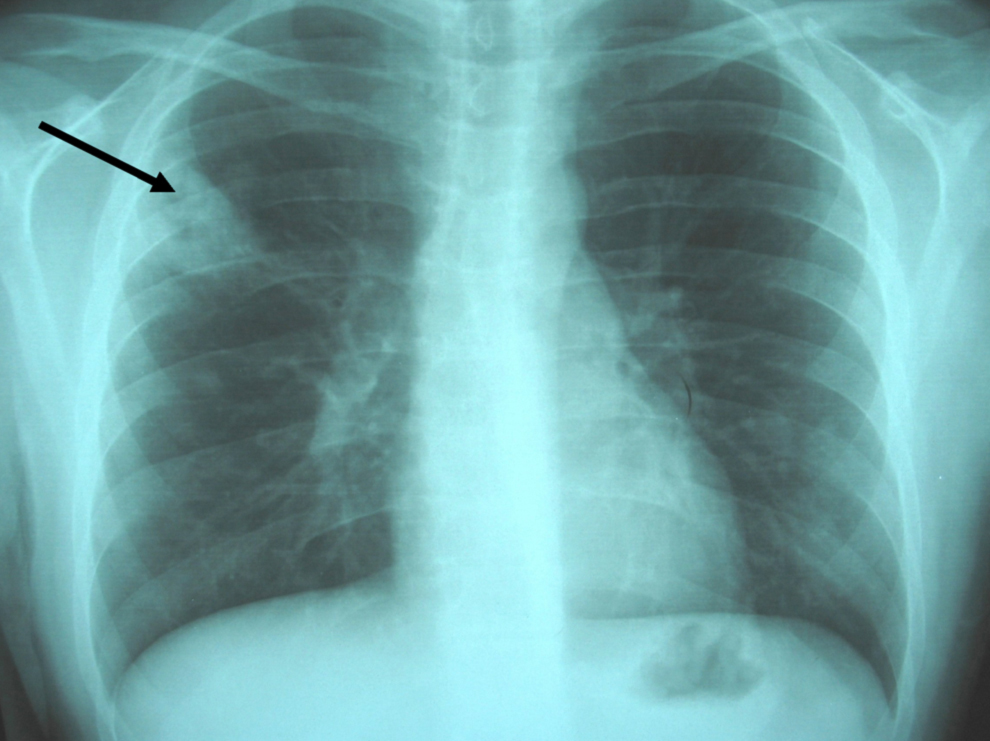
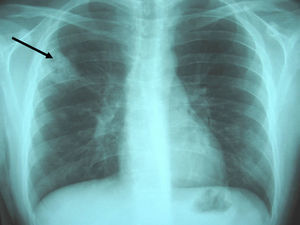
Figura 1. Radiografía simple de tórax: infiltrados pulmonares alveolares de morfología nodular en el hemitórax derecho, especialmente en el lóbulo pulmonar superior, alguno de éstos muestran un fenómeno de cavitación en su interior (flecha).
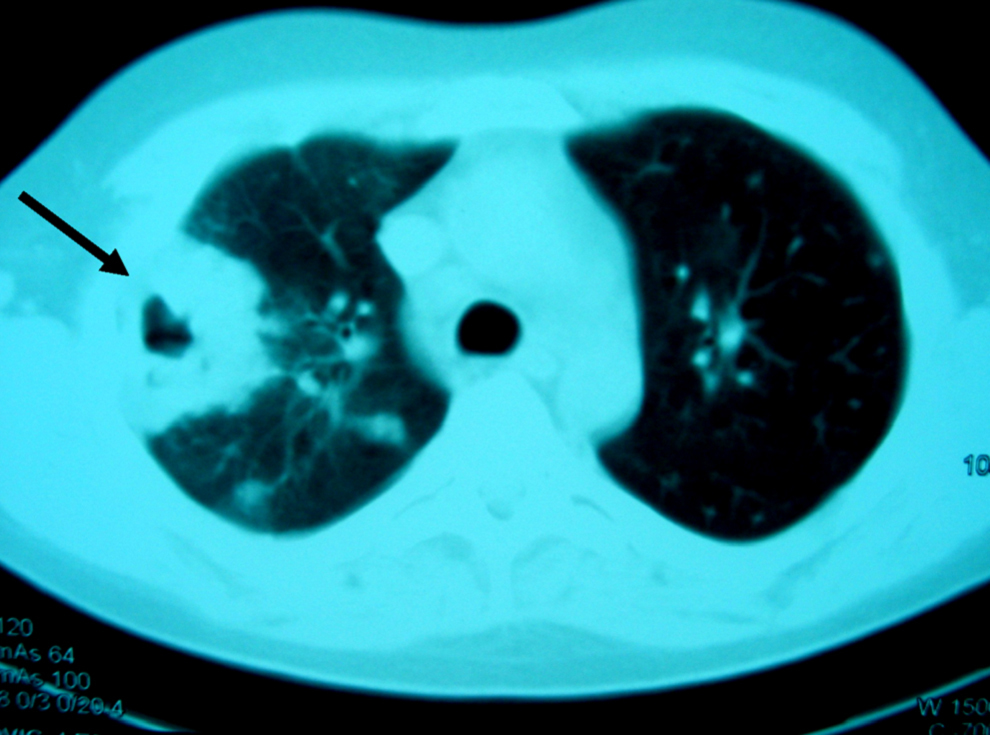
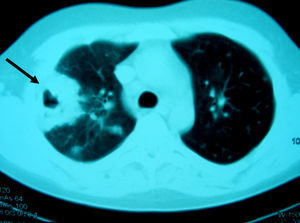
Figura 2. Tomografía computarizada de tórax: múltiples lesiones nodulares bilaterales, de predominio y mayor tamaño en hemitórax derecho, cavitada la mayor de éstas (flecha), con adenopatías en el hilio derecho y receso precarinal.
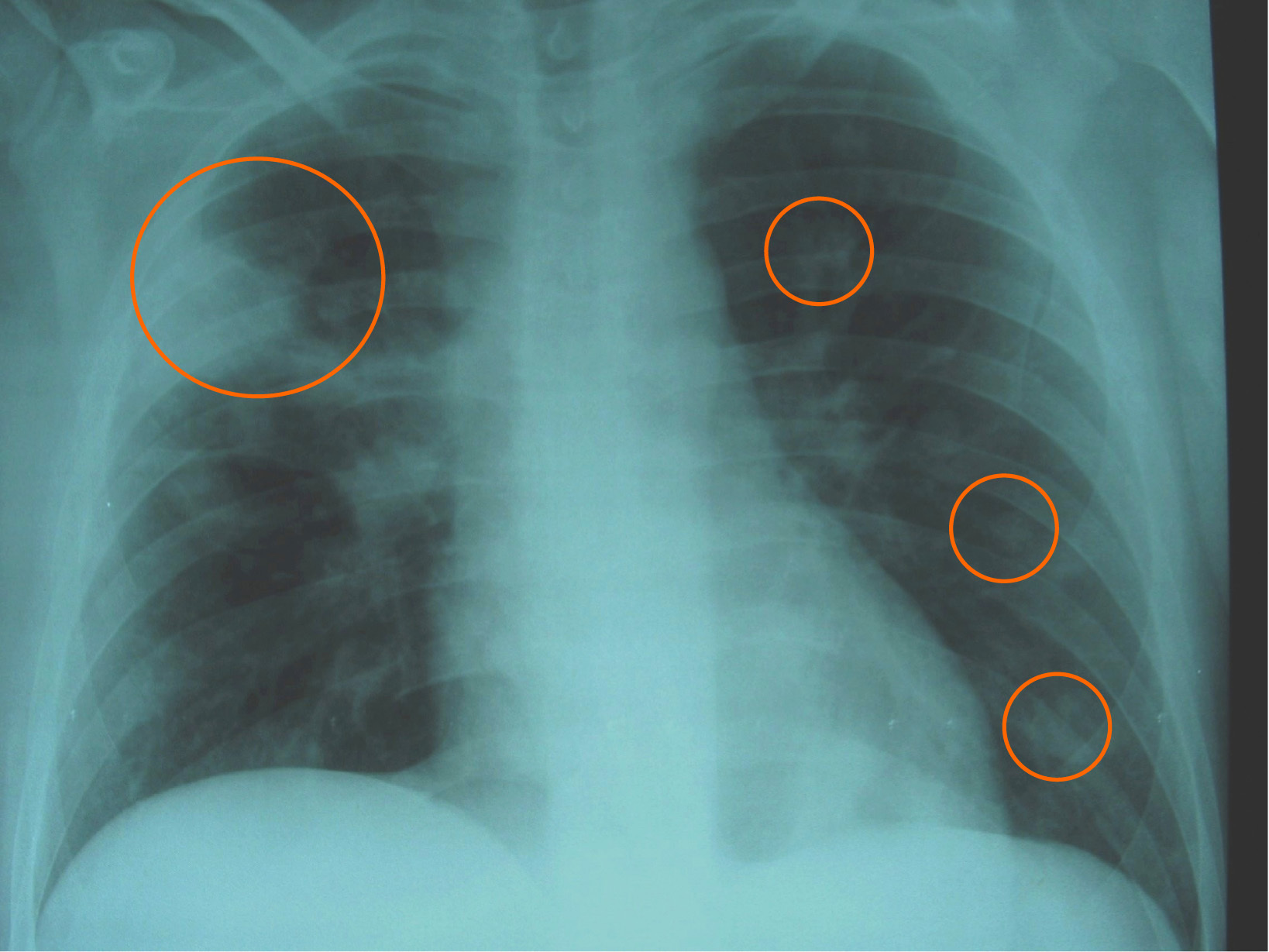
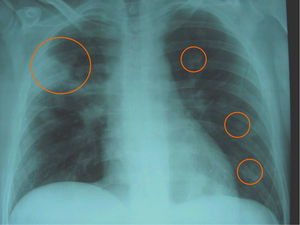
Figura 3. Radiografía de tórax que muestra el empeoramiento radiológico con aumento en el tamaño y el número de las lesiones nodulares, que se hacen bilaterales con mayor nitidez (círculos), respecto a la imagen inicial del ingreso una semana antes.
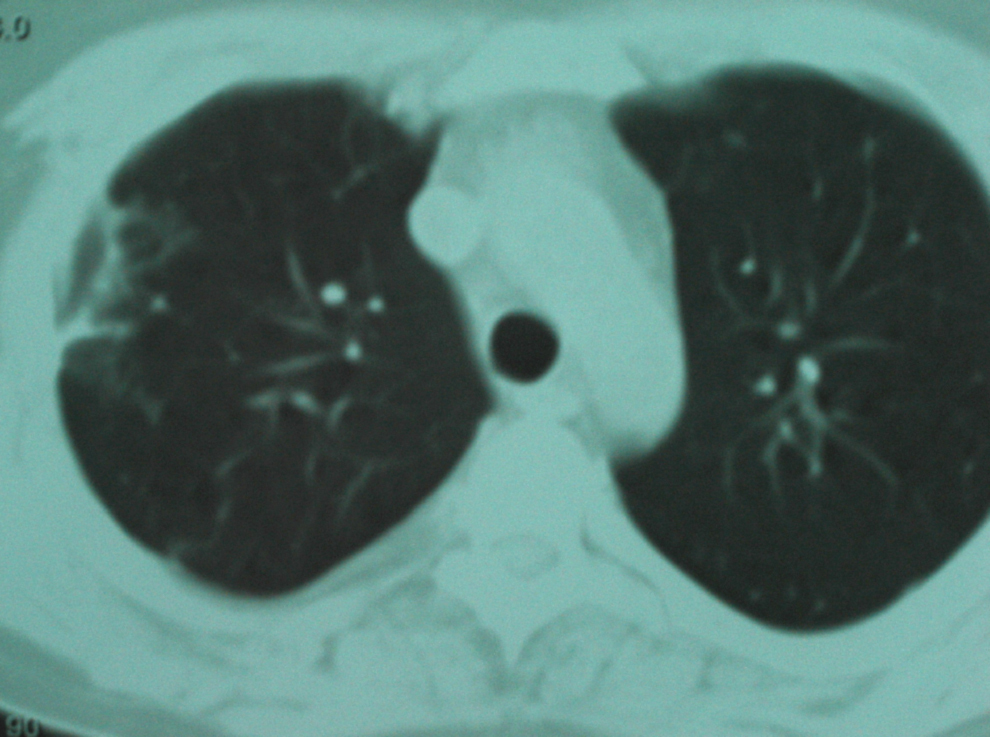
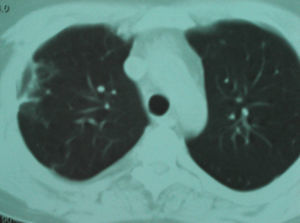
Figura 4. Tomografía computarizada torácica de control al mes del tratamiento, en la que se muestra la resolución casi completa de los infiltrados nodulares bilaterales y se observan sólo lesiones cicatriciales fibrosas residuales en las áreas de lesiones con mayor tamaño.
DiscusiónLos diversos ensayos clínicos, los estudios de seguridad y las notas de farmacovigilancia han apreciado una incidencia alta de infecciones entre pacientes tratados con agentes anti-TNF-α. Las tasas de infección oscilan entre 50 y 62 cada 1.000 personas por año de exposición, y las infecciones más frecuentes son las del tracto respiratorio superior e inferior, las vías urinarias, la piel y los tejidos blandos, y las infecciones posquirúrgicas7,23. Sin embargo, el exceso de riesgo atribuido no es fácil de definir, dada la alta prevalencia basal de infecciones en pacientes con enfermedades inflamatorias crónicas, particularmente en aquellos con formas más graves o avanzadas de la enfermedad. Es difícil caracterizar si el incremento de la susceptibilidad a las infecciones se relaciona con la enfermedad de base en sí misma, con los efectos de los corticoides, de los tratamientos inmunomoduladores previos, de los fármacos anti-TNF-α o si se debe a una combinación de varios de estos factores. De hecho, en el análisis del registro TREAT (Crohn′s Therapy, Resource, Evaluation, and Assessment Tool), una de las bases de datos más amplias sobre seguimiento y evaluación del uso de tratamientos biológicos en pacientes con enfermedad inflamatoria intestinal (6.290 enfermos), se observó que el aparente incremento del riesgo de infecciones con el uso de infliximab no se confirmaba en el análisis multivariado de regresión logística24. El infliximab no fue predictor independiente de infecciones graves en el estudio, pero sí lo fueron otros factores asociados de forma independiente, como el empleo de corticoides (odds ratio [OR] de 2,21) y la actividad moderada a grave de la enfermedad (OR de 2,11). Es más, las tasas de mortalidad fueron similares entre pacientes tratados (3.179) y no tratados (3.111) con infliximab.
Con los fármacos antagonistas del TNF-α, el riesgo de presentar infecciones es dependiente de la naturaleza de la molécula, su farmacocinética, el modo de acción y la dosis14,37. Ciertos estudios indican que el uso de infliximab se relacionaría con un mayor índice de complicaciones infecciosas comparado con el empleo de etanercept22,47, y los resultados de estos trabajos describen un aumento de 3,25 veces el riesgo de infección granulomatosa en los pacientes tratados con infliximab comparado con los tratados con etanercept46. La tasa de infecciones granulomatosas de carácter oportunista con infliximab fue de 239 cada 100.000 pacientes tratados y de 74 cada 100.000 pacientes tratados con etanercept, asumiendo los sesgos de población seleccionada y la metodología en la recogida de la información. La incidencia de tuberculosis asociada al empleo de infliximab se estima en 24,4 casos por 100.000 pacientes21, mientras que tras la introducción de etanercept la incidencia de tuberculosis registrada ha sido de 10 casos por 100.000 pacientes30. Además, la aparición del cuadro clínico es más temprana con infliximab (menos de 3 meses) que con etanercept (más de 11 meses), lo que indica que el poder de reactivación de las infecciones latentes es mayor en el caso de infliximab que en el caso de etanercept. De ahí la necesidad de establecer estudios de cribado de la infección latente, especialmente de la tuberculosis, para proceder a su detección y a su tratamiento precoz25. La mayor parte de las infecciones (aproximadamente el 70%) se da en los 3 primeros meses de su inicio. Respecto a la infección fúngica invasiva (IFI)2,16,33,48, los datos existentes muestran una incidencia de aspergilosis, histoplasmosis, candidiasis y criptococosis de 8,6; 18,7; 10,1, y 5,1 casos por 100.000 pacientes tratados con infliximab, frente a 6,1; 2,6; 5,3, y 7,1 casos por 100.000 en los tratados con etanercept, respectivamente45. Otros géneros de hongos causantes de IFI se han descrito en pacientes que han recibido inhibidores del TNF-α3,10,15,26,29. En una reciente revisión sobre infecciones fúngicas que acontecieron tras el tratamiento con fármacos inhibidores del TNF-α (281 casos), las asociadas a infliximab (226) ocurrieron en una media de 55 días tras el inicio del tratamiento y de 3 infusiones del producto, mientras que las asociadas a etanercept (44) aparecieron en una media de 144 días después42; otras 11 micosis se relacionaron con adalimumab. La mayoría de los pacientes (98%) se había tratado con otros inmunosupresores, especialmente con corticoides. La neumonía fue la forma de presentación clínica más frecuente. La mortalidad de la serie fue del 32%, por lo que se deduce la necesidad de tener un alto índice de sospecha diagnóstica de IFI en pacientes tratados con fármacos anti-TNF-α para evitar el desarrollo de formas graves o fulminantes. Las condiciones de riesgo más alto para presentar una IFI durante el tratamiento con estos agentes son la exposición ambiental, la colonización por hongos patógenos, la historia de aspergilosis invasiva previa o de infecciones por otros mohos, la enfermedad del injerto contra el huésped, los viajes a áreas geográficas de alto riesgo para micosis endémicas, las actividades ocupacionales, deportivas o de ocio de alto riesgo, y las obras de construcción próximas al enfermo42.
En relación con las infecciones por especies de Nocardia12, la incidencia sería de 3,55 casos cada 100.000 pacientes tratados con infliximab y de 0,88 casos cada 100.000 pacientes tratados con etanercept45. Se dispone de pocos datos acerca de las IFI y las nocardiosis relacionadas con el uso de adalimumab, aunque se han descrito casos de criptococosis con problemas diagnósticos, por su presentación atípica, y de tratamiento20.
En pacientes con enfermedad de Crohn tratados con infliximab se han observado infecciones monomicrobianas tanto por Aspergillus spp.1 como por Nocardia spp.40, de forma individualizada, sin referir hasta la fecha casos de coinfección simultánea por ambos tipos de microorganismos, que podrían tener un efecto patógeno sinérgico al coincidir en su localización pulmonar durante el bloqueo excesivo del TNF-α, fenómeno que explicaría tal vez la ausencia de respuesta clínica inicial en este paciente. No obstante, se ha comunicado al menos un caso de coinfección oportunista por Nocardia asteroides y Pneumocystis jirovecii en una paciente con enfermedad inflamatoria intestinal que recibía infliximab41. La coinfección por Aspergillus y Nocardia, aunque infrecuente, se ha establecido en otros tipos de pacientes inmunodeprimidos6,35,43, neoplásicos36, que reciben tratamiento quimioterapéutico, trasplantados5,17,32, con infección por VIH o receptores de tratamiento inmunosupresor13,19,44. En estos casos de coinfección destaca el tropismo por las localizaciones pulmonar, rinosinusal y orbitocerebral, además de una mortalidad más elevada por el efecto aditivo entre ambos patógenos y otros factores del huésped.
El 80% de las IFI en pacientes receptores de fármacos anti-TNF-α aparece en enfermos tratados con infliximab9,49, y es menor el número de casos para adalimumab y etanercept. El mayor riesgo de IFI estaría relacionado con su capacidad para inducir apoptosis en los monocitos y otras células que expresan el TNF-α y con la interferencia de las respuestas Th1 del huésped y la consiguiente reducción de la secreción de interferón-γ y de la proliferación linfocítica4,34. Además, los factores de virulencia de algunos hongos afectan por sí mismos la producción de TNF-α, interleucina (IL)-1β e IL-6, e incrementan las concentraciones de IL-1028, que induce una respuesta inmune de tipo Th2, que aún produce un mayor desequilibrio respecto a la respuesta Th1 y empeora el estado de inmunosupresión.
Por consiguiente, ante la aparición de lesiones pulmonares nodulares, ocasionalmente cavitadas, en pacientes receptores de infliximab u otros antagonistas del TNF-α, se deben descartar causas infecciosas y no infecciosas; entre las primeras deben contemplarse principalmente las infecciones granulomatosas bacterianas (micobacteriosis y nocardiosis) o fúngicas de carácter oportunista ya comentadas y, a veces, se debe sospechar la posibilidad de la coexistencia de más de uno de estos patógenos, como en este caso, cuando no se consigue la mejoría clínica esperada tras el tratamiento apropiado. En estos casos de coinfección puede ser necesaria para alcanzar un diagnóstico final completo la práctica de exploraciones complementarias invasivas, como la fibrobroncoscopia o la punción pulmonar transtorácica radiodirigida, así como un procesamiento microbiológico adecuado, tanto para los estudios directos como de aquellos métodos de cultivo que permitan recuperar bacterias, micobacterias y hongos con el máximo rendimiento.
Conflicto de interesesLos autores declaran la ausencia de conflicto de intereses relacionados con el presente manuscrito o tema, a excepción de M.S.
M.S. ha sido consultor y ha dictado conferencias organizadas o subvencionadas por los Laboratorios Wyeth y Schering-Plough.
Autor para correspondencia.