Los probióticos son cultivos microbianos vivos y activos que resultan beneficiosos para la salud humana cuando se ingieren en concentraciones adecuadas (aproximadamente 109-1010 microorganismos/día)11,18. La mayor parte de los probióticos comercializados para consumo humano son bacterias lácticas13,25,28. Sin embargo, el consumo de microorganismos probióticos eucariontes como las levaduras puede presentar interesantes ventajas. Por un lado, resultan resistentes a antibióticos normalmente suministrados en casos de infecciones bacterianas entéricas4,9,22; por otro, la producción industrial de probióticos debe cuidar que las tecnologías de procesamiento empleadas garanticen la estabilidad de éstos, tanto en términos de viabilidad (capacidad de reproducirse) como de actividad durante la vida útil5. Las levaduras presentan, en general, mayor resistencia a cambios ambientales bruscos (gradientes de pH, cambios osmóticos, etc.) que las bacterias lácticas, así como menores requerimientos nutricionales que redundan en la reducción de costes en los procesos de producción. Además, la mayor ácido-tolerancia de los hongos respecto de las bacterias resulta una ventaja importante, tanto en las fermentaciones (ya que disminuye el riesgo de contaminación bacteriana), como en la calidad probiótica del producto obtenido. Todos estos factores resultarían beneficiosos durante la etapa de producción, así como durante el almacenamiento y consumo19,21,23,29.
En la bibliografía clínica, se describe desde hace ya muchos años una levadura probiótica con propiedades bioterapéuticas comprobadas, identificada como Saccharomyces boulardii. Con esta denominación se expenden distintos productos comerciales, aunque varios estudios taxonómicos señalan que dicha levadura debería considerarse como una variedad de la especie Saccharomyces cerevisiae (Saccharomyces cerevisiae var. boulardii)22,32.
Actualmente, la levadura probiótica S. boulardii se comercializa como un producto liofilizado. Como dicho proceso involucra la congelación, puede verse afectada la supervivencia así como la calidad probiótica del producto. Cuando se efectúa un congelado rápido de células suspendidas en medios acuosos, el medio extracelular se congela antes que el intracelular debido a la menor osmolaridad del primero. Como consecuencia de esto, el medio extracelular se concentra mientras que el intracelular se sobreenfría. Esto produce un estrés hiperosmótico que puede inducir la salida de agua intracelular al medio externo o bien el congelamiento del medio intracelular. En condiciones de congelado lento también se produce la migración de agua intracelular31. En ambos casos, se produce un estrés hiperosmótico debido a la disminución del agua libre disponible, y las células ponen en marcha mecanismos para contrarrestar este desequilibrio. La acumulación de solutos compatibles es uno de los mecanismos que pueden implementar las células osmóticamente estresadas, así como también pueden hacerlo durante los procesos de secado24.
Por otra parte, se ha encontrado que factores como la concentración celular inicial de los cultivos8, los medios y condiciones de crecimiento, el medio de secado, así como las condiciones de rehidratación y almacenamiento pueden afectar la viabilidad de bacterias lácticas probióticas liofilizadas5.
La existencia de mecanismos comunes de respuesta y protección a estrés ha sido extensamente expuesta en la bibliografía17,20. Así, se ha verificado que la exposición previa a un único estrés aplicado en forma subletal puede estimular la protección contra una nueva aplicación letal de dicho estrés o la de otros estreses de diferente naturaleza. Estos fenómenos se denominan de "protección cruzada" y confieren a los microorganismos tolerancia hacia un amplio espectro de situaciones ambientales desfavorables. En el caso de los cultivos probióticos pueden estimular respuestas adaptadas a las condiciones que enfrentarán durante el procesamiento industrial y el tránsito gástrico que, de otro modo, podrían resultarles letales2,30.
Otro parámetro indicativo de la calidad de las levaduras es su vitalidad, que se puede asociar a la capacidad de comportarse eficientemente al ser utilizadas en los productos comerciales y que puede evaluarse mediante la estimación de su actividad metabólica, siendo esta función de la cepa y de su historia previa. Para efectuar dicha estimación, resulta de utilidad el método de "poder de acidificación", que consiste sencillamente en la medición del cambio de pH extra-celular debido al metabolismo celular al suspender las levaduras en agua pura y tras agregar glucosa. Así se reflejan las reservas de energía endógena y la actividad glucolítica de las células27.
El objetivo de este trabajo fue evaluar la producción de biomasa de S. boulardii y el mantenimiento de sus propiedades probióticas después de ser sometida a un proceso de congelado, así como la influencia del preacondicionamiento fisiológico en la calidad del producto obtenido.
Material y métodos
Microorganismo. La cepa de S. boulardii utilizada en todos los ensayos se obtuvo a partir de un producto comercial (Floratil ®Merck Química Argentina SAIC) de venta local, y se conservó en estrías a temperatura de refrigeración.
Medios utilizados. Se utilizó agar Sabouraud (4% de glucosa) para el mantenimiento de las cepas y agar Sabouraud con 0,2% de extracto de levadura (SABE) para el recuento de microorganismos viables.
En las fermentaciones se utilizaron los siguientes medios: ELP (composición/100 ml): extracto de levadura (Britania, Argentina) 0,5 g; peptona de carne (Britania) 0,5 g; glucosa anhidra (Biopack, Argentina) 4,0 g; (NH4)2SO4 (Mallinckrodt, USA) 0,3 g; KH2PO4 (Mallinckrodt) 0,3 g. ELPNG: medio ELP sin glucosa. ELPM: se preparó reemplazando la glucosa del medio ELP por melaza de caña de azúcar (60% de azúcares reductores fermentables, según información del proveedor) con el fin de alcanzar una concentración en el medio de propagación del 4% de azúcares reductores fermentables.
Recuento de microorganismos. Concentración de levaduras viables: a partir de alícuotas de las muestras a estudiar, se realizaron diluciones sucesivas en agua peptonada (solución acuosa de peptona de carne al 0,1%). Se sembraron por triplicado 20 µl de cada dilución en placas de SABE. Las placas se incubaron a 28 °C durante 72 h. Los resultados se expresaron como unidades formadoras de colonias por ml (UFC/ml).
Concentración de levaduras totales: se determinó mediante la medición de la densidad óptica (DO) en un espectrofotómetro Metrolab 330 (Technique SRL, Argentina) a una longitud de onda de 630 nm o por recuento microscópico en cámara de Neubauer.
La biomasa celular se estimó mediante la determinación del peso seco por secado en estufa de vacío a 105 °C.
Producción de biomasa. Preparación de los inóculos: las células de levadura mantenidas en estrías se sembraron en caldo ELP y se incubaron a 28 °C con agitación orbital (250 rpm) durante 36 h.
Fermentación en frascos: se inocularon 50 ml de medio ELP contenidos en frascos Erlenmeyer de 250 ml, obteniéndose una concentración inicial de 107 células de levadura/ml. Los frascos se incubaron con agitación orbital (250 rpm) a temperaturas de 28 o 37 °C.
Fermentaciones por lote en biorreactores: se inocularon 3 l de medio ELP o ELPM contenidos en fermentadores New Brunswick Serie FS300 (New Brunswick Scientific Co., USA) de 4 l de capacidad (concentración inicial: 106 células de levadura/ml), agitados por paletas (250 rpm) y aireados (36 laire/h), incubándose a temperatura de 28 ± 1 °C. Se realizaron controles en línea de pH y temperatura, y de glucosa (kit enzimático glucosa oxidasa/peroxidasa) y medición de los azúcares reductores fermentables a partir de alícuotas convenientes extraídas durante la fermentación.
Fermentaciones en lote alimentado en biorreactores: se efectuó en los fermentadores de 4 l de capacidad, según el protocolo descrito por Galvagno y Cerrutti12. El mosto agregado durante la fermentación consistió en una solución de melaza diluida al 60% p/v en agua.
El resto de las condiciones fueron las descritas para las fermentaciones en lote.
Actividad de agua (aw). Se determinó el crecimiento de S. boulardii en medio ELP (aw = 0,99) y en el mismo medio con aw reducida (entre 0,99 y 0,87) y adición de NaCl (Mallinckrodt), glucosa (Biopack) o sorbitol (Mallinckrodt) en las proporciones calculadas según las isotermas obtenidas en la bibliografía6,10. Después, se determinaron los valores de aw en un equipo Aqualab Serie 3 (casa comercial, país).
Determinación de la aw mínima de crecimiento: se inocularon 50 ml de los medios de aw previamente establecida con el propósito de alcanzar una concentración inicial de 1× 104 células de levadura/ml. Dichos cultivos se incubaron durante 48 h a 28 °C en forma estática efectuándose la medición de la DO y el recuento de UFC/ ml.
Ensayos de congelación/descongelación. Se congelaron alícuotas de 1 ml de los cultivos contenidas en tubos Eppendorf a -20 °C (velocidad de enfriamiento≈ 3 °C/min) durante 20 h, seguido de descongelación en baño de agua a 25 °C (velocidad de descongelamiento≈ 190 °C/min); luego se realizó un nuevo congelado a -20 °C durante 4 h y posterior descongelado a 25 °C. Esta metodología de congelación en 2 ciclos es una adaptación de la utilizada previamente por Lewis et al20.
Congelación de células preincubadas en medio de aw reducida. Las células de S. boulardii en fase estacionaria de crecimiento (48 h de incubación en medio ELP) se sometieron a un preestrés osmótico suspendiéndolas en medio ELPNG de aw = 0,98 fijada por adición de sorbitol. Dichas suspensiones se incubaron a 28 °C con agitación mecánica (160 rpm) durante 2 h. Al cabo de ese tiempo, se centrifugaron las muestras y las células se resuspendieron en medio ELPNG. Luego se realizó el ensayo de congelación/descongelación de alícuotas de 1 ml contenidas en tubos Eppendorf en 2 ciclos. La evaluación de la supervivencia se realizó por duplicado en los distintos tiempos de almacenamiento durante 2 meses, por recuento en placa de células viables. Los resultados obtenidos se compararon con controles de células preincubadas en medio ELPNG de aw = 0,99.
Ensayo de vitalidad-determinación del poder de acidificación (adaptación de Kara et al15). Se centrifugaron a 3.000 rpm durante 5 min alícuotas de 200 ml de las muestras suspendidas en el medio a estudiar (en las fases de crecimiento correspondientes a cada experimento). Posteriormente, se realizaron 2 lavados por suspensión y centrifugación con 20 ml de agua destilada a 4 °C. Los precipitados microbianos obtenidos se suspendieron en 10 ml de agua destilada fría (tiempo = 0 min), se centrifugaron a 3.000 rpm durante 5 min. Después se sumergieron en baño de agua a 25 °C y se agitaron magnéticamente registrándose el pH cada minuto durante 10 min. A ese tiempo se agregaron 0,5 ml de glucosa (20,2% p/v) y se continuó el registro durante 10 min más. Las mediciones de pH se realizaron con un equipo Thermo Orion 410 A (casa comercial, país).
Crecimiento en medio nutritivo con sales biliares y a pH ácido. Se preparó caldo nutritivo (Merck Química Argentina SAIC) suplementado con 0,6% de glucosa y 0,5% de sales biliares (Oxoid, Inglaterra). El pH se ajustó a 3,0 y 5,0 agregando HCl 0,1 N.
Las levaduras inoculadas (7-8× 104 células/ml) se incubaron durante 48 h a 28 °C.
Resultados y discusión
Producción de biomasa de S. boulardii. Se realizaron fermentaciones en lote y en lote alimentado con la finalidad de evaluar la cantidad y calidad de la biomasa de levadura obtenida.
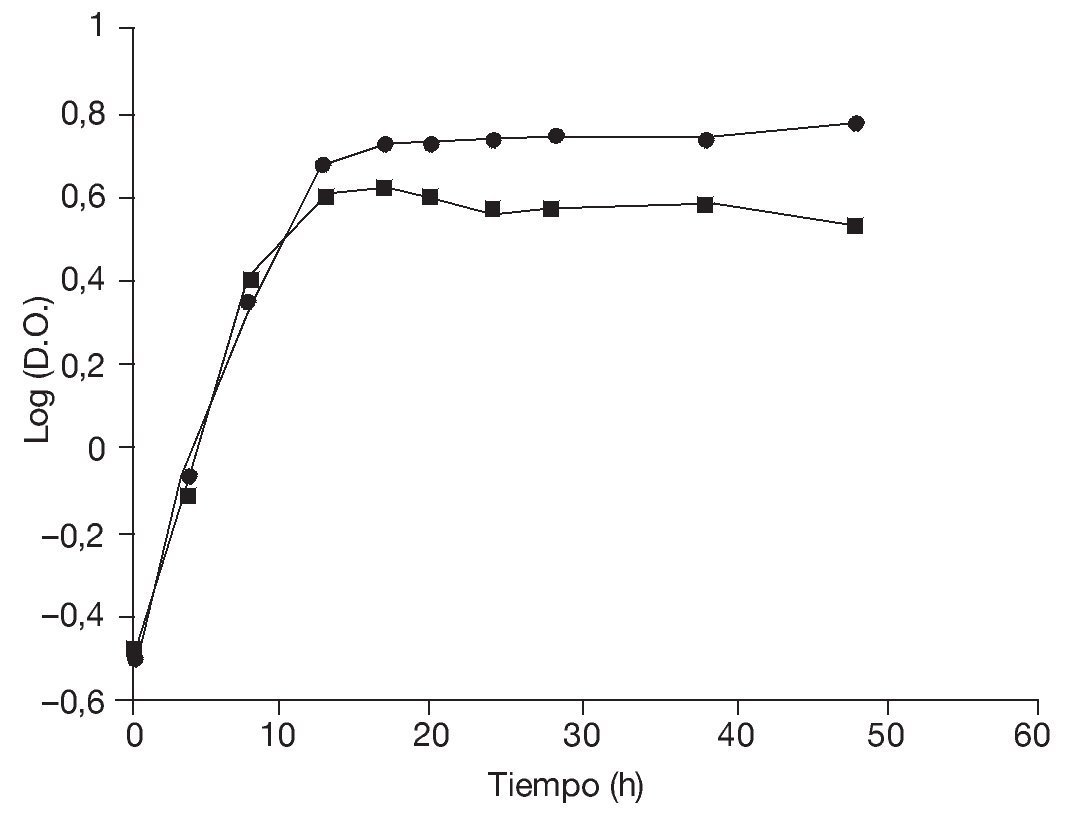
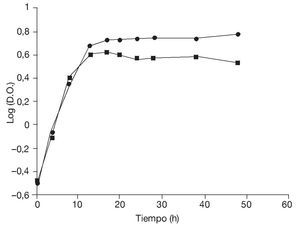
En primer lugar, se determinaron las curvas de crecimiento de la levadura en medio ELP contenido en frascos Erlenmeyer incubados con agitación durante 48 h a temperaturas de 28 y 37 °C (fig. 1) con la finalidad de evaluar los parámetros cinéticos.
Figura 1. Curvas de crecimiento de Saccharomyces boulardii en frascos agitados durante 48 h a 28 °C (¿) y a 37 °C (¿).
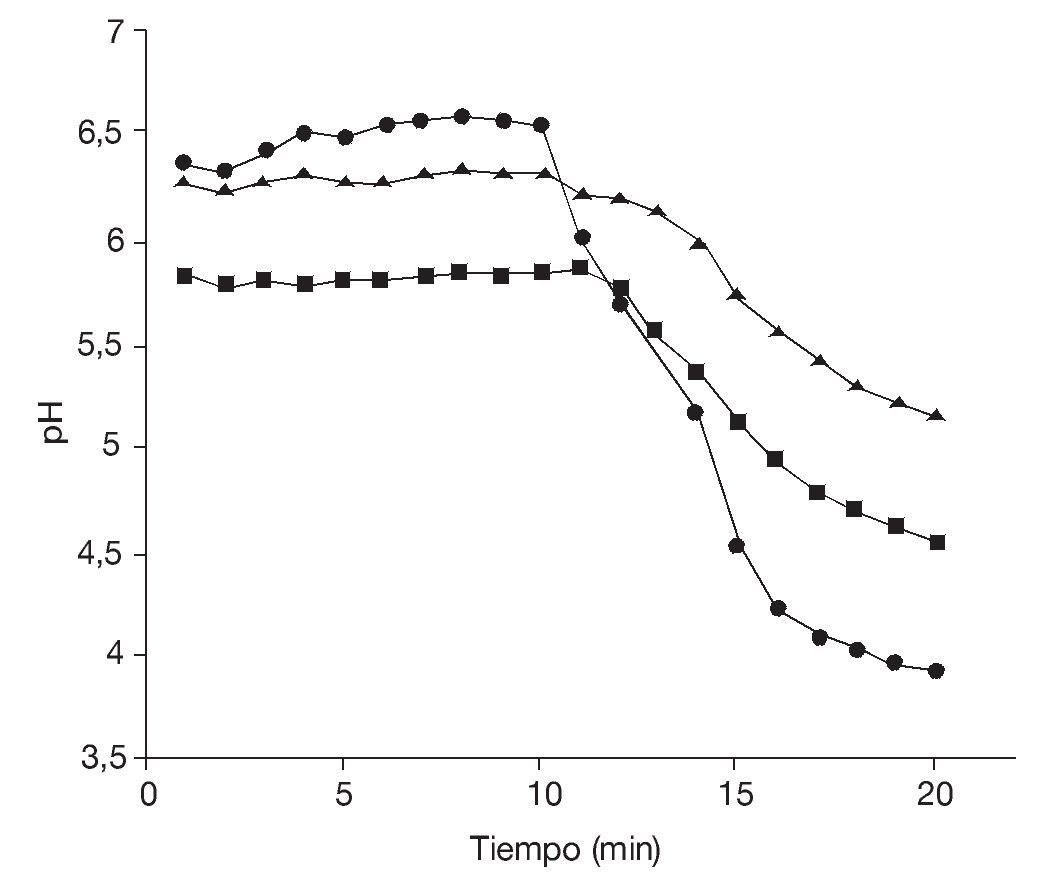
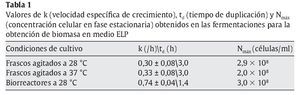
Aunque las temperaturas óptimas de crecimiento de las levaduras están generalmente comprendidas entre los 27 y los 32 °C, los resultados obtenidos en frascos agitados indican que la velocidad específica de crecimiento así como la biomasa producida a 28 y 37 °C fueron comparables (tabla 1), lo que, en este caso, posibilitaría efectuar la producción a 37 °C. Esto podría representar una ventaja en el caso de microorganismos probióticos en los cuales la capacidad de crecer a 37 °C constituye un importante factor de selección32. Además, garantizaría una buena producción en un rango relativamente amplio de temperaturas, aun ante eventuales incrementos térmicos durante la fermentación, lo que redundaría en un beneficio para la economía del proceso.
Posteriormente, se realizaron fermentaciones en biorreactores con medios ELP o ELPM a una temperatura de 28 °C. En la tabla 1 se muestran los valores de la velocidad específica de crecimiento en fase exponencial (k), el tiempo de duplicación (td) y la concentración máxima alcanzada en fase estacionaria. En los biorreactores, la trofofase finalizó al cabo de 10 h y el rendimiento obtenido, Yx/g (biomasa producida/glucosa consumida), fue del 27,5% al cabo de 10 h de fermentación. La productividad a dicho tiempo fue de 0,55 g/l h en medio ELP. Similares resultados se obtuvieron en medio ELPM (datos no mostrados).
La metodología de las fermentaciones en lote resultó sencilla y adecuada para la obtención de biomasa de S. boulardii, tanto en un medio semisintético, conteniendo glucosa como principal fuente de carbono y de energía, como en el medio conteniendo un sustrato de mucho menor coste (melaza de caña de azúcar). El empleo de materias primas y procesos económicos resulta fundamental considerando los grandes volúmenes involucrados en la producción a escala industrial.
En las condiciones ensayadas, el rendimiento fue satisfactorio teniendo en cuenta los valores hallados en la bibliografía1. Por otra parte, teniendo en cuenta que la fermentación en lote alimentado requiere mayor equipamiento y un mayor control del proceso, ya que implica bombeo regulado del sustrato alimentado con el fin de regular la velocidad de alimentación de la fuente de carbono, se puede considerar que la producción de biomasa en lote presenta ventajas para su implementación a mayor escala. Además, al tratarse de un sistema cerrado, presenta menores riesgos desde el punto de vista de las contaminaciones.
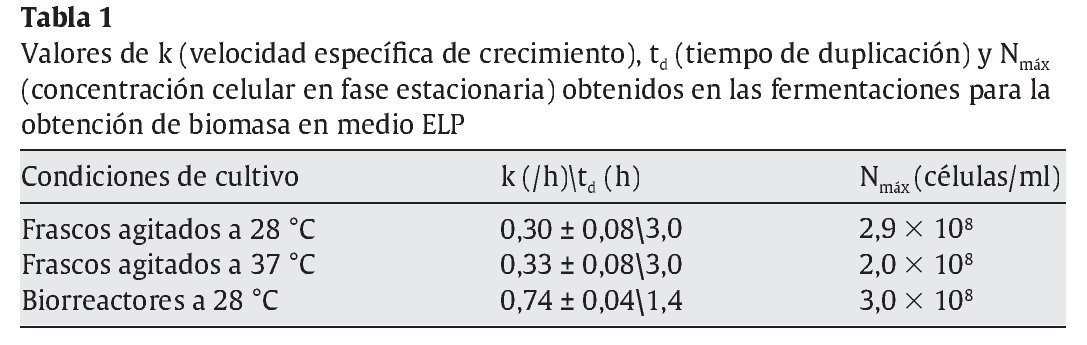
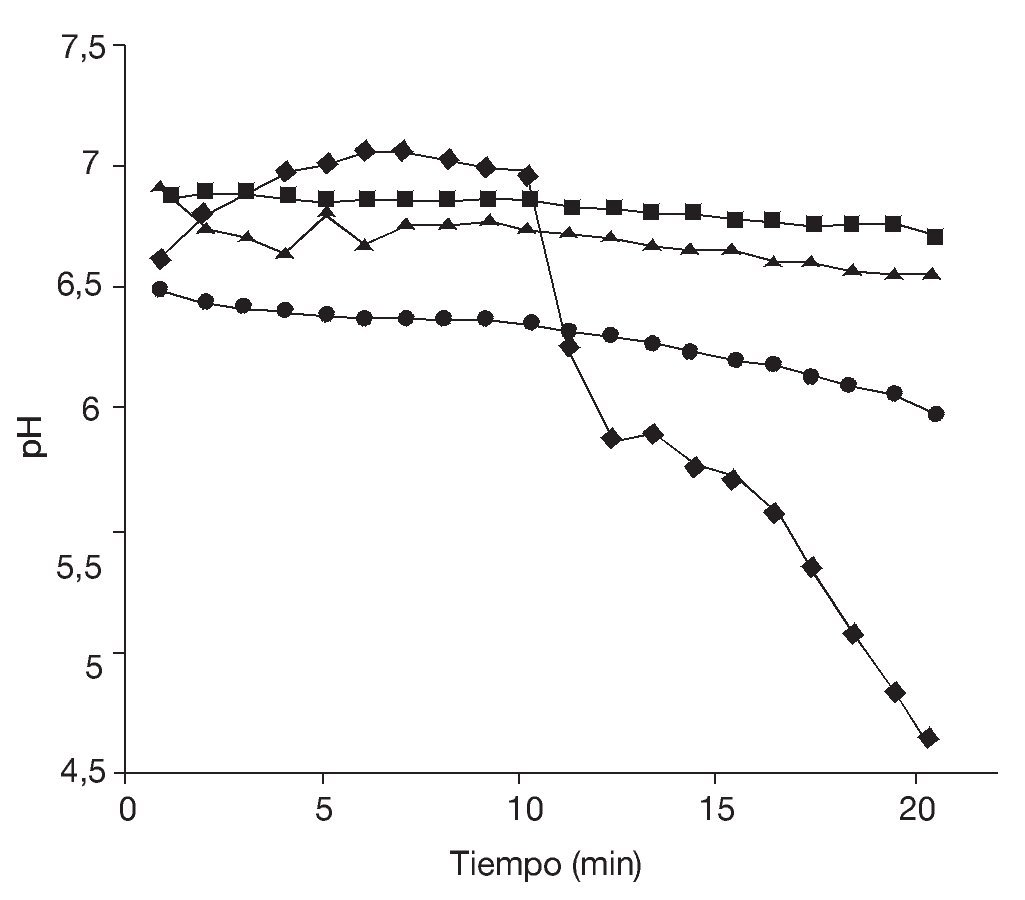
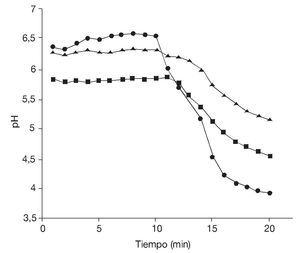
Si bien los rendimientos en lote alimentado fueron similares a los obtenidos en las fermentaciones en lote, la principal diferencia entre ambos procesos de producción se observó al determinar la calidad de la levadura obtenida. Para ello, se realizaron ensayos de "poder de acidificación" tomándolo como parámetro para estimar la vitalidad celular. En la figura 2 se observan las curvas de medición de pH realizadas en muestras obtenidas en la fermentación en lote a las 9 y 48 h (fases exponencial y estacionaria, respectivamente) y al cabo de 9 h en la fermentación por lote alimentado.
Figura 2. Test de vitalidad. Poder de acidificación (¿pH ) de las células de Saccharomyces boulardii obtenidas en fase exponencial (9 h) (¿) y estacionaria (48 h) (¿) de una fermentación en lote, y al cabo de 9 h en una fermentación en lote alimentado (¿).
En la fermentación en lote, se observa que el mayor valor de¿pH se obtuvo para células en fase exponencial (¿pH = 2,6), mientras que las células en fase estacionaria presentaron un¿pH = 1,3. Las células obtenidas por fermentación en lote alimentado presentaron un¿pH = 1,1.
Estos resultados señalan una vitalidad de las células en fase exponencial significativamente mayor respecto de las células en fase estacionaria en cultivos en lote. Por otra parte, en la fermentación en lote alimentado (en la cual se estableció como limitante la fuente de carbono aportada por la melaza de caña de azúcar), la variación del pH de la suspensión de las levaduras obtenidas fue semejante a la observada en la fase estacionaria del cultivo en lote. Se puede suponer, entonces, que la limitación en la disponibilidad de la fuente de carbono (fase estacionaria de la fermentación en lote y fermentación en lote alimentado) se traduce en una situación no ideal que afecta el estado fisiológico de las células disminuyendo la vitalidad de la levadura, cuyo efecto se evidencia en la disminución del¿pH determinado por el ensayo del "poder de acidificación".
Procesamiento "aguas abajo". Teniendo en cuenta que S. boulardii se expende en forma de producto liofilizado, se evaluó el efecto de la congelación y la disminución de la aw, ambos factores de estrés a los que se ve expuesta la levadura durante su procesamiento, sobre la viabilidad y vitalidad de la levadura.
Para ello se estudió el efecto del congelado/descongelado sobre células de levadura en distintas fases de crecimiento en lote así como el efecto de la disminución de la aw sobre el crecimiento de S. boulardii en presencia de distintos solutos. Finalmente, se estudió el efecto del congelado sobre la viabilidad y vitalidad de células preincubadas en un medio de aw reducida en condiciones preseleccionadas.
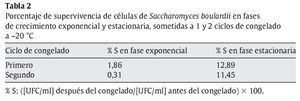
Congelación. Se estudió el efecto de 1 (20 h) y 2 (4 h más) ciclos de congelado a -20 °C sobre la viabilidad de células de levadura (7,105 UFC/ml) cosechadas en fase de crecimiento exponencial y estacionaria, respectivamente. La viabilidad de las células en fase de crecimiento exponencial disminuyó en más de 2 ciclos logarítmicos después de los 2 ciclos de congelado/descongelado, mientras que en las levaduras en fase estacionaria la disminución fue inferior a 1 ciclo logarítmico. Los porcentajes de supervivencia al cabo de cada uno de los ciclos de congelación (tabla 2) reflejaron la mayor resistencia a ésta de las células en fase estacionaria respecto de las que se encontraban en fase de crecimiento exponencial. Esto coincide con lo encontrado en la bibliografía para otros microorganismos acerca de la mayor resistencia a situaciones de estrés de células en fase estacionaria respecto de células en la etapa de crecimiento activo3,14,16.
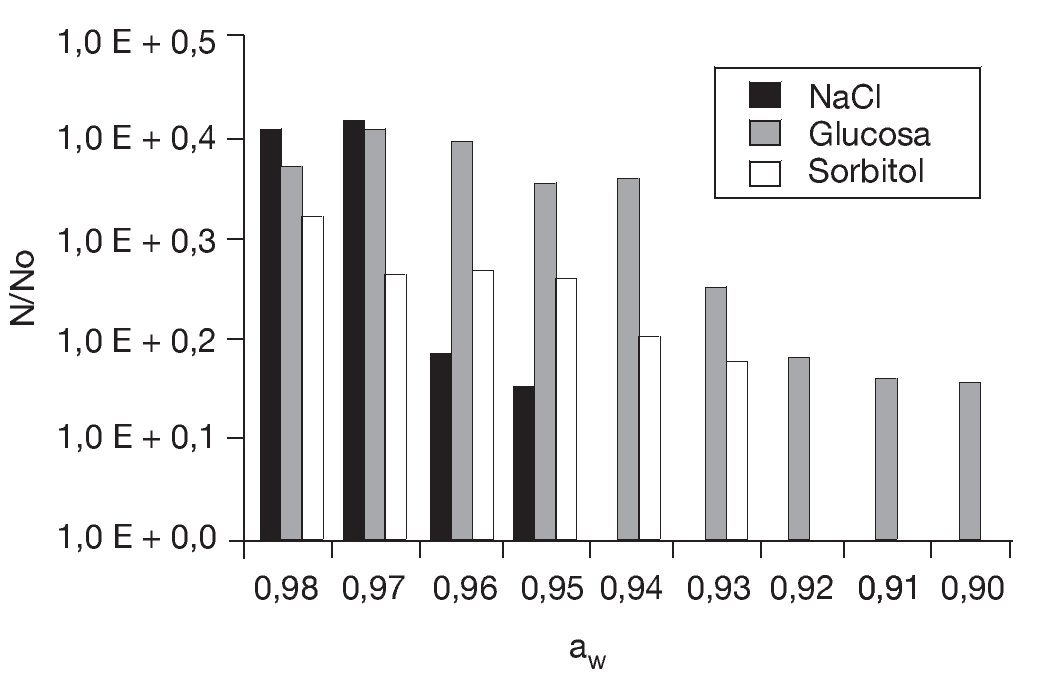
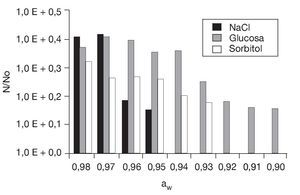
Preincubación a aw reducida y posterior congelado. En primer lugar se determinó la aw mínima de crecimiento de S. boulardii cultivada en medio ELP con adición de NaCl (soluto iónico), glucosa (soluto no iónico metabolizable) o sorbitol (soluto no iónico no metabolizable) en el rango de aw comprendido entre 0,99 y 0,87 unidades (fig. 3). El NaCl resultó ser el soluto que inhibió el desarrollo a aw más elevadas: sólo hubo crecimiento de aproximadamente 1,5 ciclos logarítmicos hasta aw = 0,95 (8% p/p de NaCl) mientras que en presencia de glucosa y sorbitol el crecimiento se observó hasta aw = 0,90 (48% p/p) y aw = 0,93 (42% p/p), respectivamente. Es de notar que otras levaduras del género Saccharomyces26, que tiene por hábitat natural los sustratos azucarados, presentaron un comportamiento similar frente a estos solutos. Por debajo de aw = 0,89 (con glucosa o sorbitol) no se detectaron células viables, probablemente debido a un daño osmótico irreversible.
Figura 3. Efecto de la disminución de la actividad de agua en el crecimiento de Saccharomyces boulardii en presencia de NaCl, glucosa y sorbitol a 28 °C. No: concentración inicial = 10 células/ml; N: células/ml al cabo de 48 h de incubación.
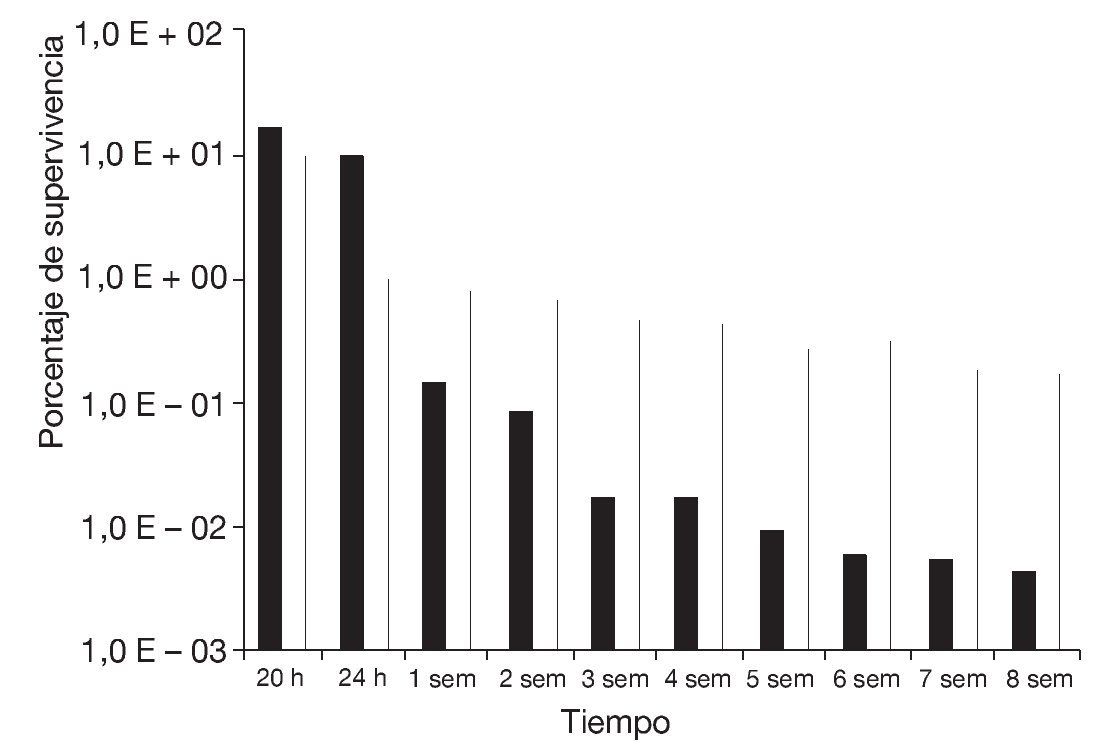
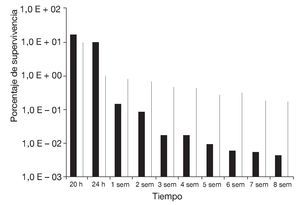
Basándose en estos resultados, se determinó la supervivencia a la congelación en función del tiempo de almacenamiento a -20 °C durante 8 semanas de células de S. boulardii preincubadas en medio ELPNG con adición de sorbitol a aw = 0,98, con respecto a un control (ELPNG de aw = 0,99) (fig. 4). En ambas condiciones se encontró un mayor descenso de la supervivencia en función del tiempo a menores tiempos de almacenamiento, mientras que a partir de la segunda-tercera semana la disminución relativa de la supervivencia evaluada al cabo de 2 ciclos de congelado fue mucho menos marcada. Al cabo de 8 semanas, la supervivencia de la levadura preincubada a aw = 0,98 fue del 0,17% mientras que la del control (aw = 0,99) fue del 0,04%. El efecto protector al congelado observado en las levaduras preincubadas en el medio de aw = 0,98 se podría atribuir a la efectiva acumulación de sorbitol durante la preincubación previa al congelado. En cambio, las células de levadura incubadas en su ausencia no habrían sido capaces de acumular concentraciones efectivas de solutos compatibles durante el corto período que dura el proceso de congelación. Similares resultados fueron informados por Carvalho et al5 en bacterias lácticas sometidas a procesos de secado.
Figura 4. Supervivencia al almacenamiento a -20 °C al cabo de 20, 24 h y hasta 8 semanas de congelado de células de Saccharomyces boulardii preincubadas durante 48 h en medio ELPNG de a = 0,99 (columnas negras) y 0,98 (columnas blancas, sorbitol).
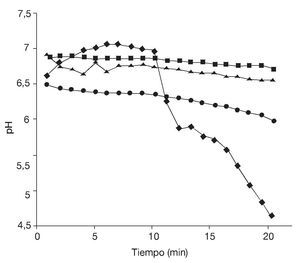
Test de vitalidad de células preincubadas a 2 niveles de aw, antes y después del congelado. Se evaluó, además, el estado fisiológico de las células sometidas a los procesos anteriormente mencionados mediante la determinación del "poder de acidificación".
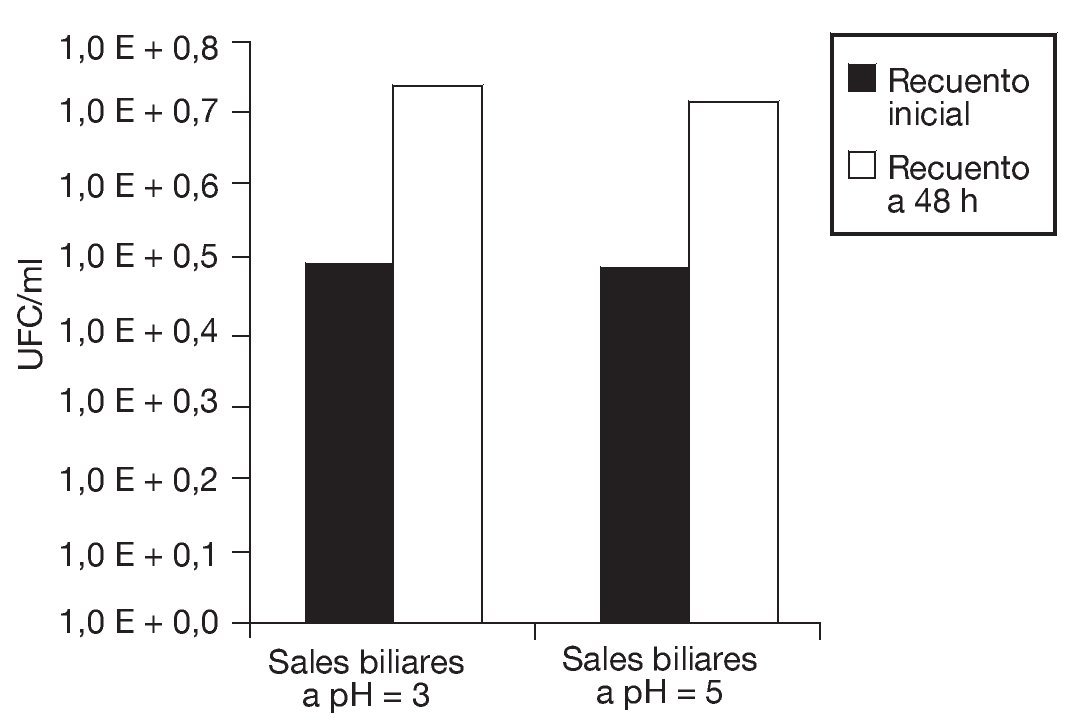
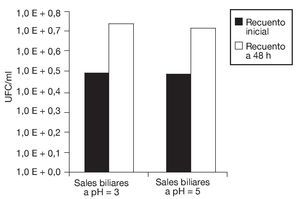
En la figura 5 se observa que tanto la disminución de la aw como el proceso de congelación afectaron la vitalidad de las células de S. boulardii, dando por resultado un menor descenso del pH extracelular. Nuevamente, se evidencia que, aunque los porcentajes de supervivencia fueron relativamente elevados, la vitalidad celular se vio afectada tras la aplicación de estos procesos. Sin embargo, las células de levadura sometidas a estos tratamientos fueron capaces de crecer aproximadamente 2 ciclos logarítmicos en un medio nutritivo que contenía sales biliares a pH 3 y 5, respectivamente (fig. 6). La tolerancia a la acidez y a las sales biliares es fundamental en el caso de microorganismos probióticos que deben atravesar el estómago y llegar vivos al intestino. Allí deben resultar resistentes a las sales biliares y ser capaces de colonizar para, finalmente, ejercer sus efectos benéficos en el huésped. Es muy importante evaluar la resistencia a la acidez y a los ácidos biliares de cada probiótico en particular, ya que las respuestas pueden variar según la especie7.
Figura 5. Test de vitalidad. Curvas de poder de acidificación (¿pH) de células de Saccharomyces boulardii: antes♦ a = 0,99, (DpH = 2,34); ¿ a = 0,98 (¿pH= 0,43) y después de la congelación ¿ a = 0,99 (¿pH = 0,21); ¿ a = 0,98 (¿pH = 0,17).
Figura 6. Crecimiento de Saccharomyces boulardii en presencia de sales biliares a pH 3,0 y 5,0, respectivamente: recuentos en placa de UFC/ml iniciales (columnas negras) y al cabo de 48 h de incubación (columnas blancas) a 28 °C.
Conclusiones
En este trabajo se ha puesto de manifiesto que la viabilidad y la vitalidad de la levadura son parámetros independientes. Cualquier condición o situación que represente un estrés para la levadura (congelación, hiperosmolaridad, falta de nutrientes, presencia de metabolitos tóxicos, etc.) parece afectar la vitalidad de ésta, sin que necesariamente se produzca una disminución de la viabilidad celular. La fase estacionaria de crecimiento en una fermentación en lote se establece por falta de algún nutriente esencial, acumulación de metabolitos tóxicos o superpoblación celular, condiciones todas que corresponden a una situación no ideal que representa un estrés para la levadura. Este hecho se vio reflejado en un descenso de la vitalidad celular, estimado por una disminución del¿pH en el ensayo de "poder de acidificación". A pesar de que las células en fase estacionaria de crecimiento resultaron más resistentes al congelado/descongelado en términos de viabilidad, su vitalidad (¿pH) fue menor que en las células en fase de crecimiento exponencial. Del mismo modo, los procesos de congelación o la reducción de la aw afectaron la vitalidad de las levaduras, aunque esto no siempre redundó en un drástico descenso de la viabilidad.
Por lo tanto, la evaluación de la vitalidad sería un buen indicador de la "calidad" de la levadura, y la relación "viabilidad-vitalidad" en función de las condiciones de proceso aplicadas se debe considerar en cada caso con el fin de suministrar a los consumidores las concentraciones efectivas necesarias para alcanzar un eficiente efecto probiótico.
Agradecimientos
Agradecemos al ingeniero Mario Kuperwaser de BPF Argentina S.A. la donación de la melaza de caña de azúcar y las determinaciones de azúcares reductores fermentables.
* Autor para correspondencia.
Correo electrónico:cerrutti@di.fcen.uba.ar (P. Cerrutti).
INFORMACIÓN DEL ARTÍCULO
Historia del artículo:
Recibido el 17 de febrero de 2008
Aceptado el 3 de julio de 2008