La infección fúngica invasora es una de las principales causas de morbilidad y mortalidad en pacientes inmunodeficientes, como son los pacientes críticos, neonatos, receptores de órganos sólidos, pacientes oncológicos y pacientes con sida, entre otros. En los últimos 10 años, la incidencia de infecciones por Candida se ha incrementado de forma drástica72,125. Aunque Candida albicans es la especie más prevalente, se está produciendo un incremento en la emergencia de infecciones por especies de Candida diferentes de C.albicans resistentes a diferentes antifúngicos. Asimismo, también se ha incrementado la frecuencia de infecciones fúngicas por Aspergillus u otros hongos4,11.
En la actualidad, se dispone de muchos recursos terapéuticos de antifúngicos de uso sistémico11,14,18,58,68: polienos (anfotericina B deoxicolato, formulaciones lipídicas de anfotericina B), azoles (fluconazol, itraconazol, voriconazol, posaconazol, ravuconazol) y equinocandinas (caspofungina, micafungina y anidulafungina) con un mecanismo de acción diferente y, por lo tanto, un espectro antifúngico y de seguridad específico.
El 16 de marzo de 2005, la US Food and Drug Administration aprobó la micafungina para el tratamiento de candidemia, candidiasis aguda diseminada, peritonitis candidiásica, abscesos y candidiasis esofágica. Posteriormente, el 23 de enero de 2008 se aprobó para la profilaxis de infecciones candidiásicas en pacientes sometidos a trasplante de células hematopoyéticas.
En Europa, el 25 de abril de 2008 la European Medicines Agency autorizó la comercialización de micafungina en toda la Unión Europea para candidiasis invasora y en profilaxis de candidiasis en los pacientes sometidos a un trasplante de médula ósea.
El 29 de febrero de 2008 la Agencia Española de Medicamentos y Productos Sanitarios autorizó la comercialización de micafungina sódica para las mismas indicaciones aprobadas en Europa.
Por sus características farmacodinámicas y farmacocinéticas, tiene un futuro prometedor en la práctica clínica diaria.
Estructura química
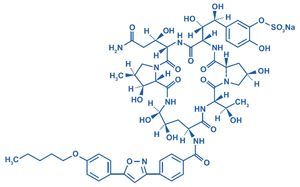
La micafungina (FK 463) es un antifúngico soluble, de la familia de las equinocandinas sintetizada por el hongo Coleophoma empetri36 a través de la apertura enzimática del hexapétido FR901370, producto natural del hongo. La incorporación de la cadena grasa N-acil proporciona el efecto antifúngico/antimicótico5,75,118.
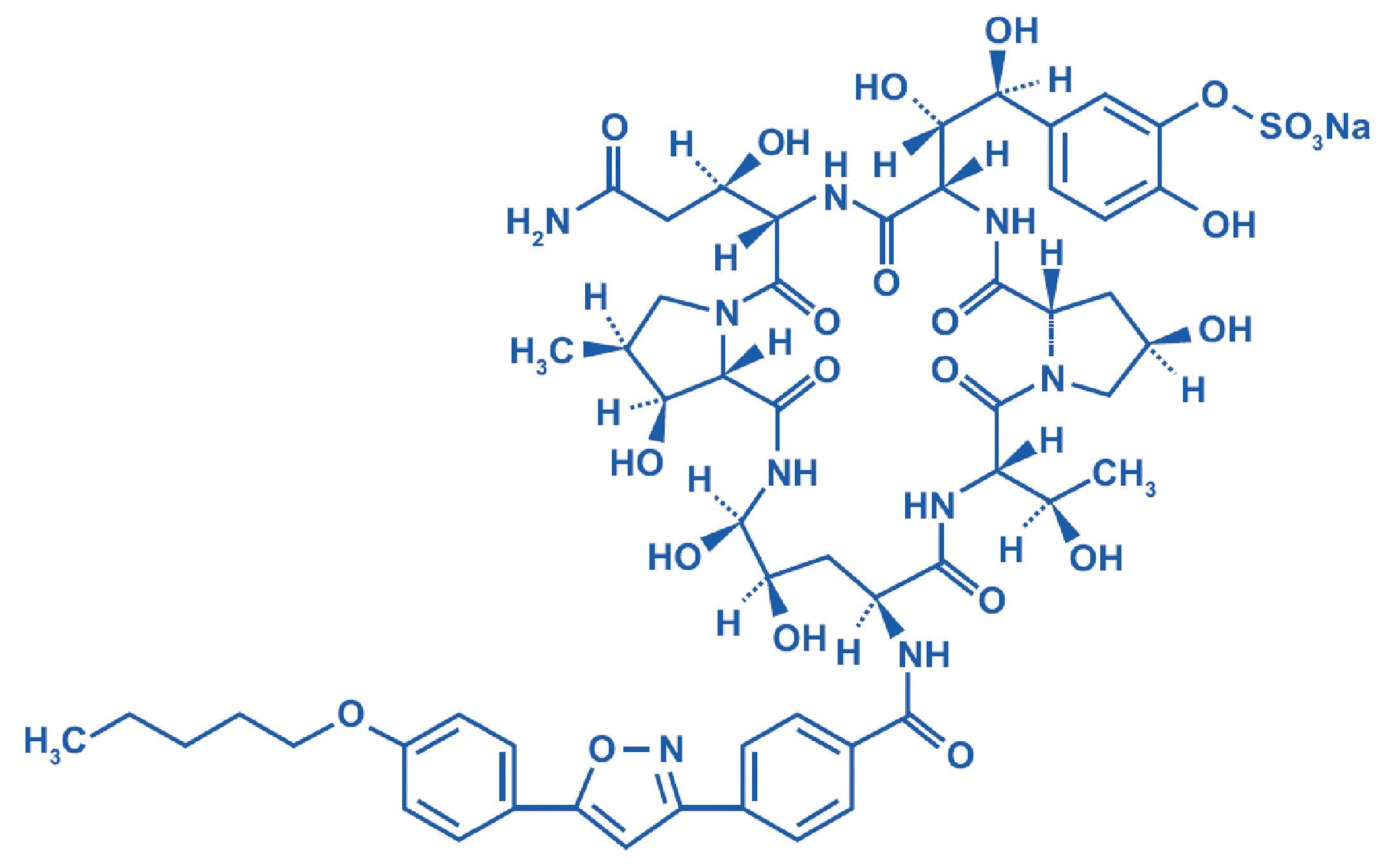
El nombre sistemático denominado por la International Union of Pure and Applied Chemistry es neumocandina A0,1-[(4R,5R)-4,5-dihidroxi-N2-[4-[5-[4-(pentiloxi)fenil]-3-isoxazolil]benzoil]-L-orni-tina]-4-[(4S)-4-hidroxi-4-[4-hidroxi-3-(sulfooxi)fenil]-L-treonina]-, monosodio. Fórmula química C56H71N9O23S con un peso molecular de 1.270,28 g/mol/1.292,26 Da. En la figura 1 se muestra la estructura química de la micafungina.
Figura 1. Estructura química de la micafungina. Neocandina A0,1-[(4R,5R)-4,5-dihidroxi-N2-[4-[5-[4-(pentiloxi)fenil]-3-isoxazolil]ben-zoil]-L-ornitina]-4-[(4S)-4-hidroxi-4-[4-hidroxi-3-(sulfooxi)fenil]-L-treonina]-, monosodio.
Los identificadores son: número CAS (Chemical Abstracts Service) 235114-32-6 y el código ATC (Anatomical Therapeutic Chemical Classification System): J02AX05.
Farmacodinamia26,55,60,68,119,133
Mecanismo de acción
La micafungina actúa, dependiente de la concentración, como un inhibidor no competitivo de la formación del enzima β-1,3-D glucano sintasa, enzima necesaria para la síntesis de β-1,3-D glucano, un polímero de la glucosa imprescindible para la estructura e integridad de la pared celular del hongo, común a la mayoría de los hongos patógenos24,39,65,85. Una interrupción de la estructura de pared celular provoca inestabilidad osmótica y lisis celular. La mayoría de la pared celular de los hongos contiene uniones α o β glucanos y una variedad de manoproteínas, aunque la cuantía y la importancia relativa de cada uno de los componentes difieren en relación con las diferentes especies de hongos82. Es el componente más importante de la pared celular de hongos tipo Candida, Aspergillus, Histoplasma capsulatum, Blastomyces dermatitidis yParacoccidioides brasiliensis. Los zigomicetos y Cryptococcus carecen de β-1,3-D glucano, lo que explicaría la pobre actividad de la micafugina contra este tipo de hongos81. Zigomicetos y Cryptococcus tienen valores bajos de β-1,3-D glucano, lo que explicaría la pobre actividad de la micafugina contra este tipo de hongos.
Micafungina presenta actividad fungicida frente a la mayoría de las especies de Candida85 e inhibe de forma importante el crecimiento activo de las hifas de Aspergillus17.
Tiene efecto postantifúngico dependiente de la concentración frente a Candida albicans, Candida glabrata, Candida krusei y Candida tropicalis25 entre 0,27 y 20,1 h, y frente Aspergillus fumigatus ≤ 0,5 h71.
Hay evidencia in vitro del efecto sinérgico de la micafungina con polienos frente a Aspergillus y Fusarium70,90 y con azoles frente a A. fumigatus87.
Actividad antifúngica in vitro
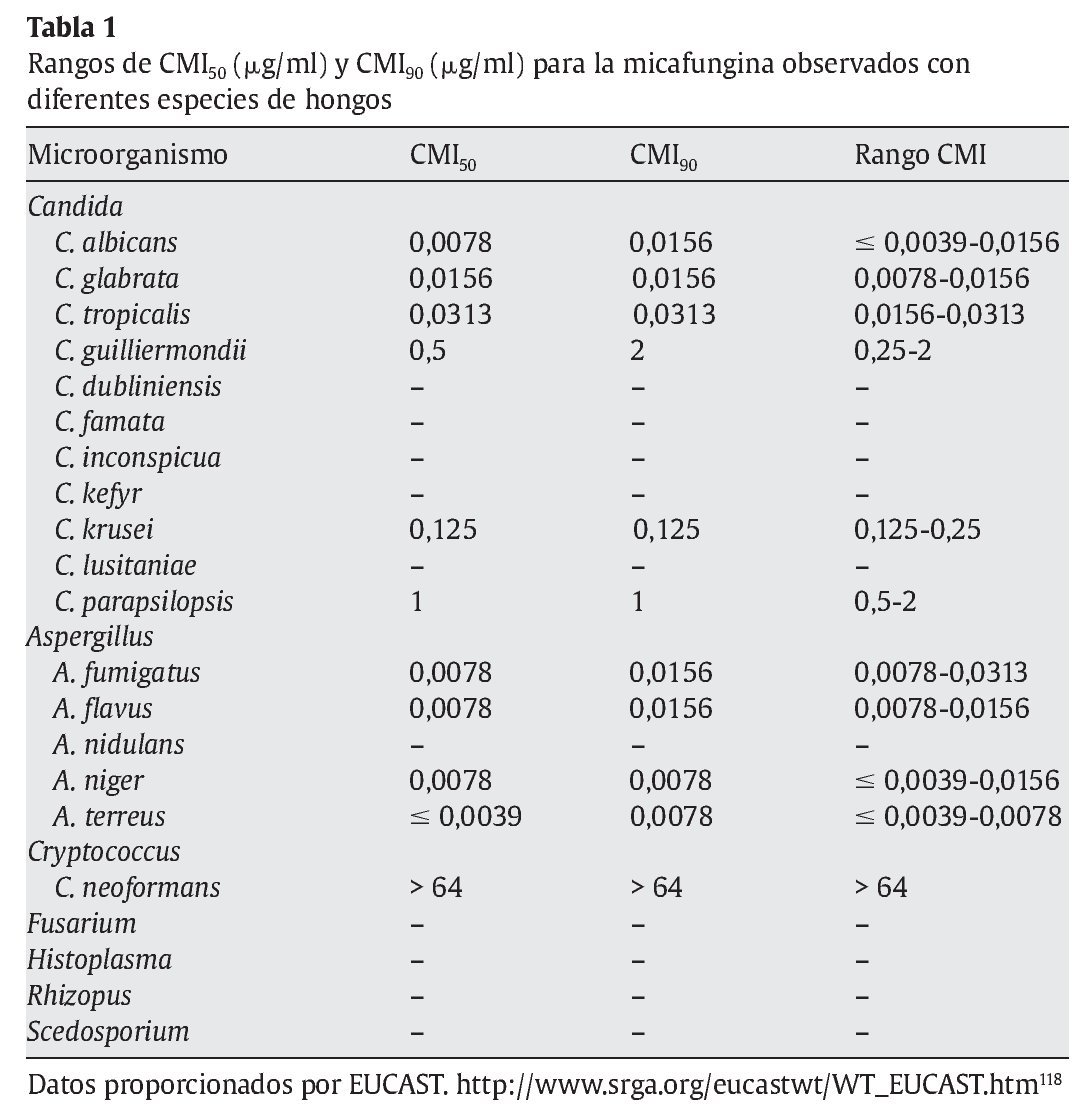
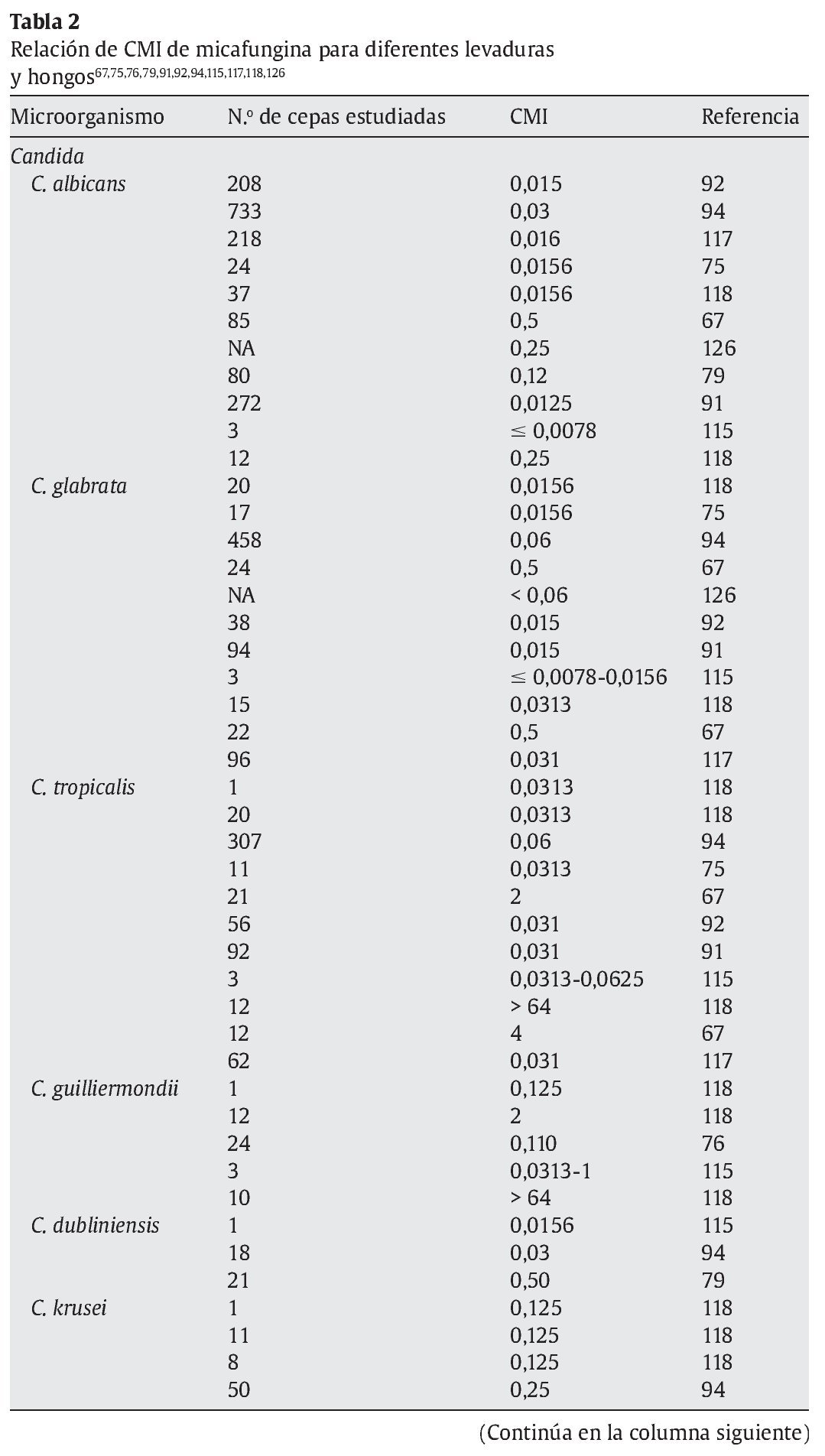
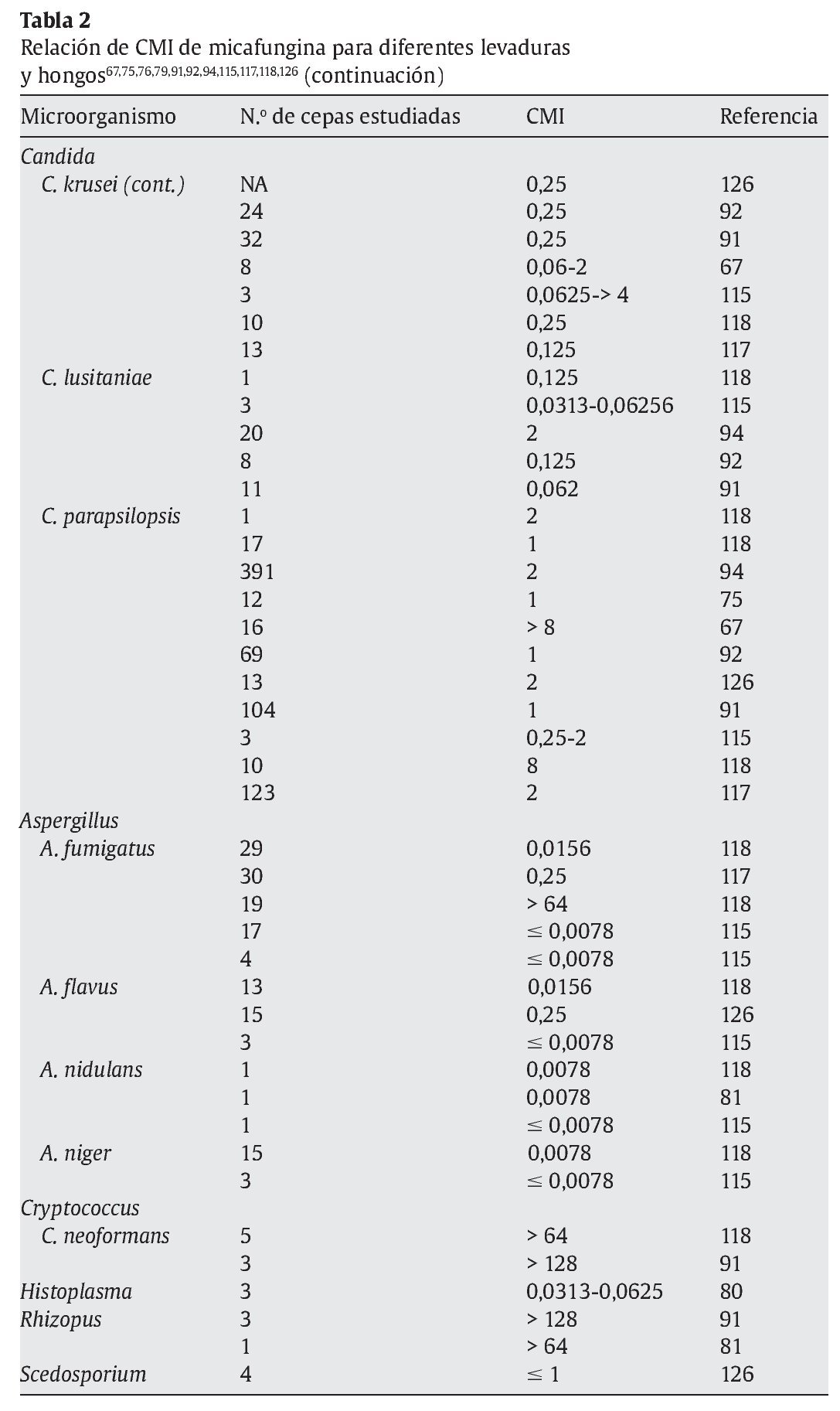
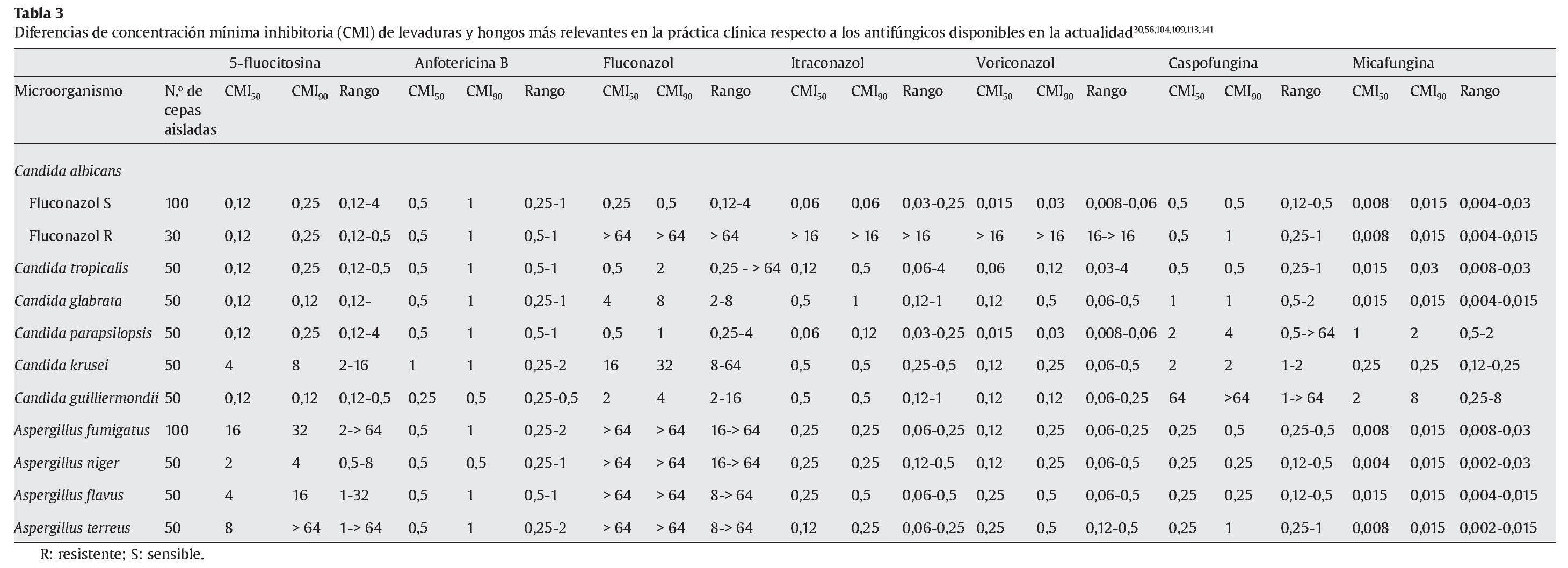
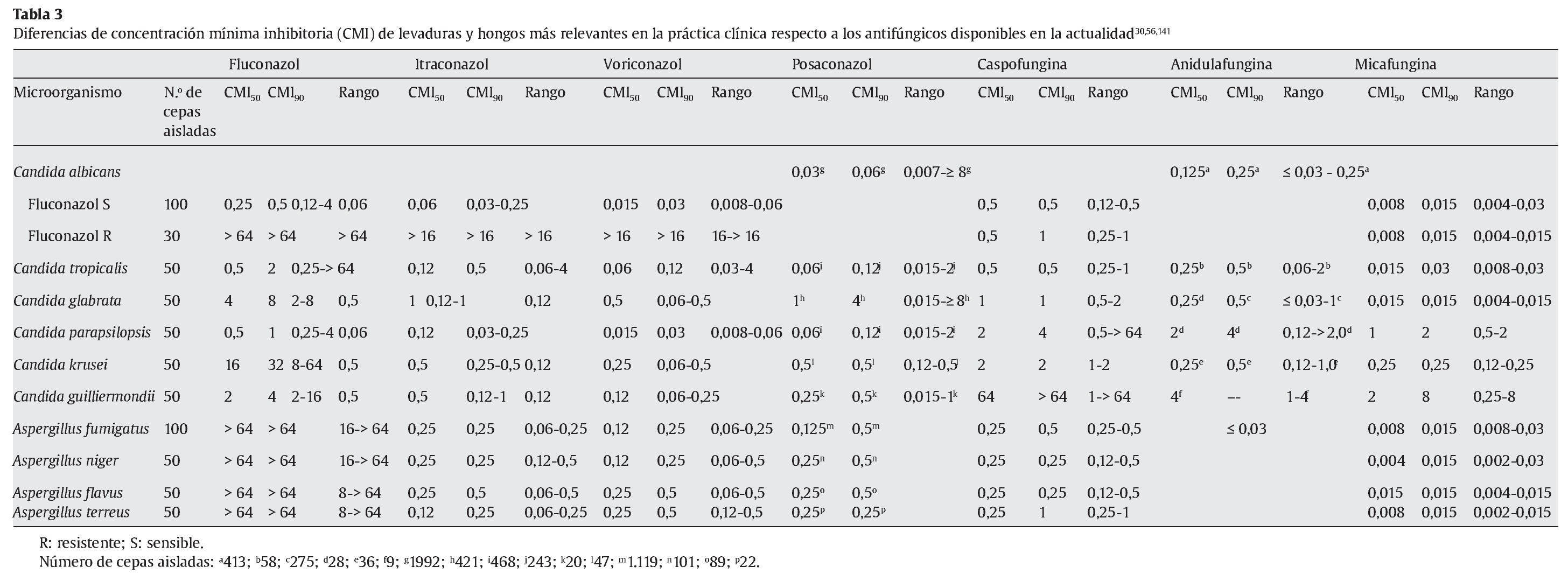
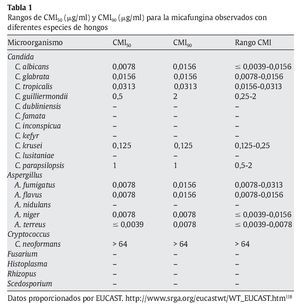
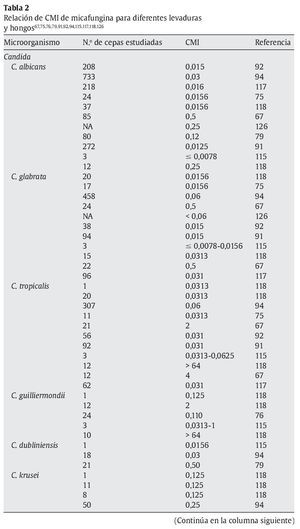
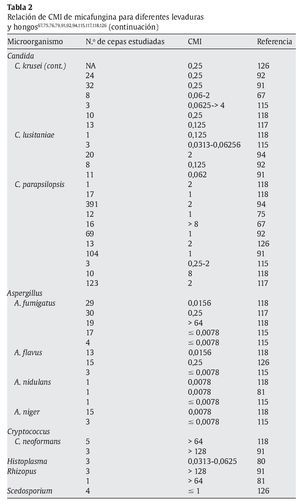
La micafungina muestra un amplia actividad in vitro frente a una gran variedad de levaduras y hongos, como muestran los diferentes estudios referidos en las tablas 1 y 2; sin embargo, los valores de concentración mínima inhibitoria (CMI) deberían interpretarse con cautela, ya que todavía no están estandarizados los test de susceptibilidad para las equinocandinas15.
En la tabla 1 se muestran las CMI50-CMI90 de micafungina frente a los patógenos más relevantes en la práctica clínica. Datos proporcionados por el European Committee on Antimicrobial Susceptibility Testing118 (http://www.srga.org/eucastwt/WT_EUCAST.htm) y la tabla 2 muestra los datos aportados en diferentes estudios.
Micafungina es muy activa frente a la mayoría de las especies de Candida, incluidas las cepas resistentes a los azoles67,118,126. La CMI frente a Candida es generalmente ≤ 0,25 μg/ml, y es más elevada para Candida krusei, Candida parapsilopsis y Candida guilliermondii67,126. La actividad de micafungina frente a C. albicans ≈C. glabrata ≈C. tropicalis < C. lusitaniae ≈C. krusei < C. parapsilosis. También muestra actividad frente aAspergillus; sin embargo, no hay suficientes estudios comparativos que muestren las diferencias entre los diferentes grupos antifúngicos. Demuestra una moderada actividad frente a Cladosporium trichoides, Exophiala dermatitidis, Exophiala spinifera y Fonsecaea pedrosoi81. Únicamente presenta una actividad potente frente a las formas miceliales de Histoplasma capsulatum, Blastomyces dermatitidis y Coccidioides immitis. No tiene ninguna actividad frente a Cryptococcus neoformans, Fusarium solani, zigomicetos, Fusarium, Pseudallescheria boydii (Scedosporium), Alternaria y Trichosporon81,112,118,126.
La micafungina tiene una actividad potente frente a Pneumocystis jiroveci, debido a que la forma quística de este microorganismo contiene β-1,3-D-glucano sintasa.
En la tabla 2 se muestran las diferencias de CMI de levaduras y hongos más relevantes en la práctica clínica respecto a los antifúngicos disponibles en la actualidad30,32,52,56,104,109,113,118,135,141.
Mecanismos de resistencia
Como los inhibidores de la síntesis de β-1,3-D glucano actúan por un mecanismo diferente a los otros antifúngicos, hay pocas resistencias cruzadas27,43,97. Las resistencias adquiridas a equinocandinas en especies de hongos y levaduras sensibles son raras. La mayoría de las mutaciones que confieren resistencias se han asociado con los genes FKS. Se han publicado el desarrollo de resistencias en la practica clínica de micafungina frente a C. parapsilosis77. Se desconoce la aparición de resistencia de micafungina frente a Aspergillus.
Farmacocinética37
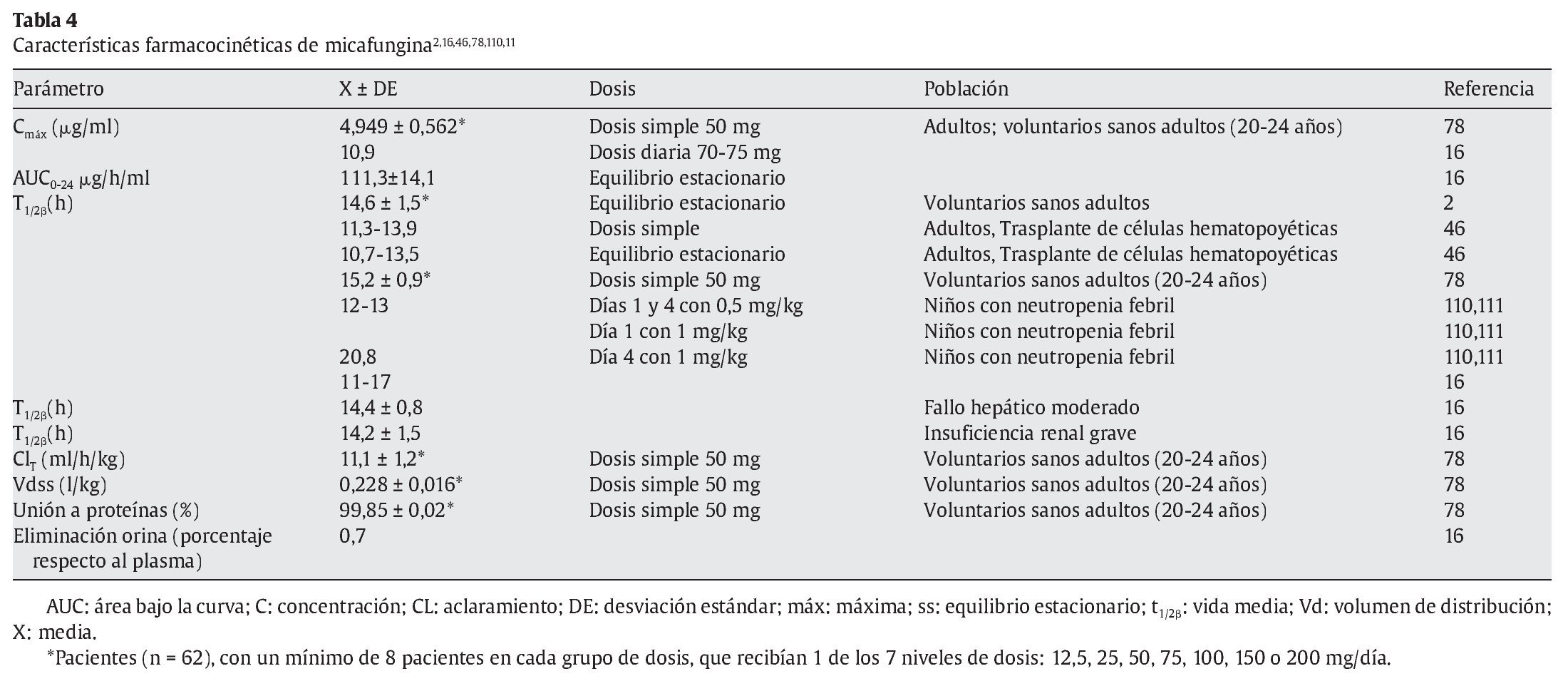
Las características farmacocinéticas de la micafungina se han estudiado en animales34,116, voluntarios sanos3,41,59,78,123, en pacientes adultos3,46,47,78, pacientes pediátricos44,51,110,111,114,120,140 receptores adultos de células hematopoyéticas47,69,83,120,123, pacientes con fracaso renal grave41 y pacientes con insuficiencia hepática moderada41.
Absorción y distribución
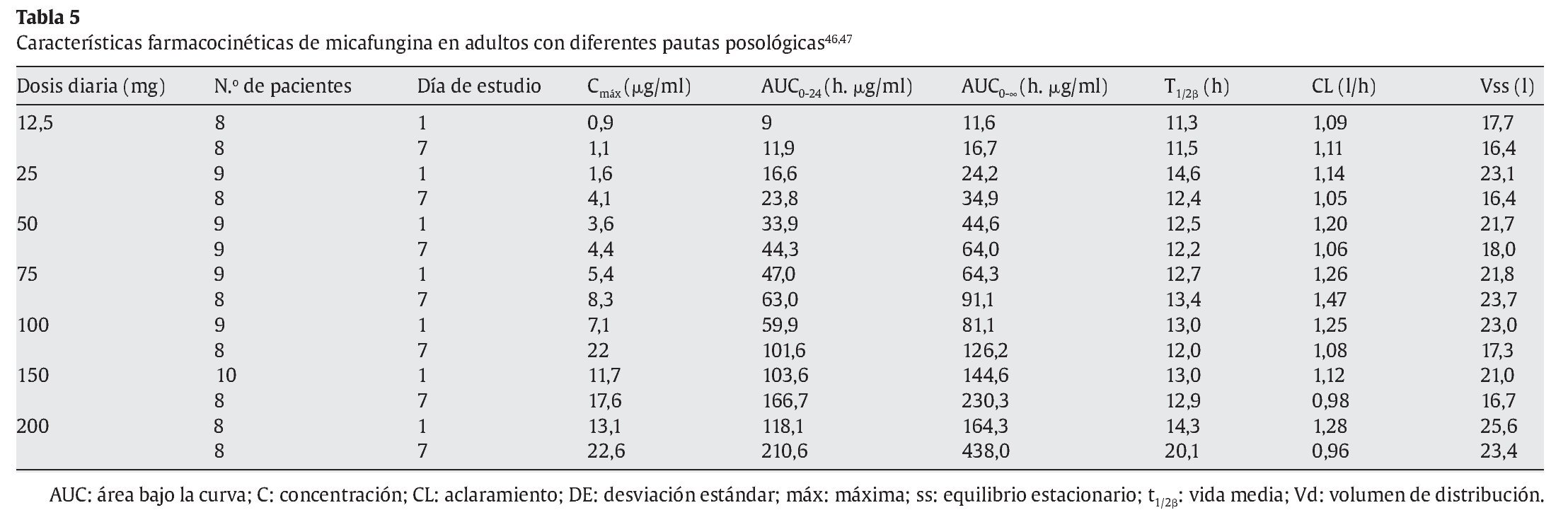
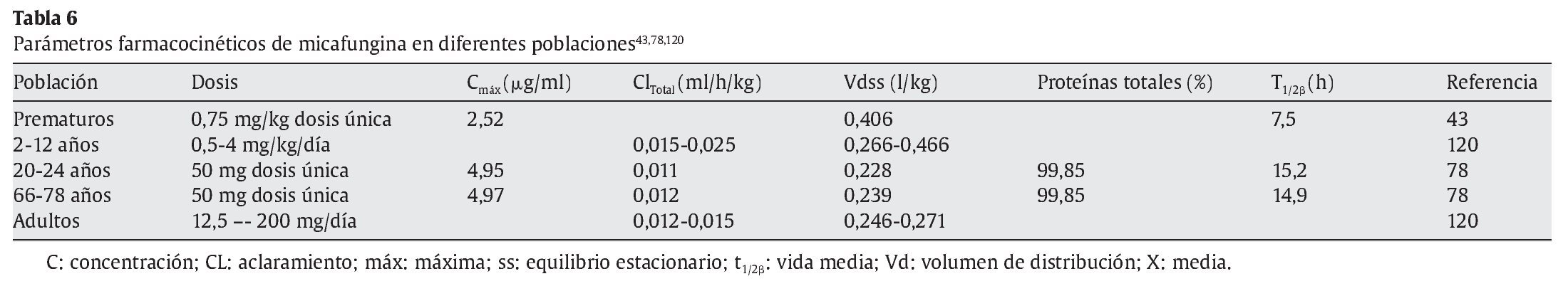
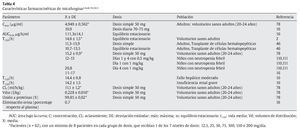
La micafungina no se absorbe por vía oral. Presenta una cinética lineal dependiente de la dosis en todo el rango de dosis diarias desde 12,5 a 200 mg en adultos y de 3-8 mg/kg en niños47. El área bajo la curva (AUC) es dependiente del tiempo-concentración y la concentración máxima alcanzada con micafungina es dependiente de la dosis3. No hay evidencia de acumulación de dosis con posología múltiple. El equilibrio estacionario se alcanza al cuarto o quinto días después de dosis repetidas. La vida media es de 14-15 h con una unión elevada a proteínas plasmáticas 99,85 ± 0,02%3. El volumen de distribución en el equilibrio estacionario es de 0,228 ± 0,016 l/kg (18-19 l). Tras una dosis única de 50 mg en voluntarios sanos, la Cmáx es de 4,949 ± 0,562 μg/ml y el aclaramiento total es de 11,1 ± 1,2 ml/h/kg (tablas 4-6).
La micafungina alcanza concentraciones elevadas en pulmón, hígado, bazo y riñones. Nicasio et al84 han realizado un estudio en voluntarios sanos en el que han analizado la farmacocinética broncopulmonar de micafungina. Quince voluntarios sanos recibieron una dosis diaria de 150 mg de micafungina intravenosa durante 3 días. Después de la tercera dosis, se realizó lavado broncoalveolar a las 4, 12 y 24 h (5 voluntarios sanos en cada punto) y determinación plasmática de micafungina basal después de finalizada la tercera dosis, a la 1, 4, 12 y 24 h. Se consiguió una Cmáx: 19,1 mg/l; ABC0-∞: 219,7 mg/ h/l; Vss: 0,19 l/kg y una t1/2β: 14,7 h. Las concentraciones alcanzadas en el líquido del revestimiento epitelial y en los macrófagos fueron a las 4, 12 y 24 h de 0,5 ± 0,1; 0,4 ± 0,1; 0,4 ± 0,2 y 10,4 ± 5,6, 8,4 ± 5,5 y 14,6 ± 8,6, respectivamente, con una penetración en el líquido de revestimiento epitelial del 5% y en los macrófagos del 106%. Estos datos indican que la penetración de la micafungina en el ámbito pulmonar permite tratar las aspergilosis pulmonares con dosis de 150 mg.
Sin embargo, la concentración alcanzada en el sistema nervioso central es pobre9,34,50,88. Okugawa et al88 publicaron un caso de aspergilosis cerebral tratada con perfusión corta de una hora de 300 mg de micafungina intravenosa. La concentración sérica máxima y mínima en el valle de micafungina alcanzadas con esa dosis fue de 32,41 y 4,08 μg/ml; estas concentraciones se correspondían a unas concentraciones en líquido cefalorraquídeo de 0,017 y 0,007 μg/ml, respectivamente. Aunque las concentraciones del micafungina fueron bajas 0,2-0,05% de la alcanzada en plasma, fue efectiva para la erradicación de la infección.
En experimentación animal, la micafungina penetra muy poco en humor vítreo y acuoso; sin embargo, la concentración que alcanza en retina y coroides es suficiente para tratar cualquier infección fúngica por Candida o Aspergillus116, datos que no se pueden extrapolar a los humanos.
Metabolismo y eliminación
La micafungina es metabolizada en el hígado no por el citocromo P-450 y excretada de manera inactiva por bilis y orina (< 1%). El porcentaje de fármaco eliminado por heces y orina es del 43,8 y el 7,4%, respectivamente124. Se han identificado 3 metabolitos de la micafungina: forma catacol (M1), forma metoxi (M2) y forma de cadena hidroxilada (M5) en concentraciones plasmáticas bajas. El metabolito M5 es el más abundante y supone el 6,5% del total de micafungina124.
En ancianos no varía la farmacocinética de la micafungina. En pacientes con insuficiencia hepática, no cambia la Cmáx ni el aclaramiento de micafungina; sin embargo, hay diferencias respecto al área sobre la curva concentración tiempo AUC0-7235. La insuficiencia renal grave no afecta la farmacocinética de la micafungina, por lo que no es necesario ajustar la dosis.
La hemodiafiltración no cambia la farmacocinética de la micafungina, por lo tanto no es necesario ajustar las dosis en los pacientes sometidos a técnicas de depuración renal continua49.
Poblaciones especiales1,20,44,57,78,110,111,120,132,136,137
La farmacocinética de dosis única de micafungina eran similares en adultos jóvenes sanos y ancianos sanos78. Después de una dosis de 50 mg por vía intravenosa, las concentraciones plasmáticas medias alcanzadas fueron 4,95 y 4,97 mg/l en 10 adultos jóvenes entre 20 y 24 años y en 10 adultos entre 66 y 78 años, respectivamente. El aclaramiento total medio en ambos grupos fue de 0,011 y 0,012 l/h/kg, el volumen de distribución en el equilibrio estacionario fue de 0,228 frente a 0,239 l/kg y la unión a proteínas plasmáticas, de 99,85% en ambos grupos de edad. La vida media de eliminación fue de 15,2 y 14,9 h, respectivamente.
Los parámetros farmacocinéticos en niños con edades comprendidas entre los 2 y los 12 años con neutropenia fue similar a la de los adultos120. La dosis que recibió el grupo pediátrico fue de 0,5-4 mg/kg/día y el grupo de adultos, de 12,5-200 mg/día. El AUC a las 24 h fue proporcional a la dosis recibida y aproximadamente un 25-30% superior al equilibrio estacionario en el grupo pediátrico y en el de adultos. El volumen de distribución en el equilibrio estacionario en el grupo de niños fue de 0,266-0,466 l/kg, comparado con el 0,246-0,271 l/kg en adultos, correspondiendo a un aclaramiento total de 0,015-0,025l/h/kg y 0,012-0,015 l/h/kg, respectivamente120.
En un estudio con 8 niños de edades comprendidas entre los 2 y los 12 años y 8 adolescentes de 13-17 años con neutropenia febril, los parámetros farmacocinéticos fueron similares en ambos grupos. Ambos grupos recibieron dosis de micafungina de 0,5-4 mg/kg/día durante una media de 8 días110,111.
En un estudio realizado en 8 prematuros que recibieron una dosis única de 0,75 mg/kg en perfusión de 30 min de micafungina la Cmáx fue de 2,52 μg/ml; Cmin 20 μg/ml; volumen de distribución 0,406 l/kg; AUC 20,6 μg/h/ml y una vida media de 7,5 h44.
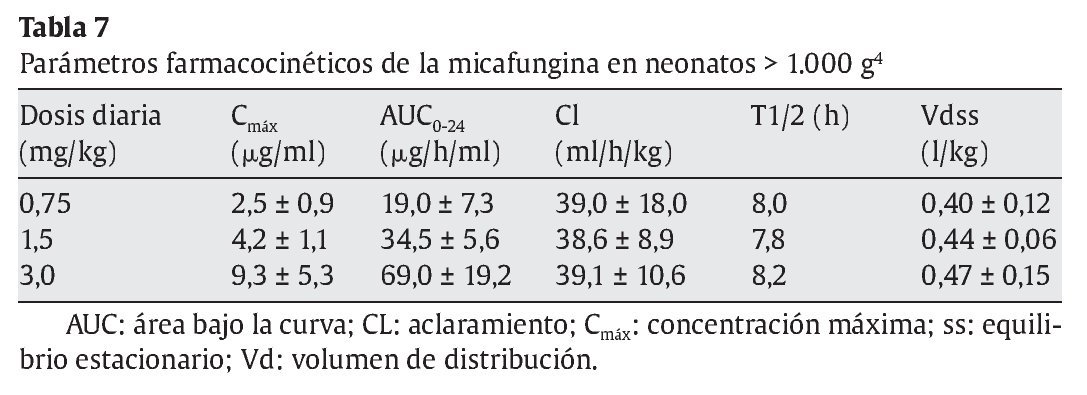
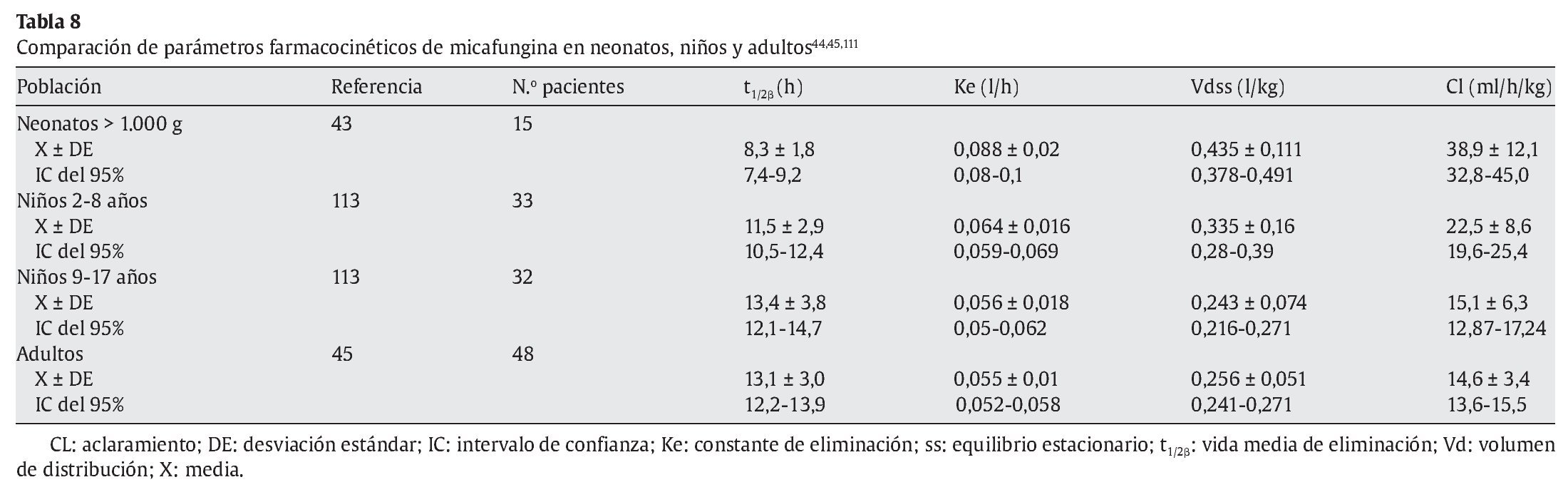
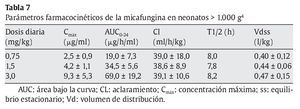
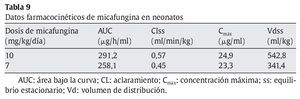
Heresi et al44 publicaron un estudio fase I, dosis simple, multicéntrico, abierto y secuencial con 3 dosis intravenosas de micafungina (0,75 mg/kg, 1,5 mg/kg y 3 mg/kg) en 18 prematuros con peso superior a 1.000 g (6 en cada grupo) y 5 neonatos entre 500 y 1.000 g recibieron 0,75 mg/kg. Los parámetros farmacocinéticos de la micafungina se muestran en la tabla 7. La concentración sérica media de micafungina era menor en el grupo de neonatos más pequeños, la vida media más corta y el aclaramiento total del fármaco, más rápido. En el grupo de neonatos entre 500 y 1.000 g, la vida media de eliminación fue de 5,5 h, con un aclaramiento de 97,3 ml/h/kg. En los neonatos con peso superior a 1.000 g, la vida media de eliminación fue de 8 h, con un aclaramiento total disminuido de 55,9 ml/h/kg similar a los obtenidos en los niños de 2-8 años con una vida media de 12 h y un aclaramiento menor de 32,2 ml/h/kg (tabla 8).
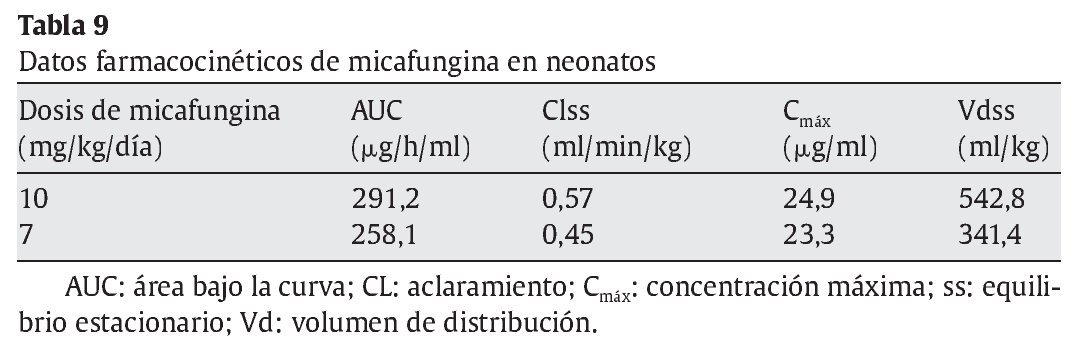
Recientemente, se ha publicado un estudio en neonatos para evaluar la farmacocinética y la seguridad de micafungina7. Se incluyó a 13 neonatos con edades comprendidas entre > 48 h de edad y < 120 días de vida. Los neonatos que pesaban < 1.000 g recibieron una dosis diaria de micafungina de 10 mg/kg, mientras que los que pesaban ≥ 1.000 g recibieron 7 mg/kg durante 4-5 días consecutivos. Del total de niños analizados, 6 pesaban menos de 1.000 g y 7 presentaban pesos superiores. Los datos farmacocinéticos obtenidos en ambos grupos se expresan en la tabla 9. Doce pacientes presentaron efectos adversos y solamente en 3 se relacionaron con el fármaco (incremento de fosfatasa alcalina, flebitis, hipopotasemia y elevación de la temperatura). No se produjo ningún fallecimiento en el grupo de estudio. Los autores demostraron que dosis elevadas de micafungina era bien tolerada y proporcionaba una cobertura adecuada en el ámbito del sistema nervioso central.
Pocos estudios con micafungina se han publicado en la población obesa. Van Wart et al131 han publicado recientemente un estudio de farmacocinética de micafungina en pacientes adultos afectados de candidiasis invasora, candidemia y candidiasis esofágica. La dosis utilizada de micafungina era de 12,5-200 mg intravenosa en perfusión de 1 h. Una de las conclusiones más reseñables es que la población con pesos inferiores a 45 kg el aclaramiento del fármaco era inferior al 30% del observado en la población y que en pacientes obesos por encima de 100 kg el aclaramiento de micafungina era superior al 30%. Consideraban que el peso del paciente es un factor predictivo del aclaramiento de micafungina estadísticamente significativo.
La farmacocinética de la micafungina en los pacientes con insuficiencia hepática moderada con Child-Pugh 7-9 no difiere de la observada en voluntarios sanos41.
Kishino et al61 publicaron un estudio farmacocinético con micafungina en trasplantes hepáticos con injerto procedente de donante vivo y que precisaban técnicas de depuración extrarrenal por presentar clínica compatible con small for size injerto pequeño. Se incluyó a 6 pacientes y se administró como tratamiento profiláctico antifúngico una dosis diaria de micafungina de 40-50 mg en infusión corta durante 3 semanas después del trasplante. La concentración media ± desviación estándar (DE) máxima y mínima plasmática de micafungina fue de 6,31 ± 1,08 μg/ml y 1,65 ± 0,54 μg/ml, respectivamente. El volumen de distribución de la micafungina cuando se alcanza el equilibrio estacionario era de 11,53 ± 1,38 l. La vida media ± DE de eliminación fue de 13,63 ± 2,77 h y la media del AUC fue de 50,05 ± 6,48 μg/h/ml. El aclaramiento de micafungina fue de 0,597 ± 0,084 l/h. Las concentraciones de micafungina en la sangre del circuito de entrada y salida del sistema de técnica de depuración extrarrenal eran similares. El cociente de la concentración de micafungina en las 2 ramas del circuito de diálisis era de 0,94 ± 0,04 y el aclaramiento de micafungina, de 0,054 ± 0,04 ml/min/kg. El total de micafungina obtenido en el ultrafiltrado era de 1 mg. Estos resultados muestran que la micafungina a dosis diaria de 40-50 mg es un antifúngico seguro y efectivo como profilaxis en pacientes trasplantados hepáticos con injerto de donante vivo y que puede administrarse en pacientes que precisan técnicas de depuración extrarrenal sin ajustar la posología.
La farmacocinética de dosis única de micafungina en pacientes con fracaso renal grave es similar a la de los voluntarios sanos41. Dosis única de 100 mg de micafungina en perfusión corta de 60 min en pacientes con fracaso renal grave (índice de filtración glomerular [GFR] < 30 ml/min) es similar a la de voluntarios sanos (GFR > 80 ml/ min). En ambos grupos la Cmáx fue de 8,68 frente a 8,17 mg/l; la tmáx fue de 1,2 frente a 1,1 h; AUC48h 107,8 frente a 111,4 mg/h/l; ABC∞ 118,8 frente a 123,8 mg/h/l; t1/2β 14,23 frente a 14,83 h y el ClTotal es de 0,011 frente a 0,010 l/h/kg110. Nueve pacientes con fracaso renal grave con un aclaramiento de creatinina (GFR) < 1,8 l/h (< 30 ml/min) recibieron una dosis única de 100 mg en infusión intravenosa corta de 60 min.
Hay pocos estudios clínicos en pacientes críticos, pero los datos publicados muestran que las técnicas de depuración extrarrenal continua no modifican la farmacocinética de la micafungina49. Se analizaron los parámetros farmacocinéticos de micafungina en 4 pacientes críticos ingresados en la unidad de cuidados intensivos que precisaban de técnicas de depuración extrarrenal continua y en 9 pacientes críticos que no presentaban fallo renal. La dosis administrada de micafungina fue de 150-300 mg/día por vía intravenosa. En los pacientes que requerían técnicas de depuración extrarrenal, se analizó la concentración de micafungina a la entrada y salida del circuito de diálisis, en el líquido de ultrafiltración y en la orina, con lo que se demostró que con la utilización de la diálisis continua no se modifica la farmacocinética del fármaco. Las concentraciones medias ± DE de micafungina en la sangre de entrada y salida del hemofiltro; líquido de ultrafiltrado y orina eran de 12,7 ± 10,2 μg/ml; 12,3 ± 10,1 μg/ml; no se detecta y 0,2 ± 1,1 μg/ml, respectivamente. Asimismo, el volumen de distribución en equilibrio estacionario y el aclaramiento del fármaco eran similares en ambos grupos con o sin hemodiálisis 17,5 ± 4,4 l frente a 16,2 ± 6,8 l (p = 0,7361) y 1,4 ± 0,7 l/h frente a 1,4 ± 0,7 l/h (p = 0,9043), respectivamente. A pesar del pequeño número de pacientes analizados, los resultados parecen demostrar que las técnicas de depuración extrarrenal continua no interfieren en la farmacocinética de la micafungina.
No hay datos suficientes sobre la utilización de micafungina en mujeres embarazadas, aunque en estudios en animales micafungina pasó la barrera placentaria y se observó toxicidad reproductiva. Debido a que se desconoce el riesgo potencial en seres humanos, no debería utilizarse durante el embarazo, excepto si fuese claramente necesario.
Se desconoce si micafungina se excreta en la leche humana materna. Los estudios realizados en animales han demostrado la excreción de micafungina en la leche materna, por lo que no se recomienda su uso en mujeres lactantes.
Correlación entre farmacocinética y farmacodinamia
En estudios experimentales se ha evaluado la correlación entre la farmacocinética y farmacodinamia (PK/PD) de la micafungina. Presenta un efecto fungicida concentración dependiente frente a Candida con efecto postantifúngico6,25,33,98,100 y efecto fungistático dependiente del tiempo12,99.
El análisis farmacodinámico indica que la actividad antifúngica no está influida por un incremento de concentración del fármaco, pero la intensidad de la actividad se incrementa con el tiempo119. Hay diferencias en el porcentaje de actividad antifúngica y la intensidad de la actividad de la micafungina frente a diferentes especies de Candidaestudiadas25. Los resultados de otros estudios dependientes del tiempo indican que la micafungina podría producir su efecto fungicida máximo contra Candida in vivo cuando la concentración de micafungina fuera ligeramente superior a la CMI en el sitio de la infección82.
La micafungina produce alteración de la pared celular y de las estructuras citoplasmáticas de Aspergillus dependiente del tiempo17.
Interacciones farmacológicas
Debido a que la micafungina no se metaboliza a través del citocromo P-450, hay pocas interacciones farmacológicas descritas86. No hay interacciones con fluconazol47,124, ciclosporina41,42,121, tacrolimus40,122 y micofenolato mofetil.
En presencia de micafungina, el AUC de itraconazol, sirolimus y nifedipina se incrementa un 20%, lo que obliga al seguimiento de la toxicidad de estos fármacos en tratamientos concomitantes30.
No se han observado interacciones farmacológicas entre micafungina y otros fármacos, como rifampicina, ritonovir, warfarina, diazepam y metotrexato.
Indicaciones y dosificación10,93,104
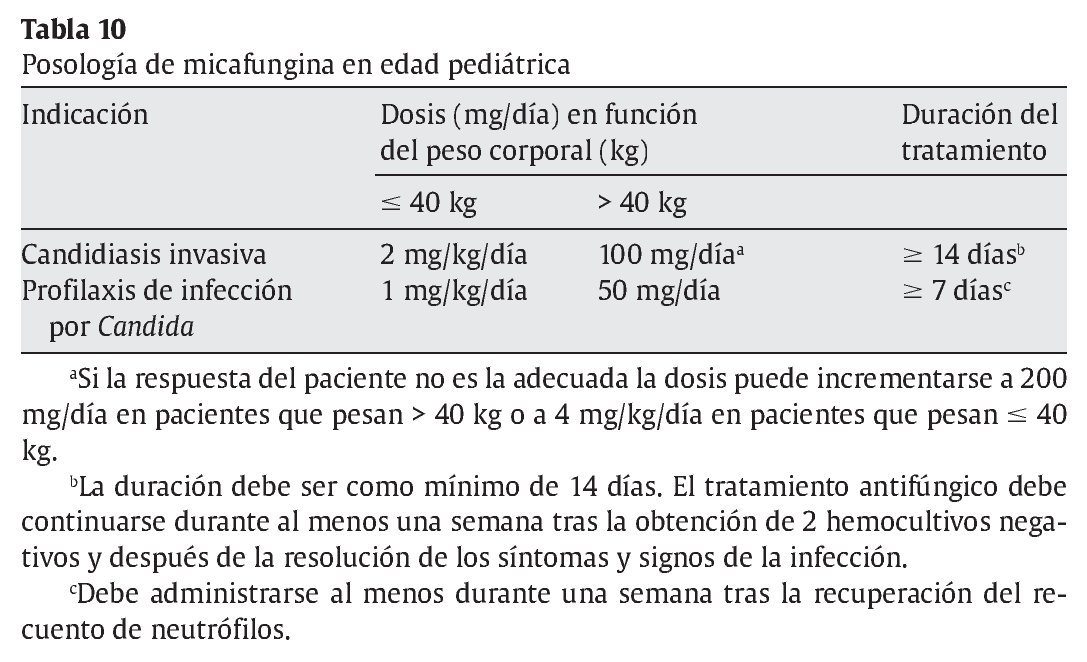
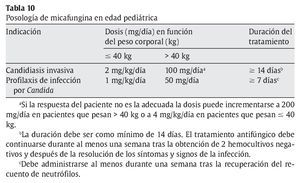
En niños (neonatos incluidos) y adolescentes < 16 años, la micafungina está indicada en:
a) Tratamiento de la candidiasis invasora.
b) Profilaxis de la infección por Candida en pacientes sometidos a trasplante alogénico de células precursoras hematopoyéticas.
c) Profilaxis de la infección por Candida en pacientes que se espera que puedan presentar neutropenia (recuento absoluto de neutrófilos < 500 células/μl) durante 10 o más días.
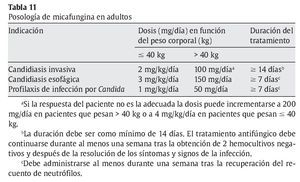
En adolescentes ≥ 16 años, adultos y ancianos, la micafungina está indicada en:
a) Tratamiento de la candidiasis invasiva.
b) Tratamiento de la candidiasis esofágica en los pacientes en los que el tratamiento intravenoso es adecuado.
c) Profilaxis de la infección por Candida en pacientes sometidos a trasplante alogénico de células precursoras hematopoyéticas.
d) Profilaxis de la infección por Candida en pacientes que se espera que puedan presentar neutropenia (recuento absoluto de neutrófilos < 500 células/μl durante 10 o más días.
En las tablas 10 y 11 se muestra la posología de la micafungina en edad pediátrica y adultos.
Efectos adversos
La micafungina es bien tolerada, independientemente de la dosis administrada y del tiempo de duración de tratamiento. El perfil de seguridad de micafungina se basa en los ensayos clínicos realizados con 3.028 pacientes tratados con micafungina: 2.002 pacientes con infecciones por Candida2,8,10,13,19,21,22,31,62,63,66,89,93,96,102,103,107, 375 pacientes con aspergilosis pulmonar23,28,54,62,73,74,95,101,108,127,134,139 y 651 pacientes en profilaxis de infecciones sistémicas fúngicas38,48,64,128,129,130,138.
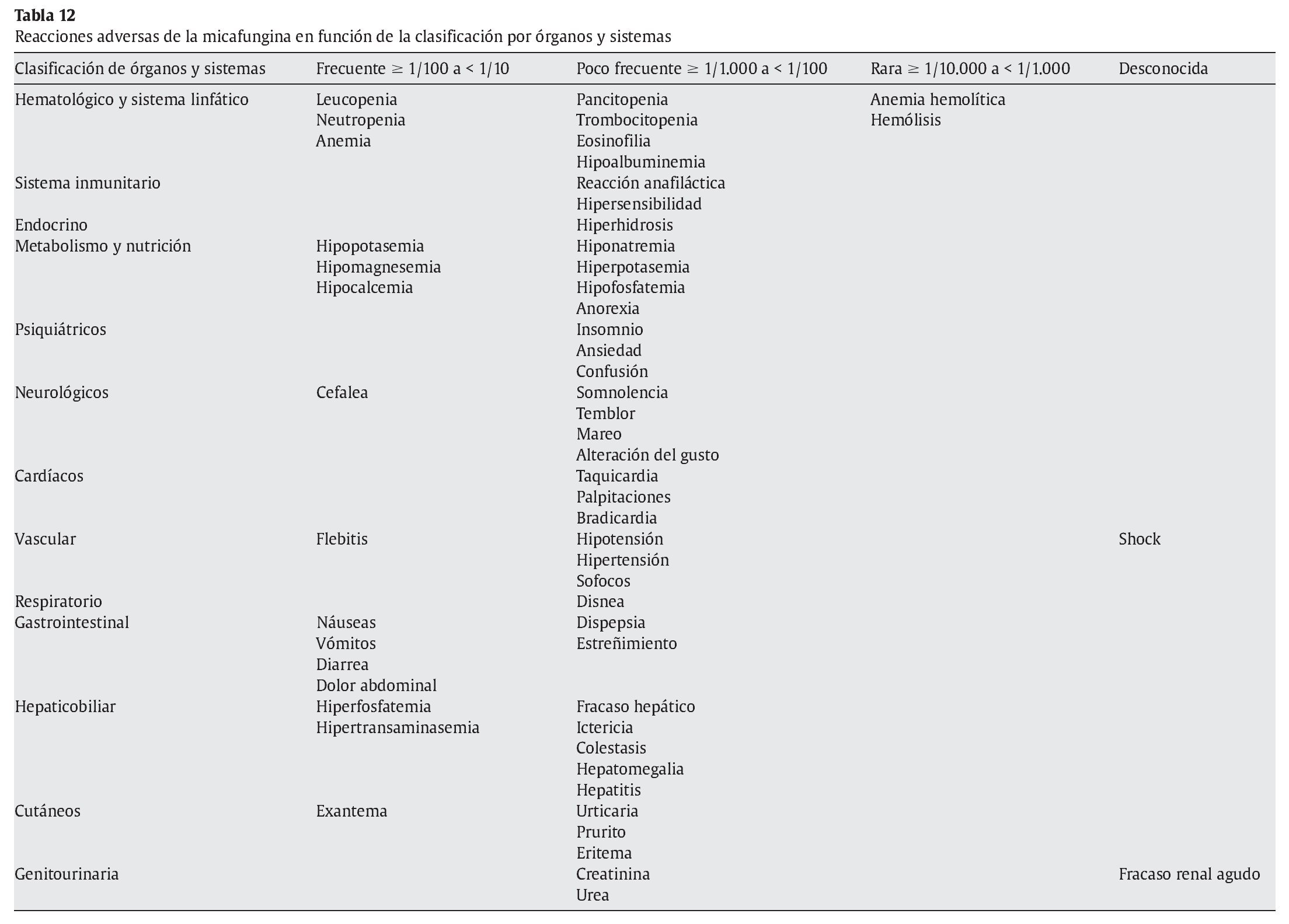
El 32,2% de todos los pacientes presentó reacciones adversas. Las más frecuentemente notificadas fueron náuseas 2,8%, incremento de la fosfatasa alcalina sérica 2,7%, flebitis 2,5%, vómitos 2,5% e incremento de aspartato aminotransferasa 2,3%, hiperbilirrubinemia 1,6%, fiebre 1%, cefalea 3%.
En el estudio realizado por Van Burik et al129, en el que se analizan los efectos adversos más frecuentes con micafungina en 425 pacientes con trasplante de células hematopoyéticas, se observó hiperbilirrubinemia en el 3,3%, náuseas en el 2,4% y diarrea en el 2,1% de los pacientes. El 4,2% de los pacientes tuvieron que suspender el tratamiento con micafungina por efectos adversos. Como ocurre con la caspofungina, también puede aparecer eosinofilia con la administración de micafungina29. Excepcionalmente se ha notificado erupción cutánea, prurito y urticaria53. También se han descrito ocasionalmente flebitis con la administración intravenosa105,106.
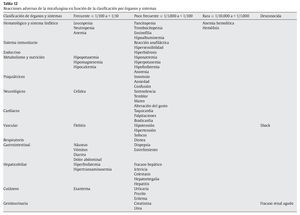
En la tabla 12 se enumeran las reacciones adversas en función de la clasificación por órganos y sistemas, y de acuerdo con el término preferido por el Medical Dictionary for Regulatory Activities. Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
En estudios en animales, se ha observado toxicidad testicular con micafungina. Puede alterar potencialmente la fertilidad masculina en humanos.
Conclusiones
La micafungina presenta un perfil farmacodinámico y fármacocinético que permite su administración de modo seguro, con mínimas interacciones medicamentosas y sin necesidad de ajuste de dosis en presencia de fracaso renal o hepático.
Correo electrónico:mmcges@yahoo.es (M. Catalán González).
Historia del artículo:Recibido el 30 de enero de 2009
Aceptado el 13 de febrero de 2009