La identificación microbiológica en infecciones endodónticas se ha enfocado principalmente a la caracterización bacteriana sin dar relevancia a las levaduras que, por sus factores de virulencia, pueden afectar el resultado del tratamiento clínico realizado.
ObjetivosDeterminar la frecuencia de Candida en condiciones anaerobias en conductos radiculares con infecciones endodónticas primarias y persistentes, y evaluar un método de muestreo microbiológico por lavado y aspiración en comparación con el método tradicional por absorción con puntas de papel.
MétodosSe tomaron 50 muestras microbiológicas de dientes con infección endodóntica primaria y persistente provenientes de 47 pacientes que requirieron tratamiento endodóntico. Se emplearon dos métodos de toma de muestra microbiológica: un método por aspiración y un método por absorción con puntas de papel, ambos con dos tipos de caldo de cultivo (M1-M4). Las muestras fueron cultivadas en condiciones de anaerobiosis hasta lograr una turbidez de 0,5 en la escala de McFarland, y se resembraron en placas de agar dextrosa Sabouraud y agar sangre enriquecido para anaerobios. Se realizó una observación macroscópica y microscópica de las colonias formadas. Las pruebas de producción de tubo germinal, crecimiento en CHROMagar e identificación bioquímica se realizaron a los aislamientos levaduriformes obtenidos.
ResultadosDe los 50 dientes evaluados, 18 de ellos (36%) mostraron infección por levaduras. En los casos de infección primaria se encontraron levaduras en 15 de 36 dientes (41,6%) y en casos de infección persistente en 3 de 14 (21,4%). El método por lavado y aspiración con caldo de dextrosa Sabouraud recuperó mayor diversidad de especies.
ConclusionesLa frecuencia de levaduras fue más alta en los dientes con infección primaria en comparación con los dientes con infección persistente. La especie de levadura predominante fue Candida albicans. El método de toma de muestra por lavado y aspiración fue más eficiente en la recuperación de aislamientos de Candida que el método tradicional por absorción con puntas de papel.
Microbiological identification in endodontic infections has focused mainly on bacteria without giving much attention to yeasts, which, due to their virulence factors, can affect the outcomes of root canal treatment.
AimsTo determine the frequency of Candida in anaerobic conditions in root canals with primary and persistent endodontic infection, as well as to evaluate a microbiological sampling method using aspiration compared to the traditional absorption method with paper points.
MethodsFifty microbiological samples were obtained from teeth of 47 patients requiring endodontic treatments, due to either primary or persistent infections. Two microbiological sampling methods were used: an aspiration method, and the traditional paper point absorption method. In each of these methods, two types of medium were used (M1-M4). Samples were cultured under anaerobic conditions until reaching 0.5 McFarland turbidity, and then inoculated on Sabouraud dextrose, as well as on anaerobic enriched blood agar plates. Macroscopic and microscopic observations of the colonies were performed. The germ-tube test, growth on CHROMagar, and biochemical identification were performed on the isolated yeasts.
ResultsFungal infection was found in 18 (36%) samples out of the 50 teeth evaluated. In the 18 samples positive for fungal infection, 15 out of 36 (41.6%) teeth were taken from a primary infection, and 3 out of 14 (21.4%) from a persistent infection. The aspiration method using Sabouraud dextrose medium recovered a greater diversity of species.
ConclusionsYeasts frequency was higher in teeth with primary infections compared to teeth with persistent infections. The predominant yeast species was Candida albicans. The aspirating sampling method was more efficient in the recovery of Candida isolates than the traditional absorption method.
Las levaduras son microorganismos eucariotas del reino Fungi que se desarrollan sobre las plantas, los animales y el ser humano; en estos últimos forman parte de la microbiota de la cavidad oral y actúan de forma comensal o patógena. Como microorganismos oportunistas aprovechan el deterioro de los tejidos duros del diente para penetrar hasta el tejido pulpar, y una vez este se encuentra necrótico ayudan al establecimiento de la infección endodóntica primaria22, avanzando por la raíz a través de los conductos radiculares hasta el ápice dental (porción final de la raíz). Estas infecciones son de etiología polimicrobiana en las que predominan las bacterias anaerobias6, aunque también se encuentran bacterias anaerobias facultativas, microaerófilas y levaduras23.
Una vez establecida una infección primaria, el tratamiento de endodoncia representa la opción clínica terapéutica para eliminarla. Este tratamiento consiste en la limpieza y desinfección del sistema de conductos radiculares con limas endodónticas y soluciones irrigantes, concluyendo con la obturación7. El sistema de conductos radiculares se compone de una red de conductos intercomunicados entre sí y con el exterior del diente, en donde, a pesar de los esfuerzos por desinfectar, algunos microorganismos pueden permanecer presentes y causar una infección persistente que afecte el resultado del tratamiento9. Este tipo de infección es causada por un pequeño grupo de microorganismos entre los que se encuentran levaduras del género Candida, que poseen diversos factores de virulencia que aumentan su resistencia al tratamiento; la infección puede diseminarse a otros tejidos del área maxilofacial28.
La caracterización de los microorganismos involucrados en esta patogenia se realiza a través de la toma de muestras microbiológicas y su posterior identificación. Tradicionalmente se realiza aislando completamente el diente para evitar la contaminación desde la cavidad oral, seguido del acceso a la cámara pulpar y un protocolo de desinfección de campo operatorio, para finalmente tomar la muestra del conducto radicular por absorción con puntas de papel estériles12. Los diferentes estudios de la microbiota endodóntica han ido enfocados al aislamiento e identificación de especies bacterianas con el uso de medios específicos y la técnica de muestreo por absorción con puntas de papel, sin prestar importancia a la presencia de levaduras, por lo que la identificación de estos microorganismos es casi siempre un hallazgo accidental4,20. Por otra parte, los estudios que se han realizado con medios específicos y enfocados al aislamiento de levaduras reportan mayores porcentajes de recuperación3,19.
El objetivo principal de este estudio fue determinar la frecuencia de Candida en condiciones anaerobias en conductos radiculares de dientes con infección endodóntica primaria y persistente, además de evaluar un método de muestreo por lavado y aspiración, en comparación con el método tradicional por absorción con puntas de papel.
Materiales y métodosDiseño del estudio y selección de pacientesSe realizó un estudio transversal, analítico y prolectivo en 47 pacientes que acudieron a la clínica para un tratamiento endodóntico. La edad promedio de los pacientes incluidos fue de 39,9 años, con una desviación estándar de 14. El 58% de los pacientes fueron del sexo femenino y el 42% del masculino.
Cada paciente incluido en el estudio autorizó y firmó una carta de consentimiento informado, aprobada por el Comité de Ética en Investigación de la institución. Se realizó la historia clínica de los pacientes y se verificó que ninguno tuviera alguna enfermedad o tratamiento que promoviera el posible desarrollo de levaduras, tales como diabetes, síndrome de inmunodeficiencia humana, quimioterapia o tratamiento antibiótico. De cada paciente fueron seleccionados dientes con infecciones endodónticas primaria (n=36) y persistente (n=14); todos los dientes fueron examinados clínica y radiográficamente para confirmar la integridad coronal suficiente para realizar aislamiento absoluto y lograr la adecuada toma de la muestra microbiológica.
Toma de muestra del conducto radicularLos dientes seleccionados se aislaron con dique de goma y grapa, y se realizó el acceso a la cámara pulpar y a los conductos radiculares con irrigación abundante. Se llevó a cabo el protocolo de desinfección del campo operatorio siguiendo los pasos definidos por Möller13 con la modificación de Manzur et al.11. Posteriormente se tomó una muestra del campo operatorio, que fue cultivada durante 24h para comprobar la adecuada desinfección; las muestras contaminadas fueron descartadas.
Sin importar el tipo de infección (primaria o persistente), se colocó una lima de endodoncia en los conductos hasta alcanzar la longitud total de la raíz basándose en la radiografía preoperatoria. La toma de muestra fue llevada a cabo por medio de cuatro diferentes protocolos: M1 y M3 fueron con el método por lavado y aspiración, M2 y M4 con el método por absorción con puntas de papel. Se humedecieron los conductos, embebiendo con caldo de tioglicolato prerreducido (Becton Dickinson, DF, México) y se rasparon levemente las paredes de los conductos radiculares con una lima Hedstroem (Kerr UK Limited, Peterborough, Reino Unido) a 1mm de la longitud de trabajo estimada inicialmente. Para la toma de muestra1 (M1) se realizó el lavado y aspiración del contenido del conducto con una aguja plástica (Capillary tips, Ultradent Products, UT, EE.UU.) insertada a una jeringa hipodérmica estéril y se inyectó en un tubo con medio de cultivo de tioglicolato. Se repitió el paso anterior, esta vez para sembrar el inóculo del contenido del conducto en un tubo con caldo dextrosa Sabouraud (M3) (Becton Dickinson). Por tercera vez se humedeció el conducto radicular para introducir cuatro puntas de papel (cada punta individualmente durante 1min). Inmediatamente después, se colocaron dos puntas dentro de un tubo con caldo de tioglicolato (M2) y dos puntas en tubo con caldo de dextrosa Sabouraud (M4). En los dientes con infección persistente, además del muestreo descrito anteriormente, también se realizó previamente a la toma de muestra la eliminación de todo el material de obturación existente con fresas Gates Glidden (Kerr UK Limited) y limas Hedstroem; dicho material se colocó dentro del tubo con caldo de tioglicolato para completar la toma de la muestra M1. Al terminar el tratamiento convencional de conductos, las muestras tomadas se llevaron al laboratorio para su procesamiento.
Procesamiento de las muestrasLas muestras fueron incubadas en una cámara de anaerobiosis (MAIC/2000 COY Laboratory, Michigan, EE.UU.) a 37°C durante 24-48h hasta obtener una turbidez de 0,5 en la escala de McFarland, momento en el cual se realizó la siembra en placas de agar dextrosa Sabouraud y agar sangre enriquecido para anaerobios (CDC) en las mismas condiciones y durante 24-48h hasta observar el desarrollo de colonias. Posteriormente se observó la morfología macroscópica al microscopio estereoscópico (Leica, EZ4D, Wetzlar, Alemania) a 40× para diferenciar las colonias formadas. Se realizó también tinción de Gram y observación de la morfología microscópica con el microscopio óptico (Leica DM500, Wetzlar, Alemania) a 100×. Una vez identificada alguna forma fúngica se realizó una resiembra en CHROMagar Candida® (Becton Dickinson); el cultivo se incubó durante 24-72h para su posterior identificación. Para confirmar la pureza del aislamiento se realizó una tinción de Gram y se realizó la identificación de cada uno mediante la prueba bioquímica API 20 C-AUX (bioMérieux, Marcy l’Etoile, Francia). Finalmente, se realizó la prueba de tubo germinal para complementar la identificación.
AnálisisSe realizó un análisis descriptivo de los resultados a través de frecuencias y porcentajes. Las posibles diferencias asociadas a la comparación en recuperación de aislamientos de Candida de acuerdo con la especie y el tipo de infección por medio de los diferentes métodos de muestreo fueron evaluadas estadísticamente por medio de la prueba exacta de Fisher, teniendo en cuenta que las variables son categóricas-nominales y en algunos casos las frecuencias fueron menores de cinco.
ResultadosIdentificación microbiológicaLos resultados mostraron la presencia de cocos grampositivos con mayor frecuencia en ambos métodos de toma de muestra, lo que representó un 54,5%, seguido por bacilos grampositivos (34%), cocos gramnegativos (26,5%), bacilos gramnegativos (23%) y levaduras (17,5%). Es importante hacer constar que en el caso del método por lavado y aspiración y uso del caldo dextrosa Sabouraud (protocolo M3), el porcentaje de recuperación de aislamientos de Candida fue mayor en comparación con el resto de los métodos de toma de muestra, con diferencias estadísticamente significativas (p<0,05, prueba exacta de Fisher).
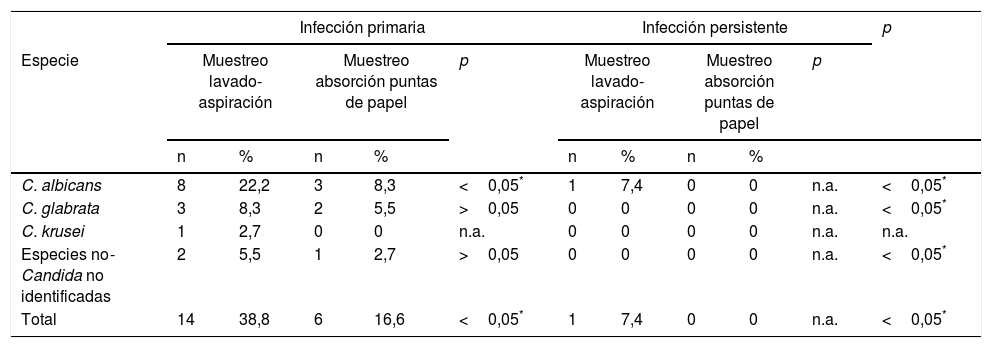
La tabla 1 muestra la frecuencia de especies de Candida según el tipo de muestreo y el tipo de infección. De los 50 dientes evaluados, 18 de ellos (36%) mostraron infección por levaduras. En los casos de infección primaria se encontraron levaduras en 15 de 36 dientes (41,6%) y en casos de infección persistente en 3 de 14 (21,4%), teniendo en cuenta los dos métodos de muestreo y ambos caldos de cultivo (M1, M2, M3, M4). En la tabla se muestra la frecuencia de especies de Candida en caldo dextrosa Sabouraud según tipo de muestreo y tipo de infección (M3 y M4).
Especies de Candida según el tipo de muestreo y el tipo de infección. Los datos provienen del uso de caldo de dextrosa Sabouraud (protocolos M3 y M4)
| Infección primaria | Infección persistente | p | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Especie | Muestreo lavado-aspiración | Muestreo absorción puntas de papel | p | Muestreo lavado-aspiración | Muestreo absorción puntas de papel | p | |||||
| n | % | n | % | n | % | n | % | ||||
| C. albicans | 8 | 22,2 | 3 | 8,3 | <0,05* | 1 | 7,4 | 0 | 0 | n.a. | <0,05* |
| C. glabrata | 3 | 8,3 | 2 | 5,5 | >0,05 | 0 | 0 | 0 | 0 | n.a. | <0,05* |
| C. krusei | 1 | 2,7 | 0 | 0 | n.a. | 0 | 0 | 0 | 0 | n.a. | n.a. |
| Especies no-Candida no identificadas | 2 | 5,5 | 1 | 2,7 | >0,05 | 0 | 0 | 0 | 0 | n.a. | <0,05* |
| Total | 14 | 38,8 | 6 | 16,6 | <0,05* | 1 | 7,4 | 0 | 0 | n.a. | <0,05* |
Casos infección primaria, n=36; casos infección persistente, n=14.
n.a.: no aplicable.
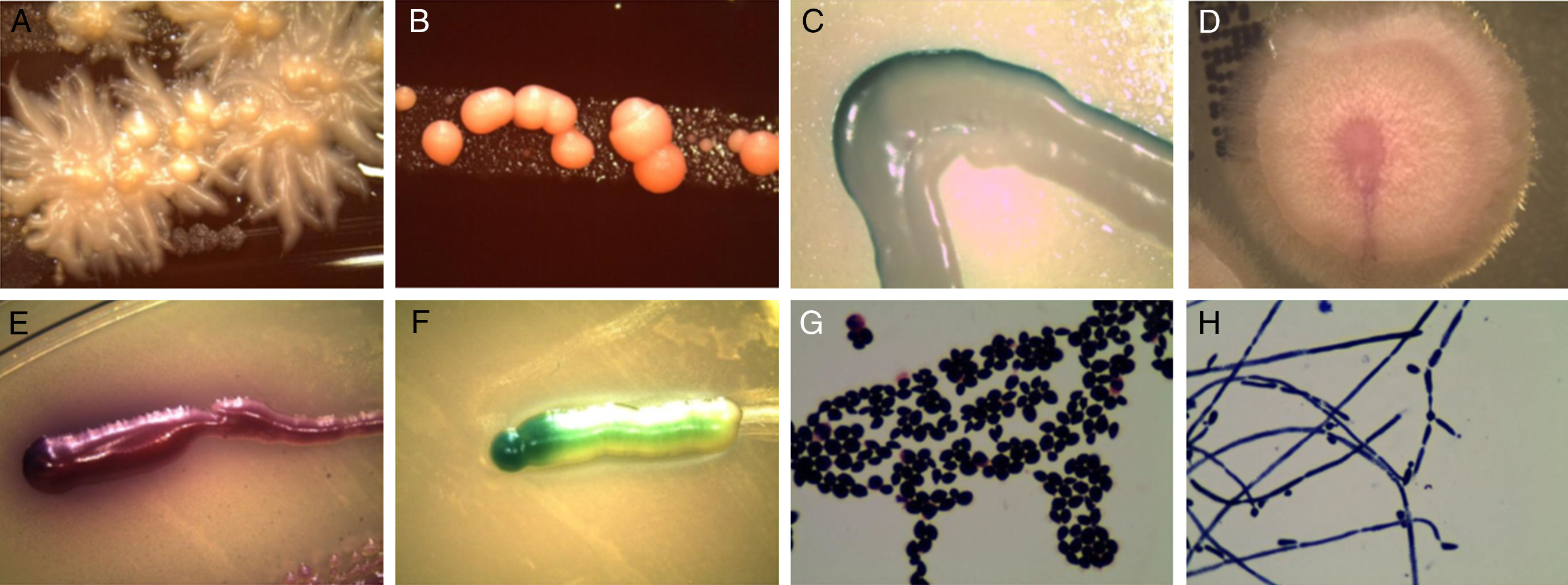
El método por lavado y aspiración con caldo de dextrosa Sabouraud (M3) recuperó una mayor diversidad de especies. Candida albicans se presentó con mayor frecuencia (9 muestras), seguida de Candida glabrata (3 muestras) y Candida krusei (1 muestra); además hubo 2 muestras en las que los aislamientos no pudieron ser identificados (catalogados como no-Candida). El método M3 arrojó valores estadísticamente significativos (p<0,05, prueba exacta de Fisher) en la recuperación de especies de levaduras en comparación con el resto de métodos. La figura 1 muestra imágenes del desarrollo e identificación de algunos de los aislamientos de Candida.
Imágenes 10× al microscopio estereoscópico de colonias de levaduras de una muestra sembrada en agar CDC (A,B). Las colonias fueron resembradas en CHROMagar (C), y las especies identificadas fueron C. krusei (D), C. glabrata (E), y C. albicans (F); se muestra una tinción de Gram (G) y una prueba de tubo germinal (H).
Estudios previos de infecciones endodónticas reportan una frecuencia de levaduras variable, desde el 0,5% hasta el 55%5,15, dependiendo de las técnicas de recuperación empleadas; la mayoría de estos estudios son enfocados a la obtención de especies bacterianas, sin dar importancia a las levaduras, por lo que su presencia puede pasar inadvertida en la mayoría de los casos8,14,25.
Con la intención de disminuir las debilidades de la toma de muestra con puntas de papel se propuso un nuevo método mediante el lavado y la aspiración del contenido del conducto radicular para así reducir la exposición de los microorganismos al medio ambiente externo. Con este método se observó que la turbidez aumentaba en un periodo más corto en comparación con las muestras tomadas con puntas de papel, lo que sugiere que la carga microbiana con este método fue mayor y/o que se aspiraron nutrientes que ayudaron al desarrollo de los microorganismos. Cabe mencionar que este método de toma de muestra no ha sido reportado previamente en la literatura.
En el presente trabajo fueron empleados dos diferentes medios de cultivo con el fin de aumentar la cantidad de especies fúngicas aisladas; el tioglicolato prerreducido fue empleado para tratar de simular las condiciones y nutrientes que se presentan dentro del conducto radicular, como son bajos niveles de oxígeno y alto nivel de nutrientes, y el caldo dextrosa Sabouraud por ser el medio ideal para el crecimiento de levaduras29.
En relación con la identificación de las bacterias, Sundqvist et al.24 mencionan que las infecciones primarias se componen de una flora polimicrobiana, y la presencia de bacterias grampositivas y gramnegativas es equilibrada; sin embargo, en este estudio se encontró que la frecuencia de las bacterias grampositivas fue mayor en comparación con las bacterias gramnegativas, lo que podría deberse a los distintos métodos de toma de muestra empleados. En las muestras con infección persistente se identificó un 51% de bacterias grampositivas, porcentaje menor que lo hallado por Molander et al.12, Möller13 y Sundqvist et al.24, cuyos porcentajes de aislamiento fueron del 69, 80 y 87%, respectivamente. Esta diferencia puede deberse a que las condiciones de cultivo fueron diferentes, ya que los experimentos se realizaron en una cámara de anaerobiosis y el objetivo principal fue el aislamiento e identificación de especies fúngicas. Las bacterias gramnegativas se observaron en un 34% de las muestras, porcentaje similar a lo establecido por Siqueira23, quien menciona que estas bacterias están presentes en un bajo porcentaje. Como se ha mencionado anteriormente, las muestras fueron incubadas en condiciones de anaerobiosis con el objetivo de reproducir las características del interior del conducto radicular, en donde las concentraciones de oxígeno son muy limitadas.
Aunque el género Candida es considerado aerobio, estudios recientes demuestran su capacidad como anaerobio facultativo17. La presencia de C. albicans en el conducto radicular puede deberse a que esta se encuentra en forma comensal en la cavidad oral26. En la presente investigación la frecuencia de levaduras fue del 36%, en contraste con el 10% hallado en estudios previos en los que se utilizó una metodología similar4; la diferencia puede deberse al tipo de medio de cultivo empleado, ya que el estudio mencionado utilizó un líquido prerreducido (RFT), mientras que en este se utilizó tioglicolato prerreducido y dextrosa Sabouraud. Otra diferencia fue el método de toma de muestra, en donde Egan et al.4 utilizaron 3 puntas de papel frente a los 4 métodos diferentes de toma de muestra de nuestro estudio. En otro estudio con características similares, Dumani et al.3 describen una frecuencia del 15,5% de C. albicans mediante reacción en cadena de la polimerasa (PCR), pero se ignoran otras especies de Candida. La frecuencia de C. albicans en nuestro estudio fue del 26%, y otras especies de Candida identificadas fueron C. glabrata (12%) y C. krusei (2%). La mayor frecuencia en este estudio puede deberse al método de toma de muestra y/o a la diferente microbiota que pueda existir en la población de estudio, esto último dependiente de factores como la dieta, el nivel socioeconómico y la localización geográfica, entre otros2,19.
La frecuencia de levaduras en infecciones primarias reportada en la literatura varía entre el 0,5 y el 40%1,5,10,21; en el presente estudio fue del 41,6%, lo que puede considerarse una frecuencia alta para este tipo de infecciones endodónticas. Este resultado podría indicar que se ha subestimado la presencia de estos microorganismos al realizar tratamientos endodónticos y ser, incluso, una posible causa de fracaso si se consideran los diversos factores de virulencia de C. albicans: resistencia a hidróxido de calcio (medicamento intraconducto más comúnmente utilizado en endodoncia), crecimiento de Candida en la dentina, dimorfismo, tigmotropismo, secreción de enzimas proteolíticas, supervivencia y formación de biopelícula en condiciones de falta de nutrientes, supervivencia en condiciones anaeróbicas y estáticas17,20,26,27, y resistencia a la desinfección con hipoclorito de sodio16. Estos mismos factores de virulencia son los que podrían estar relacionados con la frecuencia de estos microorganismos en infecciones persistentes. Nair et al.14 encuentran una frecuencia del 22% en este tipo de infecciones, y Peciuliene et al.18 de un 18,1%, valores similares al de este estudio (21,4%).
Este estudio encontró una alta frecuencia de levaduras en ambos tipos de infección endodóntica (36%), lo que sugiere que al realizar un tratamiento de endodoncia se deben utilizar todos los medios posibles para evitar la contaminación del conducto desde el medio oral y evaluar si los antimicrobianos y materiales utilizados en el tratamiento son capaces de eliminar estos microorganismos con el fin de prevenir el fracaso endodóntico.
ConclusionesLa frecuencia de levaduras fue mayor en los dientes con infección primaria que en los dientes con infección persistente. La especie de levadura encontrada con mayor frecuencia fue C. albicans. El método de toma de muestra por lavado y aspiración fue más eficiente en la recuperación de aislamientos de Candida que el método tradicional por absorción con puntas de papel.
Conflicto de interesesLos autores declaran no tener conflictos de intereses.
Programa de fortalecimiento de la UASLP/PIFI 2013 y fondo FAI C15-FAI-04-31.31, C15-FAI-10.78.78.