En la actualidad, el tratamiento de las infecciones fúngicas invasivas en el paciente crítico, desde su diag-nóstico hasta la elección de la mejor opción terapéutica, continúa siendo un desafío. El diagnóstico y el tratamiento tempranos de éstas se asocia a un mejor pronóstico, pero —excepto en los casos con aislamien-to fúngico en sangre, líquidos estériles o tejidos— el diagnóstico microbiológico es poco sensible y específi-co, lo cual suscita la necesidad de nuevos marcadores que ayuden al mejor diagnóstico de estas graves in-fecciones. Se han desarrollado técnicas serológicas, como la detección de manano y anticuerpos antimanano o anticuerpos antimicelio, o la detección de componentes no antigénicos, como (1→3)-β-D-glucano y de ácidos nucleicos, con resultados esperanzadores para su uso en el paciente crítico. Sin embargo, la evalua-ción de los factores de riesgo de infección en pacientes críticos para identificar a los que se beneficiarían de un tratamiento anticipado o empírico es una de las claves diagnósticas en estos pacientes. Para ayudar a este cribado, se han diseñado varios sistemas de puntuación (scores), alguno de ellos con elevado valor pre-dictivo negativo. Actualmente, la clave para mejorar el diagnóstico y el pronóstico de la infección fúngica invasiva en el paciente crítico radica en el uso combinado de los scores predictivos junto con las técnicas microbiológicas independientes del cultivo.
The management of invasive fungal infections in critically ill patients, from diagnosis to selection of the ther- apeutic protocol, is often a challenge. Early diagnosis and treatment are associated with a better prognosis, but apart from cases with positive cultures from blood or fluid/tissue biopsy, diagnosis is neither sensitive nor specific, and there is a need for specific markers in these diseases. Serodiagnostic assays such as mannan an-tigen, mannan antibodies, Candida albicans germ-tube antibodies or (1→3)-β-D-glucan detection, and mo-lecular techniques for the detection of fungal-specific DNA have been developed with promising results in critical care settings. One of the main features in diagnosis is the evaluation of risk factors for infection, which will identify patients in need of preemptive or empirical treatment. Clinical scores were built from those risk factors. The combination of prediction rules and non-culture microbiological tools could be currently be the key to improving the diagnosis and prognosis of invasive fungal infections in critically ill patients.
En las últimas décadas, la medicina intensiva ha evolucionado nota-blemente. En la actualidad, pacientes gravemente enfermos sobrevi-ven más fácilmente debido a los avances experimentados tanto en el ámbito médico, como quirúrgico. Por desgracia, esta nueva medicina, más tecnificada e invasiva, provoca con frecuencia un “daño colate-ral” en el sistema inmunitario del paciente, y facilita la aparición de graves procesos infecciosos. Aproximadamente el 10,4% de las infec- ciones en una unidad de cuidados intensivos (UCI) están producidas por diferentes especies de Candida, y la mayoría de estas infecciones son de origen nosocomial2. En el recientemente publicado estudio EPIC II sobre infección grave en la UCI, la incidencia de candidemia fue de 6,9 episodios/1.000 pacientes14. Sin embargo, esta cifra puede ser mayor, ya que, al menos, en el 4% de los pacientes que fallece en la UCI se diagnostica una infección fúngica, no sospechada en vida, en el examen necrópsico9. Además, la estancia en una UCI es, por sí misma, un factor independiente de riesgo para desarrollar una candidiasis invasiva (CI)40,42. Con menos frecuencia, pero asociados a una elevada morbilidad y mala evolución, también se han descrito casos de asper-gilosis invasiva (sobre todo en pacientes con enfermedad pulmonar obstructiva crónica)12,13,23 y otras micosis profundas causadas por hon-gos emergentes, como Trichosporon asahii, Saccharomyces cerevisiae, Hansenula anomala, Dipodascus capitatus y Rhizopus microsporus21.
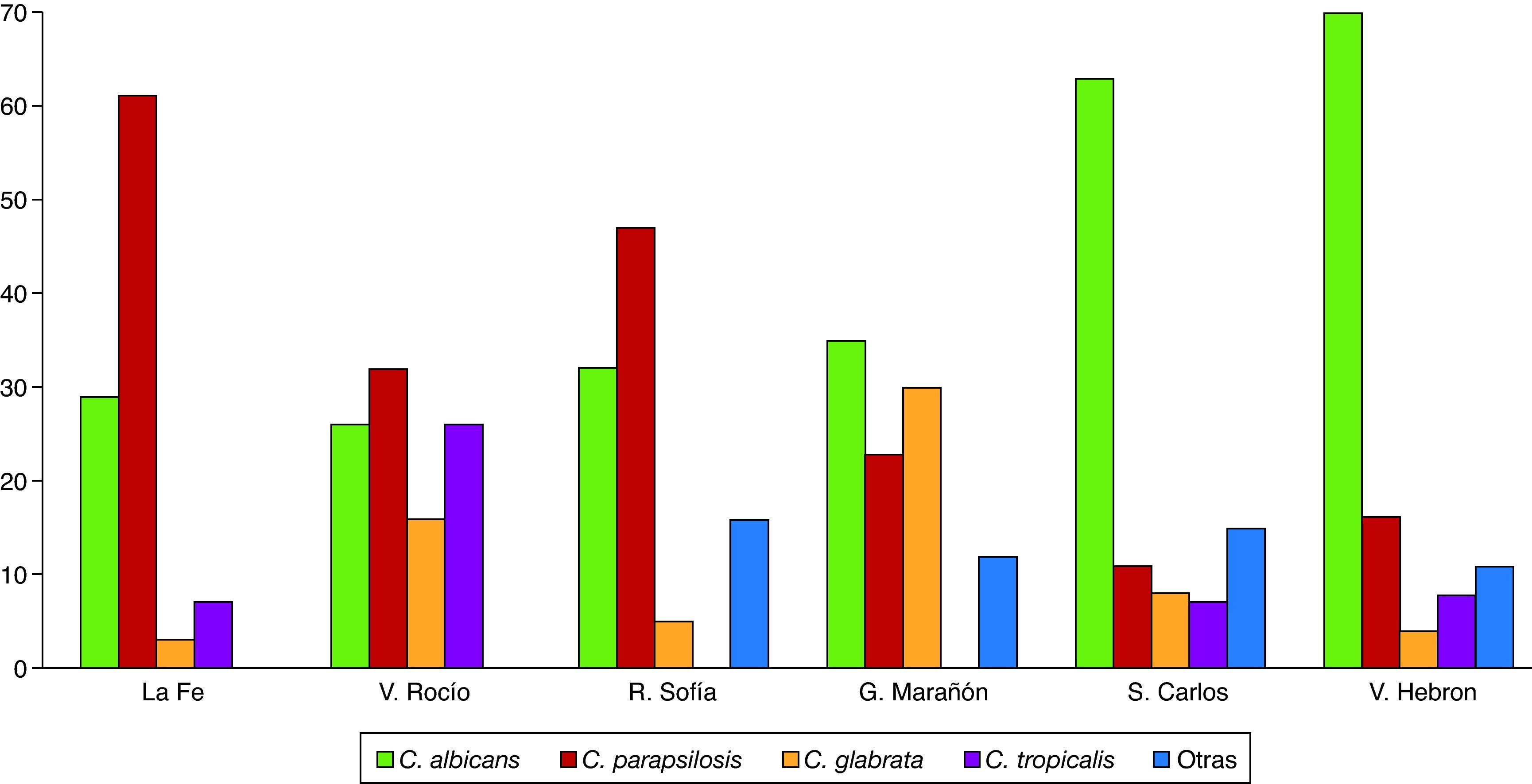
En el último estudio sobre la epidemiología de las candidemias realizado en España durante 2009 (estudio FUNGEMYCA), el 55% de las candidemias fueron causadas por especies de Candida no-Candida albicans: Candida albicans (45%), Candida parapsilosis (29%), Candi-da glabrata (11%), Candida tropicalis (8%) y otras especies (7%)34. Sin embargo, en este estudio se observan notables diferencias en la dis-tribución de las especies causantes en función de la unidad de hos-pitalización y del hospital participante. Esta distribución propia de cada centro también se aprecia en las UCI, donde el aislamiento de C. albicans fluctúa entre el 26 y el 72%; el de C. parapsilosis entre el 11 y el 61%, y el de C. glabrata entre el 3 y el 30% (fig. 1). Esta distribución tan variable de especies causantes de candidemia confirma la nece-sidad de realizar estudios periódicos para conocer la realidad epide-miológica de cada unidad de hospitalización, y así sirvan de guía en la instauración del tratamiento empírico más adecuado.
Distribución de las principales especies causales de candidemia en las unidades de cuidados intensivos de seis hospitales españoles durante 2009 (estudio FUNGEMYCA). Hospitales: La Fe (Valencia), Virgen del Rocío (Sevilla), Reina Sofía (Córdoba), Gregorio Marañón (Madrid), San Carlos (Madrid) y Vall d’Hebron (Barcelona).
Las CI se asocian a una tasa de mortalidad elevada, especialmente en pacientes críticos17. La tasa de mortalidad bruta estimada para estas infecciones es del 40-75%, y su mortalidad atribuible, del 25-43%4,28,35,42. La elevada tasa de mortalidad asociada a la candidemia debe atribuir-se, en gran parte, a la propia infección, y no sólo a otros factores de comorbilidad presentes en la mayoría de estos pacientes10.Las especies del género Candida distintas a C. albicans se aíslan cada vez con más frecuencia y representan la mitad o más de los aislamien-tos en la mayoría de las series de candidemia publicadas4,8,34,42. Diferen-tes autores coinciden en constatar su peor pronóstico en comparación con las candidemias producidas por C. albicans6,16,26 y se ha atribuido su incremento al uso generalizado de fluconazol y equinocandinas20,41. Aunque, al igual que en otros países mediterráneos y sudamericanos, en España se observa un número mayor de candidemias por C. parap-silosis en comparación con otros países del norte de Europa, Canadá o Estados Unidos. No hay que olvidar que las candidemias por esta espe-cie se asocian con una tasa de mortalidad menor (28-31%)3,35.
Además de la especie causal, se han descrito otros factores predic-tores de mal pronóstico en la candidemia, como la estancia prolonga-da en UCI, fallo renal, trombocitopenia, neoplasias hematológicas y la necesidad de ventilación mecánica o de soporte inotrópico4,6 En un estudio español multicéntrico en el que participaron UCI de 28 hos-pitales, un Acute Physiology and Chronic Health Evaluation (APACHE) II > 20 en el momento de la candidemia se asoció con tasas de mor-talidad mayores, mientras que el tratamiento antifúngico temprano y la retirada del catéter venoso central fueron factores protectores4,28. Por otra parte, el tratamiento empírico inadecuado también se ha asociado al desarrollo de infección fúngica invasiva (IFI) y a un peor pronóstico de ésta32. En dos estudios diferentes se ha demostrado una fuerte interrelación entre el retraso del tratamiento antifúngico y el aumento de la tasa de mortalidad intrahospitalaria11,27, en especial en los pacientes con shock séptico33; por lo tanto, es necesario reconocer que el tiempo desempeña un papel importante cuando se valora el tratamiento de un paciente con factores de riesgo para desarrollar una IFI. El uso adecuado y temprano del tratamiento antifúngico se asocia de forma clara con un menor coste y una estancia hospitalaria más breve46.
Evaluación del riesgoLa identificación temprana de los factores de riesgo para desarro-llar candidemia (peritonitis, cirugía abdominal, administración pre-via de antibióticos de amplio espectro, nutrición parenteral, catéteres multilumen, colonización previa por Candida, hemodiálisis o ventila-ción mecánica) se ha convertido en la herramienta fundamental del tratamiento empírico de las IFI en el paciente crítico para así reducir la alta mortalidad asociada a estas infecciones5,7,38.
La regla de Ostrosky-ZeichnerComo resultado de un estudio retrospectivo multicéntrico reali-zado en 12 UCI de Estados Unidos y Brasil, Ostrosky-Zeichner et al31 han propuesto una regla capaz de predecir el desarrollo de CI en pa-cientes críticos. Esta regla se obtuvo analizando a un grupo de 2.890 pacientes, con una incidencia de CI del 3%. El modelo estadístico de-mostró un riesgo particularmente elevado de CI en los pacientes tra-tados con antibióticos de amplio espectro (1-3 días) o portadores de catéter venoso central (1-3 días) y con al menos dos de los siguientes factores de riesgo: nutrición parenteral total (1-3 días), cualquier tipo de diálisis (1-3 días), cirugía mayor (−7-0 días), pancreatitis (−7-0 días), corticoides (−7-3 días) u otros tratamientos inmunodepresores (−7-0 días). A la hora de predecir una CI, esta regla tiene una sensibi-lidad del 34%, una especificidad del 90% y su valor predictivo positivo y negativo es del 1 y del 97%, respectivamente. En este estudio, los pacientes con cualquier combinación de diabetes mellitus, hemo-diálisis, nutrición parenteral total o antibióticos de amplio espectro presentaron una tasa de candidemia del 16,6%, significativamente su-perior a la tasa de los pacientes que no presentaron ninguno de esos factores de riesgo (5,1%; p = 0,001). Nuevas combinaciones realizadas de las variables incluidas en esta regla de predicción mejoran ligera-mente su capacidad diferenciadora, alcanzando una sensibilidad del 50% y una especificidad del 83%, aunque su valor predictivo positivo y negativo no varía (el 1 y el 97%, respectivamente)30.
Candida scoreEn el último lustro, un grupo español ha desarrollado un sistema de puntuación (score) que permite identificar a los pacientes críticos no neutropénicos, con sospecha de candidemia, que se beneficiarían de un tratamiento antifúngico temprano18. El Candida score se basa en el valor predictivo de diferentes factores de riesgo previamente demos-trados, ajustado para posibles variables de confusión mediante un aná-lisis de regresión logística. La puntuación asignada para cada factor de riesgo es: nutrición parenteral (1), cirugía previa (1), colonización mul-tifocal por Candida (1) y sepsis grave (2). Según los autores del estudio, un Candida score superior a 2,5 puede seleccionar a los pacientes que se beneficiarían de un tratamiento antifúngico temprano (sensibilidad del 81% y especificidad del 74%). Posteriormente, en el estudio CAVA, se validó de forma prospectiva este índice y se demostró la hipótesis de que menos del 5% de los pacientes con un Candida score menor de 3 desarrollan una CI19. Según este estudio, el área bajo la curva fue de 0,77, mejorando al índice de colonización. Además, se demostró una correlación lineal entre el valor del Candida score y la incidencia de CI, siendo mucho más llamativo este hecho en los pacientes sometidosa cirugía abdominal, ya que, cuando presentan un score mayor de 3 puntos, uno de cada 3 pacientes desarrollan una CI. A la vista de estos resultados, nuestro grupo recomienda el tratamiento empírico de pa-cientes quirúrgicos con un Candida score de 4-5 puntos36.
Índice de colonización corregidoPiarroux et al39 confirmaron la eficacia del tratamiento antifún-gico anticipado para prevenir la CI probada, en pacientes quirúrgi-cos críticos, utilizando el índice de colonización corregida (ICC). Este índice (número de muestras con alta colonización/número total de muestras analizadas) cuantifica la intensidad de la colonización de mucosas por Candida. Los pacientes con un ICC ≥ 0,4 recibieron trata-miento antifúngico anticipado con fluconazol y la incidencia de can-didiasis probada intra-UCI disminuyó de modo significativo del 2,2 al 0%. Sin embargo, es posible que la sobrecarga de muestras enviadas al laboratorio de microbiología, que la aplicación de esta estrategia implica, limite el uso generalizado de ésta.
Técnicas diagnósticasLa mala evolución de las IFI se debe, en parte, a las dificultades para su diagnóstico microbiológico en sus primeros estadios. El he-mocultivo sólo es eficaz en el 50% de las infecciones invasivas por Candida y Fusarium, y es excepcionalmente positivo en las aspergi-losis invasiva. Por su parte, los cultivos de lavado broncoalveolar o cepillado bronquial sólo son positivos en < 50% de los pacientes con aspergilosis pulmonar invasiva. Además, los cultivos positivos de muestras no estériles pueden deberse tanto a colonización como a infección, y la distinción entre ambas no siempre es fácil.
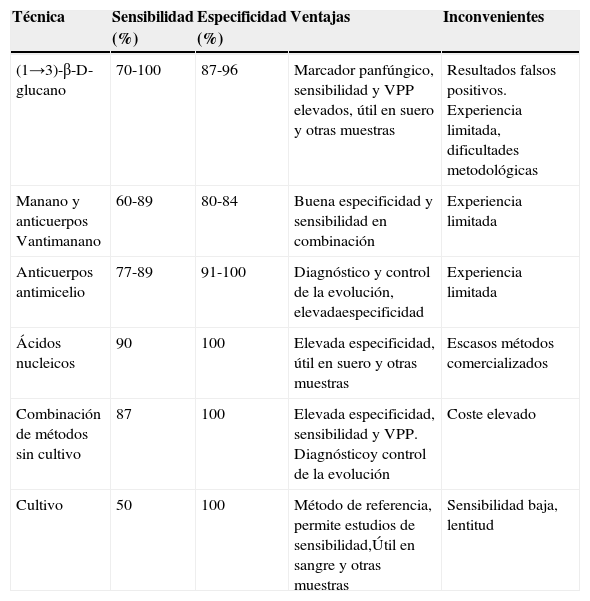
Por lo tanto, el empleo de técnicas diagnósticas independientes del cultivo puede proporcionar una valiosa ayuda a los métodos tra-dicionales. Hasta la fecha, los resultados publicados con la detección de (1→3)-β-D-glucano, galactomanano, manano y antimanano, anti-cuerpos antimicelio o ácidos nucleicos son prometedores y podrían ser muy útiles como guía del tratamiento antifúngico anticipado. En la tabla 1 se describen las ventajas e inconvenientes de cada una de estas técnicas.
Técnicas microbiológicas para el diagnóstico de la candidiasis invasiva en la unidad de cuidados intensivos
| Técnica | Sensibilidad (%) | Especificidad (%) | Ventajas | Inconvenientes |
| (1→3)-β-D-glucano | 70-100 | 87-96 | Marcador panfúngico, sensibilidad y VPP elevados, útil en suero y otras muestras | Resultados falsos positivos. Experiencia limitada, dificultades metodológicas |
| Manano y anticuerpos Vantimanano | 60-89 | 80-84 | Buena especificidad y sensibilidad en combinación | Experiencia limitada |
| Anticuerpos antimicelio | 77-89 | 91-100 | Diagnóstico y control de la evolución, elevadaespecificidad | Experiencia limitada |
| Ácidos nucleicos | 90 | 100 | Elevada especificidad, útil en suero y otras muestras | Escasos métodos comercializados |
| Combinación de métodos sin cultivo | 87 | 100 | Elevada especificidad, sensibilidad y VPP. Diagnósticoy control de la evolución | Coste elevado |
| Cultivo | 50 | 100 | Método de referencia, permite estudios de sensibilidad,Útil en sangre y otras muestras | Sensibilidad baja, lentitud |
VPP: valor predictivo positivo.
La detección de este componente de la pared celular de muchos hon-gos, pero no de todos, mediante la técnica comercializada Glucatell® (As-sociates of Cape Cod [Estados Unidos]) goza de gran especificidad y valor predictivo positivo (VPP) en pacientes con IFI probada o probable29. Sin embargo, esta técnica no detecta (1→3)-β-D-glucano en pacientes con infección por Mucor, Rhizopus o Cryptococcus, y en pacientes hemodiali-zados y colonizados por Candida, con bacteriemia, en quimioterapia, en tratamiento con albúmina, con factores de coagulación, con amoxicilina-ácido clavulánico o con piperacilina-tazobactam, puede dar lugar a re-sultados falsamente positivos. No obstante, esta técnica puede ser útil tanto si se utiliza de forma aislada, como si se incluye en una estrategia de vigilancia en pacientes de riesgo alto. Utilizando un punto de corte diagnóstico (cut-off) de 60 pg/ml, la sensibilidad y la especificidad de la técnica es del 69,9 y del 87,1%, respectivamente, con un VPP del 83,8% y un valor predictivo negativo (VPN) del 75,1%. Con un cut-off de 80 pg/ml, la sensibilidad y especificidad son del 64,4 y el 92,4%, respectivamente (VPP del 89% y VPN del 73%).29
En un estudio español recientemente publicado, para esta técnica se asigna un área bajo la curva de 0,60 para pacientes críticos y CI, con un VPN del 94%, y únicamente es positivo el 30% de las determinacio-nes en pacientes diagnosticados de CI1. Acaba de publicarse un estudio realizado en 57 pacientes críticos quirúrgicos en el que se ha usado un punto de corte igual o mayor de 80 pg/ml.25. Aunque se observaron hasta un 25% de falsos positivos en las muestras tomadas en el día +3 del estudio, la técnica ofreció una sensibilidad del 87% y una especifi-cidad del 73%, siendo llamativa su positivización entre 4 y 8 días antes que los hemocultivos, por lo que a partir del cuarto día podría ser una técnica muy válida para anticipar de forma correcta el tratamiento, si bien este hecho debe confirmarse en nuevos estudios.
Detección de antígeno manano y anticuerpo antimananoDesde hace años se comercializa (Platelia Candida Ag® y Platelia Candida Ab/Ac/Ak®; Bio-Rad) la detección de antígeno manano y de anticuerpos frente a este antígeno de Candida, mediante ELISA. Para evitar el escaso rendimiento de estas técnicas cuando se emplean por separado (debido a la baja sensibilidad de la detección de antígeno y a la alta prevalencia de anticuerpos antimanano en la población sana o colonizada), se recomienda realizar de forma conjunta am-bas pruebas en todo paciente con sospecha de CI. En una reciente revisión sistemática de la bibliografía, que incluye tanto a pacientes oncohematológicos, como a críticos, se demuestra que la detección combinada de antígeno y anticuerpo es superior a la de cada uno por separado en CI (sensibilidad del 83% y especificidad del 86%), por lo que su uso podría ser útil en estos pacientes24.
Detección de anticuerpos antimicelioEn 2006 nuestro grupo evaluó la técnica de inmunofluorescen-cia indirecta (C. albicans IFA IgG, Vircell) para detectar anticuerpos antimicelio (CAGTA) en una población seleccionada de pacientes críticos44. En el estudio no se apreciaron diferencias de edad, sexo, fallo hepático o renal en los pacientes CAGTA-positivos y CAGTA-negativos; sin embargo, la tasa de mortalidad intra-UCI fue signifi-cativamente más baja en pacientes CAGTA-positivos (el 25 frente al 65,2%; p = 0,025). En un análisis posterior se encontraron diferencias estadísticamente significativas en mortalidad a favor de los pacien-tes que tuvieron títulos crecientes y recibieron tratamiento antifún-gico.45 Además, su positividad se asoció a pacientes quirúrgicos, sin modificarse por la colonización ni el tratamiento antifúngico previo37. Por lo tanto, el empleo de una estrategia basada en la determinación temprana CAGTA puede reducir la mortalidad de los pacientes con riesgo de desarrollar una CI en la UCI, especialmente en los pacientes quirúrgicos. No obstante, son necesarios más estudios para confirmar estos resultados en el paciente crítico.
Detección de ácidos nucleicosEn los últimos años se han desarrollado nuevos métodos molecu-lares mediante reacción en cadena de la polimerasa (PCR) en tiempo real, que constituyen una interesante alternativa para el diagnóstico rápido de la IFI, ya que su número de resultados falsos positivos es bajo y, además, ofrecen la posibilidad de identificar el patógeno causal en 4-5h, llegando a alcanzar una sensibilidad y especificidad muy ele-vadas (el 90,9 y el 100%, respectivamente)15,22,43. Desgraciadamente, y aunque parezca el formato más práctico y adecuado, la falta de estan-darización de la PCR a tiempo real (método de extracción, cebadores, y sistema de detección del material amplificado) impide su uso generali-zado y su reconocimiento en guías y documentos de consenso.
Por lo tanto, es evidente la necesidad de realizar un diagnóstico temprano de los pacientes críticos con sospecha de IFI que facilite la instauración temprana del tratamiento antifúngico, para así poder disminuir la elevada tasa de mortalidad de estas graves infecciones.
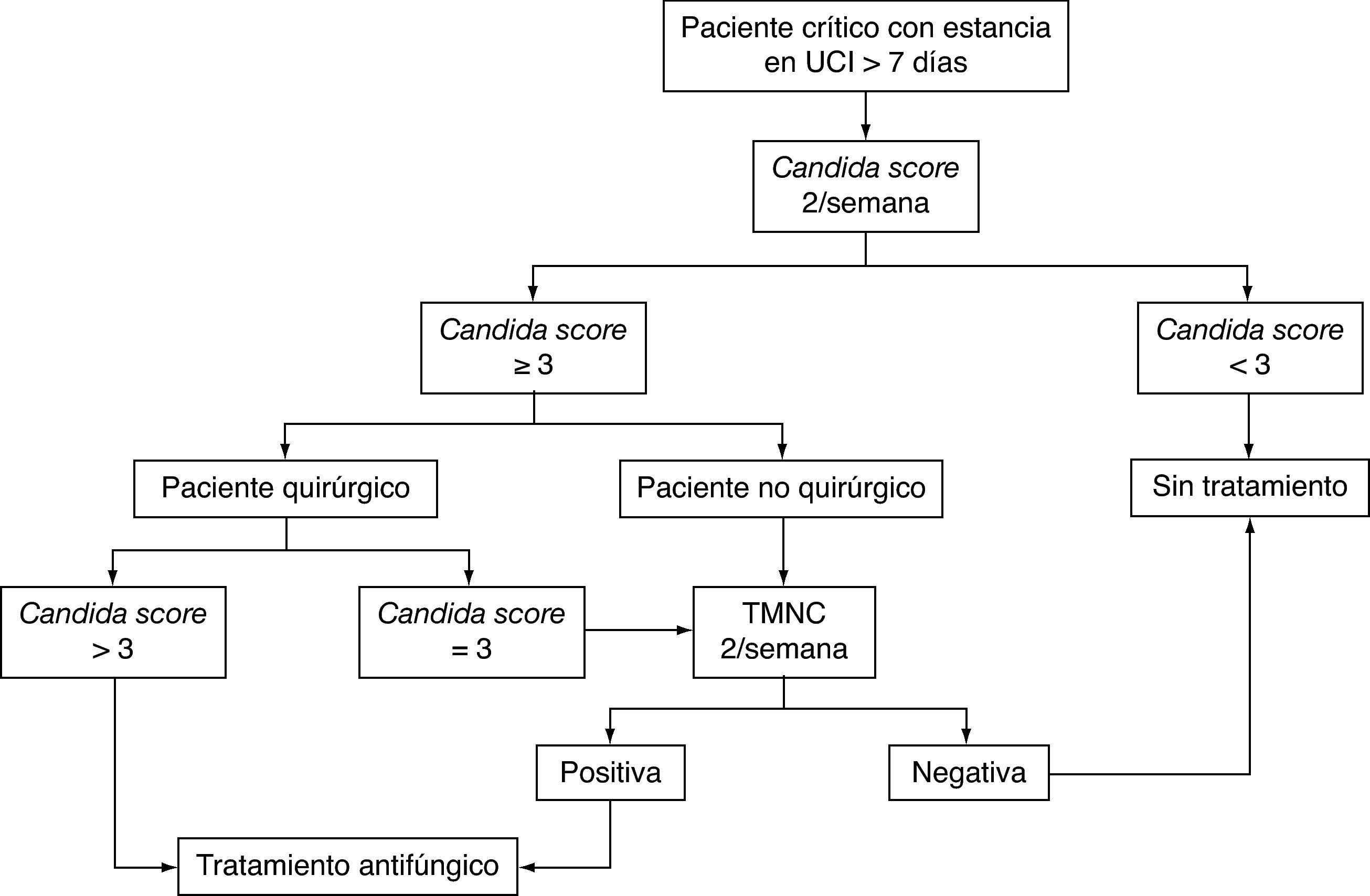
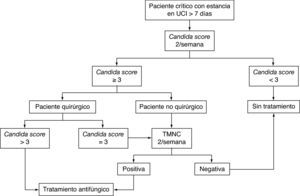
Pero hasta que no haya un nuevo método de referencia diagnóstico, una aproximación decuada podría ser una estrategia basada en la combinación de índices clínicos de predicción junto con el uso de técnicas microbiológicas no basadas en el cultivo. En la figura 2 se propone un algoritmo de actuación para estos pacientes.
Algoritmo para el inicio del tratamiento antifúngico empírico o anticipado en el paciente crítico con sospecha de infección fúngica invasiva. TMNC: técnicas microbiológicas no basadas en el cultivo: detección de (1→3)-β-D-glucano, manano y anticuerpos antimanano, anticuerpos antimicelio o ácidos nucleicos; UCI: unidad de cuidados intensivos.
Los autores han recibido honorarios de Pfizer en relación con la coordinación y la edición de este número monográfico de la revista iberoamericana de micología.
Referencias no citadas