El hierro es un elemento esencial para el crecimiento y la virulencia de la mayoría de los microorganismos. Dentro de los mecanismos de inmunidad innata (o nutricional) los mamíferos han desarrollado diversas estrategias para su transporte y almacenamiento, limitando así la disponibilidad de hierro libre en el medio. Para poder sobrevivir en este entorno hostil los hongos potencialmente patógenos disponen de mecanismos específicos para la captación del hierro, entre los que destaca la síntesis de sideróforos, moléculas solubles de bajo peso molecular con elevada capacidad de quelación. La sobrecarga férrica y el consiguiente aumento de la concentración de hierro libre son factores de riesgo para el desarrollo de infección fúngica invasiva (IFI) por Mucorales y Aspergillus. Por tanto, la reducción del hierro libre circulante mediante el uso de quelantes constituye un abordaje terapéutico atractivo. El primer quelante del hierro autorizado (deferoxamina) se reveló, paradójicamente, como un factor de riesgo para el desarrollo de IFI al actuar como un xenosideróforo para los Mucorales. Por el contrario, los quelantes orales de nueva generación (deferiprona y deferasirox) han demostrado inhibir el crecimiento fúngico in vitro y en modelos animales. La presente revisión analiza el papel del metabolismo férrico en la patogenia de la IFI, así como los datos preclínicos disponibles y la, hasta la fecha, limitada experiencia clínica que respalda el empleo de los nuevos quelantes del hierro en el tratamiento de la mucormicosis y de la aspergilosis invasiva.
Iron is an essential factor for both the growth and virulence of most of microorganisms. As a part of the innate (or nutritional) immune system, mammals have developed different mechanisms to store and transport this element in order to limit free iron bioavailability. To survive in this hostile environment, pathogenic fungi have specific uptake systems for host iron sources, one of the most important of which is based on the synthesis of siderophores-soluble, low-molecular-mass, high-affinity iron chelators. The increase in free iron that results from iron-overload conditions is a well-established risk factor for invasive fungal infection (IFI) such as mucormycosis or aspergillosis. Therefore, iron chelation may be an appealing therapeutic option for these infections. Nevertheless, deferoxamine –the first approved iron chelator– paradoxically increases the incidence of IFI, as it serves as a xeno-siderophore to Mucorales. On the contrary, the new oral iron chelators (deferiprone and deferasirox) have shown to exert a deleterious effect on fungal growth both in vitro and in animal models. The present review focuses on the role of iron metabolism in the pathogenesis of IFI and summarises the preclinical data, as well as the limited clinical experience so far, in the use of new iron chelators as treatment for mucormycosis and invasive aspergillosis.
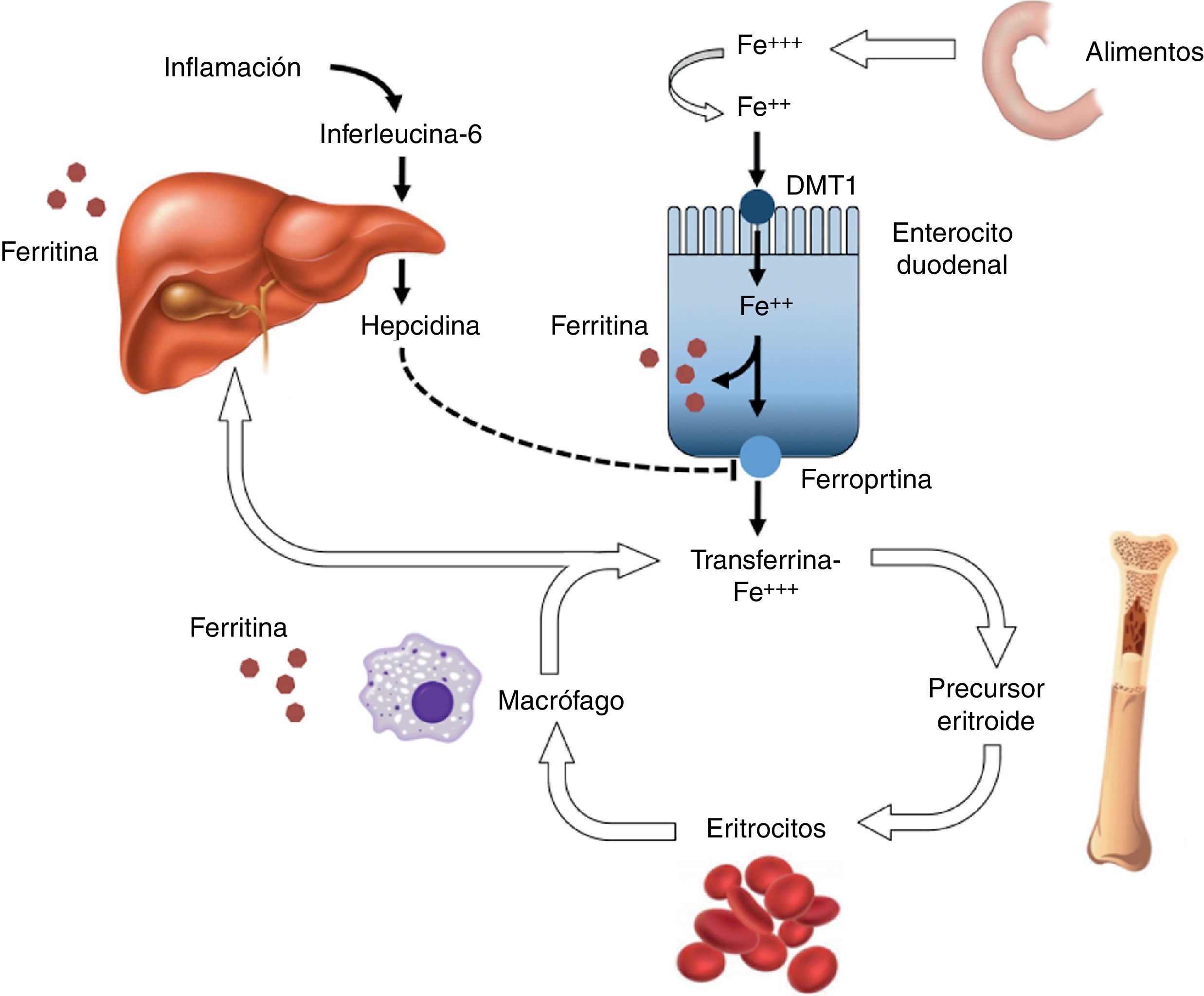
El hierro se encuentra en la naturaleza en dos formas iónicas: ferrosa (Fe2+) y férrica (Fe3+). Gracias a su capacidad de cesión y captación de electrones constituye un cofactor esencial en numerosas reacciones intracelulares de oxidación-reducción, incluyendo la cadena de respiración mitocondrial, el metabolismo de los aminoácidos o la síntesis de ácidos nucleicos. El organismo de un adulto sano posee aproximadamente 40-50mg/Kg de este elemento, en su mayor parte integrado en el grupo hemo de la hemoglobina (65%) y la mioglobina (10%), o como grupo prostético de diversas enzimas (peroxidasa, catalasa o citocromos). El 20% restante se almacena en forma de depósito (ferritina y hemosiderina), en tanto que menos del 1% del hierro corporal total es transportado en el suero unido a la transferrina, o bien excretado en la leche materna y otros fluidos asociado a la lactoferrina (constituyendo, en conjunto, el hierro circulante)74. El ser humano carece de mecanismos eficaces para la eliminación del exceso de hierro. Las pérdidas diarias (por vía fecal, biliar o urinaria, a través de la mucosa intestinal o mediante descamación cutánea) no superan los 0,02mg/Kg en varones adultos, si bien las mujeres en edad fértil están expuestas a una depleción adicional por pérdidas menstruales12. Un elemento clave en esta homeostasis es la hormona hepcidina, un reactante de fase aguda de tipo 2 que ejerce su acción sobre un transportador presente en la membrana basolateral del enterocito denominado ferroportina. La hepcidina induce la internalización y la degradación lisosómica de dicho transportador, impidiendo el paso del hierro de los alimentos desde el enterocito duodenal a la sangre y, en último término, reduciendo la sideremia y la disponibilidad de hierro libre. La síntesis hepática de hepcidina se ve inducida en los estados de inflamación aguda e infección a través de la interleucina 630 (fig. 1). Adicionalmente, en el curso de la reacción inflamatoria también tiene lugar un incremento en la síntesis de ferritina en el hígado y de lactoferrina por parte de los leucocitos polimorfonucleares con el objetivo común de privar a los microorganismos del oligoelemento14,51. Las concentraciones molares de hierro iónico libre en condiciones fisiológicas son extremadamente reducidas (del orden de 10-18). Así, la escasa disponibilidad de hierro libre en el medio supone un factor limitante para el crecimiento de los microorganismos patógenos y constituye un mecanismo de inmunidad innata (o nutricional) muy preservado a nivel evolutivo en los mamíferos14,51,74.
Ciclo biológico del hierro. Los enterocitos duodenales absorben aproximadamente 1-2mg diarios del hierro de los alimentos a través de un sistema formado por 2 trasportadores distintos: uno importador, situado en la membrana apical (divalent metal transporter 1 [DMT1]), y otro exportador, situado en la basolateral (ferroportina). El hierro circula unido a la transferrina sérica y es suministrado a los precursores eritroides (hierro en forma hemo), o bien es reciclado y almacenado en el sistema reticuloendotelial y en el hígado en forma de ferritina (hierro no hemo). La entrada del hierro en la circulación es controlada por la hormona hepcidina, sintetizada en el hígado, que induce la internalización y degradación lisosómica de la ferroportina de los enterocitos. Entre otros estímulos, los estados inflamatorios inducen la síntesis de hepcidina a través de la interleucina 6.
Los estados patológicos de sobrecarga férrica modifican esta delicada homeostasis y aumentan la disponibilidad de hierro libre en el organismo, favoreciendo el desarrollo de determinadas infecciones. Por ejemplo, está bien documentada la mayor susceptibilidad de los pacientes con hemocromatosis hereditaria (HH) a la bacteriemia por Vibrio vulnificus, microorganismo que carece de mecanismos propios para la captación eficaz del hierro7. En la etiopatogenia de las complicaciones infecciosas propias de la HH parece jugar un papel crucial la desregulación del eje ferroportina-hepcidina antes descrito. Los tipos i, ii y iii de la HH cursan con niveles anormalmente bajos de hepcidina, mientras que el tipo iv presenta una mutación en la ferroportina de los enterocitos que induce una pérdida de la regulación inhibitoria de la hepcidina, con el consiguiente exceso en el transporte de hierro desde el duodeno30,49. La hepcidina, de hecho, fue originalmente caracterizada como un péptido con funciones antimicrobianas y ha demostrado actividad antifúngica frente a Candida albicans, Aspergillus fumigatus y Aspergillus niger65.
Hace ya décadas que se comprobó que los pacientes con leucemia mieloide aguda y valores elevados de sideremia presentan una mayor incidencia de infecciones por C. albicans19. Otras condiciones que aumentan la disponibilidad de hierro libre, como los tratamientos quimioterápicos50, la cetoacidosis diabética5 o la ß-talasemia11,89, conllevan igualmente un riesgo incrementado de complicaciones infecciosas, en particular de etiología fúngica. El trasplante, tanto de órgano sólido como de progenitores hematopoyéticos (TPH), supone otra situación de riesgo. El contenido de hierro en la pieza de hepatectomía, evaluado mediante tinción de Perls, se ha revelado como un factor de riesgo independiente para el desarrollo de infección fúngica invasiva (IFI) en receptores de trasplante hepático3. En estos pacientes los parámetros de metabolismo férrico determinados en la primera semana postrasplante predicen no solo el riesgo de infección, sino también el de mortalidad global al año del procedimiento21. Según aumenta el índice de saturación de la transferrina (IST) se produce un aumento del hierro no ligado a la transferrina. Así, para un IST superior al 80% se puede detectar hierro no ligado a la transferrina en cerca del 90% de los receptores de un TPH alogénico, en tanto que su prevalencia desciende a menos del 10% con un IST por debajo del 8%70. En el curso del tratamiento de acondicionamiento previo al TPH alogénico en pacientes con neoplasias hematológicas el IST puede llegar al 100% en el segundo día, limitándose así su capacidad para capturar el hierro sérico; en la mayoría de los pacientes el IST persiste por encima del 80% hasta 2 semanas después del procedimiento, con el consecuente incremento del hierro no ligado a la transferrina70.
Por otra parte, el exceso de hierro ejerce un efecto deletéreo sobre la respuesta inmune del huésped, tanto innata como adaptativa62. Se ha comprobado que la capacidad fagocítica y bactericida de los leucocitos polimorfonucleares y de los monocitos, así como su respuesta quimiotáctica, aparece disminuida en pacientes con sobrecarga férrica en comparación con controles sanos84. Los sujetos con la ß-talasemia presentan una expansión anómala de los linfocitos T-CD8+ (proporcional al número de transfusiones recibidas35) y una inhibición de la respuesta a mitógenos y de la función de los linfocitos T-CD4+, con la consiguiente inversión del cociente normal entre ambas poblaciones24,86. La actividad de las células natural killer y el proceso de diferenciación de los linfocitos B también están alterados en estos pacientes2,28.
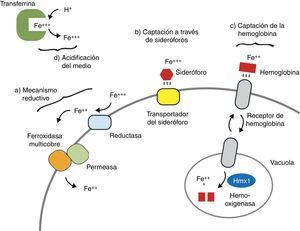
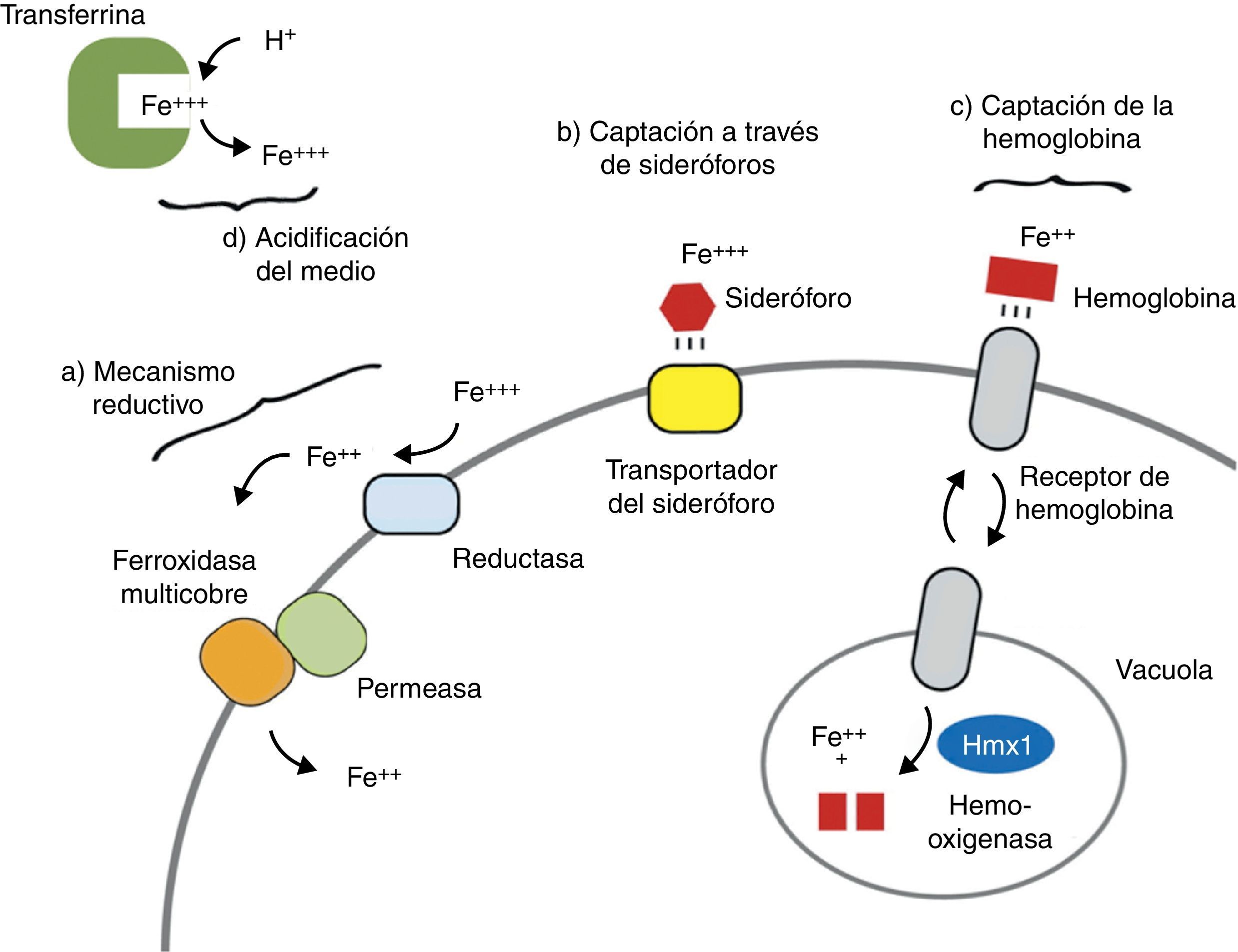
Mecanismos fúngicos de captación del hierroComo se ha comentado, la disponibilidad de hierro libre supone un factor limitante para el crecimiento y proliferación de numerosas especies fúngicas de interés clínico. Por este motivo los hongos han desarrollado mecanismos complejos de captación y almacenamiento que les permiten competir de forma exitosa por este elemento en el medio39,57. Básicamente pueden distinguirse 4 estrategias (fig. 2):
- a)
La reducción extracelular del hierro en estado férrico (Fe3+) a ferroso (Fe2+) mediante la acción de reductasas localizadas en la pared fúngica constituye uno de los mecanismos empleados por hongos levaduriformes como Saccharomyces cerevisiae,82Cryptococcus neoformans48 o C. albicans,63 así como por algunos hongos dimórficos (Histoplasma capsulatum)31. Estas reductasas están asociadas a permeasas que permiten la internalización del hierro en el citoplasma. Además, en presencia de bajas concentraciones de hierro estos hongos pueden expresar sistemas de trasporte de alta afinidad dependientes de cobre63.
- b)
La síntesis y secreción al medio de moléculas de bajo peso con actividad quelante del hierro, en conjunto denominadas sideróforos (del griego sideros [hierro] y phoros [transportador]), constituye otro de los mecanismos de captación al que recurren algunos hongos en condiciones ambientales extremas. Una vez unidos al hierro, los sideróforos introducen este elemento en el interior de la célula mediante diversos mecanismos enzimáticos y no enzimáticos. Desde un punto de vista estructural la mayor parte de estas moléculas pertenecen al grupo de los hidroxamatos (ferricromos y ferricrocina en A. fumigatus20), o al de los policarboxilatos (rizoferrina en los Mucorales23,60). Sin embargo, se ha comprobado que algunos de estos sideróforos propios son relativamente ineficientes a la hora de quelar y transportar el hierro del medio, tal y como ocurre con la rizoferrina de Rhyzopus oryzae60. Por este motivo ciertos hongos han desarrollado la capacidad de aprovechar los quelantes producidos por otros microorganismos (las ferrioxaminas bacterianas, por ejemplo), denominándose en tal caso xenosideróforos40.
- c)
Una gran parte de las reservas de hierro en los mamíferos se encuentran en forma de grupo hemo. Por ello algunos hongos, como C. albicans, han desarrollado sistemas enzimáticos con actividad homóloga a la de la hemooxigenasa humana (codificados en el gen CaHmx1), que son capaces de liberar el hierro de la hemoglobina tras la lisis eritrocitaria67,71. La reciente identificación de secuencias génicas similares en R. oryzae podría explicar el bien conocido carácter angioinvasivo de la mucormicosis47,62.
- d)
Por último, se ha sugerido que algunos hongos pueden obtener el hierro gracias a la acidificación del medio en condiciones anaerobias. La consiguiente formación de hidrogeniones libres desplazaría al elemento de su unión con la transferrina sérica, permitiendo así su captación fúngica39. Este mecanismo puede ser clínicamente relevante, por ejemplo, en la mucormicosis rinocerebral de la cetoacidosis diabética5,47. El pH ácido induciría la liberación del hierro libre desde las proteínas transportadoras, favoreciendo el crecimiento fúngico. A su vez, la proliferación e invasión endovascular y tisular se ven promovidas por los defectos fagocitarios del huésped, ya sean de naturaleza cuantitativa (neutropenia) o funcional (por acción de la corticoterapia o de la hiperglucemia y la cetoacidosis). La adherencia y la lesión de las células endoteliales por el hongo permite la máxima angioinvasión y trombosis vascular, con las subsecuentes necrosis tisular y diseminación al sistema nervioso central a través de los senos venosos cerebrales y de los senos paranasales62,79.
En esencia, un quelante es una sustancia capaz de formar complejos estables no tóxicos con un metal pesado. Estos complejos, o quelatos, compiten con los metales en su forma libre por los grupos reactivos fisiológicos, disminuyendo su efecto tóxico sobre el organismo y facilitando su movilización desde los depósitos viscerales y su excreción biliar13. El primer quelante del hierro disponible en la práctica clínica fue la deferoxamina (DFO), derivado del Streptomyces pilosus y aprobado en 196864. La observación, a lo largo de la década de 1980, de que los pacientes en hemodiálisis sometidos a tratamiento con DFO presentaban una mayor incidencia de IFI, particularmente mucormicosis9, motivó la realización de diversos estudios in vitro y sobre modelos animales con el objetivo de clarificar el papel ejercido por este fármaco8,10. En condiciones fisiológicas el suero humano ejerce un efecto fungistático sobre los Mucorales, como demostraron Boelaert et al.8 tras aportar concentraciones crecientes de suero a los cultivos de Rhizopus microsporus. Dicho efecto inhibitorio está mediado por la capacidad de la transferrina sérica de fijar y retirar el hierro libre existente en el medio, impidiendo su captación por el hongo, y se hace ya patente a concentraciones relativamente bajas de suero (≤10%). Sin embargo, la adición al medio de mínimas cantidades (del orden de 1μM) de Fe-DFO (el quelato de la DFO) produce una marcada abolición de este efecto fungistático y favorece el crecimiento exponencial de Rhizopus microsporus, hasta el punto de que se precisarían concentraciones de hierro libre 1.000 veces superiores para alcanzar el mismo efecto8. Este resultado tan llamativo sobre el crecimiento fúngico solo puede justificarse asumiendo que la DFO actúa como un sideróforo exógeno (o xenosideróforo) para Rhizopus spp., que potencia su capacidad de captación del hierro presente en el medio. Por tanto, si bien la DFO se comporta como un quelante del hierro en el humano, en el caso de Rhizopus y de otros Mucorales actúa como un donador de este oligoelemento que facilita su crecimiento.
Esta actividad como xenosideróforo de la DFO parece ser relativamente específica para los Mucorales y no se ha demostrado con la misma intensidad en otras especies fúngicas. La adición de Fe-DFO en los medios de cultivo no tiene un efecto apreciable sobre el crecimiento de C. albicans e incrementa tan solo de forma modesta el de A. fumigatus8. De este modo, la administración de hierro libre y DFO disminuye significativamente la supervivencia en modelos animales de mucormicosis y de aspergilosis, pero no presenta un efecto relevante en modelos de candidiasis8,10.
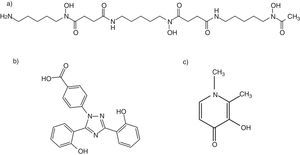
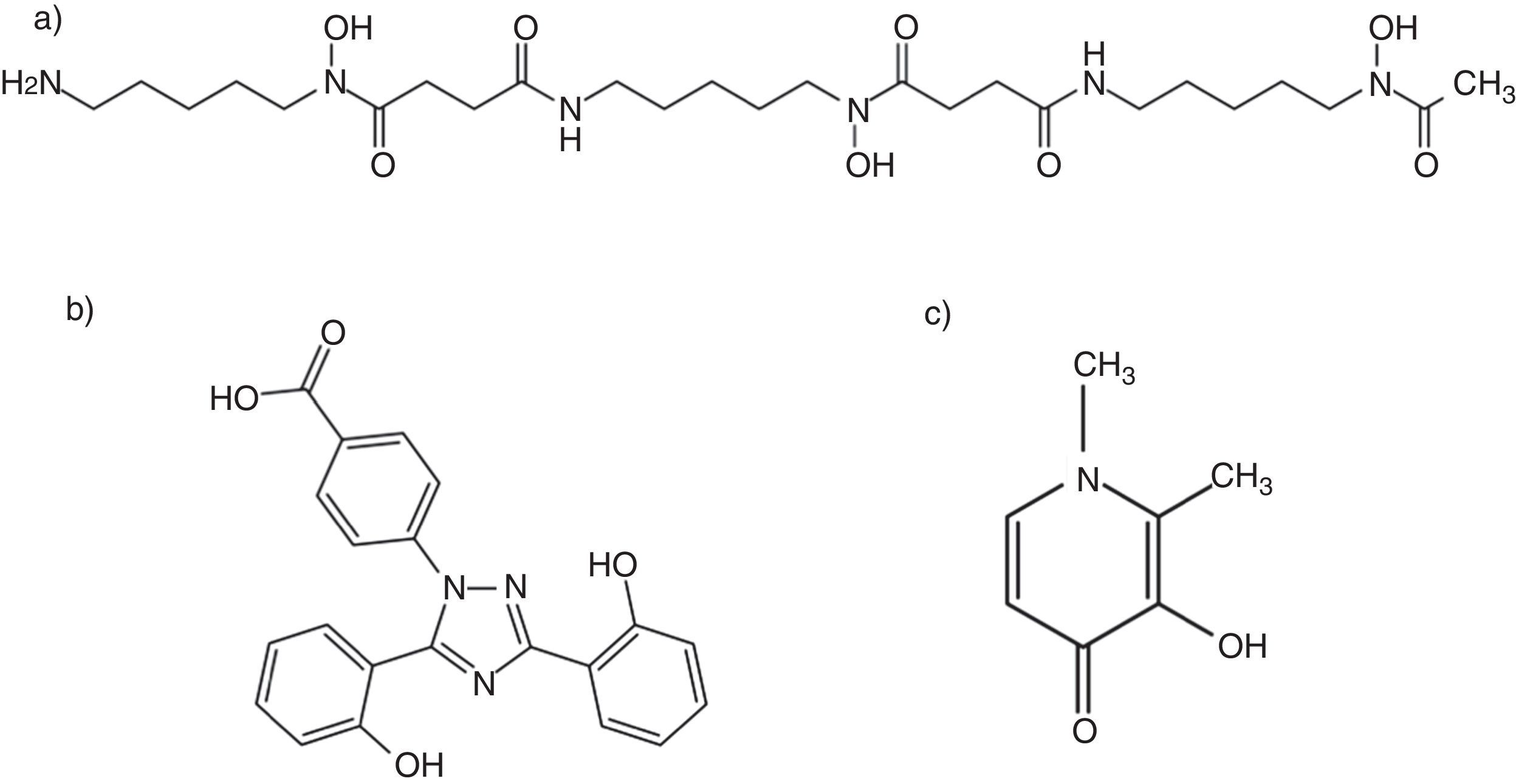
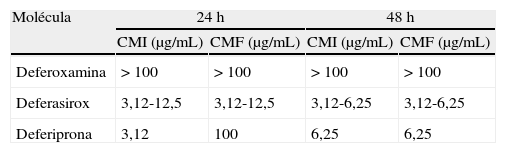
Nuevos quelantes del hierro y mucormicosisAdemás del comentado incremento del riesgo de IFI, la DFO presenta otros inconvenientes que limitan su empleo como quelante al cabo de 40 años de uso clínico, entre los que destacan su administración parenteral y elevado precio6. Esta circunstancia ha motivado el desarrollo de nuevas moléculas estructuralmente diferentes de la DFO (fig. 3). Actualmente están comercializados la deferiprona (DFP), desarrollada a partir de un sideróforo presente en cepas mutantes de Salmonella typhimurium54, y el deferasirox (DFX), derivado de un potente quelante producido por Streptomyces antibioticus36. Estos fármacos fueron aprobados en 2006 y 2005, respectivamente, por la Food and Drug Administration, para el tratamiento de los estados de sobrecarga férrica en pacientes con anemia y dependencia transfusional. La tabla 1 resume las vías de administración, la posología y el perfil de toxicidad de los 3 quelantes64.
Vías de administración y toxicidad de los quelantes del hierro actualmente disponibles
| Molécula y nombre comercial | Vía de administración | Posología habitual | Toxicidad | Comercialización |
| Deferoxamina mesilato (EFG) | Parenteral | 20-60mg/Kg/día (infusión SC lenta)a5mg/Kg/día (IV)b | Hipotensión, rubefacción, urticaria, alteraciones visuales, anafilaxia | Mundial |
| Deferasirox (Exjade®) | Oral | 10-30mg/Kg/díaa | Síntomas gastrointestinales, artralgias, neutropenia (5%), agranulocitosis (0,5%) | Europa e India |
| Deferiprona (Ferriprox®) | Oral | 20mg/Kg/8h | Síntomas gastrointestinales, insuficiencia renal, hepatitis, hemorragia digestiva | EE. UU. y Europa |
EFG: especialidad farmacéutica genérica; IV: por vía intravenosa; SC: subcutánea.
La mucormicosis es un tipo de IFI causada por hongos filamentosos pertenecientes al orden de los Mucorales (subdivisión Mucoromycotina), dentro de los cuales Rhyzopus constituye el género más frecuentemente identificado en muestras clínicas59,75. Esta infección afecta de forma casi exclusiva a pacientes con factores predisponentes (neoplasias hematológicas, TPH, diabetes mellitus o traumatismo grave), y las últimas décadas han asistido a un incremento en su incidencia paralelo al experimentado por estas condiciones, especialmente la inmunosupresión iatrógena34,47. Muchos de los estados patológicos que incrementan el riesgo de mucormicosis se caracterizan por un aumento de las concentraciones de hierro libre en el medio (tabla 2). La principal opción terapéutica actualmente disponible es la anfotericina B liposomal (AmB-L) asociada al desbridamiento quirúrgico agresivo. El posaconazol y, en menor medida, las equinocandinas suelen reservarse como tratamiento de rescate, habitualmente en el contexto de regímenes combinados con AmB-L. Sus tasas de mortalidad siguen siendo inaceptablemente elevadas, pues oscilan entre el 11 y el 50% en función de la enfermedad de base59,75, aproximándose al 100% en las formas diseminadas34.
Factores de riesgo para el desarrollo de mucormicosis y su relación con el metabolismo férrico
| Factor | Mecanismo implicado de sobrecarga férrica |
| Cetoacidosis diabética | Acidosis metabólica |
| Tratamiento con DFO | Comportamiento como xenosideróforo |
| TPH y EICH | Politransfusión |
| Quimioterapia | Lisis celular |
| Desnutrición | Disminución de la transferrina sérica |
| Corticoterapia | Ninguno |
| Neutropenia | Ninguno |
DFO: deferoxamina; EICH: enfermedad de injerto contra huésped; TPH: trasplante de progenitores hematopoyéticos.
A diferencia de la DFO, los nuevos quelantes orales del hierro (DFP y DFX) no se comportan como xenosideróforos para los Mucorales. Esta discrepancia podría explicarse por sus diferentes relaciones estequiométricas en el proceso de quelación64. La molécula de DFO tiene un peso molecular elevado y se une a la molécula de hierro en una relación 1:1 (fig. 3); sin embargo, para quelar una molécula de hierro son necesarias 2 moléculas de DFX (estequiometría 2:1) y 3 de DFP (estequiometría 3:1). Es posible que estos últimos adquieran una configuración espacial que impida el acceso del hongo a la molécula de hierro o que formen enlaces de naturaleza más estable.
En modelos experimentales porcinos de mucormicosis por R. microsporus y R. arrhizus la administración concomitante de DFO se asoció a una menor supervivencia, efecto que no se demostró con la administración de DFP38. Tanto la captación de hierro in vitro como la velocidad de crecimiento de R. oryzae aumentaron en presencia de DFO pero no de DFP10. De hecho, DFP ejerció un efecto fungostático frente a este hongo a las 24h de incubación, y fungicida al cabo de 48h43. El DFX también ha mostrado ser fungicida a las 24h de incubación para diferentes Mucorales, incluyendo R. oryzae y especies del género Mucor, y a concentraciones inferiores a las obtenidas con las dosis habitualmente empleadas en los estados de sobrecarga férrica45 (tabla 3). Esta acción fungicida del DFX desapareció al añadir al medio de cultivo concentraciones equimolares de hierro libre capaces de saturar su capacidad de quelación45.
En modelos de IFI por R. oryzae con ratones y cobayas sin sobrecarga de hierro, la DFP aumentó la supervivencia con respecto a placebo10,43. Además se ha mostrado tan efectivo como la AmB-L a dosis elevadas (15mg/Kg/24h) tanto en la disminución de la mortalidad como en la reducción de la carga fúngica en muestras histológicas de tejido cerebral. De forma análoga a lo observado con el DFX, la saturación de los enlaces libres de la DFP tras la adición de cloruro férrico libre en el medio revertía por completo esta acción43.
El DFX también incrementa, frente a placebo, la supervivencia en infecciones por Rhizopus en modelos animales con cetoacidosis sin sobrecarga férrica y, en menor medida, con neutropenia. Al igual que DFP, tiene una eficacia comparable a la de la AmB-L a dosis elevadas y presenta un efecto sinérgico cuando se asocia a esta45. En este estudio los ratones tratados con DFX presentaron niveles más elevados de citoquinas proinflamatorias (factor de necrosis tumoral α e interferón γ) y de linfocitos Th1 y Th2 en muestras de tejido esplénico y renal, en comparación con los que recibieron placebo o DFX saturado con hierro. De este modo, el DFX parece ejercer, además, un efecto inmunomodulador, potenciando la respuesta del huésped frente a la infección45.
Por último, un estudio reciente basado en un modelo murino de cetoacidosis inducida por estreptozocina con IFI por R. oryzae evaluó la eficacia de una terapia triple con DFX, AmB-L y micafungina46. Esta combinación obtuvo una supervivencia a los 28 días (40%) superior al placebo o a los regímenes en monoterapia y biterapia (supervivencias entre el 0 y el 10%), además de disminuir la carga fúngica en muestras de tejido renal y cerebral. Inesperadamente, los animales que recibieron la asociación de micafungina y DFX presentaron una mayor carga fúngica en comparación con los tratados con cualquiera de estos fármacos en monoterapia, sugiriendo un posible antagonismo entre ambos46.
Si bien el DFX es generalmente bien tolerado, hasta la tercera parte de los pacientes con sobrecarga férrica que recibieron este fármaco en el seno de los ensayos pivotales presentaron un deterioro al menos moderado de la función renal, de carácter dependiente de la dosis18,85. Esta elevación parece ser reversible una vez finalizado el tratamiento, aunque se desconoce si su administración conjunta con otro nefrotóxico como es la AmB-L en pacientes sin sobrecarga férrica podría incrementar la toxicidad renal, limitando así su utilización clínica como antifúngico. No obstante, en una experiencia preliminar con 8 pacientes con mucormicosis tratados con AmB-L y DFX no se observó la aparición de toxicidades relevantes de naturaleza renal, hepática o hematológica78.
En base a la experiencia acumulada in vitro y en modelos animales, el DFX ha sido administrado como tratamiento de rescate en pacientes con mucormicosis, con resultados aparentemente favorables15,68,78, aunque también se han comunicado fracasos terapéuticos77. A fin de proporcionar una evidencia más definitiva, en 2010 finalizó un ensayo clínico en fase 2 de diseño doble ciego y multicéntrico, denominado Deferasirox-AmBisome Therapy for Mucormycosis –DEFEAT Mucor–80. Un total de 20 pacientes con diagnóstico de mucormicosis probable o probada fueron aleatorizados a recibir AmB-L (≥5mg/Kg/24h al menos 3 veces por semana) en combinación con DFX (20mg/Kg/24h) o placebo durante 14 días, además de ser sometidos a desbridamiento quirúrgico. No se observaron diferencias en la frecuencia de efectos adversos entre ambos grupos, si bien la mortalidad a los 30 y 90 días fue mayor en el brazo de DXF (45 y 82%) que en el de placebo (11 y 22%, respectivamente). La mayor parte de las muertes fueron atribuidas a fracaso terapéutico o progresión de la enfermedad de base, sin evidencia de toxicidad grave. Estos decepcionantes resultados contrastan con los comunicados hasta el momento en modelos animales y en casos aislados de tratamiento de rescate con DFX. No obstante, es preciso señalar que, por su lento ritmo de reclutamiento, el ensayo DEFEAT Mucor vio limitada su potencia estadística. El proceso de aleatorización dio lugar a desequilibrios notables entre grupos, pues las enfermedades oncohematológicas y la neutropenia fueron más frecuentes en los pacientes que recibieron DFX, así como las formas pulmonares de mucormicosis80. Tal y como recuerdan los autores, la mayor parte de la experiencia previa con DFX proviene de modelos animales de cetoacidosis con formas rinoorbitarias, escenario que se asocia a un mejor pronóstico que las formas pulmonares en presencia de neutropenia como factor predisponente59,69. Desgraciadamente, el diseño de nuevos ensayos clínicos que analicen el papel del tratamiento combinado en la mucormicosis se enfrentará a importantes obstáculos tanto logísticos (su incidencia anual estimada es de un caso por cada 200.000 habitantes)42 como financieros (se requeriría reclutar 200-300 pacientes para obtener una potencia estadística adecuada)81.
Nuevos quelantes del hierro y aspergilosis invasivaAspergillus es un hongo filamentoso de distribución ubicua. Al igual que se ha comentado en el caso de la mucormicosis, la incidencia de aspergilosis invasiva (AI) ha experimentado un incremento sostenido en las últimas décadas66, si bien los triazoles de espectro extendido han demostrado su eficacia en la prevención en los pacientes de alto riesgo22,61. No obstante, esta estrategia se ve amenazada por la aparición de cepas de A. fumigatus con sensibilidad disminuida a triazoles76 y por la emergencia de especies resistentes, como Aspergillus calidoustus26. A pesar de la mejoría en el pronóstico de la AI comunicada en los últimos años, las tasas de mortalidad siguen superando el 40% en pacientes con leucemia mieloide aguda55,66.
A. fumigatus recurre a dos formas diferentes para la captación del hierro: un mecanismo reductivo (mediado por un complejo reductasa-permeasa denominado FtrA/FetC) y un sistema de sideróforos de tipo hidroxamato (codificados por los genes sidC, sidD, sidF y sidG)1. La síntesis de lactoferrina por parte de los leucocitos polimorfonucleares ejerce un efecto deletéreo sobre el desarrollo de las conidias de A. fumigatus a través del secuestro del hierro libre del medio88. Sin embargo, y contrariamente a lo observado en la mayoría de los hongos, su crecimiento no es inhibido por el suero humano. De hecho, la adición al medio de cultivo de suero humano o fetal al 10%, lejos de ejercer un efecto fungistático, aumenta hasta 4 veces su velocidad de crecimiento33. Este hallazgo puede ser explicado por la mediación de los 2 sideróforos mayoritarios (ferricrocina y N’,N”,N”’-triacetilfusarinina C), que son capaces de obtener el hierro directamente de la transferrina sérica. Además, A. fumigatus puede secretar proteinasas en fases estacionarias de su crecimiento que degradan la transferrina y permiten la liberación del hierro transportado por esta molécula37. Por otra parte, la inactivación de la permeasa de alta afinidad FtraA no reduce la virulencia del hongo en un modelo murino de AI, por lo que el mecanismo reductivo de asimilación no parece desempeñar un papel destacado en su patogenicidad72.
Recientemente ha sido identificado el gen que regula la síntesis de los sideróforos de A. fumigatus y Aspergillus nidulans, denominado sidA. Este gen codifica la enzima L-ornitina N5-oxigenasa, que interviene en el primer paso de la biosíntesis de los sideróforos de tipo hidroxamato1,27. Las cepas de Aspergillus deficientes para este gen (cepas ΔsidA) carecen de la capacidad de crecimiento en medios de suero humano pobres en hierro, a diferencia de lo que ocurre en las cepas salvajes. Esta inhibición se revierte incorporando al cultivo los sideróforos deficitarios (ferricrocina y N’,N”,N”’-triacetilfusarinina C), hallazgo que confirma que son estos los encargados de quelar el hierro ligado a la transferrina humana. Así, las cepas ΔsidA presentan una casi absoluta ausencia de virulencia en modelos murinos, evidenciando que este gen juega un papel relevante en la patogenia de la AI in vivo1,27. También se ha comprobado que estos sideróforos intervienen en la modulación de la respuesta inmune innata frente a A. fumigatus, pues las cepas ΔsidA no inducen la síntesis de factor de necrosis tumoral en cultivos de líneas celulares de macrófagos, contrariamente a lo que ocurre en presencia de cepas salvajes73. Dado que las células humanas no producen siderórofos, algunos de estos genes (particularmente sidA y sidC) podrían constituir dianas terapéuticas prometedoras1.
A diferencia de lo observado en los hongos filamentosos del grupo de los Mucorales60, la concentración de hierro libre no supone un factor limitante para el crecimiento de A. fumigatus. No obstante, diversas observaciones tanto experimentales como clínicas sugieren que los estados de sobrecarga férrica se asocian a un incremento de la incidencia de AI17,87. Garcia-Vidal et al. demostraron que la concentración sérica de ferritina superior a 2.000ng/ml, como marcador subrogado de los depósitos corporales totales de hierro, constituía un factor de riesgo independiente para el desarrollo de IFI por hongos filamentosos en una amplia cohorte de receptores de TPH alogénico32. En otro estudio realizado igualmente en pacientes con neoplasia hematológica sometidos a TPH, hasta el 70% presentaba una concentración hepática de hierro superior a 100μmol/g de tejido seco, y cerca de la mitad, un índice hepático de hierro por encima de 1,9 (que es el punto de corte establecido como criterio diagnóstico de la HH), sin diferencias significativas entre trasplantes autólogos y alogénicos. Se demostró la presencia de AI en el estudio necrópsico en el 37% de los pacientes con sobrecarga férrica (concentración hepática de hierro≥150μmol/g de tejido seco) frente al 12% de los pacientes sin sobrecarga (p=0,035), sin que existiera una asociación similar con la candidiasis4. Un tercer estudio basado en la evaluación retrospectiva de la concentración de hierro en biopsias de médula ósea comparó 33 pacientes con leucemia mieloide aguda, sometidos a TPH alogénico que desarrollaron AI, con una cohorte de 33 controles sin tal complicación. El 70% de los pacientes con AI presentaron datos de sobrecarga medular de hierro (score≥3 en una escala semicuantitativa) frente al 16% de los controles (p<0,0001). La sobrecarga férrica se mantuvo como un factor de riesgo independiente para el desarrollo de AI en el análisis multivariante56.
A la vista de estos hallazgos algunos estudios han abordado la utilidad potencial de los quelantes del hierro en el tratamiento de la AI, si bien la experiencia es más limitada que con la mucormicosis. La combinación de DFP con ketoconazol o fluconazol ejerce un efecto sinérgico en la inhibición in vitro del crecimiento de conidias de A. fumigatus88. El DFX exhibe una menor actividad frente a Aspergillus que frente a Rizhopus, a pesar de lo cual ha demostrado que incrementa de forma modesta frente a placebo la supervivencia de ratones neutropénicos con AI. Además, su asociación con AmB-L prolonga la supervivencia y disminuye la carga fúngica en tejido pulmonar, en comparación con ambos fármacos en monoterapia y con placebo44. En el citado estudio de Ibrahim et al.46. la triple terapia con DFX, AmB-L y micafungina en ratones inmunodeprimidos con AI mejoró la supervivencia a los 28 días frente a placebo (70 y 31%, respectivamente) o a AmB-L, pero no frente a la monoterapia con micafungina o DFX. La asociación de micafungina y DFX se asoció a una mayor mortalidad respecto a la monoterapia con micafungina, de forma similar a lo observado en el modelo de mucormicosis46. Hasta la fecha no se ha comunicado ninguna experiencia clínica del empleo de quelantes en el tratamiento de pacientes con AI.
Mecanismos de captación del hierro en otras infecciones fúngicasSon múltiples los estudios que han analizado los sistemas de captación de hierro implicados en otros tipos de IFI, como las producidas por Candida16,39,41,52,53,58,71 o Cryptococcus16,39,48,83. Por desgracia, estos hongos parecen disponer de mecanismos redundantes e independientes para obtener este elemento del medio, circunstancia que limita su aprovechamiento terapéutico.
La candidiasis es la IFI más frecuente. En el curso de la infección y en medios deplecionados de hierro, Candida puede recurrir a diferentes mecanismos de captación en función de las fuentes disponibles39,52,71. Así, se han caracterizado sistemas reductasa-permeasa capaces de obtener incluso el hierro ligado a la transferrina (codificados en el gen FTR1)52. receptores para sideróforos de la familia de los ferricromos (CaFtr1p)41 y receptores de alta afinidad para grupos hemo y hemoglobina16,39,71. Sin embargo, ninguno de ellos, de manera individual, parece ser indispensable para el desarrollo y la virulencia del hongo. Algún estudio in vitro ha demostrado que el uso combinado de azoles y lactoferrina podría tener un efecto fungistático sinérgico58 que desaparece con la adición de hierro libre al medio de cultivo, lo que sugiere que la actividad antifúngica de la lactoferrina depende, en parte, de su acción como quelante de hierro53. En esta línea, Fiori y van Dijck han demostrado que doxiciclina, un antibiótico del grupo de las tetraciclinas, potencia el efecto antifúngico de fluconazol frente a C. albicans de forma dependiente de dosis, disminuyendo la concentración mínima inhibitoria y transformando en fungicida su actividad habitualmente fungostática. Esta sinergia aparece mediada por la actividad quelante de la doxiciclina y su interferencia en la síntesis del ergosterol de la membrana fúngica, pues la adición de suplementos de hierro al medio restaura el crecimiento fúngico aun en presencia de fluconazol y doxiciclina29.
La criptococosis es la forma más frecuente de meningoencefalitis fúngica. La adquisición de hierro es un paso importante para el crecimiento de Cryptococcus y para la formación de su cápsula polisacárida de glucuronoxilomanano, responsable en gran parte de la virulencia del hongo gracias a su capacidad antifagocitaria82. Cryptococcus posee diferentes mecanismos basados en reductasas39, receptores para xenosideróforos de tipo hidroxamato (ferrioxamina B)83 y sistemas de captación del hierro en forma hemo (manoproteína extracelular Cig1)16. Sin embargo, y al igual que ocurre en el caso de Candida, no parece que ninguno de estos procesos actúe individualmente como un factor limitante para el desarrollo del hongo, por lo que su utilidad como diana antifúngica resulta limitada.
ConclusionesLos estados de sobrecarga férrica aumentan el riesgo de IFI al incrementar la concentración de hierro libre, elemento necesario para el crecimiento fúngico y para el desarrollo de sus mecanismos de patogenicidad. Además, el exceso de hierro ejerce un efecto deletéreo sobre la respuesta inmune del huésped, particularmente a nivel de la capacidad fagocitaria de los neutrófilos. Los Mucorales son más dependientes de la disponibilidad de hierro libre en el medio que Aspergillus, ya que este género dispone de mecanismos más eficientes para su captación a partir de la transferrina sérica. No obstante, la sobrecarga de hierro también se ha revelado como un factor relevante en la virulencia de la AI.
A diferencia de la DFO, la nueva generación de quelantes de hierro (DFP y DFX) constituye un abordaje potencialmente útil en el tratamiento de la IFI. No obstante, la mayor parte de la experiencia acumulada con estos fármacos se limita a datos preclínicos (modelos in vitro y animales) y a estudios no controlados con un reducido número de pacientes. Con las limitaciones antes señaladas, el único ensayo clínico realizado hasta la fecha (DEFEAT Mucor) ha puesto en entredicho el papel del tratamiento combinado con DFX y AmB-L, al menos en pacientes neutropénicos con mucormicosis pulmonar. La eficacia de esta estrategia debería ser evaluada en un mayor número de pacientes, preferentemente con formas rinoorbitarias en el contexto de cetoacidosis diabética, antes de poder extraer conclusiones definitivas. Por desgracia, la investigación en este campo se verá previsiblemente condicionada por los resultados negativos de este estudio preliminar y por dificultades logísticas y financieras, tal y como han señalado en un reciente editorial Donnelly y Lahav25. En cualquier caso, la quelación del hierro ofrece una alternativa prometedora no solo en el tratamiento, sino, tal vez, en la prevención de la infección fúngica y por otros microorganismos en pacientes con sobrecarga férrica.
FinanciaciónMario Fernández Ruiz disfruta actualmente de un Contrato de Formación en Investigación Río Hortega (CM11/00187) del Ministerio de Economía y Competitividad (Instituto de Salud Carlos III).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.






![Ciclo biológico del hierro. Los enterocitos duodenales absorben aproximadamente 1-2mg diarios del hierro de los alimentos a través de un sistema formado por 2 trasportadores distintos: uno importador, situado en la membrana apical (divalent metal transporter 1 [DMT1]), y otro exportador, situado en la basolateral (ferroportina). El hierro circula unido a la transferrina sérica y es suministrado a los precursores eritroides (hierro en forma hemo), o bien es reciclado y almacenado en el sistema reticuloendotelial y en el hígado en forma de ferritina (hierro no hemo). La entrada del hierro en la circulación es controlada por la hormona hepcidina, sintetizada en el hígado, que induce la internalización y degradación lisosómica de la ferroportina de los enterocitos. Entre otros estímulos, los estados inflamatorios inducen la síntesis de hepcidina a través de la interleucina 6. Ciclo biológico del hierro. Los enterocitos duodenales absorben aproximadamente 1-2mg diarios del hierro de los alimentos a través de un sistema formado por 2 trasportadores distintos: uno importador, situado en la membrana apical (divalent metal transporter 1 [DMT1]), y otro exportador, situado en la basolateral (ferroportina). El hierro circula unido a la transferrina sérica y es suministrado a los precursores eritroides (hierro en forma hemo), o bien es reciclado y almacenado en el sistema reticuloendotelial y en el hígado en forma de ferritina (hierro no hemo). La entrada del hierro en la circulación es controlada por la hormona hepcidina, sintetizada en el hígado, que induce la internalización y degradación lisosómica de la ferroportina de los enterocitos. Entre otros estímulos, los estados inflamatorios inducen la síntesis de hepcidina a través de la interleucina 6.](https://static.elsevier.es/multimedia/11301406/0000003000000004/v1_201311090032/S1130140613000442/v1_201311090032/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)