Candida parapsilosis constituye un complejo de especies formado por Candida parapsilosis sensu stricto, Candida orthopsilosis y Candida metapsilosis. Estudios a nivel mundial han descrito su epidemiología y sensibilidad a los antifúngicos.
ObjetivosLos objetivos de este trabajo fueron identificar molecularmente aislamientos de sangre del complejo Candida parapsilosis y determinar su sensibilidad in vitro a los antifúngicos de uso sistémico.
MétodosSe estudiaron 86 aislamientos del complejo C. parapsilosis, provenientes de la Red de Vigilancia de Candidemia del Departamento de Micología del Instituto Nacional de Higiene Rafael Rangel, recogidos en el periodo 2008-2011. Se realizó la amplificación del gen de la deshidrogenasa alcohólica secundaria por reacción en cadena de la polimerasa y los productos fueron analizados mediante los polimorfismos de la longitud de sus fragmentos de restricción, mediante el uso de la enzima BanI. Las pruebas de sensibilidad se realizaron mediante Etest® según las instrucciones del fabricante, con modificaciones.
ResultadosDe los 86 aislamientos estudiados, 81 (94,2%) fueron C. parapsilosis sensu stricto, 4 (4,6%) C. orthopsilosis y uno (1,2%) C. metapsilosis. C. parapsilosis fue sensible a la anfotericina B y la caspofungina, y su porcentaje de resistencia al fluconazol y el voriconazol fue bajo. C. orthopsilosis y C. metapsilosis fueron sensibles a todos los antifúngicos probados.
ConclusionesLos resultados aportaron por primera vez en Venezuela información importante sobre la distribución del complejo C. parapsilosis en casos de candidemia, y apoyan la necesidad de continuar con los programas de vigilancia, incluyendo la discriminación molecular de las especies y las pruebas de sensibilidad a los antifúngicos, que permitirán orientar la terapia específica.
Candida parapsilosis is a species complex consisting of Candida parapsilosis sensu stricto, Candida orthopsilosis, and Candida metapsilosis. Studies worldwide have described its epidemiology and susceptibility to antifungal agents.
AimsThe aims of this study were to carry out the molecular identification of blood isolates belonging to the Candida parapsilosis species complex, and to determine their in vitro susceptibility to antifungals of systemic use.
MethodsA study of 86 strains of C. parapsilosis species complex collected in 2008-2011 and obtained from the Candidaemia Surveillance Network of Mycology Department of the Rafael Rangel National Institute of Hygiene, was made. Secondary alcohol-dehydrogenase gene amplification was performed using polymerase chain reaction, and the products were analysed by restriction fragments length polymorphisms using the enzyme BanI. Susceptibility tests were performed using Etest®, following the manufacturer's instructions with modifications.
ResultsOf the 86 isolates studied, 81 (94.2%) were C. parapsilosis sensu stricto, 4 (4.6%) C. orthopsilosis, and one (1.2%) C. metapsilosis. C. parapsilosis isolates were susceptible to amphotericin B and caspofungin, showing low rates of resistance to fluconazole and voriconazole. C. orthopsilosis and C. metapsilosis were susceptible to all the antifungals tested.
ConclusionsThe results obtained in Venezuela provide for the first time important information about the distribution of C. parapsilosis species complex in cases of candidaemia, and support the need for continuing surveillance programs, including molecular discrimination of species and antifungal susceptibility tests, which may guide specific therapy.
Durante la última década la incidencia de Candida parapsilosis se ha incrementado drásticamente, llegando a situarse como la segunda levadura más frecuentemente aislada en hemocultivos, después de Candida albicans28.
La variabilidad genética de C. parapsilosis, descrita por el análisis del polimorfismo de los fragmentos de restricción del gen de la deshidrogenasa alcohólica secundaria (SADH), llevó a su separación en tres grupos, con la consiguiente conformación de un complejo de especies: C. parapsilosis sensu stricto (grupo i), C. orthopsilosis (grupo ii) y C. metapsilosis (grupo iii)6,24,25. Curiosamente, una serie de alelos de C. parapsilosis sensu stricto están presentes en cepas de C. orthopsilosis y C. metapsilosis, pero alelos de C. orthopsilosis y C. metapsilosis no se han detectado en C. parapsilosis sensu stricto. Esto evidencia que esta última podría haber surgido hace poco tiempo, por divergencia de una subpoblación genéticamente homogénea; su elevada distribución global y alta tasa de aislamiento en muestras clínicas avala su naturaleza clonal e indican una veloz propagación geográfica, debido a su rápida transmisión horizontal de persona a persona y excelente adaptación como comensal al ser humano, en contraposición a lo observado en sus dos especies hermanas13,25.
Estudios sobre la sensibilidad a los antifúngicos de aislamientos del complejo C. parapsilosis (CCP) han reportado valores de concentración mínima inhibitoria (CMI) elevados para la anfotericina B (AB), las equinocandinas y los azoles, específicamente el fluconazol (FZ) para C. parapsilosis sensu stricto, mientras que C. orthopsilosis y C. metapsilosis suelen presentar valores CMI más bajos11,27; en otro estudio, sin embargo, se encontraron valores CMI similares entre todas las especies12. Esto evidencia la necesidad de realizar la identificación molecular de los aislamientos pertenecientes a este complejo, ya que pueden existir diferencias en el patrón de sensibilidad a los antifúngicos, particularmente para los azoles y las equinocandinas14.
Materiales y métodosProcedencia de los aislamientosSe estudiaron 86 aislamientos del CCP provenientes de la Red de Vigilancia de Candidemias del Departamento de Micología del Instituto Nacional de Higiene Rafael Rangel, escogidos al azar y aislados en el periodo 2008-2011. Los aislamientos se mantuvieron preservados por el método de agua de Castellani18 hasta el momento de su procesamiento.
Preparación de los aislamientosLa recuperación de los aislamientos se realizó mediante pases sucesivos en agar Sabouraud dextrosa y su incubación durante 24-48h a 35°C. Se constató así su viabilidad y pureza. La identificación taxonómica de las cepas se realizó mediante pruebas fenotípicas: resistencia a la cicloheximida (agar Mycosel®, Oxoid), producción de pigmentos en agar cromógeno (Oxoid), visualización de la morfología microscópica en agar harina de maíz y el uso de Vitek® 2 Compact (bioMérieux, Marcy-l’Étoile, Francia).
Extracción del ADN genómicoSe preparó en solución salina estéril al 0,85% una suspensión de los aislamientos a una concentración 0,5 McFarland en un densitómetro (Densimat™, bioMérieux) a 530nm; el ADN genómico fue extraído mediante la utilización del QIAamp® DNA Mini Kit (QIAGEN) y siguiendo las instrucciones del fabricante.
Amplificación por reacción en cadena de la polimerasa (PCR) del gen SADHSe siguió el protocolo descrito por Tavanti et al.25 y se estandarizó a las condiciones del laboratorio de micología molecular del Departamento de Micología del Instituto Nacional de Higiene Rafael Rangel. Para la preparación de la mezcla de reacción se utilizaron los siguientes reactivos: 5μl de ADN genómico; 0,5μl de Taq polimerasa 5U/μl (KAPATaq™, HotStart-Kapa Biosystems); 5μl de buffer libre de magnesio 10X (Invitrogen); 1,5μl de MgCl2 50mM (Invitrogen); 2,4μl de ditiotreitol 0,1mM (Invitrogen); 0,1μl de inhibidor recombinante de ribonucleasas 40U (Invitrogen); 1μl de DNTP 10mM; 1μl de cada uno de los cebadores 5′-GTT GAT GCT GTT GGA TTG T-3′ y 3′-CAA TGC CAA ATC TCC CAA-5′ (Bioneer, Inc.) y 32,5μl de agua libre de nucleasas, para completar un volumen de 50μl. La amplificación fue llevada a cabo en un termociclador modelo iCycler® (SensoQuest) bajo las siguientes condiciones: un primer ciclo de desnaturalización de 7min a 94°C; 35 ciclos de desnaturalización a 95°C durante 30s, alineamiento a 55°C durante 60s y elongación a 72°C durante 90s; se terminó con un ciclo de elongación final a 72°C durante 5min.
El producto obtenido fue sometido a electroforesis en gel de agarosa al 2% teñido con bromuro de etidio, para observar así la presencia de un producto de 716pb que distingue a los aislamientos dentro del CCP. Se utilizó un marcador de 100pb de peso molecular (Amersham GE Healthcare) y la visualización se realizó en el sistema de documentación de imágenes Gel Doc XR® con el software de análisis 1D Quantity One® (Laboratorios Bio-Rad).
Análisis del fragmento SADH mediante enzimas de restricción25Los amplicones obtenidos por PCR fueron digeridos con la enzima de restricción BanI (New England Biolabs, Ipswich, MA), con la siguiente mezcla de reacción: 0,14μl de enzima BanI (Invitrogen); 1,4μl de buffer 10X (Invitrogen); 0,14μl de BSA 100X (Invitrogen); 7μl del producto de PCR y 5,32μl de agua grado molecular, para completar un volumen total de 14μl; posteriormente se incubaron a 37°C en un termobloque durante 2h. Los productos de digestión obtenidos fueron sometidos a electroforesis y análisis posterior bajo las condiciones descritas anteriormente. Los aislamientos analizados debían presentar productos de 550 y 200pb, 750pb y 400pb para ser discriminados molecularmente como C. parapsilosis sensu stricto, C. orthopsilosis y C. metapsilosis, respectivamente.
Control de calidadSe utilizaron los siguientes reactivos: 1) ADN comercial de 500pb como control de la reacción de PCR (Laboratorios Perkin-Elmer, Estados Unidos); 2) agua libre de nucleasas como control de reactivos; 3) las cepas de colección de C. parapsilosis ATCC 22019 y ATCC 90018; C. orthopsilosis ATCC 96139 y ATCC 96141; C. metapsilosis ATCC 96144 y ATCC 96143 como controles positivos, y 4) la cepa de colección de Candida tropicalis ATCC 66029 como control negativo. Todos los controles fueron procesados bajo las mismas condiciones de los aislamientos en estudio a fin de detectar posibles contaminaciones y validar los resultados obtenidos.
Estudio de la sensibilidad a los antifúngicosPara la preparación de los inóculos se utilizaron colonias de los aislamientos sembrados en agar Sabouraud dextrosa; las colonias se suspendieron en solución salina estéril a un valor de 0,5 en la escala de McFarland con la ayuda de un densitómetro (Densimat™, bioMérieux) a 530nm. Para el estudio de la sensibilidad se utilizó el método Etest® (AB bioMérieux) bajo las instrucciones del fabricante4,22, pero con la modificación del uso de agar Müeller Hinton suplementado con glucosa al 2% más azul de metileno. Sobre el agar en las placas de Petri se colocaron en cada caso las tiras de FZ (0,016-256μg/ml), caspofungina (CS), AB y voriconazol (VO) (0,002-32μg/ml para estos tres últimos antifúngicos). Las placas se incubaron a 35°C y la CMI se leyó a las 24h, con un tiempo final máximo de 48h. Como control de calidad se utilizaron las cepas C. parapsilosis ATCC 22019 y Candida krusei ATCC 6258, tratadas de igual forma que los aislamientos empleados en este estudio.
Criterios de interpretación de la CMILa lectura de la CMI se realizó en el punto de intersección de la elipse producida por la zona de inhibición, según la escala de medición de cada una de las tiras. Para la interpretación de las CMI se utilizaron los valores establecidos en el documento de referencia M27-S4 del Instituto de Estándares Clínicos y de Laboratorio (Clinical and Laboratory Standards Institute)26. El Etest® posee un gradiente continuo de CMI y para correlacionar los valores con los del método de referencia los valores situados entre dos diluciones consecutivas fueron llevados a la dilución inmediatamente superior del método; los valores en el límite superior de la tira fueron llevados a la máxima concentración permitida y los valores en el límite inferior se mantuvieron sin cambios21. Los criterios de interpretación utilizados fueron aislamiento sensible (S), aislamiento sensible dependiente de la dosis (SDD), aislamiento de sensibilidad intermedia (I) y aislamiento resistente (R), según los puntos de corte clínicos en μg/ml establecidos en el ya mencionado documento. Estos puntos son, para FZ, S≤2; SDD=4 y R≥8; para VO, S≤0,125; SDD=0,25-0,5 y R≥1; para AB, S≤1 y R≥2; y para CS, S≤2; I=4 y R≥8.
Análisis de los datosLos datos se describieron mediante porcentajes. Para describir la distribución de las CMI frente a los distintos antifúngicos ensayados se emplearon medidas de dispersión como rangos de concentración y los percentiles 50 y 90, que representan los valores de CMI que inhiben al 50 y al 90% de los aislamientos, respectivamente. La relación entre los valores de sensibilidad y resistencia entre el FZ y el VO para las cepas estudiadas se analizó mediante las tablas de contingencia y la prueba de Chi cuadrado con corrección de Yates mediante el programa Statgraphics 5.0. Un valor de p≤0,05 fue considerado significativo.
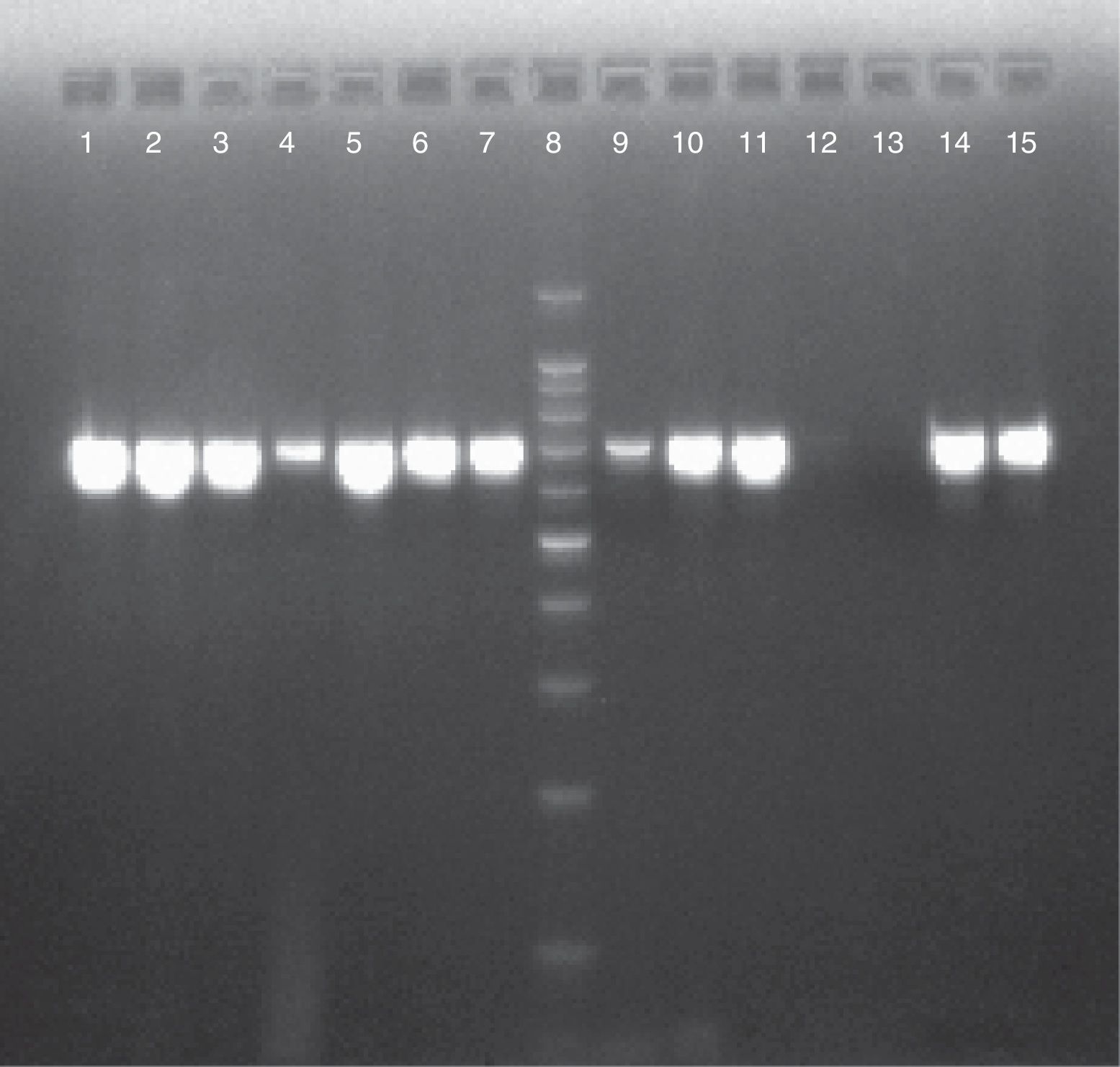
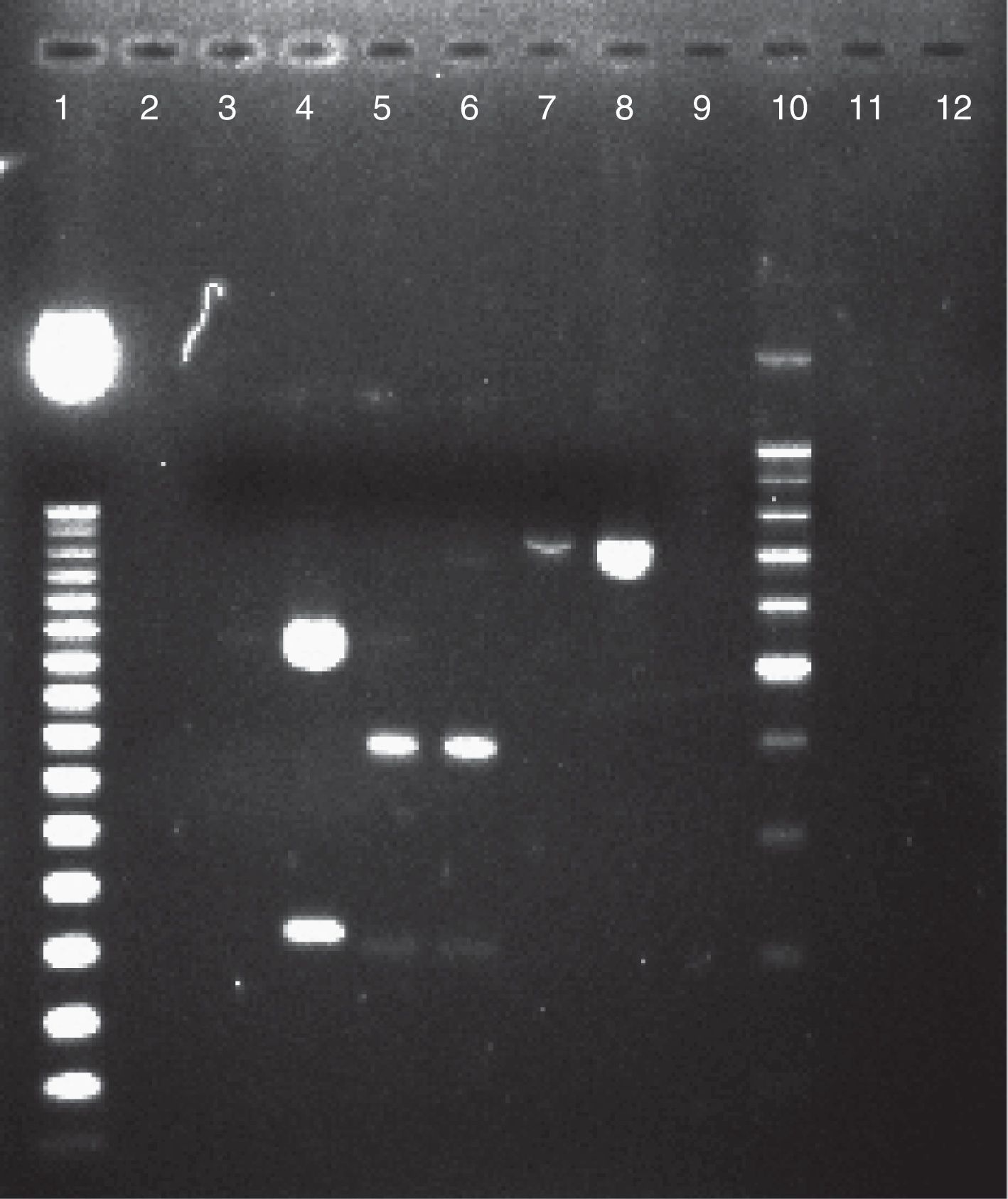
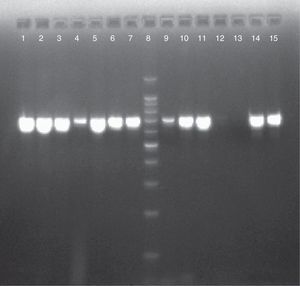
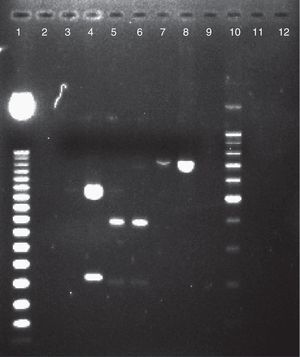
ResultadosDe cada uno de los 86 aislamientos estudiados se obtuvo un producto de 716pb al realizarse el análisis molecular del gen SADH, resultado que confirmó su situación dentro del CCP (fig. 1). Mediante la utilización de la enzima de restricción BanI se encontró que 81 aislamientos (94,2%) fueron C. parapsilosis sensu stricto, 4 (4,6%) C. orthopsilosis y uno (1,2%) C. metapsilosis (fig. 2).
Electroforesis en gel de agarosa al 2% de los productos de PCR-SADH para los aislamientos del CCP. Calles 1, 2, 3, 4, 6, 7, 9, 10, 14 y 15: aislamientos del CCP (716pb). Calle 5: C. parapsilosis ATCC 22019. Calle 8: marcador de peso molecular 100pb. Calle 11: C. parapsilosis ATCC 90018. Calle 12: agua libre de nucleasas. Calle 13: Candida tropicalis ATCC 66029.
Electroforesis en gel de agarosa al 2% de productos de PCR-SADH digeridos por la enzima de restricción BanI, para la caracterización de las especies del CCP. Calle 1: marcador de peso molecular de 50pb. Calle 2: agua libre de nucleasas. Calle 3: Candida tropicalis ATCC 66029. Calle 4: C. parapsilosis ATCC 22019 (550 y 200pb). Calle 5: aislamiento de C. metapsilosis (400pb). Calle 6: C. metapsilosis ATCC 96144 (400pb). Calle 7: aislamiento de C. orthopsilosis (750pb). Calle 8: C. orthopsilosis ATCC 96139 (750pb). Calle 9: Candida tropicalis ATCC 66029. Calle 10: marcador de peso molecular 100pb. Calles 11 y 12: agua libre de nucleasas.
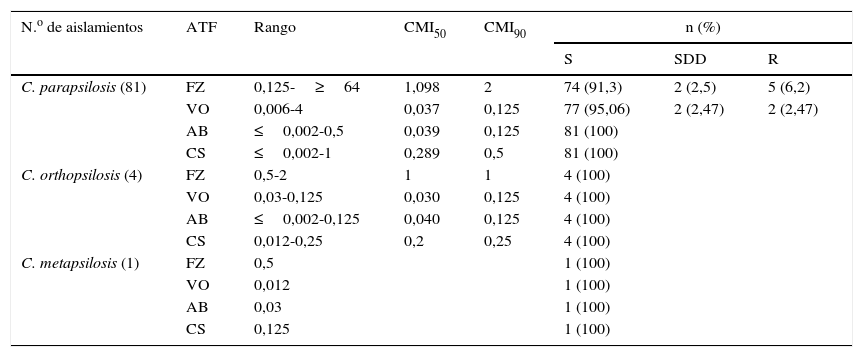
Los resultados obtenidos para los rangos de sensibilidad, percentiles 50 y 90 de las CMI y los porcentajes de S, SDD, I y R de las tres especies para los antifúngicos ensayados se presentan en la tabla 1. Según los puntos de corte establecidos por el Clinical and Laboratory Standards Institute, C. parapsilosis fue sensible a AB y CS, y presentó bajos porcentajes de resistencia a FZ y VO. C. orthopsilosis y C. metapsilosis fueron sensibles a todos los antifúngicos probados. Debido al escaso número de C. orthopsilosis y C. metapsilosis obtenido no se pudieron comparar los perfiles de sensibilidad entre las tres especies.
Rango de sensibilidad, CMI50, CMI90 y porcentaje de aislamientos S, SDD y R de C. parapsilosis, C. orthopsilosis y C. metapsilosis a cuatro antifúngicos por Etest® (n=86)
| N.o de aislamientos | ATF | Rango | CMI50 | CMI90 | n (%) | ||
|---|---|---|---|---|---|---|---|
| S | SDD | R | |||||
| C. parapsilosis (81) | FZ | 0,125-≥64 | 1,098 | 2 | 74 (91,3) | 2 (2,5) | 5 (6,2) |
| VO | 0,006-4 | 0,037 | 0,125 | 77 (95,06) | 2 (2,47) | 2 (2,47) | |
| AB | ≤0,002-0,5 | 0,039 | 0,125 | 81 (100) | |||
| CS | ≤0,002-1 | 0,289 | 0,5 | 81 (100) | |||
| C. orthopsilosis (4) | FZ | 0,5-2 | 1 | 1 | 4 (100) | ||
| VO | 0,03-0,125 | 0,030 | 0,125 | 4 (100) | |||
| AB | ≤0,002-0,125 | 0,040 | 0,125 | 4 (100) | |||
| CS | 0,012-0,25 | 0,2 | 0,25 | 4 (100) | |||
| C. metapsilosis (1) | FZ | 0,5 | 1 (100) | ||||
| VO | 0,012 | 1 (100) | |||||
| AB | 0,03 | 1 (100) | |||||
| CS | 0,125 | 1 (100) | |||||
AB: anfotericina B; ATF: antifúngico; CMI50: concentración que inhibe el 50% de los aislamientos; CMI90: concentración que inhibe el 90% de los aislamientos; CS: caspofungina; FZ: fluconazol; R: resistente; S: sensible; SDD: sensible dependiente de la dosis; VO: voriconazol.
Todos los valores se expresan en μg/ml.
Setenta y cuatro cepas de C. parapsilosis fueron S a FZ y VO (91,4%); 2 fueron SDD a FZ y S a VO (2,5%); una fue R a FZ y S a VO (1,2%); 2 fueron R a FZ y SDD a VO (2,5%) y 2 fueron R a FZ y VO (2,5%), lo que implica la presencia de resistencia cruzada; la asociación entre los valores de S, SDD y R para FZ y VO fue estadísticamente significativa con un 99% de confianza (p<0,01).
Las cepas utilizadas para el control de calidad de las pruebas de sensibilidad se mantuvieron dentro de los valores establecidos por el documento M27-S4.
DiscusiónLas infecciones del torrente sanguíneo causadas por levaduras del género Candida han emergido en las últimas dos décadas, y aunque C. albicans es el agente etiológico más frecuente de candidemias a nivel mundial, la rápida expansión del CCP refuerza la necesidad de vigilar su incidencia y conocer su perfil de sensibilidad a los antifúngicos2. Salavert Lletí et al.23 han descrito que las infecciones por especies de Candida no-C. albicans representan del 35 al 65% de todas las candidemias en general, donde el CCP oscila entre un 20 y un 40%. Las candidemias por C. parapsilosis en Estados Unidos se han descrito en niños menores de un año debido a prematuridad, uso de catéter y nutrición parenteral, mientras que en América Latina se presentan en todas las edades16,23.
Los resultados obtenidos en este estudio coinciden con los de otras investigaciones internacionales, donde C. parapsilosis sensu stricto fue la más frecuentemente aislada en muestras clínicas, particularmente de sangre, seguida por C. orthopsilosis y C. metapsilosis en menor proporción3,6,11,24,26,27.
La identificación molecular de estas especies es de suma importancia en nuestro país debido a la elevada frecuencia de aislamiento del CCP. Según un estudio de Dolande Franco et al.8, C. parapsilosis aislada del torrente sanguíneo ocupó el segundo lugar (26% de los aislamientos); por su parte, según Panizo et al.17, C. parapsilosis fue el agente más comúnmente aislado de episodios de candidemia (48,5%). Otros estudios sobre candidemia en Venezuela han publicado porcentajes variables (43-51%) de aislamientos de C. parapsilosis5,7,15. Nucci et al.16 describen el incremento de C. parapsilosis, que se situaría como segundo agente causal de candidemias en América Latina, pero países participantes en el estudio, como Venezuela y Colombia, sitúan a esta especie como la primera causante de infecciones del torrente sanguíneo, con un 39 y 38,5%, respectivamente.
Una limitación importante en esta investigación fue no disponer de los datos demográficos y epidemiológicos asociados a las infecciones, por lo que no se pudieron establecer comparaciones con estas variables y el análisis se limitó solo a los aspectos microbiológicos.
Los aislamientos de C. orthopsilosis y C. metapsilosis en sangre demuestran que ambas levaduras pueden comportarse como patógenos para el ser humano. Curiosamente, C. metapsilosis no ha sido aislada con frecuencia de muestras clínicas y, según estudios in vitro, carece de la virulencia mostrada por C. parapsilosis y C. orthopsilosis. Estas dos últimas, sin embargo, han sido aisladas en uñas, piel, pulmones, orina, catéteres y sangre, comportándose no solo como comensales, sino como patógenos, lo que resalta su importancia clínica2,10,11,25.
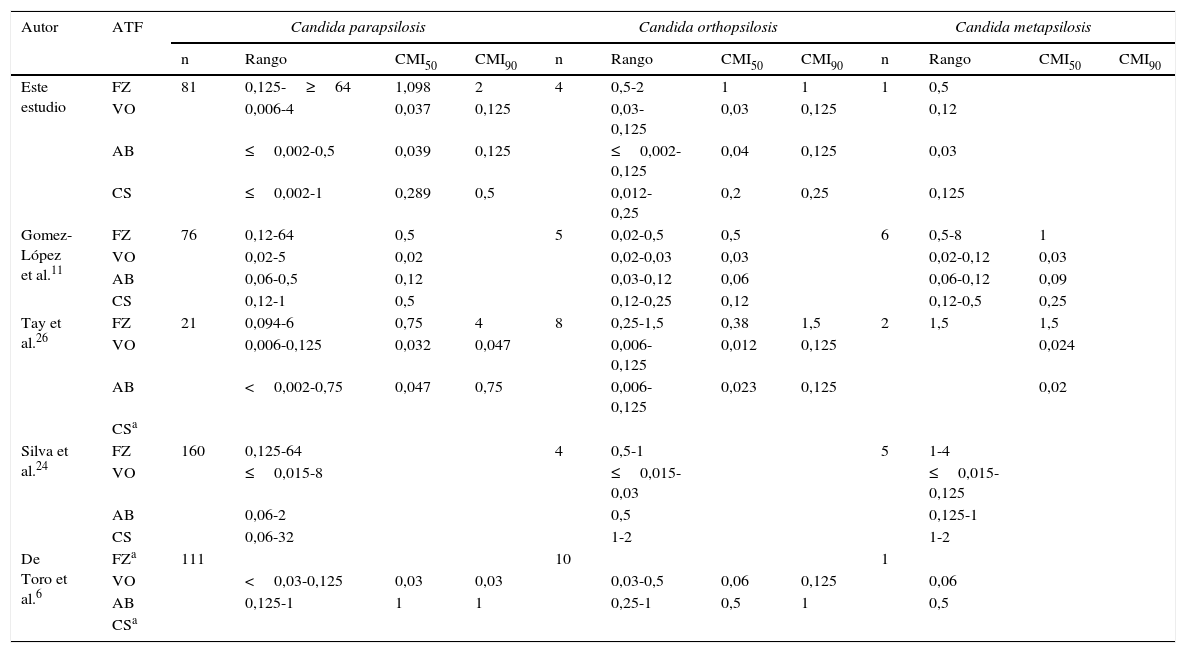
Existen pocas publicaciones que hayan informado acerca de los perfiles de sensibilidad de las tres especies, si bien los resultados obtenidos en este trabajo concuerdan con ellos (tabla 2); ello incluye la ausencia de análisis comparativos debido al escaso número de aislamientos de C. orthopsilosis y C. metapsilosis6,11,24,26,27. La estandarización existente entre los métodos que se utilizan actualmente para la evaluación de la sensibilidad a los antifúngicos, como los desarrollados por el Comité Europeo de Pruebas de Sensibilidad a los Antibióticos (European Committee on Antibiotic Susceptibility Testing) y el Clinical and Laboratory Standards Institute, permiten la comparación de los resultados obtenidos en este trabajo con los de otras series. Se ha demostrado que el Etest® es una técnica sencilla, rápida, económica y fácil de implementar en un laboratorio de microbiología de rutina, cuyos resultados son comparables a los obtenidos por los métodos de referencia1,4,9,19,22.
Número de aislamientos, rango de sensibilidad, CMI50 y CMI90 frente a los cuatro antifúngicos ensayados y resultados de otras investigaciones
| Autor | ATF | Candida parapsilosis | Candida orthopsilosis | Candida metapsilosis | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| n | Rango | CMI50 | CMI90 | n | Rango | CMI50 | CMI90 | n | Rango | CMI50 | CMI90 | ||
| Este estudio | FZ | 81 | 0,125-≥64 | 1,098 | 2 | 4 | 0,5-2 | 1 | 1 | 1 | 0,5 | ||
| VO | 0,006-4 | 0,037 | 0,125 | 0,03-0,125 | 0,03 | 0,125 | 0,12 | ||||||
| AB | ≤0,002-0,5 | 0,039 | 0,125 | ≤0,002-0,125 | 0,04 | 0,125 | 0,03 | ||||||
| CS | ≤0,002-1 | 0,289 | 0,5 | 0,012-0,25 | 0,2 | 0,25 | 0,125 | ||||||
| Gomez-López et al.11 | FZ | 76 | 0,12-64 | 0,5 | 5 | 0,02-0,5 | 0,5 | 6 | 0,5-8 | 1 | |||
| VO | 0,02-5 | 0,02 | 0,02-0,03 | 0,03 | 0,02-0,12 | 0,03 | |||||||
| AB | 0,06-0,5 | 0,12 | 0,03-0,12 | 0,06 | 0,06-0,12 | 0,09 | |||||||
| CS | 0,12-1 | 0,5 | 0,12-0,25 | 0,12 | 0,12-0,5 | 0,25 | |||||||
| Tay et al.26 | FZ | 21 | 0,094-6 | 0,75 | 4 | 8 | 0,25-1,5 | 0,38 | 1,5 | 2 | 1,5 | 1,5 | |
| VO | 0,006-0,125 | 0,032 | 0,047 | 0,006-0,125 | 0,012 | 0,125 | 0,024 | ||||||
| AB | <0,002-0,75 | 0,047 | 0,75 | 0,006-0,125 | 0,023 | 0,125 | 0,02 | ||||||
| CSa | |||||||||||||
| Silva et al.24 | FZ | 160 | 0,125-64 | 4 | 0,5-1 | 5 | 1-4 | ||||||
| VO | ≤0,015-8 | ≤0,015-0,03 | ≤0,015-0,125 | ||||||||||
| AB | 0,06-2 | 0,5 | 0,125-1 | ||||||||||
| CS | 0,06-32 | 1-2 | 1-2 | ||||||||||
| De Toro et al.6 | FZa | 111 | 10 | 1 | |||||||||
| VO | <0,03-0,125 | 0,03 | 0,03 | 0,03-0,5 | 0,06 | 0,125 | 0,06 | ||||||
| AB | 0,125-1 | 1 | 1 | 0,25-1 | 0,5 | 1 | 0,5 | ||||||
| CSa | |||||||||||||
AB: anfotericina B; ATF: antifúngicos; CMI50: concentración que inhibe el 50% de los aislamientos; CMI90: concentración que inhibe el 90% de los aislamientos; CS: caspofungina; FZ: fluconazol; VO: voriconazol.
Todos los valores se expresan en μg/ml.
Existen en la literatura opiniones encontradas acerca de la utilidad para el laboratorio clínico de la discriminación molecular de las tres especies, basadas en las ligeras diferencias existentes en sus perfiles de sensibilidad a los antifúngicos6,11. Aunque las diferencias son sutiles, los datos obtenidos en este estudio evidencian que C. orthopsilosis y C. metapsilosis son más sensibles a AB y CS que C. parapsilosis; este hecho puede tener relevancia clínica e influir en las decisiones terapéuticas, sobre todo en nuestro país, según los estudios nacionales realizados5,6,8,15,17.
La relevancia clínica de la resistencia cruzada entre los azoles ha sido informada en series de casos de candidemias. Se ha descrito que C. parapsilosis puede presentar sensibilidad reducida o resistencia a FZ y VO20, resultados que concuerdan con los obtenidos en este estudio, que a su vez implican la necesidad de continuar con la vigilancia de casos de candidemias y el uso de VO, sobre todo cuando es precedido por tratamientos prolongados con FZ.
Aunque los métodos moleculares no se encuentran disponibles de forma rutinaria en los laboratorios de diagnóstico microbiológico, la separación de las tres especies del CCP puede realizarse de forma sencilla mediante la utilización del análisis del fragmento SADH mediante enzimas de restricción25. Recomendamos este método como una alternativa para la caracterización molecular, ya que los métodos bioquímicos y morfológicos no poseen suficiente sensibilidad para lograr la discriminación.
En conclusión, los resultados obtenidos en este trabajo aportan por primera vez en Venezuela información importante sobre la distribución de aislamientos del CCP en episodios de candidemias, y apoyan la necesidad de continuar con los programas de vigilancia e incluir la discriminación molecular de las especies del complejo y la realización de pruebas de sensibilidad a los antifúngicos. Estos resultados muestran también que pueden existir sutiles diferencias especie-específicas entre las CMI encontradas en los ensayos de sensibilidad a los antifúngicos en el CCP, particularmente para AB y CS, que pudieran tener relevancia clínica y posibilitarían orientar de forma más específica la terapia antifúngica.
Conflicto de interesesNo existe ningún conflicto de intereses por parte de los autores en esta investigación.
Al Dr. Geber Peña por contribuir con los reactivos para las pruebas moleculares.