Las mucormicosis son infecciones generalmente agudas, angioinvasivas, que provocan necrosis difusas no supurantes y gran destrucción tisular. Representan el 1,6% de todas las infecciones fúngicas invasivas, y predominan en pacientes inmunodeprimidos con factores de riesgo. Su incidencia se ha incrementado de forma significativa, incluso en pacientes sin inmunodeficiencias.
A propósito de un caso de mucormicosis diseminada producida por Rhizomucor pusillus en un paciente joven sin inmunodeficiencias conocidas, hemos realizado una revisión bibliográfica de los casos de mucormicosis en pacientes adultos sin inmunodeficiencias reportados en PubMed, según sus principales localizaciones anatómicas y con referencia especial a los casos de mucormicosis diseminadas.
Se revisan los principales factores de riesgo y la patogenia de la enfermedad, las formas clínicas de presentación y sus posibilidades diagnósticas, incidiendo en las técnicas de diagnóstico precoz, y la terapia actual disponible, discutiendo la indicación del tratamiento de combinación de antifúngicos y el pronóstico. Además, se revisa la taxonomía actual del género Mucor y su clasificación.
Mucormycosis is usually an acute angioinvasive infections, which leads to non-suppurative necrosis and significant tissue damage. It represents 1.6% of all the invasive fungal infections and predominates in immunosuppressed patients with risk factors. Incidence has been significantly increased even in immunocompetent patients.
Due to finding a case of disseminated mucormycosis caused by Rhizomucor pusillus in a young immunocompetent patient, a systematic review was carried out of reported cases in PubMed of mucormycosis in immunocompetent adults according to the main anatomic locations, and especially in disseminated cases.
A review of the main risk factors and pathogenicity, clinical manifestations, techniques of early diagnosis, current treatment options, and prognosis is presented. Taxonomy and classification of the genus Mucor has also been reviewed.
Las infecciones fúngicas invasivas han emergido en las últimas décadas como causa principal de enfermedad, e inciden especialmente sobre pacientes inmunodeprimidos o con enfermedades subyacentes o concomitantes graves62.
Las mucormicosis son infecciones poco frecuentes en el ser humano, suponen el 1,6% de todas las infecciones fúngicas invasivas5, y aunque aparecen de forma esporádica son la cuarta infección fúngica sistémica tras la candidiasis, la aspergilosis y la criptococosis. Tienen una prevalencia aproximada 10 veces menor que la de la aspergilosis y 50-100 veces menor que la de la candidiasis5,67, aunque representan el 8-13% de todas las infecciones fúngicas encontradas en las autopsias61.
La incidencia de las mucormicosis varía dependiendo del área geográfica y del periodo de estudio5,9,67,77,81. En España en 2005 era de 0,43 casos por millón de habitantes y de 0,62 casos por cada 100.000 admisiones hospitalarias89. En Francia aumentó desde 0,7 casos en 1997 a 1,2 casos por millón de habitantes en 200610; y en Bélgica, la incidencia anual se multiplicó por 10 en una década72.
La importancia actual de las mucormicosis se basa en dos aspectos: el incremento de casos reportados en los últimos años, por lo que han de ser consideradas infecciones emergentes, y su elevada mortalidad global (30-60%) que alcanza hasta el 58-100% en los casos de mucormicosis diseminadas9,10,70,80.
Las mucormicosis son infecciones generalmente agudas, angioinvasivas, que provocan necrosis difusas no supurantes y gran destrucción tisular. Se han descrito seis formas de presentación clínica basadas en su localización anatómica: 1) rino-órbito-cerebral, 2) pulmonar, 3) cutánea, 4) abdomino-pélvica o gastro-intestinal, 5) diseminada, y 6) una miscelánea de otras formas (endocarditis, osteomielitis, etc.).
La forma clínica de presentación y el pronóstico están estrechamente relacionados con los factores de riesgo7,80,83,85. Estas infecciones aparecen fundamentalmente en pacientes inmunodeprimidos71, aunque también pueden producirse en pacientes sin inmunodeficiencias, generalmente como formas de presentación localizada cutáneas tras traumatismos. Pero se han descrito casos de presentaciones rino-cerebrales23,41, pulmonares1,48, renales35, digestivas20,76 u óseas25. Sin embargo, en la literatura médica, existen muy pocos casos publicados de mucormicosis diseminadas en pacientes sin inmunodeficiencias y sin factores de riesgo94.
Revisamos estas infecciones a propósito de un caso de mucormicosis diseminada producida por Rhizomucor pusillus en un paciente joven, sin factores de riesgo conocidos de inmunodepresión, tras sufrir un traumatismo cráneo-facial leve. En el caso presentado64, el intervalo de tiempo desde el traumatismo hasta el momento del diagnóstico de las lesiones dérmicas fue de 21 días aproximadamente, y el curso clínico fue muy prolongado y complicado por las lesiones concurrentes: perforación del tabique nasal y gran destrucción tisular nasal, graves secuelas cerebrales secundarias a múltiples infartos cerebrales fronto-témporo-parietales, perforaciones gastro-intestinales que requirieron reintervenciones quirúrgicas y donde se confirmó la diseminación de la mucormicosis, y lesiones pulmonares bilaterales y cavitadas en coinfección con Aspergillus niger, que provocaron episodios de neumotórax recidivante.
R. pusillus ha sido considerado un saprobio termófilo y es utilizado en la industria del queso. La incidencia de R. pusillus como agente etiológico de mucormicosis es baja (<5%)29, y aunque tiene un bajo potencial patógeno, posiblemente mutaciones de sus factores de virulencia (proteasas) provocan la enfermedad y mayor predisposición a la diseminación hematógena69. La mayoría de los casos de mucormicosis por R. pusillus descritos en personas presentaron una forma clínica pulmonar o diseminada29,69,70, pero no hemos encontrado en la bibliografía formas diseminadas por R. pusillus en pacientes sin inmunodeficiencias.
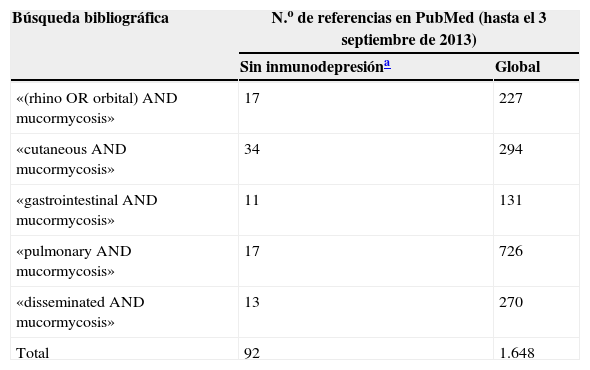
Material y métodosLos casos de mucormicosis publicados están muy dispersos en las bases de datos bibliográficas, lo cual complica la realización de búsquedas sistemáticas. Se ha realizado una búsqueda bibliográfica en PubMed de los casos publicados de mucormicosis en pacientes sin inmunodeficiencias según sus principales localizaciones anatómicas (tabla 1) y de los casos de mucormicosis diseminadas (tabla 2). Se seleccionaron aquellos casos sin enfermedades subyacentes y sin otros factores de riesgo que no fueran traumatismos o actividades cotidianas, descartándose los casos de pacientes con diabetes, enfermedades crónicas o antecedentes de consumo de drogas.
Número de referencias reportadas en PubMed de casos de mucormicosis en pacientes adultos sin inmunodeficiencias conocidas según su localización anatómica o forma de presentación
| Búsqueda bibliográfica | N.o de referencias en PubMed (hasta el 3 septiembre de 2013) | |
|---|---|---|
| Sin inmunodepresióna | Global | |
| «(rhino OR orbital) AND mucormycosis» | 17 | 227 |
| «cutaneous AND mucormycosis» | 34 | 294 |
| «gastrointestinal AND mucormycosis» | 11 | 131 |
| «pulmonary AND mucormycosis» | 17 | 726 |
| «disseminated AND mucormycosis» | 13 | 270 |
| Total | 92 | 1.648 |
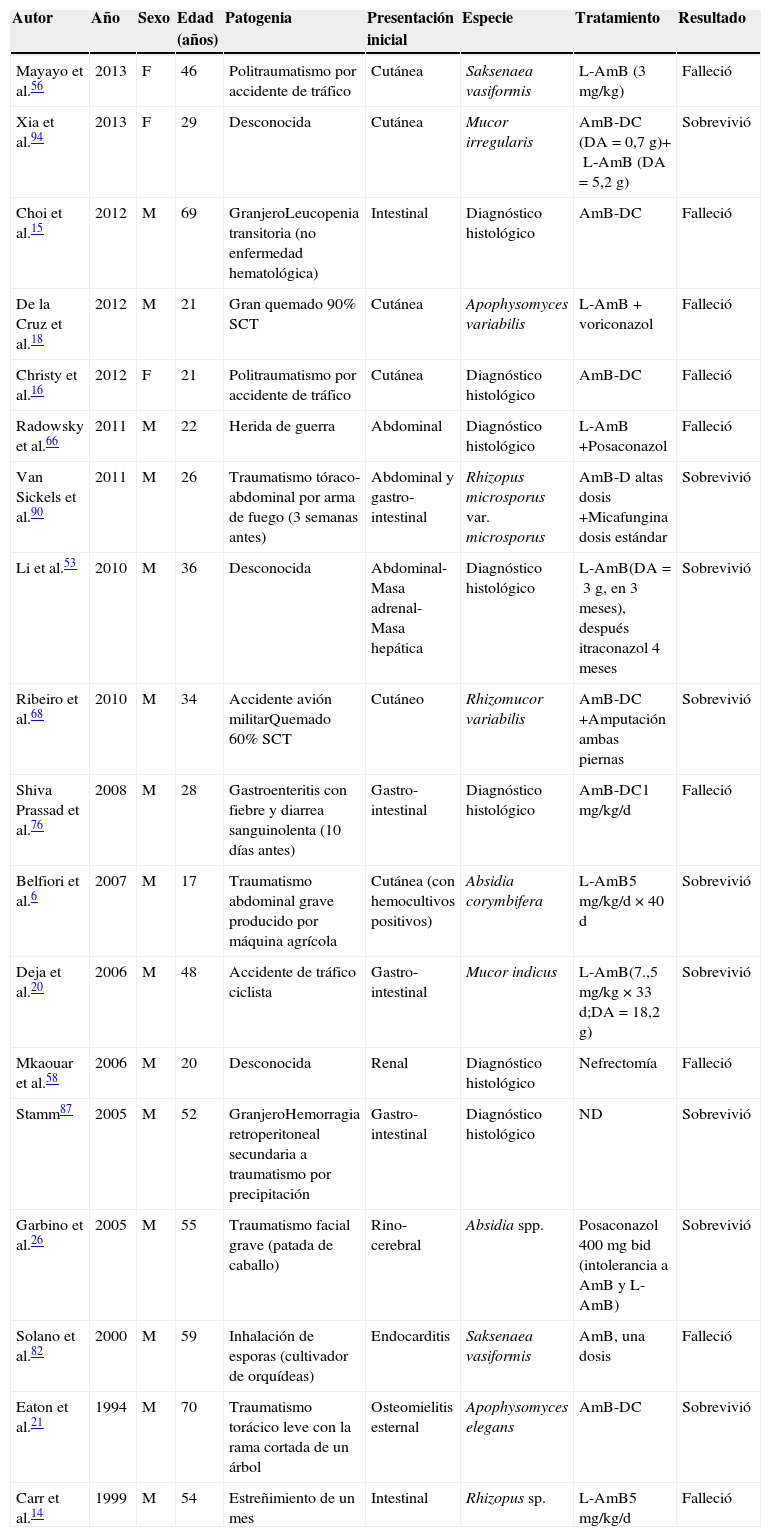
Mucormicosis diseminadas en pacientes sin inmunodeficiencias
| Autor | Año | Sexo | Edad (años) | Patogenia | Presentación inicial | Especie | Tratamiento | Resultado |
|---|---|---|---|---|---|---|---|---|
| Mayayo et al.56 | 2013 | F | 46 | Politraumatismo por accidente de tráfico | Cutánea | Saksenaea vasiformis | L-AmB (3mg/kg) | Falleció |
| Xia et al.94 | 2013 | F | 29 | Desconocida | Cutánea | Mucor irregularis | AmB-DC (DA=0,7g)+L-AmB (DA=5,2g) | Sobrevivió |
| Choi et al.15 | 2012 | M | 69 | GranjeroLeucopenia transitoria (no enfermedad hematológica) | Intestinal | Diagnóstico histológico | AmB-DC | Falleció |
| De la Cruz et al.18 | 2012 | M | 21 | Gran quemado 90% SCT | Cutánea | Apophysomyces variabilis | L-AmB+voriconazol | Falleció |
| Christy et al.16 | 2012 | F | 21 | Politraumatismo por accidente de tráfico | Cutánea | Diagnóstico histológico | AmB-DC | Falleció |
| Radowsky et al.66 | 2011 | M | 22 | Herida de guerra | Abdominal | Diagnóstico histológico | L-AmB+Posaconazol | Falleció |
| Van Sickels et al.90 | 2011 | M | 26 | Traumatismo tóraco-abdominal por arma de fuego (3 semanas antes) | Abdominal y gastro-intestinal | Rhizopus microsporus var. microsporus | AmB-D altas dosis+Micafungina dosis estándar | Sobrevivió |
| Li et al.53 | 2010 | M | 36 | Desconocida | Abdominal- Masa adrenal- Masa hepática | Diagnóstico histológico | L-AmB(DA=3g, en 3 meses), después itraconazol 4 meses | Sobrevivió |
| Ribeiro et al.68 | 2010 | M | 34 | Accidente avión militarQuemado 60% SCT | Cutáneo | Rhizomucor variabilis | AmB-DC+Amputación ambas piernas | Sobrevivió |
| Shiva Prassad et al.76 | 2008 | M | 28 | Gastroenteritis con fiebre y diarrea sanguinolenta (10 días antes) | Gastro-intestinal | Diagnóstico histológico | AmB-DC1mg/kg/d | Falleció |
| Belfiori et al.6 | 2007 | M | 17 | Traumatismo abdominal grave producido por máquina agrícola | Cutánea (con hemocultivos positivos) | Absidia corymbifera | L-AmB5mg/kg/d×40d | Sobrevivió |
| Deja et al.20 | 2006 | M | 48 | Accidente de tráfico ciclista | Gastro-intestinal | Mucor indicus | L-AmB(7.,5mg/kg×33d;DA=18,2g) | Sobrevivió |
| Mkaouar et al.58 | 2006 | M | 20 | Desconocida | Renal | Diagnóstico histológico | Nefrectomía | Falleció |
| Stamm87 | 2005 | M | 52 | GranjeroHemorragia retroperitoneal secundaria a traumatismo por precipitación | Gastro-intestinal | Diagnóstico histológico | ND | Sobrevivió |
| Garbino et al.26 | 2005 | M | 55 | Traumatismo facial grave (patada de caballo) | Rino-cerebral | Absidia spp. | Posaconazol 400mg bid (intolerancia a AmB y L-AmB) | Sobrevivió |
| Solano et al.82 | 2000 | M | 59 | Inhalación de esporas (cultivador de orquídeas) | Endocarditis | Saksenaea vasiformis | AmB, una dosis | Falleció |
| Eaton et al.21 | 1994 | M | 70 | Traumatismo torácico leve con la rama cortada de un árbol | Osteomielitis esternal | Apophysomyces elegans | AmB-DC | Sobrevivió |
| Carr et al.14 | 1999 | M | 54 | Estreñimiento de un mes | Intestinal | Rhizopus sp. | L-AmB5mg/kg/d | Falleció |
AmB-DC: anfotericina B desoxicolato; DA: dosis acumulada; F: femenino; L-AmB: anfotericina B liposómica; M: masculino; ND: no determinado; SCT: superficie corporal total.
También se revisó la bibliografía en lo referente a los factores de riesgo, patogenia y diagnóstico de las diversas formas de presentación, con especial interés en los casos de pacientes sin inmunodeficiencias o sin factores de riesgo conocidos de inmunodepresión, así como el tratamiento de las formas generalizadas o diseminadas.
PatogeniaLas mucormicosis aparecen generalmente en pacientes de riesgo, pacientes inmunodeprimidos con factores de riesgo predisponentes71. Entre estos se incluyen pacientes con hemopatías malignas (leucemias, linfomas u otros tumores sólidos o pacientes trasplantados de médula ósea) y neutropenia posquimioterapia46,47,60, pacientes con insuficiencia renal crónica y sobrecarga de hierro o en tratamiento con deferoxamina12, pacientes con diabetes mellitus mal controlada, y pacientes con enfermedades inmunodepresoras, con trasplante de órgano sólido o en tratamiento con inmunosupresores50,51. También se han descrito mucormicosis en neonatos, en pacientes malnutridos, usuarios de drogas, pacientes con traumatismos o quemados.
Habitualmente existe algún factor de riesgo que predispone a la enfermedad, aunque se ha incrementado el número de casos publicados de pacientes sin factores de riesgo conocidos o aparentes, o pacientes con estados de inmunodeficiencia ocultos20,82, frecuentemente relacionados con traumatismos2,4,22,56,90; estos episodios suponen alrededor del 20% de todos los casos de mucormicosis29,69. En estos pacientes se han de descartar factores de riesgo frecuentes como diabetes, discrasias sanguíneas (hemograma y punción medular), antecedentes de consumo de drogas, y alteraciones inmunológicas (factores del complemento, distribución de inmunoglobulinas, poblaciones linfocitarias).
La puerta de entrada habitual de los mucorales es la vía aérea, por aspiración de conidias del suelo, o a través de traumatismos que sobrepasan la barrera mucocutánea. También pueden penetrar por vía digestiva tras la colonización de alimentos (granos) o materia orgánica; se han publicado casos de infecciones por agua contaminada68 o infecciones nosocomiales por contaminación ambiental o instrumental54.
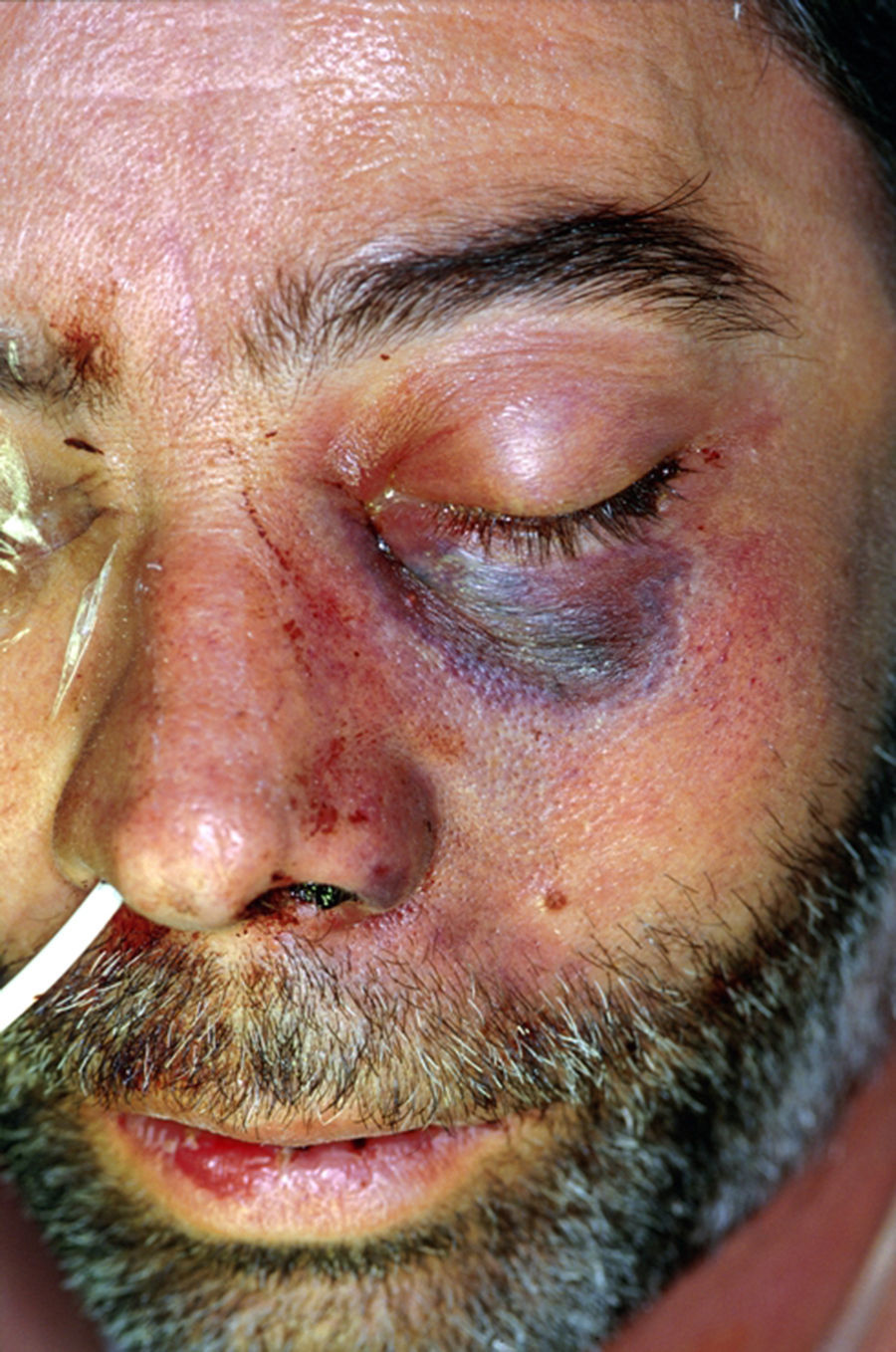
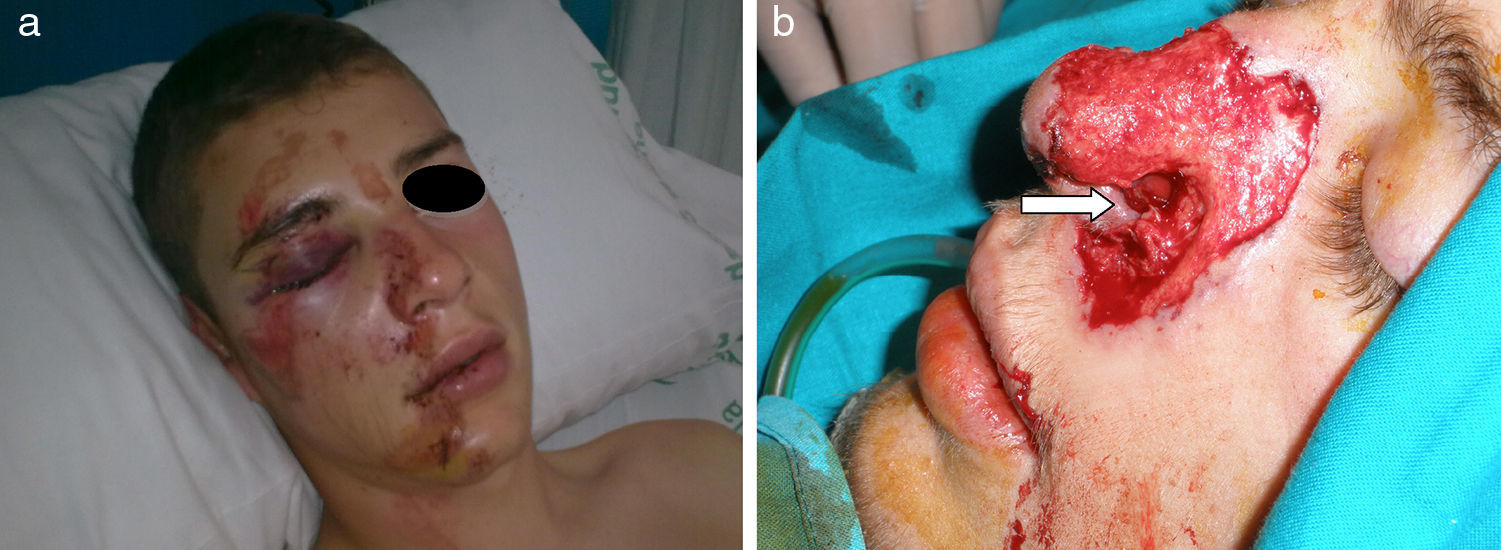
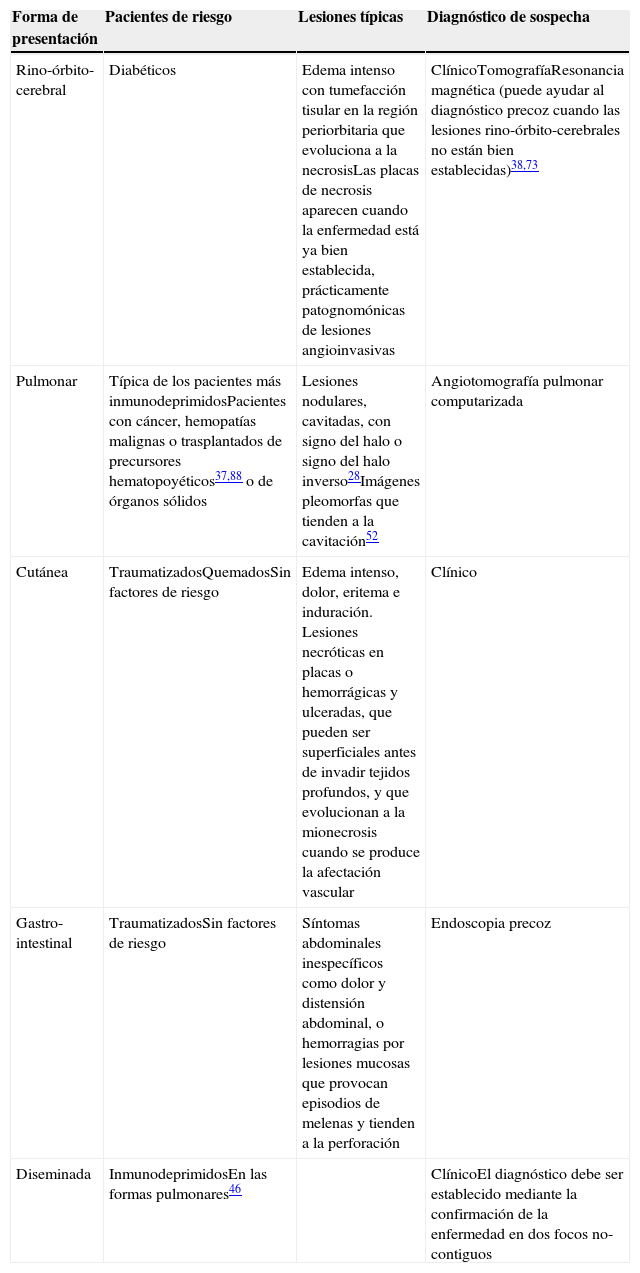
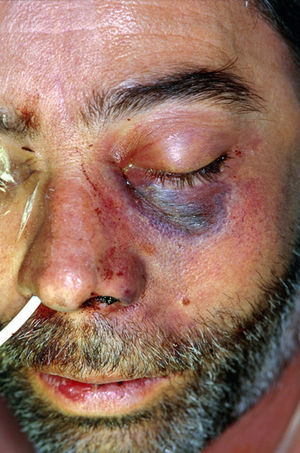
Clínica y diagnóstico de las mucormicosisLa forma clínica de presentación está relacionada con el perfil de riesgo de los pacientes, con su grado de inmunodepresión y con factores de riesgo concomitantes. La localización anatómica condicionará el pronóstico70,80. Es habitual la existencia de un periodo de latencia, de 2-4 semanas hasta el comienzo de los síntomas, preciso para la germinación de las conidias aspiradas o inoculadas durante el traumatismo y la invasión de las hifas4,59,65,90. Se han publicado casos de apariciones mucho más tardías, dado que las conidias de algunos hongos son marcadamente termófilas y permanecen viables a la temperatura corporal. También se ha demostrado en algunos zigomicetos la formación de biofilms78 que les permitiría persistir durante más tiempo. Durante este intervalo de latencia es frecuente la aparición de infecciones intercurrentes que hacen el curso evolutivo complejo. Las lesiones cutáneas necróticas en placas (fig. 1) o hemorrágicas y ulceradas aparecen cuando la enfermedad está ya bien establecida y son prácticamente patognomónicas de lesiones angioinvasivas, pero son tardías. Previamente aparece intenso edema y tumefacción tisular, aunque la sospecha clínica es difícil en pacientes no inmunodeprimidos que han sufrido accidentes de tráfico, y a veces no graves o con escasa destrucción cutánea (fig. 2). Las mucormicosis cutáneas son un problema particular en pacientes quemados, y se caracterizan por fiebre, eritema, edema intenso, dolor e induración.
La sospecha clínica de mucormicosis en pacientes de riesgo es obligada (tabla 3). El diagnóstico clínico de sospecha es el factor de mayor impacto sobre la supervivencia del paciente, supone el tratamiento anticipado a la presentación de formas diseminadas y por ello está asociado a mayor supervivencia.
Clínica y diagnóstico de sospecha de las mucormicosis
| Forma de presentación | Pacientes de riesgo | Lesiones típicas | Diagnóstico de sospecha |
|---|---|---|---|
| Rino-órbito-cerebral | Diabéticos | Edema intenso con tumefacción tisular en la región periorbitaria que evoluciona a la necrosisLas placas de necrosis aparecen cuando la enfermedad está ya bien establecida, prácticamente patognomónicas de lesiones angioinvasivas | ClínicoTomografíaResonancia magnética (puede ayudar al diagnóstico precoz cuando las lesiones rino-órbito-cerebrales no están bien establecidas)38,73 |
| Pulmonar | Típica de los pacientes más inmunodeprimidosPacientes con cáncer, hemopatías malignas o trasplantados de precursores hematopoyéticos37,88 o de órganos sólidos | Lesiones nodulares, cavitadas, con signo del halo o signo del halo inverso28Imágenes pleomorfas que tienden a la cavitación52 | Angiotomografía pulmonar computarizada |
| Cutánea | TraumatizadosQuemadosSin factores de riesgo | Edema intenso, dolor, eritema e induración. Lesiones necróticas en placas o hemorrágicas y ulceradas, que pueden ser superficiales antes de invadir tejidos profundos, y que evolucionan a la mionecrosis cuando se produce la afectación vascular | Clínico |
| Gastro-intestinal | TraumatizadosSin factores de riesgo | Síntomas abdominales inespecíficos como dolor y distensión abdominal, o hemorragias por lesiones mucosas que provocan episodios de melenas y tienden a la perforación | Endoscopia precoz |
| Diseminada | InmunodeprimidosEn las formas pulmonares46 | ClínicoEl diagnóstico debe ser establecido mediante la confirmación de la enfermedad en dos focos no-contiguos |
El diagnóstico de la enfermedad puede ser microbiológico si existe crecimiento fúngico en muestras estériles. Las pruebas serológicas no han demostrado utilidad. El diagnóstico microbiológico es complicado porque los cultivos con frecuencia son negativos excepto en las muestras cutáneas. Los hemocultivos tienen escasa sensibilidad y el rendimiento del cultivo de biopsias de vías respiratorias es bajo (30%). El cultivo de un hongo filamentoso no septado en muestras no estériles no es un criterio diagnóstico de enfermedad19; en estos casos el diagnóstico de confirmación es histopatológico32. Por ello, ante la mínima sospecha clínica es obligada la biopsia inmediata de las lesiones. El examen microscópico directo es una técnica sencilla de realizar, rápida, sensible, de bajo costo y específica cuando se utiliza la tinción con blanco de calcoflúor.
El diagnóstico histológico suele ser más rápido que el microbiológico y también puede valorar la extensión de la enfermedad. En la práctica histológica diaria, los mucorales son identificados por la presencia de filamentos hialinos en forma de cintas, con hifas de paredes irregulares y de diámetro variable, aunque más anchos en comparación con otros hongos filamentosos hialinos. Las hifas crecen irregularmente ramificadas, en ángulos mayores de 45° que con frecuencia se describen como «en ángulo recto», y con ausencia o con muy escasos septos. Pueden ser visibles con las tinciones rutinarias de hematoxilina-eosina por sus prolongaciones eosinófilas en trombos o en tejidos necróticos, aunque generalmente requieren de tinciones específicas o procedimientos moleculares sobre tejidos frescos o fijados. La utilización de blanco de calcoflúor puede facilitar la observación de hifas cuando hay poca cantidad de muestra o cuando su concentración en la misma es baja. En el procesamiento de las muestras para diagnóstico histológico de las infecciones fúngicas se realizan habitualmente dos tinciones específicas: la técnica del ácido peryódico de Schiff y la técnica de Gomori-Grocott a base de metenamina de plata. La identificación de estos hongos también puede llevarse a cabo mediante técnicas inmunohistoquímicas44 y procedimientos moleculares que facilitan el diagnóstico sobre muestras biológicas y cultivos34,40,57,74,75. Distintos métodos de laboratorio para la detección y el diagnóstico de las mucormicosis han sido revisados por Guarner et al.32.
Las nuevas técnicas moleculares pueden ayudar de forma muy significativa al diagnóstico precoz17,45,57,92, y a la detección, identificación y diferenciación de diferentes hongos filamentosos95.
El cultivo de un hongo filamentoso en las muestras de biopsias sirve para realizar el diagnóstico etiológico y la identificación microbiológica, y es fundamental para establecer la sensibilidad a los antifúngicos. También es preciso para establecer el diagnóstico en los casos de infección fúngica mixta o combinada por hongos filamentosos (aspergilosis y mucormicosis), que pueden aparecer en pacientes intensamente inmunodeprimidos, pacientes con linfomas11 o trasplantados40 y, de forma excepcional, en pacientes sin inmunodeficiencias64.
El diagnóstico de las formas diseminadas, alrededor del 15-25% de los casos50,61, debe ser establecido mediante la confirmación de la enfermedad en dos focos no contiguos.
Taxonomía actualLa taxonomía de los hongos es compleja y cambiante36,55. La clasificación de los hongos se ha basado tradicionalmente en la morfología de sus estructuras fértiles, aunque en la actualidad la identificación de hongos patógenos se realiza mediante la identificación de secuencias de ácidos nucléicos por marcadores moleculares33,39,43. Los estudios moleculares del ADN ribosómico de distintas regiones genéticas3 y de pequeñas secuencias de ARN ribosómico49 son herramientas útiles en la identificación de las especies más comunes y clínicamente significativas, y han servido para la reclasificación filogenética de algunos elementos. Sin embargo, estas técnicas solo se utilizan en laboratorios de referencia.
«Zigomicosis» es el término que comprendía las infecciones causadas por los hongos del phylum Zygomycota, nombre este último no incluido en los sistemas taxonómicos. La taxonomía de los hongos se basaba en las similitudes morfológicas de sus estructuras reproductivas sexuales, reconociéndose tres clases: Phycomycetes, Ascomycetes y Basidiomycetes. La clase Phycomycetes fue eliminada y sus miembros fueron acomodados en otras subclases (Zygomycetes, Chytridiomycetes, Hypochytridiomycetes, Trichomycetes, y Oomycetes). Posteriormente, la clasificación fue modificada teniendo en cuenta aspectos ecológicos, del ciclo vital, de modos nutricionales, bioquímicos y de ultraestructura.
En la actualidad el reino Fungi se divide en dos subreinos: Dykaria, que agrupa las divisiones Ascomycota y Basidiomycota, y el llamado de los «Hongos basales», que agrupa al resto de los hongos30,31,33. El análisis filogenético molecular ha confirmado que el antiguo phylum Zygomycota sería polifilético y la taxonomía convencionalmente clasificada como Zygomycota ahora es distribuida entre el nuevo phylum Glomeromycota y 4 subphyla de incierta adscripción. El phylum Zygomycota contenía a los Mucorales, Entomophthorales, y ocho órdenes más, pero los primeros son tan distintos que fueron incluidos en dos subphyla separados: Mucoromycotina y Entomophthoromycotina, y que se equiparan con otros dos subphyla, Kickxellomycotina y Zoopagomycotina30,31,49. La subdivisión Mucoromycotina contiene tres órdenes (Endogonales, Mucorales, y Mortierellales), más de 60 géneros, y más de 300 especies. El orden Mucorales lo forman hongos filamentosos tubulares blancos con esporangios esféricos negros, y a las enfermedades producidas por estos hongos se optó por nombrarlas de manera específica «mucormicosis».
Los mucorales son hongos ubicuos de distribución universal. La mayoría son saprobios y su hábitat natural es la materia orgánica en descomposición. Crecen sobre sustratos en suelos, frutas y excrementos. Se encuentran con frecuencia sobre el pan mohoso, y en las patatas y frutas en putrefacción. A veces se aíslan como contaminantes o parásitos de la piel y el tubo digestivo de animales, en raíces de plantas y en hongos, y son causa de infecciones en animales (frecuente en bovinos) y en el ser humano. Dentro de este orden, predominan los géneros Rhizopus, Lichtheimia (anteriormente Absidia) y Mucor, que suponen el 70-80% en conjunto. Menos frecuentes son Rhizomucor, Cunninghamella, Saksenaea y otros mucorales3,29.
El cultivo de las muestras no requiere de medios especiales, crecen bien en agar glucosado de Sabouraud a 25-30°C, produciendo colonias algodonosas que cubren la superficie de la placa en pocos días. La incubación a 37°C produce un rendimiento 10 veces superior63. Siempre hay que descartar una posible contaminación de la muestra, puesto que los mucorales son contaminantes muy frecuentes en los laboratorios. En los casos de crecimiento de hongos filamentosos no septados, la identificación del género y la especie sigue siendo una tarea difícil y que consume tiempo, aunque las características morfológicas evaluadas por microbiólogos expertos en la identificación de hongos pueden proporcionar un alto nivel de precisión.
Tratamiento actualNo existe tratamiento estandarizado de las mucormicosis en pacientes no inmunodeprimidos. El tratamiento habitual se basa en la extrapolación de las guías terapéuticas en pacientes inmunodeprimidos13,24,79. Las conclusiones de la Conferencia Europea para el tratamiento de las infecciones en pacientes con leucemia (ECIL-3) recomiendan el abordaje global como primera línea de tratamiento de las mucormicosis (recomendación A-II) basado en los fármacos antifúngicos junto a la cirugía del foco y al control de los factores predisponentes79. El retraso en el tratamiento multiplica por ocho el riesgo de muerte92, por lo que la profilaxis o el tratamiento anticipado estarían indicados en pacientes de riesgo sin signos de infección pero con crecimiento de mucorales en cultivos de lugares no estériles, dada la extrema gravedad de los cuadros de mucormicosis invasiva.
El antifúngico de elección es la anfotericina B liposómica (AmB-L)24,79,86. No existe consenso en la dosificación de AmB-L, aunque en pacientes sin comorbilidades pueden tolerarse aceptablemente dosis de hasta 10-15mg/kg/día93. La dosis debe ser individualizada dependiendo de la gravedad de la infección y de las condiciones del paciente. Se recomienda la dosis inicial de 5-7,5mg/kg/día, intentando alcanzar la mayor dosis/día posible y una dosis acumulada superior a 10g. La cirugía debe ser lo más radical posible para disminuir de forma significativa la carga fúngica, erradicar la enfermedad y evitar la recidiva. La duración del tratamiento antifúngico también ha de individualizarse dependiendo de la forma clínica y de la respuesta al tratamiento.
Se han realizado tratamientos con combinación de antifúngicos, generalmente triazoles de tercera generación o candinas asociados a AmB-L, pero no existen estudios controlados y aleatorizados para determinar si la terapia de combinación con cualquiera de estas opciones es superior a la monoterapia con AmB-L. En la actualidad el uso de la terapia de combinación no está estandarizada, y su prescripción podría conllevar mayor frecuencia de efectos adversos para los pacientes, y un costo difícilmente justificable, si no demuestra su superioridad84.
Se han publicado casos de mucormicosis tratados con posaconazol y con candinas como agentes únicos o en combinación79,91, con factores estimuladores de colonias de neutrófilos27 y con los nuevos agentes quelantes del hierro (deferasirox y deferiprone) como terapia de rescate o adyuvante42, todos ellos con buenos resultados, aunque no existen datos suficientes para hacer actualmente una recomendación fuerte de uso, excepto retirar la deferoxamina en los casos prescritos y ser lo más restrictivo posible con las transfusiones de hematíes, ya que es preciso evitar el aporte de hierro al hongo como factor patogénico.
La mortalidad de las mucormicosis es muy elevada a pesar de conseguir un diagnóstico etiológico y un tratamiento adecuado. Las comorbilidades del paciente, las neoplasias activas, la neutropenia, los niveles de hierro y ferritina elevados, y el retraso o la mala respuesta inicial al tratamiento son factores independientes asociados a la mortalidad85,92. En los pacientes sin inmunodeficiencias o sin factores de riesgo de inmunodepresión se obtienen mejores resultados, oscilando la mortalidad global desde el 4,2% hasta el 35%10,70, dependiendo de la localización anatómica. El pronóstico es mejor en pacientes traumatizados y peor en quemados, pero el pronóstico de los pacientes sigue siendo sombrío cuando ya se ha producido la diseminación (mortalidad del 96%)70. Por ello, solo la sospecha clínica precoz, incluso en pacientes sin inmunodeficiencias, y las nuevas técnicas de imagen y de diagnóstico microbiológico8,37,57 podrán mejorar estos resultados clínicos.
ConclusiónLas mucormicosis son infecciones emergentes que aparecen predominantemente en pacientes inmunodeprimidos y con factores de riesgo, pero que pueden presentarse en pacientes sin inmunodeficiencias. Pueden tener un periodo de latencia prolongado hasta la aparición de la clínica relacionada con la infección fúngica, y el curso clínico puede estar jalonado de múltiples infecciones bacterianas concomitantes. Los estudios histológicos y microbiológicos son fundamentales para establecer el diagnóstico de certeza, la identificación del hongo y la sensibilidad a los antifúngicos, pero precisamos realizar técnicas radiológicas y procedimientos microbiológicos moleculares basados en la detección de los ácidos nucléicos fúngicos para el diagnóstico precoz.
El tratamiento debe ser global: cirugía radical del foco, eliminación de los factores predisponentes y uso de fármacos antifúngicos a dosis elevadas. El fármaco de elección es la AmB-L y se recomienda alcanzar una dosis total acumulada mayor de 10g. Actualmente no tenemos suficiente evidencia científica para recomendar terapias de combinación. El diagnóstico precoz y el tratamiento con AmB-L son los principales factores de éxito. A pesar de todo ello, las formas diseminadas tienen una mortalidad mayor del 80%, pero en pacientes sin inmunodeficiencias la supervivencia parece ser mayor.
AutoríaJCPL ha participado en la elaboración del manuscrito y siguientes revisiones, y en la revisión final.
APM, CPS, JCRA y MJLS han participado en la elaboración del manuscrito y la revisión final.
Conflicto de interesesLos autores declaran no tener conflictos de intereses.