La mucormicosis pulmonar es una infección oportunista rara con alta mortalidad causada por hongos Mucorales. Los más frecuentes son Rhizopus, Mucor, Lichtheimia y Rhizomucor.
Caso clínicoSe presenta el caso de una mujer de 56 años con diabetes mellitus tipo 2 y enfermedad renal crónica, receptora de un trasplante de riñón cadavérico dos años antes de su ingreso. Por este motivo recibió tratamiento inmunomodulador con timoglobulina, micofenolato de mofetilo, tacrolimus y prednisona. La paciente ingresó por un cuadro neumónico con tos, expectoración y disnea; una tomografía computarizada mostró una lesión cavitada en el lóbulo superior derecho. Con la sospecha de una aspergilosis pulmonar invasiva se comenzó un tratamiento antifúngico con voriconazol, sin mejoría. Se realizó una biopsia por aspiración con aguja fina, y en el cultivo de la misma creció Rhizomucor pusillus. La identificación se confirmó por PCR. A pesar del tratamiento con anfotericina B, la paciente presentó hemoptisis masiva incoercible, que provocó su fallecimiento.
ConclusionesLa mucormicosis pulmonar es una infección rara que suele ser fatal en receptores de trasplante renal con terapia antirrechazo. Los mucorales producen fenómenos trombóticos, necrosis y destrucción tisular, que provocaron en nuestra paciente una hemoptisis incoercible. Es importante un diagnóstico preciso que permita instaurar un tratamiento quirúrgico adecuado y la administración de anfotericina B.
Pulmonary mucormycosis is a rare opportunistic infection with high mortality that is caused by species of Mucorales. The most common species involved are Rhizopus, Mucor, Lichtheimia, and Rhizomucor.
Case reportA 56 year-old woman presented with a clinical history of diabetes mellitus type 2 and chronic renal disease. She underwent a cadaveric kidney transplantation two years before her admission, for which immunomodulating therapy with thymoglobulin, tacrolimus, mofetil-microphenolate and prednisone was established. The patient suffered a pneumonic process with cough, expectoration, and dyspnoea. The computed tomography scan showed a cavitation in the right upper lobe. With all these findings an invasive broncopulmonary aspergillosis was suspected and the patient began an antifungal treatment with voriconazole without improvement. Rhizomucor pusillus was isolated from a clinical specimen obtained by fine needle aspiration, and its identification was confirmed by PCR. After this finding amphotericin B was administered, but the patient had an uncontrolled haemoptysis and died.
ConclusionsPulmonary mucormycosis is a rare infection, usually fatal in kidney transplant recipients with anti-rejection therapy. Mucorales species usually produce thrombotic phenomena, associated with necrosis and parenchymal destruction that caused a fatal uncontrolled haemoptysis in our patient. Early diagnosis is important in order to perform any surgical treatment and to administer amphotericin B.
La mucormicosis (zigomicosis) es una micosis profunda o sistémica causada por hongos oportunistas del subfilo Mucoromycotina (anteriormente Zygomycetes), orden Mucorales; el género Rhizopus es el más común en estas infecciones11,16. La infección tiene lugar por la inhalación de esporangiosporas o por inoculación directa de los hongos en lesiones dérmicas o mucosas16. Los mucorales son angiotropos, lo que da lugar a infartos y trombosis en los órganos que afectan (piel, pulmón, mucosa nasal, oral y, en especial, cerebro). En pacientes inmunodeprimidos pueden diseminarse y provocar una alta mortalidad10,12,14,16. Un factor de riesgo para tener mucormicosis en países desarrollados son las enfermedades hematológicas malignas, con o sin trasplante de células madre, mientras que en países en desarrollo la diabetes descontrolada es el principal factor. Otros factores de importancia son la neutropenia grave crónica, el uso prolongado de corticosteroides, el trasplante, la prematuridad neonatal y la desnutrición4,6,10,14.
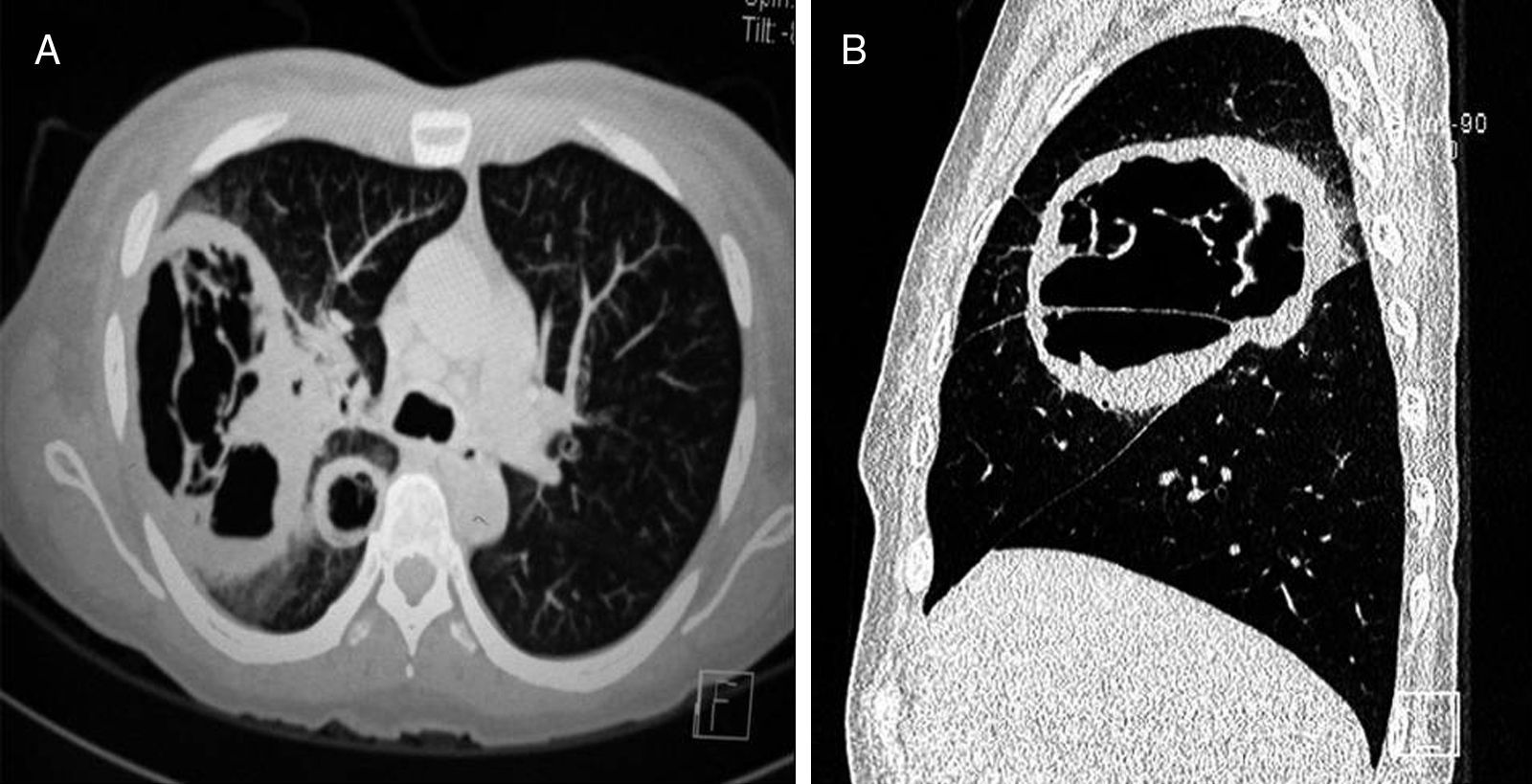
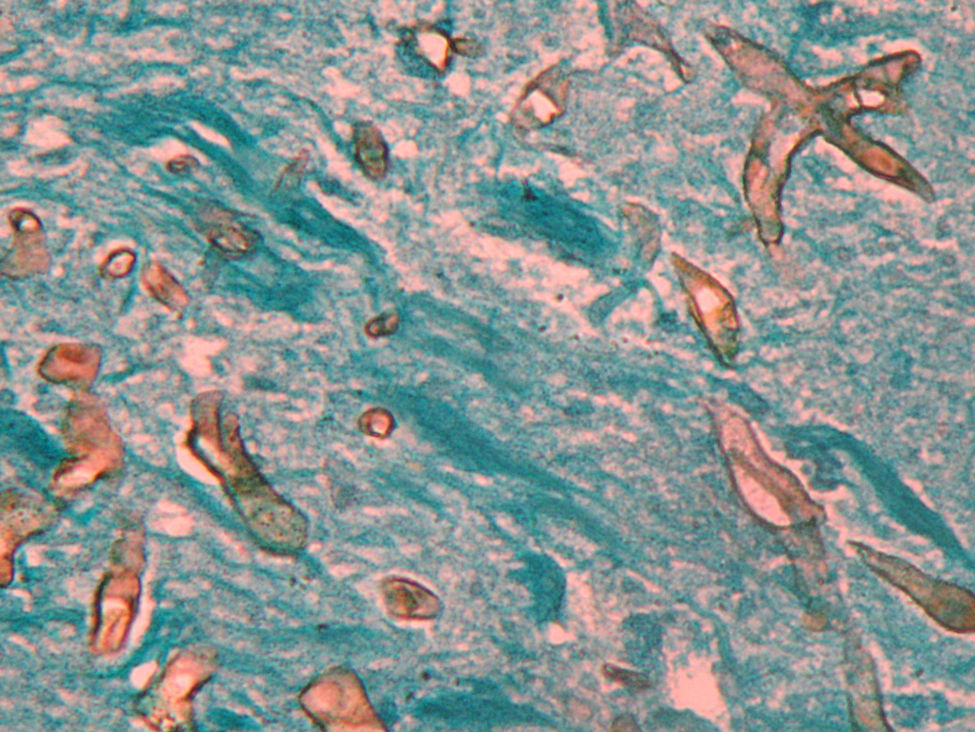
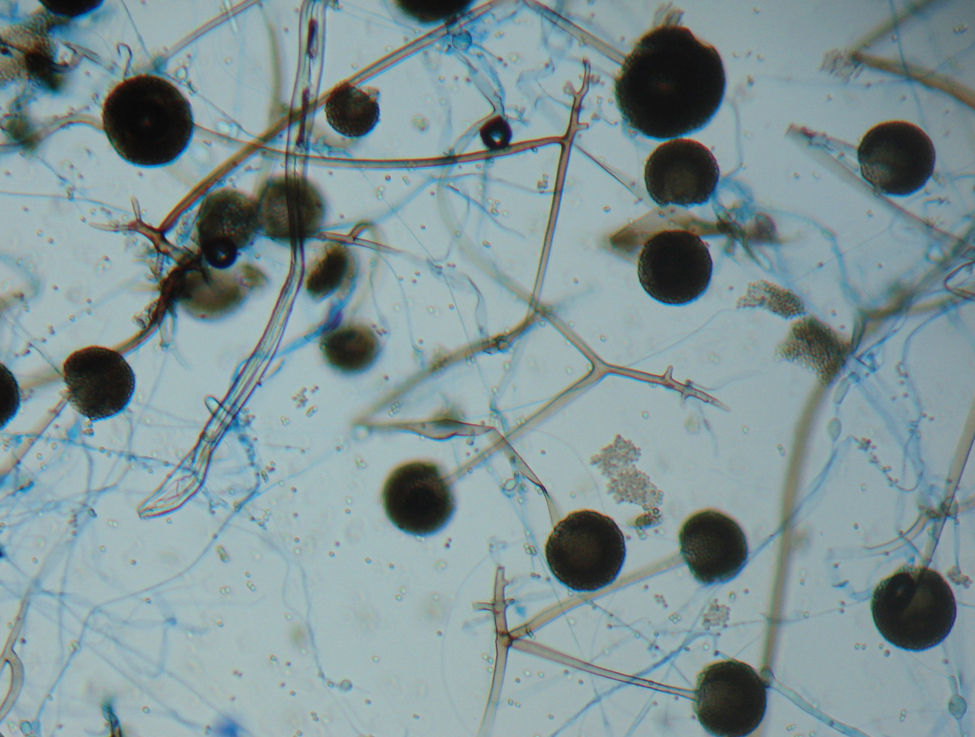
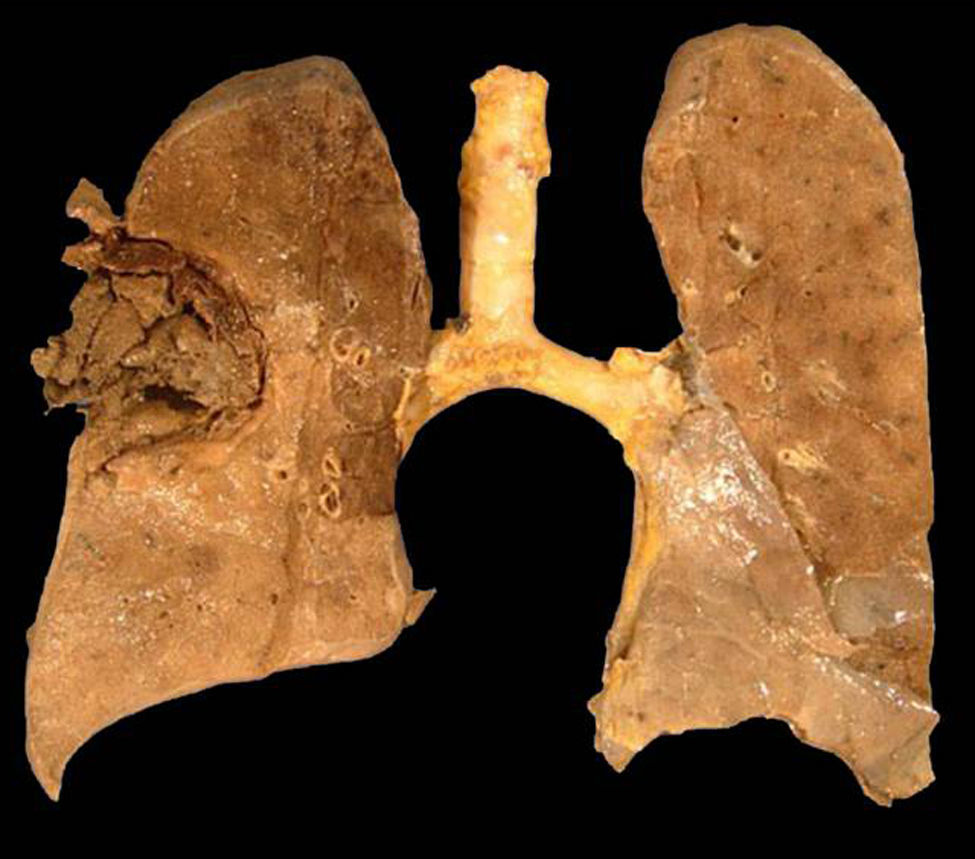
Caso clínicoPresentamos el caso de una mujer de 56 años con diabetes mellitus tipo 2 debido a enfermedad renal crónica, motivo por el cual se le realizó un trasplante renal de donante cadáver 20 meses antes de su ingreso. Inicialmente recibió terapia inmunomoduladora con timoglobulina (5mg/kg peso) durante dos meses, y como tratamiento de mantenimiento, micofenolato de mofetilo (1g/12h), tacrolimus (1g/12h) y prednisona (5mg/día). La paciente tenía un buen funcionamiento del riñón trasplantado (creatinina 0,9mg/dl) y un buen control glucémico (glucosa en ayuno 110-140mg/dl, parámetros normales en pacientes hospitalizados). La paciente fue hospitalizada con un síndrome febril, inicialmente sin foco aparente, que se trató con 1g de imipenem intravenoso cada 8h, durante 14 días, sin observarse mejoría alguna. La fiebre persistió y la paciente desarrolló posteriormente un cuadro neumónico con tos, escasa expectoración hialina y disnea de esfuerzo. En la radiografía de tórax se observó en el lóbulo superior derecho una lesión cavitada con nivel hidroaéreo, pared gruesa y bordes bien definidos. Con dichos hallazgos se realizó una broncoscopia y un lavado bronquial. En el procesado del lavado bronquial no se observaron bacilos ácido-alcohol resistentes, y tanto los cultivos para Mycobacterium tuberculosis (en medios líquido MGIT y Lowenstein-Jensen; 60 días de incubación) como para hongos (medio agar Sabouraud dextrosa y agar Sabouraud dextrosa+cloranfenicol; incubación durante 20 días) fueron negativos. Asimismo, los hemocultivos convencionales realizados fueron negativos para bacterias y hongos. Se realizó también la determinación de galactomanano sérico, cuyo resultado fue negativo (0,125 DO). Sin embargo, la tomografía axial computarizada mostraba la persistencia de la cavidad y sendas lesiones en los lóbulos superior y medio (figs. 1 y 2). Con todos estos datos se sospechó de una aspergilosis pulmonar (es la micosis pulmonar más frecuente) y se trató a la paciente con voriconazol (400mg/día) durante 10 días, sin observar mejoría clínica ni radiológica, además de persistir la cavidad con nivel hidroaéreo. Ante dicha evolución clínica, se decidió realizar una biopsia por aspiración con aguja fina; se obtuvo un líquido de aspecto purulento en el que se observaron al examen directo (KOH 10%) hifas gruesas, cenocíticas y ramificadas en ángulo recto. En el cultivo de esta muestra creció un hongo mucoral que fue identificado según su micromorfología como Rhizomucor pusillus. La identificación fue confirmada mediante PCR y secuenciación de dos regiones fúngicas no codificantes: ITS y D1/D2. Para esta identificación molecular se hizo primeramente una extracción de ADN mediante el kit Exgene Plant SV (GeneAll) a partir de un cultivo puro del hongo en caldo glucosado de Sabouraud. Con el ADN obtenido se amplificó por PCR estándar la región ITS mediante los cebadores ITS5 e ITS4, así como la región D1/D2 con los cebadores F63 y R635. Los dos productos de PCR obtenidos fueron purificados con el kit DNA Clean & Concentrator-5 (Zymo Research), para finalmente llevar a cabo su secuenciación por el método de Sanger. De acuerdo con el análisis realizado mediante el programa BLAST del GenBank, el aislamiento fue identificado como Rhizomucor pusillus, con una homología del 99,9%5 (figs. 3 y 4). Con la confirmación del diagnóstico se cambió el tratamiento a anfotericina B liposomal a una dosis de 250mg/día. La paciente, sin embargo, presentó hemoptisis masiva incoercible y falleció rápidamente, lo que impidió intentar un tratamiento de embolización de las arterias bronquiales. En la necropsia se observó en el pulmón derecho una amplia cavidad llena de coágulos con extensas áreas de destrucción tisular (fig. 3), si bien el riñón trasplantado no presentaba alteraciones.
La mucormicosis (zigomicosis) pulmonar (MP) es causada por diferentes especies de mucorales pertenecientes a los géneros Rhizopus, Lichtheimia, Mucor y Rhizomucor. En México la diabetes mellitus descontrolada es un factor asociado en más del 70% de los casos, especialmente con la forma rinocerebral11. La infección pulmonar es el resultado de la alteración de las defensas respiratorias asociadas a una neutropenia o disfunción ciliar inducida por quimioterapia. La neutropenia grave y prolongada es un factor de riesgo presente en el 15% de los casos de MP15. Los pacientes neutropénicos con neoplasias hematológicas y bajo quimioterapia, receptores de trasplante hematopoyético con tratamiento inmunosupresor antirrechazo, o tratados con deferoxamina constituyen otro grupo de alto riesgo11,12,14. Los pacientes con leucemia como enfermedad de base es otro grupo especialmente afectado.
Se ha descrito una mortalidad del 40-76% en sujetos con progresión local rápida debido a la marcada angioinvasión y posterior trombosis15. La hiperglucemia y los niveles de hierro elevados sobrerregulan la expresión de la proteína 78 regulada por glucosa, lo que promueve la invasión celular endotelial por un mecanismo dependiente de receptor6. La mucormicosis invasiva se caracteriza por el desarrollo rápido de necrosis tisular como resultado de la invasión vascular y la trombosis subsecuente7.
La incidencia de la enfermedad en receptores de trasplante renal es inferior, 0,2-1,2%, si bien suele ser de curso rápido y fatal en pacientes bajo terapia intensiva antirrechazo. La inmunosupresión crónica, el uso indiscriminado de antibióticos y la diabetes mellitus son factores de riesgo para presentar una mucormicosis, como ocurrió en este caso10. La MP tiene lugar, generalmente, en el primer año después del trasplante renal y su incidencia es de aproximadamente el 68%12. Este valor llega hasta el 80% en receptores de trasplante de órgano sólido en los primeros seis meses del trasplante10. Los síntomas de la MP son inespecíficos y similares a los de la aspergilosis7,10,11, y su presentación clínica depende del estado inmunitario del huésped5. Los estudios de imagen son inespecíficos e indistinguibles de la aspergilosis pulmonar; los hallazgos más frecuentes son áreas de consolidación, nódulos, cavitaciones, atelectasias, derrame pleural, linfadenopatía mediastinal o hiliar y engrosamiento traqueal posterior. El signo del «halo reverso» puede verse, si bien no estaba presente en nuestro caso. La presencia de más de 10 nódulos y derrame pleural puede tener valor diagnóstico3,5. La MP se localiza con más frecuencia en los lóbulos superiores (55-84% de los casos), y la enfermedad bilateral es común7.
El diagnóstico se basa en los estudios micológicos a partir del lavado bronquial o por aspiración con aguja fina de las lesiones, ambas como muestra para cultivo, debiendo confirmarse la identidad del microorganismo por PCR (espaciador ITS y regiones D1 y D2). Rhizomucor pusillus ha sido hallado previamente en formas pulmonares6,9. En caso de enfermedad cavitaria las muestras obtenidas por broncoscopia proporcionan mejor material de estudio5. En el examen histopatológico lo que más destaca es la invasión de hifas gruesas ramificadas con predominio de ángulos rectos, localizadas en vasos sanguíneos y trombosis11,12.
La mortalidad global de la MP es alta, y es mayor en pacientes con inmunosupresión grave10. El antimicótico más útil en casos de mucormicosis es la anfotericina B liposomal; la combinación de resección quirúrgica temprana y la terapia antimicótica incrementa de forma significativa la supervivencia, en comparación con la terapia antimicótica sola5,10,12,15. La duración de la terapia debe individualizarse; la desaparición de las alteraciones radiográficas, los cultivos negativos o la resolución del estado de inmunosupresión suelen determinar la duración del tratamiento15. Otros agentes antimicóticos como el voriconazol son menos efectivos y pueden favorecer la progresión de la enfermedad8,10. Se ha propuesto la combinación de anfotericina B con las equinocandinas o asociada al posaconazol, que tiene un mayor espectro antimicótico in vitro frente a la mayoría de los agentes etiológicos1,13. En un estudio reciente sobre las concentraciones mínimas inhibitorias de los principales mucorales, se reportó que la mayoría de las cepas de Rhizomucor pusillus son sensibles a la anfotericina B (0,125-0,5μg/ml) y al posaconazol (0,25-0,5μg/ml), lo que evidencia que esta es una adecuada combinación para infecciones por esta especie2.
Este caso es ilustrativo de la gravedad de la infección por Rhizomucor pusillus en pacientes con un riesgo asociado, como el de la paciente presentada aquí (trasplantada con riñón cadavérico y diabetes mellitus controlada), en la que la evolución de la enfermedad llevó a la formación de una cavidad compleja en el parénquima pulmonar y a su fallecimiento por una hemoptisis incoercible.