Los pacientes seropositivos para el virus de la inmunodeficiencia humana (VIH) presentan una elevada prevalencia de hepatopatía crónica terminal para los que el trasplante hepático supone la única terapéutica posible. El riesgo de infección fúngica en esta población puede ser muy elevado.
Caso clínicoSe presenta el curso clínico del periodo postoperatorio inicial de un paciente coinfectado por VIH y virus de la hepatitis C sometido a trasplante hepático. Se valoran las indicaciones de la profilaxis antifúngica, y los fármacos de elección en relación a su eficacia y perfil de seguridad. Se describe el tratamiento médico general y se comentan las posibles interacciones farmacocinéticas.
ConclusionesLa profilaxis antifúngica con anidulafungina ha demostrado ser eficaz y no ha presentado efectos adversos significativos en un paciente de alto riesgo de infección fúngica y múltiples factores de riesgo de interacciones medicamentosas.
Seropositive human immunodeficiency virus (HIV) patients have a high prevalence of chronic liver disease for which liver transplantation is the only possible treatment. Risk of fungal infection in this population may be very high.
Case reportWe describe the clinical course of the early postoperative period in a patient coinfected with HIV and hepatitis C virus undergoing liver transplantation. We discuss antifungal prophylaxis indications and drugs of choice in relation to their efficacy and safety profile. Other medical treatments are described, as well as possible pharmacokinetic interactions.
ConclusionsAntifungal prophylaxis with anidulafungin has proven effective and has presented no significant adverse effects on a patient at high risk of fungal infection and multiple risk factors for drug interactions.
Paciente varón de 46 años, que tras ser sometido a trasplante hepático ingresó en el Servicio de Medicina Intensiva para tratamiento postoperatorio. Tenía antecedentes de cirrosis hepática de etiología viral (virus de la hepatitis C –VHC- genotipo 1b) con coinfección por el virus de la inmunodeficiencia humana (VIH). Había recibido tratamiento con interferón pegilado y ribavirina, con respuesta viral sostenida, y también tratamiento antirretroviral de gran actividad con atazanavir, ritonavir y efavirenz por resistencias virológicas.
Un año antes había presentado 3 lesiones focales compatibles con carcinoma hepatocelular multifocal que fueron tratadas en 2 sesiones de quimioembolización transarterial, sin deterioro de la función hepatocelular ni episodios de descompensaciones clínicas. En el momento del trasplante, el paciente se encontraba en estadio A-5 de Child-Pugh, y MELD de 8, presentaba 315 linfocitos CD4/μl y no mostraba replicación viral (carga viral negativa por PCR-VIH). La serología (detección de anticuerpos IgG) de Toxoplasma era negativa. El paciente tampoco tenía alergias medicamentosas conocidas.
Se realizó el trasplante hepático mediante técnica de preservación de la vena cava, sin complicaciones intraoperatorias y sin necesidad de transfusión de hemoderivados durante la intervención quirúrgica. Tras la revascularización, el hígado presentaba buen aspecto y se apreciaba emisión de bilis. El injerto procedía de una mujer de 32 años, de constitución normal, fallecida por hemorragia intracerebral, y que había presentado una bacteriemia por cocos grampositivos coagulasa-negativos, por lo que se inició una profilaxis antibiótica en el receptor con vancomicina.
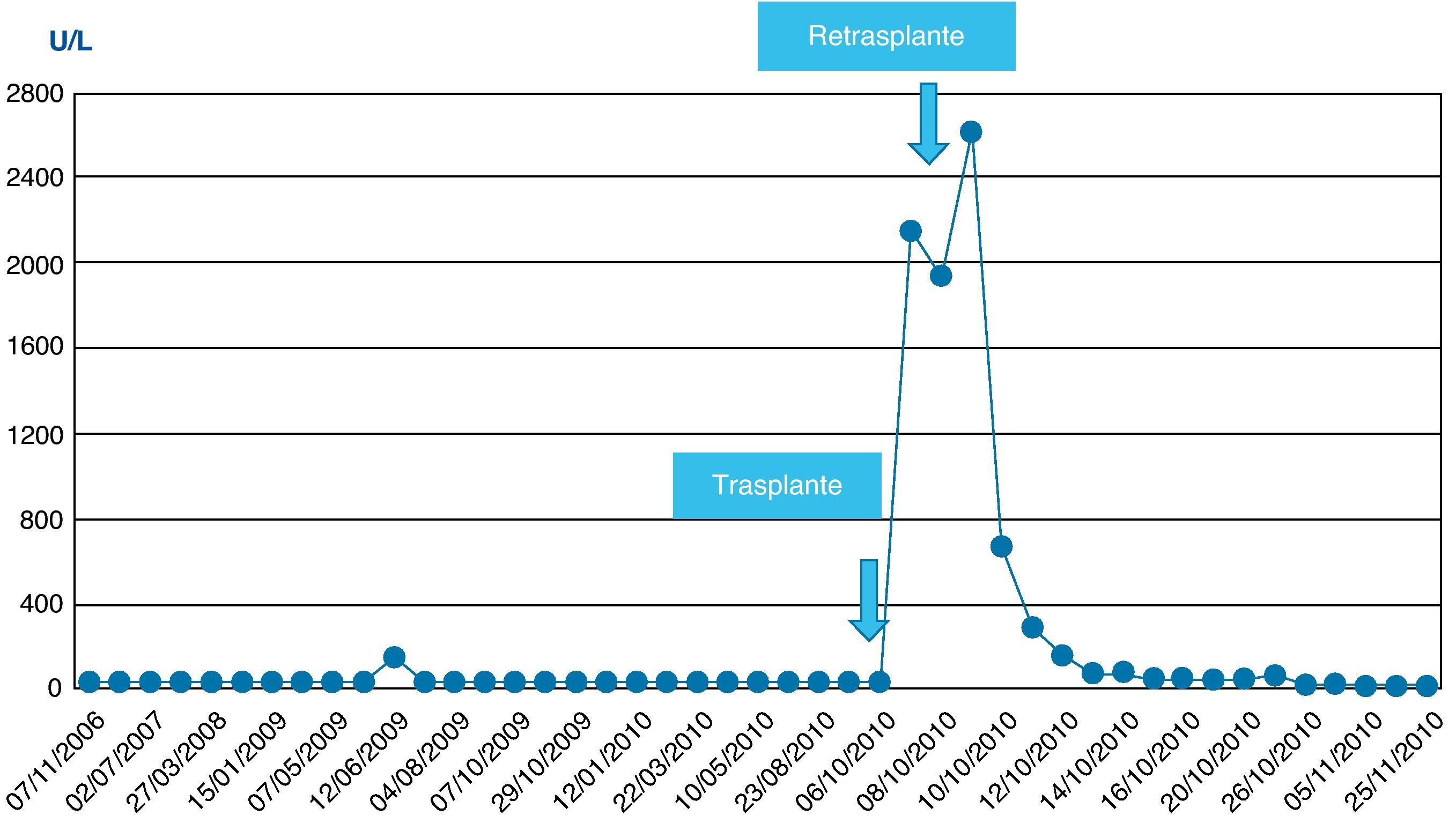
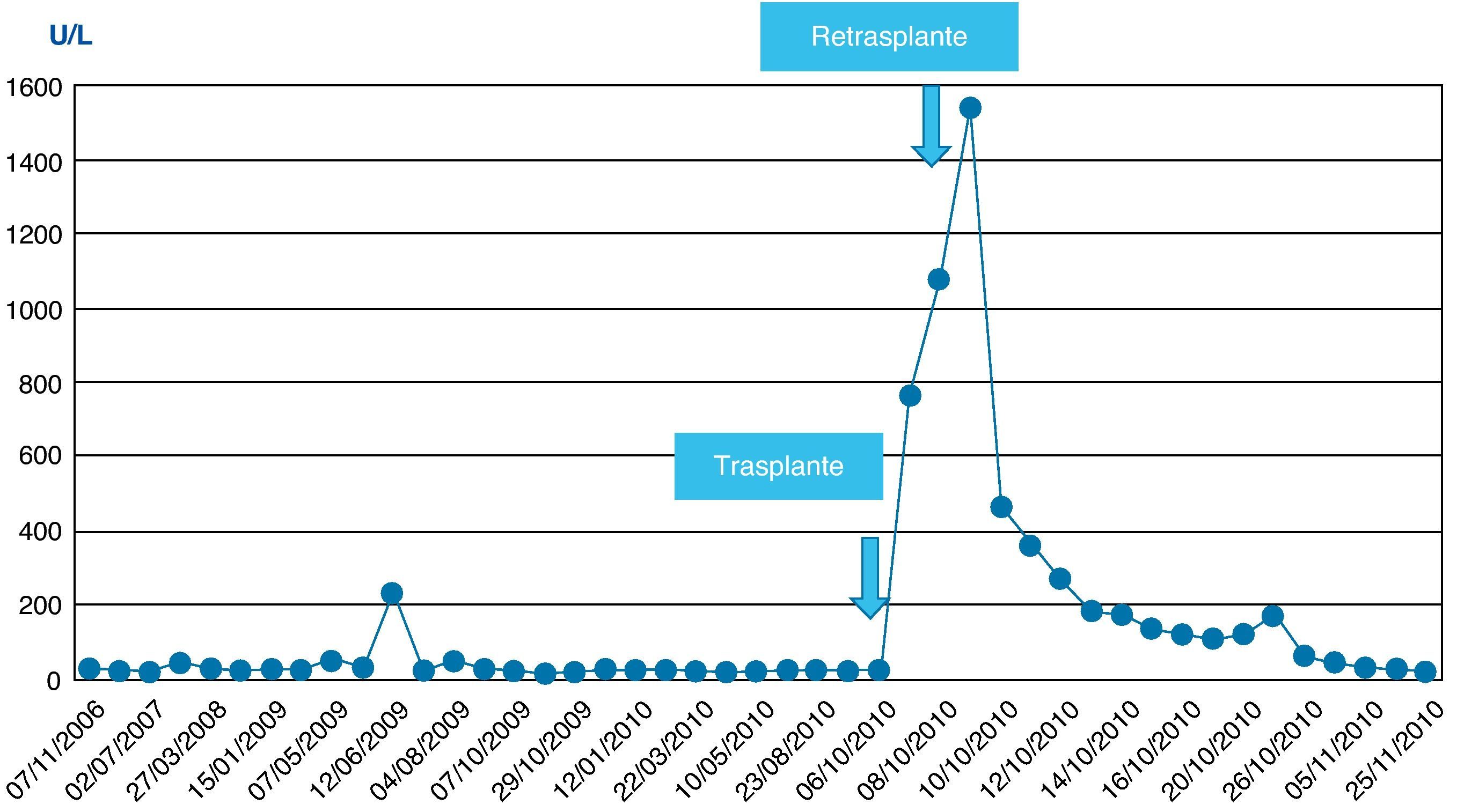
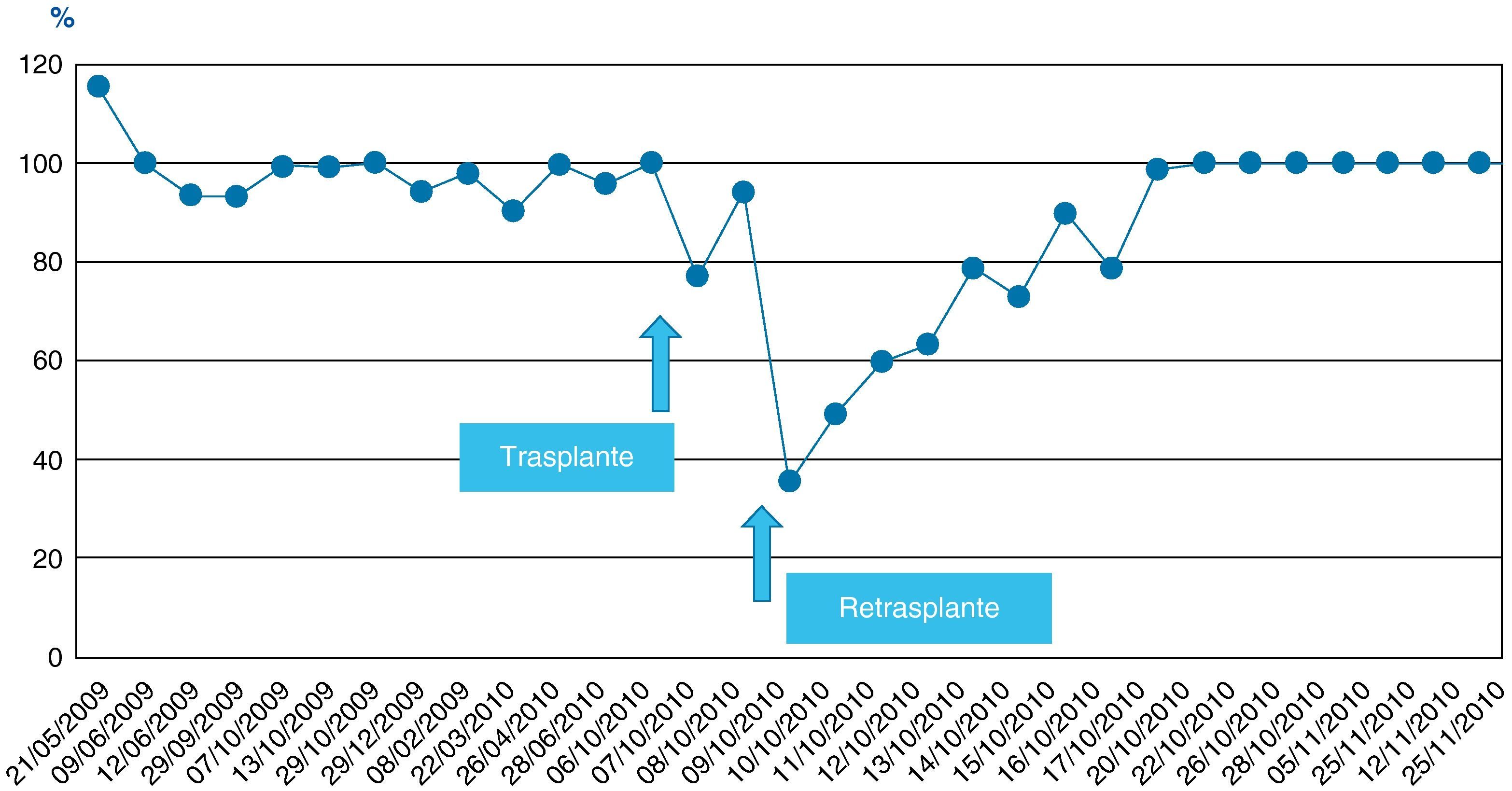
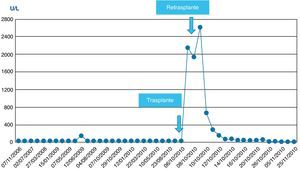
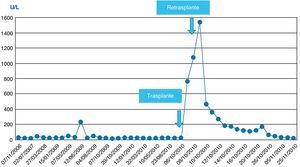
La evolución postoperatoria inicial fue favorable, recuperándose de la anestesia general. La función pulmonar no presentó deterioro significativo y pudo ser extubado tras 2h de ventilación mecánica. El paciente mantenía una adecuada perfusión periférica y estabilidad de los parámetros hemodinámicos sin necesidad de aminas vasoactivas. A pesar de ello, presentó intensa citólisis postoperatoria inicial con valores pico de aspartato y alanino-aminotransferasas (AST/ALT) de 2.492/1.095 U/l, si bien la función del injerto se recuperaba progresivamente, alcanzando una actividad de protrombina del 88% a las 24h de postoperatorio. Se realizó una eco-doppler para estudio vascular que mostró ausencia de flujo en la arteria hepática. Se confirmó el diagnóstico mediante angio-TAC, que mostró múltiples áreas parcheadas hipodensas, sugestivas de necrosis hepática, y la arteria hepática fue visualizada sólo en su porción proximal. El paciente fue sometido a reintervención quirúrgica a las 24h del trasplante por sospecha de trombosis de la arteria hepática. Se confirmó el diagnóstico y se realizó trombectomía con una sonda de Fogarty, comprobándose a continuación la permeabilidad vascular. Durante el acto quirúrgico se implantó malla de vicryl para cierre de pared. Se inició profilaxis con enoxaparina, se prolongó la profilaxis antimicrobiana y se inició profilaxis antifúngica con anidulafungina.
La evolución postoperatoria inmediata fue desfavorable. Apareció una intensa citólisis postoperatoria secundaria a disfunción isquémica grave del injerto con pico de AST/ALT de 4.190/1.839 U/l, y disfunción renal progresiva con disminución de la diuresis e incremento de la uremia y de la creatinemia (estadio RIFLE I).
Ante la situación clínica del paciente, el deterioro de la función del injerto y los factores de riesgo se decidió realizar de manera urgente un nuevo trasplante, que se realizó 24h después del diagnóstico. Se constató la presencia de un gran hematoma subcutáneo por encima de la malla. La cirugía transcurrió sin incidencias intraoperatorias. Se transfundieron 6 U de hematíes, 2 U de plasma y 1 pool de plaquetas. La donante fue una mujer de 35 años, de constitución normal, fallecida por hemorragia intracerebral, y la duración de su estancia en UCI había sido de un día.
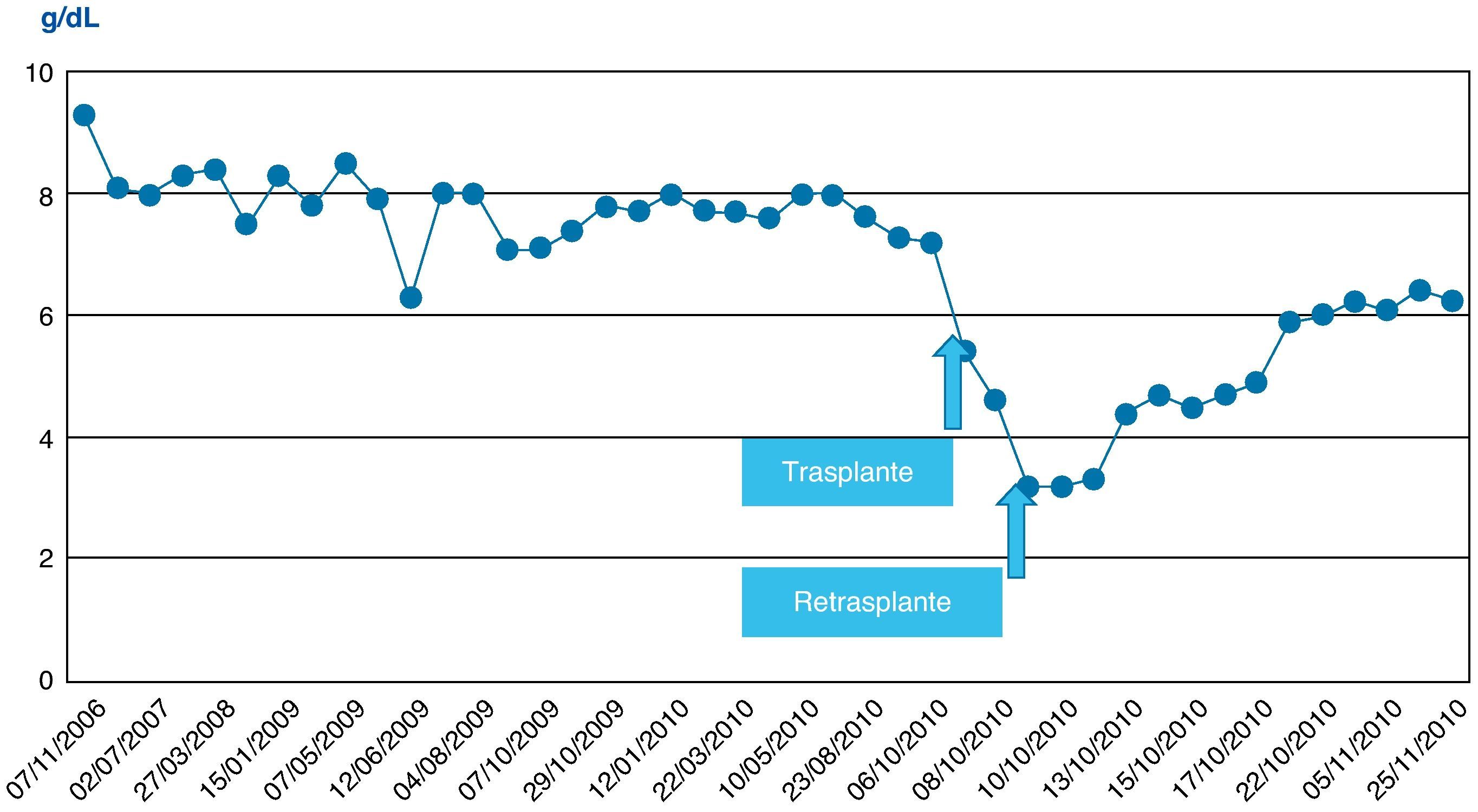
Tras el retrasplante urgente la función pulmonar se deterioró gravemente presentando criterios de síndrome de distrés respiratorio (SDRA) de causa multifactorial, aunque con importante componente secundario a hipoproteinemia muy grave (proteínas totales 33g/l). Se decidió mantener la ventilación mecánica hasta mejorar la situación hemodinámica y del medio interno. El paciente pudo después ser extubado sin complicaciones respiratorias durante su evolución.
Asimismo, tras el retrasplante se retiró la profilaxis con vancomicina por disfunción renal grave con tendencia a oligoanuria (estadio RIFLE F) y se inició la pauta habitual con amoxicilina/ácido clavulánico y cefotaxima, manteniéndose la profilaxis antifúngica. Se reanudó el tratamiento inmunosupresor estándar con doble terapia: tacrolimus de liberación prolongada y esteroides en pauta intravenosa descendente.
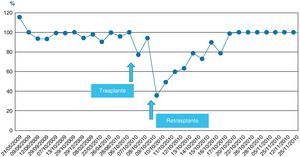
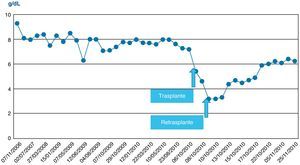
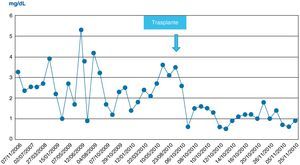
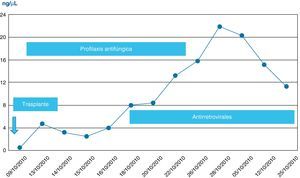
En las siguientes 24h se produjo una rápida disminución de las enzimas de citólisis, con recuperación progresiva de la función de síntesis (figs. 1–3), alcanzando una actividad de protrombina del 80% al tercer día del nuevo trasplante. Mediante eco-doppler se visualizó flujo arterial normal y se mantuvo la profilaxis con enoxaparina. La función del injerto fue buena, y la evolución clínica posterior favorable, con recuperación de la función renal, y sin otras complicaciones. Al alta de UCI en el día 11 tras su ingreso presentaba cifras de colemia y creatinemia normales (1 y 0,7mg/dl, respectivamente).
Tras la reintroducción del tratamiento antirretroviral al séptimo día del nuevo trasplante (atazanavir 0-0-200mg+raltegravir 400-0-400mg), se ajustaron las dosis de tacrolimus y se monitorizaron sus niveles para mantenerlos en rango terapéutico (5-15 ng/ml). Se realizó profilaxis con famotidina34.
La evolución clínica posterior fue favorable, aunque el paciente presentó leucocitosis mantenida durante las primeras 2 semanas, in crescendo-in decrescendo, sin signos clínicos de sepsis ni incremento de los marcadores de inflamación sistémica (proteína C reactiva 14 ng/ml y procalcitonina 0,08 ng/ml). Se realizaron hemocultivos de control y estudios moleculares de screening para múltiples microorganismos productores de sepsis (SeptiFast®, Roche), que fueron negativos. No presentó signos de infección fúngica invasora ni superficial, ni necesidad de hospitalización durante los 3 meses siguientes al retrasplante. La tolerancia inicial a los fármacos antirretrovirales fue aceptable, aunque precisó ajustes de dosis de los inmunosupresores inhibidores de calcineurina.
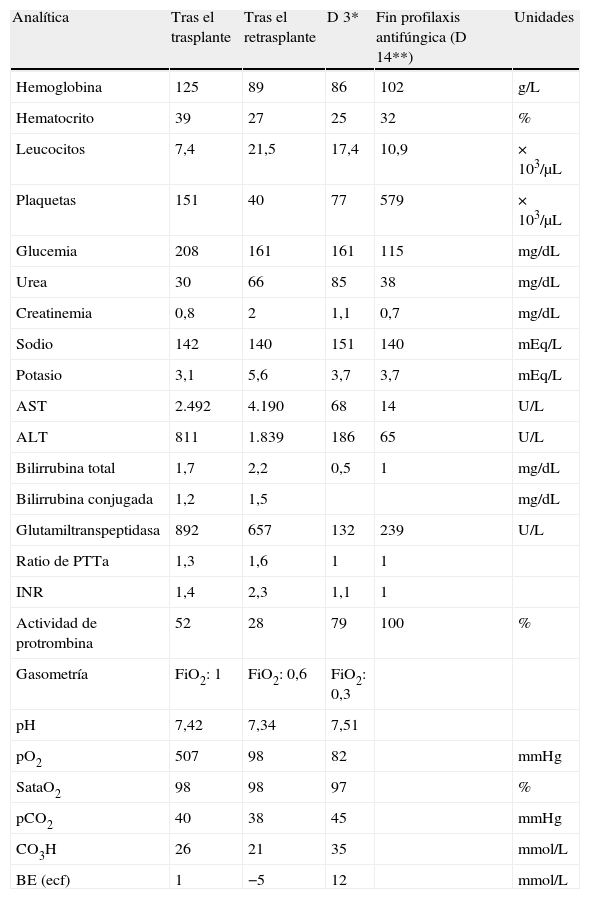
En resumen, se trata de un receptor de trasplante hepático por carcinoma hepatocelular sobre cirrosis viral no-descompensada coinfectado por VIH, que presentó una trombosis aguda de la arteria hepática a las 24h del trasplante, precisando reintervención quirúrgica urgente, con signos de isquemia aguda del injerto y criterios de síndrome de disfunción multiorgánica secundarios al fallo agudo del injerto. Fue retrasplantado de forma urgente, y durante el periodo postoperatorio aparecieron signos de insuficiencia respiratoria aguda con criterios de SDRA de causa multifactorial, pero con recuperación progresiva de la función del injerto y de las otras funciones orgánicas. Se mantuvo la profilaxis antibacteriana durante 5 días, y la descontaminación selectiva intestinal con norfloxacino y nistatina junto con la profilaxis antifúngica sistémica con anidulafungina durante 2 semanas. Se reintrodujo la medicación antirretroviral (atazanavir y raltegravir) sin complicaciones, aunque precisó reajustes del tratamiento. En la tabla 1 se muestra la evolución de los parámetros biológicos durante el periodo de profilaxis.
Evolución analítica durante la profilaxis antifúngica
| Analítica | Tras el trasplante | Tras el retrasplante | D 3* | Fin profilaxis antifúngica (D 14**) | Unidades |
| Hemoglobina | 125 | 89 | 86 | 102 | g/L |
| Hematocrito | 39 | 27 | 25 | 32 | % |
| Leucocitos | 7,4 | 21,5 | 17,4 | 10,9 | × 103/μL |
| Plaquetas | 151 | 40 | 77 | 579 | × 103/μL |
| Glucemia | 208 | 161 | 161 | 115 | mg/dL |
| Urea | 30 | 66 | 85 | 38 | mg/dL |
| Creatinemia | 0,8 | 2 | 1,1 | 0,7 | mg/dL |
| Sodio | 142 | 140 | 151 | 140 | mEq/L |
| Potasio | 3,1 | 5,6 | 3,7 | 3,7 | mEq/L |
| AST | 2.492 | 4.190 | 68 | 14 | U/L |
| ALT | 811 | 1.839 | 186 | 65 | U/L |
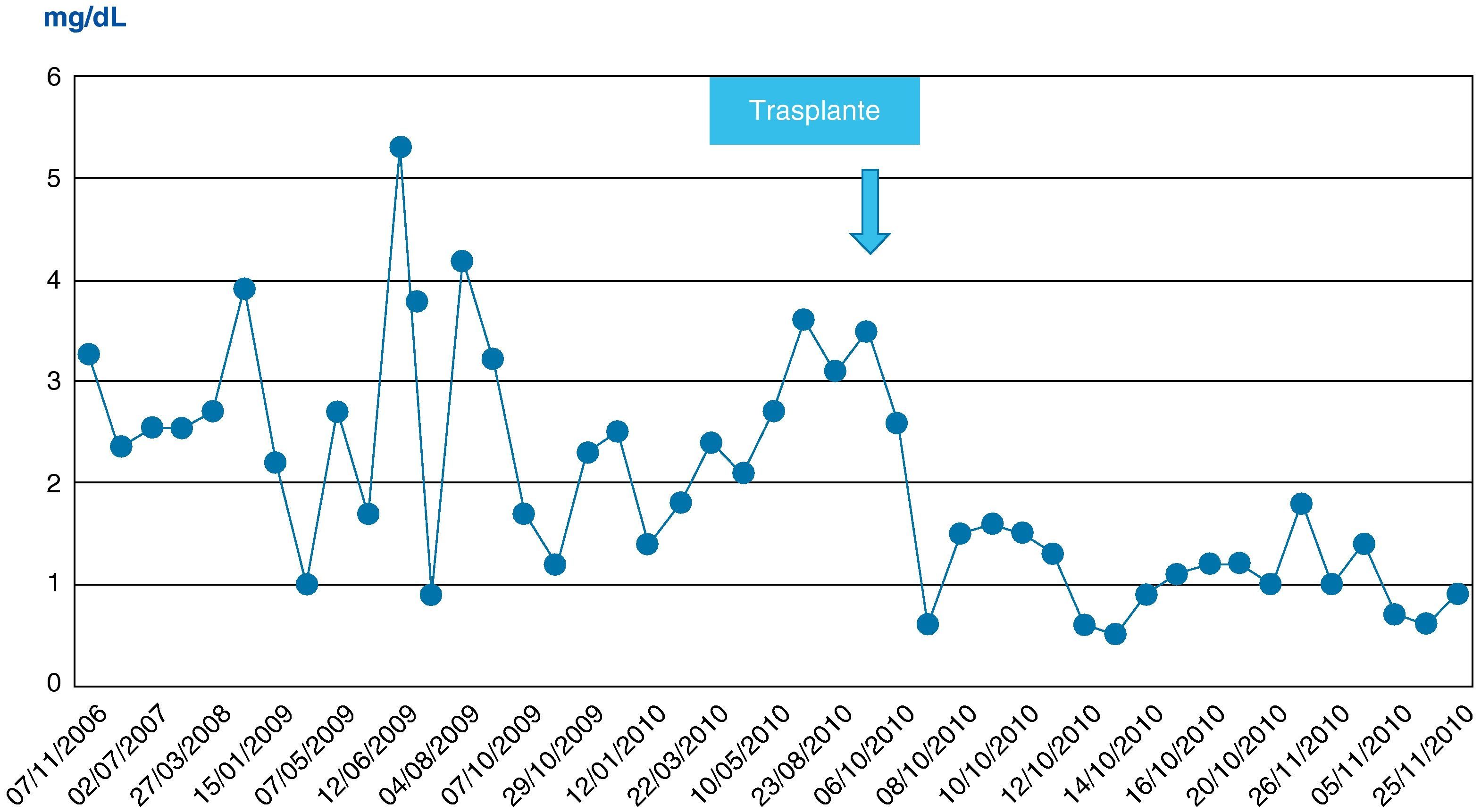
| Bilirrubina total | 1,7 | 2,2 | 0,5 | 1 | mg/dL |
| Bilirrubina conjugada | 1,2 | 1,5 | mg/dL | ||
| Glutamiltranspeptidasa | 892 | 657 | 132 | 239 | U/L |
| Ratio de PTTa | 1,3 | 1,6 | 1 | 1 | |
| INR | 1,4 | 2,3 | 1,1 | 1 | |
| Actividad de protrombina | 52 | 28 | 79 | 100 | % |
| Gasometría | FiO2: 1 | FiO2: 0,6 | FiO2: 0,3 | ||
| pH | 7,42 | 7,34 | 7,51 | ||
| pO2 | 507 | 98 | 82 | mmHg | |
| SataO2 | 98 | 98 | 97 | % | |
| pCO2 | 40 | 38 | 45 | mmHg | |
| CO3H | 26 | 21 | 35 | mmol/L | |
| BE (ecf) | 1 | −5 | 12 | mmol/L |
*D 3: día 3 tras el segundo trasplante.
**D 14: día 14 tras el segundo trasplante.
Existen múltiples cuestiones que definir en el trasplante de órganos sólidos de pacientes VIH seropositivos, entre las que queremos debatir la profilaxis antifúngica.
DiscusiónInfecciones fúngicas en receptores de trasplantes de órganos sólidosEn los receptores de trasplantes de órganos sólidos (RTOS), los regímenes inmunosupresores utilizados para reducir el riesgo de rechazo de los injertos, la condición clínica previa de los pacientes y la agresión tisular propia de los procedimientos quirúrgicos aumentan el riesgo de diferentes infecciones, desde virus latentes a otros patógenos adquiridos en el hospital o en la comunidad11.
Las infecciones fúngicas invasoras (IFI) en receptores de alto riesgo continúan siendo una preocupación especial12, habiendo alcanzado una incidencia mayor del 40% en la era previa a la profilaxis22. Las más frecuentes son causadas por Candida, y representan aproximadamente el 80%. La infección por Candida aparece generalmente dentro de los 2-3 primeros meses después del trasplante y, una vez que la infección ha sido diagnosticada, la tasa de mortalidad es muy elevada26,27. La prevención es, sin duda, la estrategia más útil para disminuir la mortalidad de las IFI24.
El número de opciones terapéuticas disponibles para la profilaxis y el tratamiento de las IFI ha aumentado en los últimos 10-15 años. El fluconazol5,35, la formulación liposomal de anfotericina B17,33 y las candinas9,18 han demostrado eficacia antifúngica en los enfermos receptores de trasplante hepático (RTH).
Durante el periodo postoperatorio precoz, los RTH considerados de alto riesgo de sufrir infección fúngica deben recibir profilaxis antifúngica, desde el momento del trasplante o inmediatamente tras la aparición del factor de riesgo20. Se consideran factores de alto riesgo relacionados con este caso, la reintervención quirúrgica, la disfunción isquémica del injerto, el retrasplante y la disfunción renal aguda.
El fluconazol ha sido el fármaco de elección para la profilaxis, por su bajo coste y perfil de seguridad, habiendo demostrado en un metaanálisis la reducción de la incidencia de infección fúngica invasora y de mortalidad atribuible a la infección, aunque las tasas de mortalidad global no disminuyeron7,23. Los RTH de alto riesgo presentan intensas alteraciones fisiopatológicas que incrementan las interacciones farmacocinéticas. A menudo, el uso de fluconazol está limitado por sus interacciones con los inmunosupresores inhibidores de la calcineurina, como ciclosporina o tacrolimus6, y por los efectos adversos que produce, especialmente en RTH con disfunción del injerto o deterioro de la función renal, dado que el fármaco se metaboliza en el hígado y en gran medida se elimina activo por orina8.
Hepatopatía grave en pacientes infectados por el VIHEn la actualidad existe un importante problema de salud pública como consecuencia del incremento progresivo de pacientes VIH seropositivos que desarrollan signos de hepatopatía grave y terminal. La hepatopatía crónica por virus de la hepatitis es la comorbilidad más relevante que presentan los sujetos infectados por el VIH, por su frecuencia, por la progresión a enfermedad hepática terminal y por la hepatotoxicidad del tratamiento antirretroviral19.
En España, más del 60% de los pacientes VIH seropositivos han presentado coinfección por el VHB o por el VHC −dado que los virus comparten las mismas vías de transmisión−, y entre el 6-10% desarrollan cirrosis hepática15. La hepatopatía es rápidamente progresiva porque en la historia natural de la coinfección ambos virus se influyen negativamente, acelerando la progresión de la enfermedad hepática. En estos pacientes se triplica el riesgo de mortalidad por causa hepática, especialmente por hepatocarcinoma. Los fármacos usados en la actualidad para el tratamiento de la hepatopatía por VHC, interferón y ribavirina, interaccionan con algunos fármacos antirretrovirales y pueden modificar su eficacia o aumentar sus efectos tóxicos. En Andalucía, la frecuencia de coinfección resulta de especial importancia si se tiene en cuenta que el 42% de los pacientes atendidos en 1999 padecían una hepatopatía crónica, asociada fundamentalmente al VHC3. Los pacientes VIH seropositivos que fallecen actualmente están coinfectados por el VHC en un porcentaje elevado; sin embargo, gracias a la eficacia de la terapia con fármacos antirretrovirales en los seis meses previos a la muerte más de la mitad presentaban carga viral indetectable y cifras de linfocitos CD4+ superiores a 200 cél/μl4.
Indicaciones de trasplante de órganos sólidos en pacientes VIH seropositivosDesde 1996 la terapia de combinación de nuevos fármacos antirretrovirales, con mayor potencia para inhibir la replicación del VIH, produjo un cambio sustancial en la evolución de los pacientes infectados que ha permitido detener el deterioro de la función inmune, y se traduce en una disminución de la incidencia de enfermedades oportunistas y de la mortalidad asociada a la infección. Sin embargo, de forma paralela se incrementó la morbilidad producida por enfermedades no relacionadas directamente con el estado de inmunodepresión o la toxicidad de los inmunosupresores.
Esta situación ha originado la existencia de numerosos pacientes estables desde el punto de vista clínico, inmunológico y virológico que presentan enfermedades crónicas terminales –la hepatopatía terminal es el paradigma de este fenómeno− y en los que, al igual que en la población general, el trasplante supone la única alternativa terapéutica posible. La misma situación se establece en pacientes con nefropatía terminal32.
La infección por el VIH ha constituido tradicionalmente una contraindicación absoluta para el trasplante, y aunque existen múltiples cuestiones por resolver, cada vez aparecen más evidencias que favorecen un replanteamiento de este problema28,31. Ya en 2002 la United Network for Organ Sharing (UNOS) estableció que los pacientes con infección por VIH asintomáticos no deberían necesariamente ser excluidos como receptores de trasplante25. En nuestro país, la Organización Nacional de Trasplantes (ONT), siguiendo las recomendaciones del grupo de expertos de la Sociedad Española de Enfermedades Infecciosas, recomendaba considerar la infección VIH como una contraindicación relativa que por sí sola no contraindica el trasplante, aunque esta infección debe ser tenida en cuenta en la evaluación individual de cada paciente, dejando la decisión última en los comités evaluadores de candidatos a trasplante2. Los criterios establecidos para poder ser RTOS también habían sido definidos30.
Necesidad de profilaxis antifúngica en los receptores de trasplante de órganos sólidos VIH seropositivosLas pautas de profilaxis antifúngica universal por vía sistémica no han demostrado ser eficaces y no están exentas de efectos adversos en los pacientes trasplantados. Por ello, actualmente existe consenso en realizar profilaxis antifúngica sólo en los RTOS de alto riesgo de IFI20,29. Los criterios de alto riesgo han sido bien establecidos para los RTH14,16,20, pero no así en otros tipos de trasplantes.
No existen recomendaciones específicas para la profilaxis antifúngica en receptores de trasplantes VIH seropositivos, aunque deben considerarse pacientes de alto riesgo de infección fúngica y debieran ser incluidos dentro de los grupos de pacientes que deben recibir profilaxis antifúngica desde el momento del trasplante.
La duración de la profilaxis no está bien establecida10, pero estamos de acuerdo en las recomendaciones de los expertos de mantenerla una o dos semanas21. Un tratamiento más prolongado sólo estaría justificado en casos de riesgo mantenido o como terapia empírica.
Elección de la terapia antifúngica e interacciones medicamentosas. Seguridad y eficacia en poblaciones especialesLas recomendaciones actuales de la Infectious Diseases Society of America (IDSA) en relación a la profilaxis antifúngica de los pacientes trasplantados de órganos sólidos abogan por el uso de fluconazol o anfotericina B liposomal en pacientes de alto riesgo21. Si bien la profilaxis antifúngica en pacientes trasplantados puede ser realizada tanto con fluconazol como con anfotericina B liposomal, hay que tener en cuenta la posibilidad de presentar efectos adversos graves por interacciones medicamentosas o nefrotoxicidad en pacientes de riesgo.
Tanto el fluconazol como la anfotericina B liposomal presentan efectos adversos que pueden ser graves. El fluconazol hace que tanto los inhibidores de la calcineurina como los antirretrovirales presenten sustanciales modificaciones farmacocinéticas por las interacciones medicamentosas relacionadas con su metabolismo hepático a nivel del sistema del citocromo P450; y la anfotericina B liposomal, por su potencial nefrotoxicidad, agrava la disfunción renal previa, que ocurre tanto en receptores de riñón como en RTH, especialmente desde que se implantó la estratificación MELD, o en receptores cardiacos con bajo gasto crónico. Por ello se está explorando la profilaxis con candinas en pacientes de alto riesgo14.
El perfil de seguridad de las candinas se ajusta mejor en los receptores de trasplantes, tanto por la ausencia de nefrotoxicidad como por sus menores interacciones sobre el sistema del citocromo P450 –especialmente la anidulafungina, que carece de metabolismo hepático.
Anidulafungina tiene buena actividad antifúngica in vitro frente a Candida y Aspergillus, pero su farmacocinética es la característica más interesante en pacientes trasplantados. Presenta metabolismo plasmático por rotura fisiológica del anillo y degradación por peptidasas no específicas, y no precisa de metabolismo hepático por lo que no tiene dependencia del sistema del citocromo P450, ni de la función hepática, ya sea de un injerto hepático o de la posible disfunción hepática relacionada con la sepsis en el trasplante de cualquier otro órgano. Dado que el fármaco no se metaboliza en el hígado ni se elimina a través del riñón, los ajustes de la dosis no son necesarios en estas poblaciones especiales, y está libre de interacciones con los inmunosupresores (prednisona, ciclosporina A, tacrolimus, micofenolato mofetil, everolimus y otros) que requieren metabolismo hepático. También presenta menor toxicidad que caspofungina. Aunque la experiencia es aún limitada, la anidulafungina es de gran utilidad en el manejo clínico de los pacientes trasplantados1,13. Por ello, podríamos considerarla como el fármaco de elección y de particular importancia en los receptores VIH seropositivos.
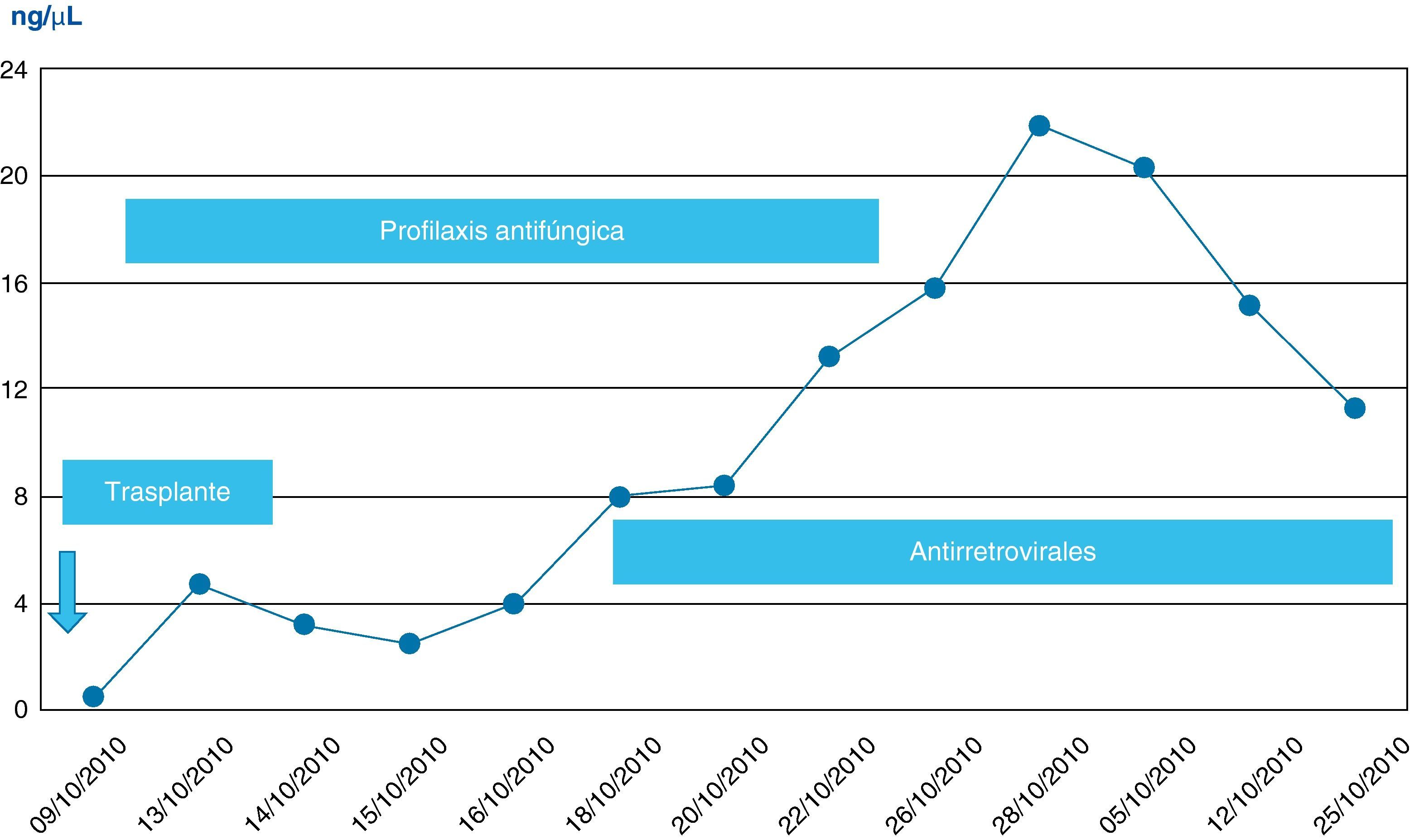
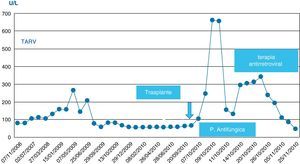
En nuestro caso, la profilaxis con anidulafungina se ha mostrado segura y eficaz. La anidulafungina no presentó interacciones significativas con tacrolimus ni con la medicación antirretroviral (figs. 1–7). Se administró al paciente tacrolimus de liberación prolongada al día siguiente del trasplante, manteniendo dosis de 2-4mg/día para conseguir niveles plasmáticos en el rango inferior de la normalidad (alrededor de 5 ng/ml). Se inició el tratamiento con fármacos antirretrovirales al séptimo día del segundo trasplante. El tratamiento con fármacos antirretrovirales previo al trasplante incluía dos inhibidores de la proteasa (atazanavir y ritonavir), y tras el trasplante fue modificado inicialmente para evitar interacciones medicamentosas graves, sustituyendo los inhibidores de la proteasa por un inhibidor de la integrasa (raltegravir).
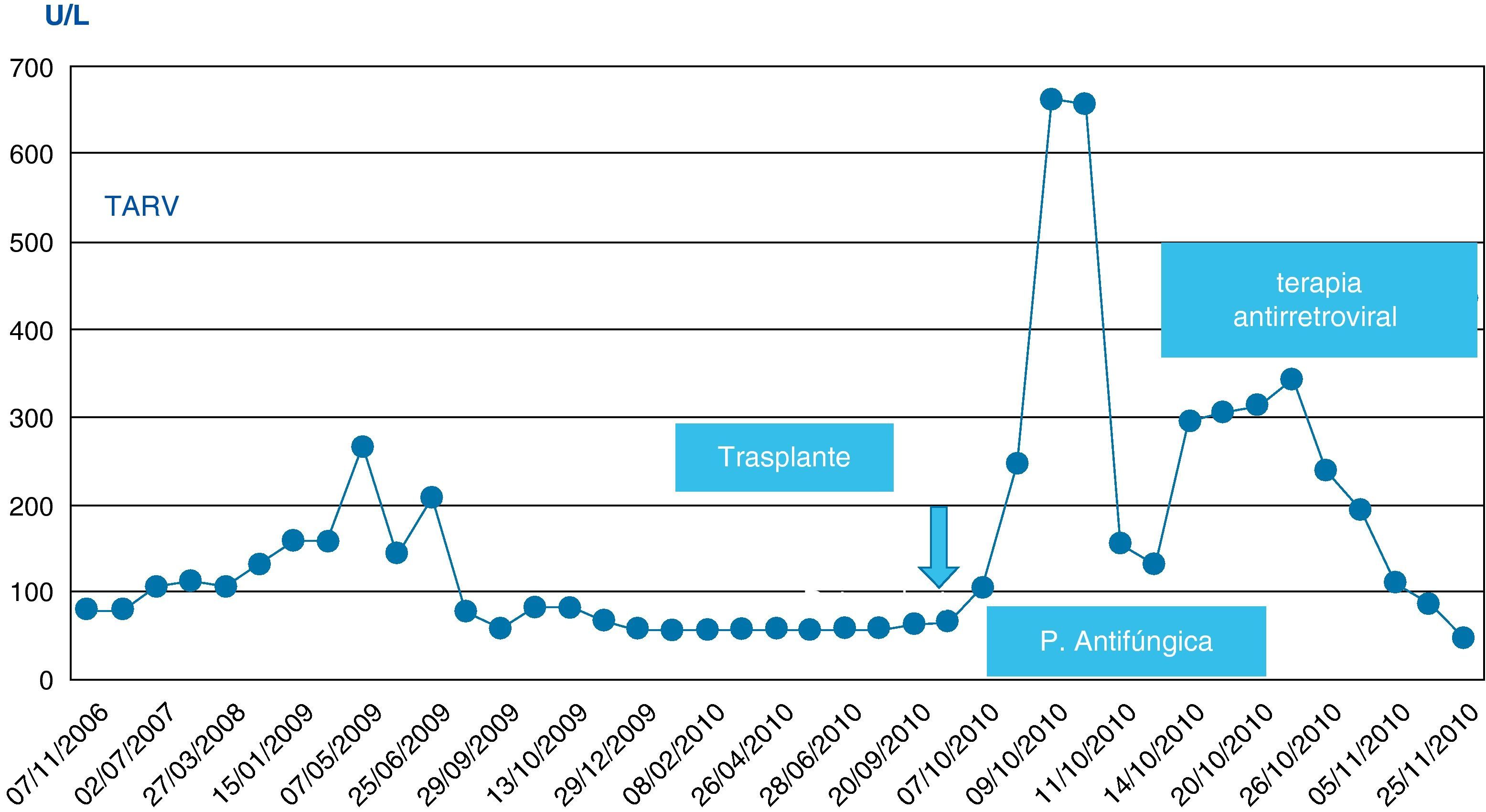
Evolución perioperatoria de la enzima gamma-glutamil transpeptidasa. El incremento posterior a la introducción de la terapia antirretroviral es un marcador de la colestasis secundaria a las interacciones farmacológicas, que se normaliza progresivamente tras los ajustes de medicación.
Nota: En todas las figuras pueden no existir algunos valores que estén reflejados en la descripción del texto o tablas por interés del caso; dado que el sistema automático del laboratorio inscribe sólo un valor de todos los resultados del día, y se muestran los valores de días alternos o cuando el valor existe.
No se observó citólisis hepática tras el retrasplante (figs. 1 y 2), la recuperación de la función del injerto fue normal, valorada por la actividad de protrombina, así como la síntesis de proteínas plasmáticas y la colemia (figs. 3–5). La dosificación de tacrolimus fue progresiva, con un incremento predictible de sus niveles sanguíneos (fig. 6), consiguiendo mantenerlos dentro del rango terapéutico tras la introducción de la medicación con fármacos antirretrovirales, sin reacciones clínicas adversas ni incremento significativo de la gamma-glutamil transpeptidasa (fig. 7), que mantiene cifras habituales en este tipo de pacientes durante la primera semana de postoperatorio. Esto coincide con la experiencia previa en otras poblaciones (datos no publicados). Incluso puede observarse en la figura 6 que, tras la retirada de la anidulafungina después de 14 días de profilaxis, los niveles de tacrolimus se incrementaron con la mayor exposición a los fármacos antirretrovirales pero no por el antifúngico.
ConclusionesActualmente existe un grave problema sanitario en la población de pacientes VIH seropositivos que presentan hepatopatía crónica terminal, generalmente relacionada con la coinfección por virus de la hepatitis, especialmente VHC. En estos pacientes VIH que tienen controlada su enfermedad con fármacos antirretrovirales no existe contraindicación per se para el trasplante de órganos sólidos.
Los pacientes VIH seropositivos receptores de órganos deben ser considerados de alto riesgo para desarrollar IFI en el periodo postoperatorio inicial y deben recibir profilaxis antifúngica. La elección del antifúngico debe considerar los fármacos que presenten un mejor perfil de seguridad, con mínimas interacciones farmacológicas y ausencia de toxicidad. Las candinas, y especialmente anidulafungina por su ausencia de metabolismo hepático, pueden ser de elección.