Las queratomicosis tienen como desencadenante traumatismos corneales o quirúrgicos (pueden aparecer tras un trasplante de córnea), el uso de lentes de contacto contaminadas o alteración lagrimal. Su diagnóstico y su tratamiento son un reto para conservar una buena función visual.
ObjetivoRevisión retrospectiva, descriptiva y lineal del diagnóstico, la epidemiología, la etiología y la evolución de 219 casos de queratomicosis en México.
MétodoSe estudió el diagnóstico, el tratamiento y la evolución de 219 pacientes a los que se había atendido en el Servicio de Córnea en un hospital de atención oftalmológica de la Ciudad de México, provenientes de diversos estados de la República de México.
ResultadosEl antecedente de traumatismo se refirió en 77 casos (36%), de los que 12 (5,4%) fueron traumatismos quirúrgicos; en 142 casos (64,8%) no se refirió traumatismo alguno. Ciento sesenta y cinco pacientes (75,3%) eran de sexo masculino y 54 (24,6%) de sexo femenino, con una media de edad de 46 años. Para su recuperación clínica y visual se recurrió a tratamientos con antimicóticos tópicos y orales y a cirugías. En 81 pacientes (36,9%) se practicaron una o más cirugías. En 62 casos (28,3%) se practicó trasplante de córnea y en 19 (8,7%) se llevaron a cabo recubrimientos conjuntivales o parches corneoesclerales.
ConclusionesEn México, las queratomicosis afectan a pacientes de sexo masculino en una proporción de 4:1 respecto a las mujeres. Fusarium solani fue el hongo más frecuente en nuestro estudio (37,2%), y el mayor número de evisceraciones se presentó en los pacientes afectados por el género Aspergillus (26%). La mejor respuesta clínica se obtuvo con combinaciones de antimicóticos tópicos en las infecciones por hongos dematiáceos.
Some of the most common precipitating events for keratomycoses (fungal keratitis), include surgical trauma (after cornea transplantation), the use of contaminated contact lenses or alterations in lacrimal secretions. Diagnosis and treatment (to avoid loss of vision) for these type of infections are challenging.
ObjectiveRetrospective review of the diagnosis, epidemiology, etiology and response to treatment in 219 patients with fungal keratitis in Mexico.
MethodsWe have studied the diagnosis, epidemiology, etiology and response to treatment in 219 patients from different states in the Mexican Republic in the Cornea Department at an Ophthalmology Hospital in Mexico D.F.
ResultsTrauma was the precipitating event in 77 patients (36%), of which 12 (5.4%) were due to surgical trauma; 152 patients (64.8%) did not report any prior trauma. There were 165 male (75.3%) and 54 female (24.6%) patients, with an average age of 46 years old. For clinical and visual treatment patients were treated with topical and oral antifungals and surgery. One or more surgeries were performed on a total of 81 patients (36.9%). A total of 62 patients (28.3%) received a corneal transplant, and 19 patients (8.7%) were subjected to conjunctival flap or scleral-conjunctival surgery.
ConclusionsIn Mexico, keratomycoses affect mostly male patients in a 4:1 ratio over females. Fusarium solani was the most frequent agent of fungal keratitis in our study (37.2%), and the highest number of corneal ulcers and eviscerations (26%) was present in patients infected by Aspergillus. The best therapeutic responses were with combination of topical antifungals against dematiaceous fungi.
Las queratomicosis son infecciones corneales causadas por hongos. Se inician principalmente por traumatismos con materiales vegetales contaminados con conidios de hongos. Se conocen como factores de riesgo la alteración de la película lagrimal o el uso de lentes de contacto contaminadas, y se puede presentar incluso sin la participación de tierra o materiales extraños16.
La frecuencia de especies aisladas es variable y depende de las condiciones climáticas del lugar del estudio. Los géneros de hongos comúnmente involucrados en la India como causantes de queratomicosis son Fusarium, Aspergillus y Candida2,3. Houang et al describieron en China, además de Fusarium solani, otros hongos como Alternaria alternata, Acremonium spp., Aspergillus spp., Penicillium spp. y Paecilomyces spp. como las especies aisladas con más frecuencia de las lesiones corneales6. Rosa et al describieron en Florida (EE. UU.) una serie de 125 casos donde Fusarium fue el principal agente aislado (66,2%), seguido de Candida albicans, Candida parapsilosis, Candida tropicalis (13,5%), Aspergillus terreus y Trichosporon spp.10.
En México, son pocos los estudios publicados sobre queratitis infecciosa; algunos de ellos se refieren a casos aislados de queratomicosis1. La casuística más grande es un estudio retrospectivo de 7 años en 200 pacientes con diagnóstico de queratitis infecciosa supurativa; la frecuencia de queratomicosis fue del 9% y se identificaron Fusarium, Acremonium, Aspergillus, Penicillium, Paecilomyces spp., Alternaria spp., Curvularia spp. y Cladosporium spp18.
El objetivo del presente estudio fue hacer una revisión retrospectiva de la epidemiología, la etiología, el diagnóstico y la respuesta al tratamiento médico-quirúrgico de 219 casos de queratomicosis de pacientes atendidos en un hospital para el tratamiento de enfermedades oftálmicas de la Ciudad de México.
Material y métodosPacientes. Este estudio se desarrolló en forma retrospectiva, descriptiva y lineal en 219 pacientes atendidos en el Servicio de Córnea del Hospital Asociación para Evitar la Ceguera en México Dr. Luis Sánchez Bulnes durante el período de 1981 a 2004.
Los criterios de inclusión fueron los siguientes:
- 1.
Pacientes con diagnóstico clínico de queratomicosis, confirmados por frotis o cultivo.
- 2.
Pacientes con lesiones corneales de bordes elevados e irregulares, infiltrado denso y sin respuesta al tratamiento previo con antibacterianos.
- 3.
Acceso al expediente para dar seguimiento al tratamiento, evolución clínica con o sin cirugía y resultado final en la capacidad visual.
- 4.
Se tomaron en consideración, además, la edad, el sexo, el lugar de residencia y los factores de riesgo u ocupacionales.
Los criterios de exclusión fueron los siguientes:
- 1.
Úlceras corneales de origen no micótico (bacterianas, postherpéticas, distróficas o degenerativas).
- 2.
Frotis y cultivos negativos para hongos en las muestras de las lesiones de córnea.
Toma de la muestra. Se administró a cada paciente 2 gotas de anestésico (solución de tetracaína, 5mg/ml) en el ojo afectado para la toma de la muestra de la úlcera corneal. Tras 1–2min de instilación del anestésico, se tomaron 3 muestras con espátula de Kimura de la zona central y periférica de la úlcera para tinciones y para cultivos de bacterias y hongos.
Cultivos de las muestras. Las muestras obtenidas de cada paciente se inocularon en medios de cultivo en tubo para hongos y bacterias: agar Biggy, agar Emmons y agar Sabouraud glucosado sin cicloheximida y con un 0,005% de cloranfenicol12,17. Los tubos se incubaron a 27°C durante más de 3 semanas. Se inocularon también placas de Petri con agar sangre y agar chocolate para cultivo de bacterias con incubación a 37°C, y se realizaron frotis que se tiñeron con ácido periódico de Schiff y Gram.
Identificación de los hongos filamentosos. La determinación del género y la especie de los hongos filamentosos se realizó por un estudio macroscópico y microscópico en el microcultivo de los aislamientos crecidos en agar Sabouraud glucosado y agar papa glucosado12.
Identificación de las especies de hongos levaduriformes. Todos los aislamientos levaduriformes se resembraron en agar Sabouraud glucosado. Se realizó la prueba de formación de tubo germinativo en suero a 37°C, la producción de clamidoconidios en agar harina de maíz con Tween 80 al 1% y la asimilación de hidratos de carbono utilizando el sistema Auxacolor 2® (BioRad, Marnes-la-Coquette, Francia).
Para el tratamiento tópico, se preparó una suspensión con el antifúngico seleccionado (ketoconazol o itraconazol) en lágrima artificial siguiendo las indicaciones de Torres et al15 o con los comercialmente disponibles de natamicina o miconazol oftálmico en ungüento.
La dosis y la frecuencia de administración tópica de los colirios variaron según la gravedad del cuadro y el tiempo de evolución previo. En el 80% de los casos se administraron cada 2 h en los primeros 8 días, y se continuó con aplicaciones cada 8 h durante 6 meses en los casos graves. En el 20% restante, la dosificación y el tiempo de aplicación se ajustaron de acuerdo con las necesidades de cada paciente. Se administraron gotas de tripocamida al 0,5% más fenilefrina al 5% (TP® Laboratorios Sophia; Guadalajara, México) 3 veces al día como dilatador de la pupila para disminuir el dolor y las posibles sinequias posteriores del iris. No se administraron corticoides antes de completar los 30 días de tratamiento con el antimicótico y de observar una franca mejoría.
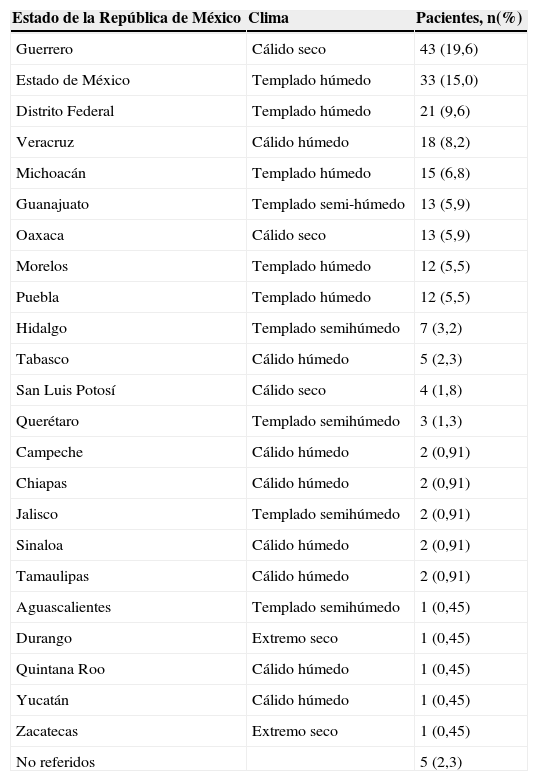
ResultadosSe confirmó con frotis y cultivo el diagnóstico clínico de queratomicosis en 219 pacientes. De los pacientes estudiados, 165 (75,3%) eran de sexo masculino y 54 (24,6%) de sexo femenino. Las edades iban desde los 8 meses hasta los 92 años, con una media de 46 años. De los 219 pacientes, 71 (32,4%) se dedicaban a labores agrícolas o manuales y 148 (67,5%) a otras actividades. En la tabla 1 se muestra el lugar de residencia de los pacientes en la República de México así como las condiciones climáticas de cada Estado y el número de pacientes provenientes de cada uno de ellos en su ingreso al Servicio de Córnea para su atención.
Procedencia geográfica de los 219 pacientes con queratomicosis
| Estado de la República de México | Clima | Pacientes, n(%) |
| Guerrero | Cálido seco | 43 (19,6) |
| Estado de México | Templado húmedo | 33 (15,0) |
| Distrito Federal | Templado húmedo | 21 (9,6) |
| Veracruz | Cálido húmedo | 18 (8,2) |
| Michoacán | Templado húmedo | 15 (6,8) |
| Guanajuato | Templado semi-húmedo | 13 (5,9) |
| Oaxaca | Cálido seco | 13 (5,9) |
| Morelos | Templado húmedo | 12 (5,5) |
| Puebla | Templado húmedo | 12 (5,5) |
| Hidalgo | Templado semihúmedo | 7 (3,2) |
| Tabasco | Cálido húmedo | 5 (2,3) |
| San Luis Potosí | Cálido seco | 4 (1,8) |
| Querétaro | Templado semihúmedo | 3 (1,3) |
| Campeche | Cálido húmedo | 2 (0,91) |
| Chiapas | Cálido húmedo | 2 (0,91) |
| Jalisco | Templado semihúmedo | 2 (0,91) |
| Sinaloa | Cálido húmedo | 2 (0,91) |
| Tamaulipas | Cálido húmedo | 2 (0,91) |
| Aguascalientes | Templado semihúmedo | 1 (0,45) |
| Durango | Extremo seco | 1 (0,45) |
| Quintana Roo | Cálido húmedo | 1 (0,45) |
| Yucatán | Cálido húmedo | 1 (0,45) |
| Zacatecas | Extremo seco | 1 (0,45) |
| No referidos | 5 (2,3) |
El antecedente de traumatismo con diversos vegetales o tierra se confirmó en 77 pacientes (36%). Doce pacientes (5,4%) tuvieron antecedente de trauma quirúrgico. Ciento dieciocho pacientes (53,8%) no reportaron antecedente de traumatismo y 12 (5,9%) tenían antecedentes de diabetes mellitus.
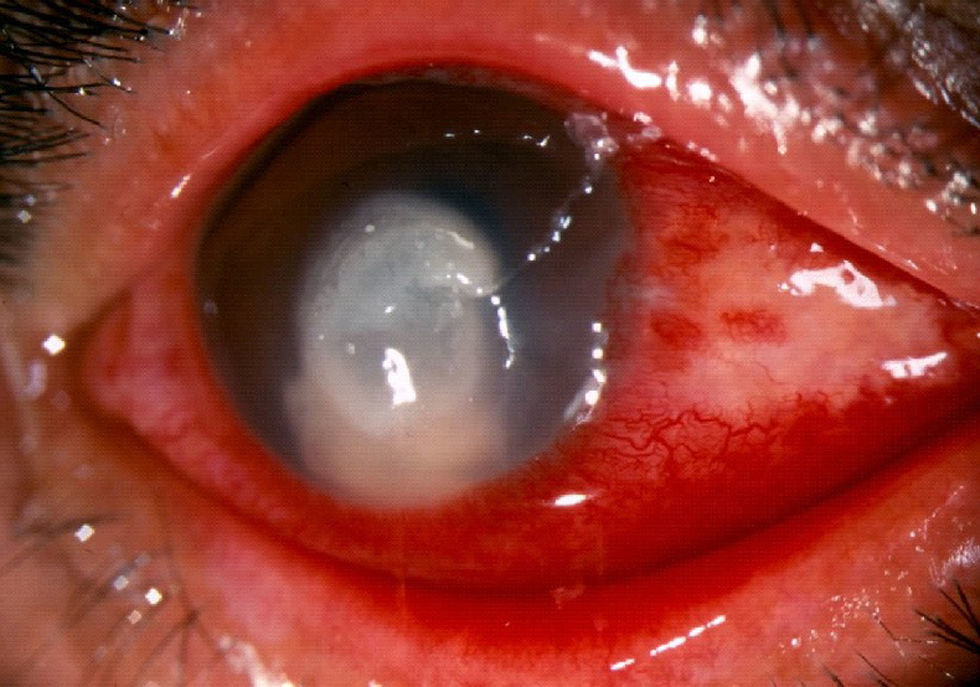
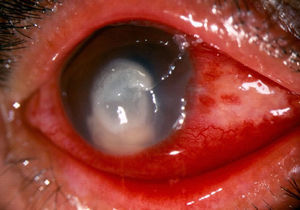
Ciento doce pacientes (51,1%) tuvieron afección del ojo derecho y 107 (48,9%) del ojo izquierdo. La localización de la úlcera, que afecta en forma importante al pronóstico visual, fue central en 167 pacientes (76,3%) y paracentral superior, inferior o lateral en 52 (23,7%). Los pacientes incluidos presentaron 4 o más de los siguientes signos: úlceras sobre el epitelio de la córnea con bordes irregulares, presencia de un infiltrado denso blanquecino en la estroma corneal, pliegues en la membrana de Descemet, lesiones satélites y edema generalizado de la córnea y el hipopión (fig. 1).
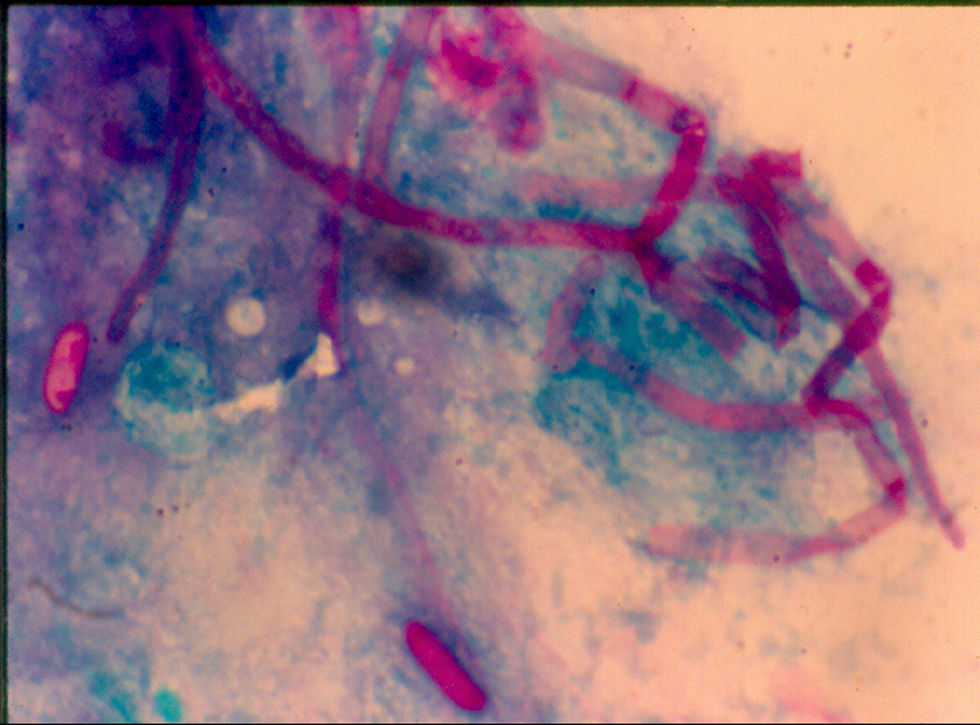
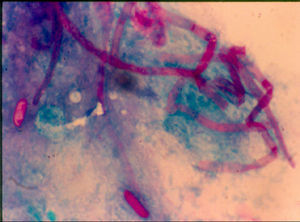
El diagnóstico de queratomicosis se estableció considerando el frotis teñido con ácido periódico de Schiff y el cultivo. En 189 pacientes (86,3%) se observaron en el frotis hifas septadas (fig. 2). El cultivo fue positivo en 205 casos (93,6%): en 150 (73,1%) se desarrollaron hongos hialinos, en 39 (19%) hongos dematiáceos y en 16 (7,8%) hongos levaduriformes (fig. 2). El cultivo fue negativo en 14 casos (6,4%), aunque el frotis arrojó la presencia de hifas.
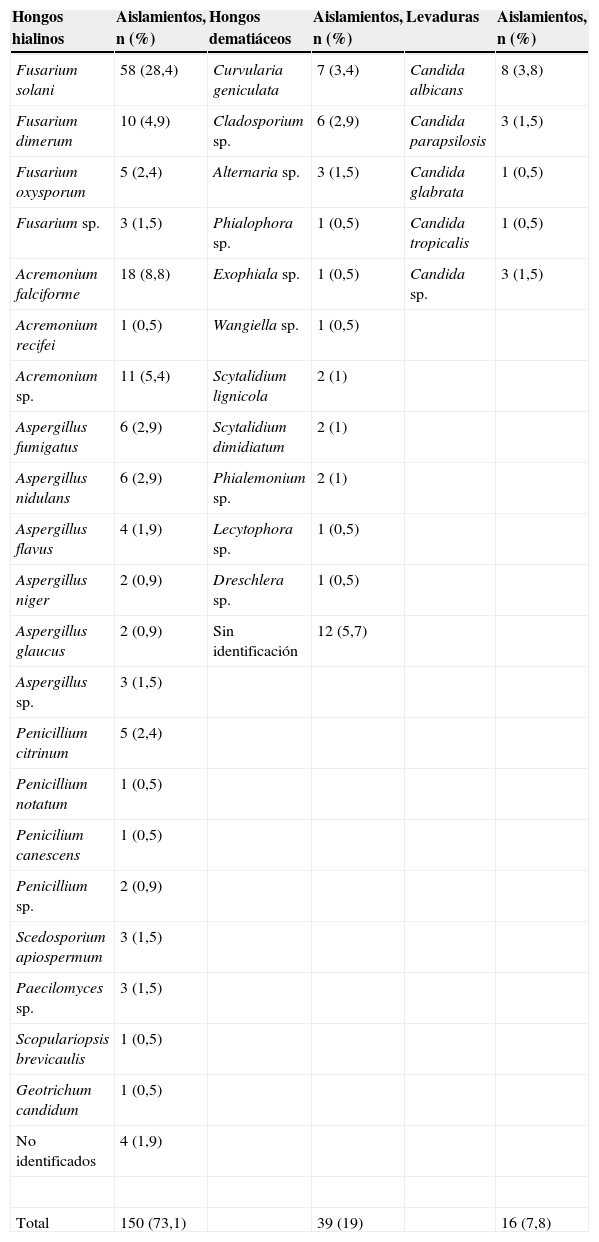
En la tabla 2 se muestran los hongos identificados. De los hongos hialinos, el más frecuente fue Fusarium spp. (en un 37% de los casos), seguido de Acremonium (14,7%) y de Aspergillus (11%). Treinta y nueve casos (19%) correspondieron a hongos dematiáceos, de los que Curvularia geniculata supuso el 3,4% de los aislamientos. De las levaduras, la especie más frecuente fue C. albicans, seguida de C. parapsilosis.
Hongos aislados de 205 pacientes con queratomicosis
| Hongos hialinos | Aislamientos, n (%) | Hongos dematiáceos | Aislamientos, n (%) | Levaduras | Aislamientos, n (%) |
| Fusarium solani | 58 (28,4) | Curvularia geniculata | 7 (3,4) | Candida albicans | 8 (3,8) |
| Fusarium dimerum | 10 (4,9) | Cladosporium sp. | 6 (2,9) | Candida parapsilosis | 3 (1,5) |
| Fusarium oxysporum | 5 (2,4) | Alternaria sp. | 3 (1,5) | Candida glabrata | 1 (0,5) |
| Fusarium sp. | 3 (1,5) | Phialophora sp. | 1 (0,5) | Candida tropicalis | 1 (0,5) |
| Acremonium falciforme | 18 (8,8) | Exophiala sp. | 1 (0,5) | Candida sp. | 3 (1,5) |
| Acremonium recifei | 1 (0,5) | Wangiella sp. | 1 (0,5) | ||
| Acremonium sp. | 11 (5,4) | Scytalidium lignicola | 2 (1) | ||
| Aspergillus fumigatus | 6 (2,9) | Scytalidium dimidiatum | 2 (1) | ||
| Aspergillus nidulans | 6 (2,9) | Phialemonium sp. | 2 (1) | ||
| Aspergillus flavus | 4 (1,9) | Lecytophora sp. | 1 (0,5) | ||
| Aspergillus niger | 2 (0,9) | Dreschlera sp. | 1 (0,5) | ||
| Aspergillus glaucus | 2 (0,9) | Sin identificación | 12 (5,7) | ||
| Aspergillus sp. | 3 (1,5) | ||||
| Penicillium citrinum | 5 (2,4) | ||||
| Penicillium notatum | 1 (0,5) | ||||
| Penicilium canescens | 1 (0,5) | ||||
| Penicillium sp. | 2 (0,9) | ||||
| Scedosporium apiospermum | 3 (1,5) | ||||
| Paecilomyces sp. | 3 (1,5) | ||||
| Scopulariopsis brevicaulis | 1 (0,5) | ||||
| Geotrichum candidum | 1 (0,5) | ||||
| No identificados | 4 (1,9) | ||||
| Total | 150 (73,1) | 39 (19) | 16 (7,8) |
En todos los casos se indicaron tratamientos con diversos antifúngicos como natamicina, clotrimazol y miconazol en aplicación tópica, ketoconazol e itraconazol en aplicaciones tanto tópicas como orales, y fluconazol tópico e intravenoso en un caso. El tratamiento de ketoconazol e itraconazol suspendidos en lágrima artificial se indicó durante un período que podía ir desde uno hasta 365 días, con una media de 29 días. Para la recuperación clínica y visual de los pacientes se realizaron diversas cirugías en 81 pacientes (36,9%): en 62 casos (28,3%) se realizó trasplante de córnea y en 19 (8,7%) recubrimiento conjuntival o parche corneoescleral.
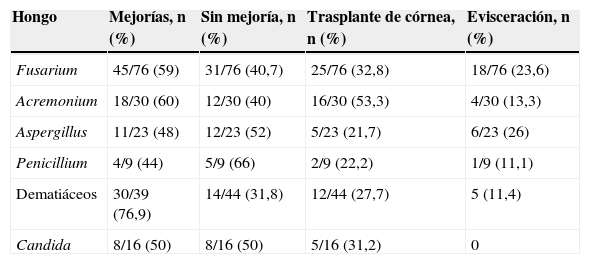
En la tabla 3 se muestra la relación entre el agente causal y la respuesta al tratamiento médico o quirúrgico. La evolución clínica fue la siguiente: en 132 pacientes (60,3%) se observó una mejoría de la lesión, considerada como disminución o desaparición de los signos de inflamación, y una mejoría de la función visual. En 87 pacientes (39,7%) no se logró mejoría y 36 pacientes (16,4%) terminaron en evisceración. Las respuestas en porcentaje de los casos tratados con antimicóticos usados en forma tópica u oral se observan en la tabla 4. El grupo de pacientes infectados por Aspergillus spp. presentó el mayor porcentaje de evisceraciones y pérdida del órgano debido a la pobre respuesta a los antimicóticos.
Relación entre el hongo causal y la respuesta de los pacientes al tratamiento médico o quirúrgico empleado
| Hongo | Mejorías, n (%) | Sin mejoría, n (%) | Trasplante de córnea, n (%) | Evisceración, n (%) |
| Fusarium | 45/76 (59) | 31/76 (40,7) | 25/76 (32,8) | 18/76 (23,6) |
| Acremonium | 18/30 (60) | 12/30 (40) | 16/30 (53,3) | 4/30 (13,3) |
| Aspergillus | 11/23 (48) | 12/23 (52) | 5/23 (21,7) | 6/23 (26) |
| Penicillium | 4/9 (44) | 5/9 (66) | 2/9 (22,2) | 1/9 (11,1) |
| Dematiáceos | 30/39 (76,9) | 14/44 (31,8) | 12/44 (27,7) | 5 (11,4) |
| Candida | 8/16 (50) | 8/16 (50) | 5/16 (31,2) | 0 |
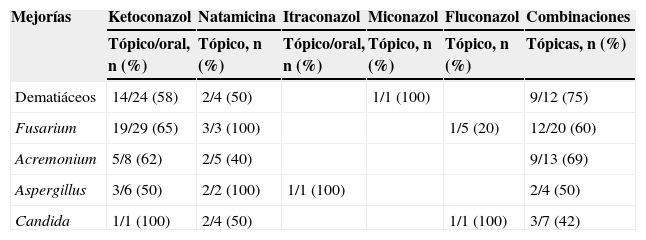
Relación entre el hongo causal y la respuesta al tratamiento con antimicóticos, y porcentaje de éxito del tratamiento
| Mejorías | Ketoconazol | Natamicina | Itraconazol | Miconazol | Fluconazol | Combinaciones |
| Tópico/oral, n (%) | Tópico, n (%) | Tópico/oral, n (%) | Tópico, n (%) | Tópico, n (%) | Tópicas, n (%) | |
| Dematiáceos | 14/24 (58) | 2/4 (50) | 1/1 (100) | 9/12 (75) | ||
| Fusarium | 19/29 (65) | 3/3 (100) | 1/5 (20) | 12/20 (60) | ||
| Acremonium | 5/8 (62) | 2/5 (40) | 9/13 (69) | |||
| Aspergillus | 3/6 (50) | 2/2 (100) | 1/1 (100) | 2/4 (50) | ||
| Candida | 1/1 (100) | 2/4 (50) | 1/1 (100) | 3/7 (42) |
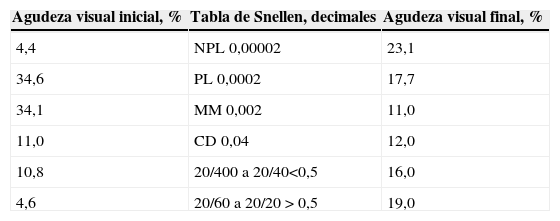
Las queratomicosis causaron pérdida de la visión como se muestra en la tabla 5; el 23% de los pacientes dejó de percibir la luz. De todo el grupo tratado, el 19% presentaba al final una agudeza visual aceptable (de 20/60 a 20/20 de acuerdo con la tabla de Snellen).
Variación en la agudeza visual de los pacientes tratados
| Agudeza visual inicial, % | Tabla de Snellen, decimales | Agudeza visual final, % |
| 4,4 | NPL 0,00002 | 23,1 |
| 34,6 | PL 0,0002 | 17,7 |
| 34,1 | MM 0,002 | 11,0 |
| 11,0 | CD 0,04 | 12,0 |
| 10,8 | 20/400 a 20/40<0,5 | 16,0 |
| 4,6 | 20/60 a 20/20 > 0,5 | 19,0 |
CD: cuenta dedos a 2m; MM: movimiento de las manos; NPL: no percepción de luz; PL: percepción de luz.
Las queratomicosis son poco frecuentes. Los pacientes pueden presentar pérdida de la visión o bien pérdida del órgano si no responden al tratamiento. En la literatura médica se documenta que la población más afectada es la masculina con una relación de 4 hombres por cada mujer4, semejante a la observada en el presente estudio. En otros países, se ha encontrado un predominio de casos en el sexo femenino6.
De la población incluida en este estudio, el sexo masculino estaba dedicado en su mayoría a actividades agrícolas o manuales y expuesto, por tanto, a traumatismos oculares con vegetales y a contaminación con tierra. Así, el antecedente traumático se refirió en el 36% de los casos. En la mayoría del grupo femenino, las queratomicosis estuvieron relacionadas con antecedente de lágrima de mala calidad por carencia del equilibrio de sus componentes o por baja producción de ésta con diagnóstico de ojo seco, como ya se ha descrito5.
Las infecciones fueron causadas en el 70,7% por hongos hialinos, en el 21,4% por dematiáceos y por levaduras en el 7,8%. Esta frecuencia es muy similar a la observada por otros autores9. En el presente estudio, la frecuencia de queratitis por hongos hialinos, particularmente Fusarium spp., fue mayor en los estados con clima cálido templado, como Puebla, Oaxaca, Michoacán, Morelos y Veracruz. La frecuencia de géneros fúngicos encontrada en México fue similar a la reportada en la India por Gopinathan et al5.
La frecuencia de Aspergillus en la presente serie fue del 11%, que es menor a la encontrada por Subbannayya et al en 1992, también en la India, en la que el principal agente fue Aspergillus fumigatus13. En los pacientes de nuestro estudio originarios de las zonas más secas y cálidas del Estado de Guerrero se identificaron con más frecuencia hongos dematiáceos (el 33% de los casos), resultado similar al encontrado por Rosa et al10.
Para el tratamiento se ha recomendado la natamicina tópica al 5% por su amplio espectro8. En nuestro país, para los primeros casos de queratomicosis se recetó natamicina en forma de ungüento dérmico7, con buena respuesta al tratamiento en 3 casos por Fusarium y en 2 casos por Aspergillus. Más tarde, al no estar comercialmente disponible, se recurrió en los pacientes posteriores al tratamiento con ketoconazol suspendido en gotas oftálmicas, además de la administración de ketoconazol por vía oral (200mg/12h), con buenos resultados en el 65% de los pacientes tratados por infección con Fusarium15. A un paciente con infección por un dematiáceo sin identificar se le administró miconazol en ungüento oftálmico con muy buena respuesta4.
Cuando los resultados terapéuticos no fueron los esperados (un caso de infección por Aspergillus), se recurrió a itraconazol tópico suspendido en lágrimas artificiales asociado a la administración por vía oral, con muy buena respuesta al tratamiento14. Finalmente, en algunos casos se usaron combinaciones de fluconazol/ketoconazol y en otros casos se administró de forma alterna natamicina en colirio al 5% con uno de los antimicóticos antes mencionados, con mejorías clínicas en el 75% de los casos causados por hongos dematiáceos y en el 69% de los casos causados por Acremonium, como se muestra en la tabla 4.
Las queratoplastias penetrantes o los trasplantes corneales se recomendaron cuando el riesgo de perforación de la córnea era inminente11,19; esta cirugía se realizó cuando las condiciones de la córnea del receptor lo permitieron y se practicó solo cuando la infección corneal estuvo inactiva, tras 4 o más semanas de tratamiento con antimicóticos. Para la recuperación clínica y visual de los pacientes se recurrió al recubrimiento conjuntival o a la queratoplastia penetrante (el 36,9% de los casos). En algunos casos se practicó más de una cirugía.
Las queratomicosis pueden tener como secuela la pérdida de la agudeza visual e incluso del órgano de la visión. A pesar de la relativa baja frecuencia con la que se presentan estas infecciones en la práctica oftalmológica, es necesario establecer un diagnóstico oportuno y un tratamiento adecuado para disminuir el riesgo de secuelas oculares graves e irreversibles.