Las infecciones fúngicas en las uñas se consideran como uno de los mayores problemas en dermatología. Entre las principales causas están la alta tasa de fracaso terapéutico, las dificultades en el tratamiento y los largos períodos necesarios, los deficientes diagnósticos y seguimiento micológicos, y las alteraciones secundarias de las uñas. Sin embargo, la aparición de nuevos antifúngicos, las nuevas formulaciones, los tratamientos combinados o los nuevos métodos han supuesto mejoras evidentes. No obstante, es imprescindible continuar la investigación en este campo.
Nail fungal infections are considered one of the major dermatological problems due to their high rate of therapeutic failure, management and treatment difficulties. Long-term treatments, inadequate therapies, mycological misdiagnosis and follow-up, secondary alterations of the nail, and resistant microorganisms, are some of the causes of these complications. Although the discovery of new antifungal agents has provided some effective molecules, none of the current available drugs are totally effective. It is important to continue researching in this field to provide new antifungal agents and combined therapies.
La onicomicosis es una de las micosis superficiales con mayor dificultad en el tratamiento; sobre esta, además, recae una elevada tasa de fracaso terapéutico que oscila, según algunos autores, entre el 20–50%54,62,68,74,78,89. La prevalencia de este tipo de infecciones puede variar entre el 2,5–16%, dependiendo de factores geográficos y de distintos factores predisponentes no siempre conocidos, aunque es difícil llegar a conocer realmente la dimensión de este tipo de infecciones16,17,40,43,52,54,62,66–68,77,78,98. Una compleja combinación de variables, entre las que no se puede infravalorar la difícil fidelización del paciente a los diferentes tratamientos existentes, afecta a la tasa de curación. En este sentido, se estima que la tasa de cumplimiento del tratamiento es tan solo del 51%78. Los tratamientos son necesariamente largos debido al lento crecimiento de las uñas, y durante gran parte de este período no llegan a observarse efectos satisfactorios inmediatos por parte del paciente. Factores como un diagnóstico micológico incorrecto, alteraciones secundarias de la uña, una elevada carga de microorganismos en la uña, la acumulación de masas de micelio (dermatofitomas), agentes etiológicos multirresistentes, inmunodeficiencia, diabetes mellitus o enfermedad vascular periférica, junto con una modalidad de tratamiento inadecuada, también influyen en la baja tasa de curación y en la elevada tasa de recidivas o reinfecciones33,52,55,66,67,77,89,90,99. Por otro lado, es importante considerar los problemas de índole farmacológica relacionados con la capacidad de penetración y el porcentaje de retención del antifúngico en la uña y la existencia de resistencias primarias o secundarias33,68,78. Así, es necesario conocer el perfil y el espectro de actividad del fármaco seleccionado para el tratamiento y, también, aunque no de forma imprescindible, determinar la sensibilidad del agente etiológico sobre las esporas durmientes en la queratina de la uña y las formas proliferativas del hongo90. Esto hace valorar el papel que desempeña el estudio de sensibilidad a los antifúngicos en el laboratorio y la utilidad de éste para el dermatólogo, si bien este tipo de pruebas, hasta el momento, sólo están recomendadas para aislamientos de infecciones sistémicas graves36.
Los cambios experimentados en el tratamiento de las onicomicosis han desplazado a las técnicas de avulsión quirúrgica y las preparaciones magistrales locales, y han dado paso al uso de nuevos agentes antifúngicos, de uso tópico u oral, o bien una combinación de ambos debido tanto a las frecuentes reinfecciones y recaídas como a los efectos posquirúrgicos16,53,66,80,82. Pero es fundamental e imprescindible una correcta identificación del agente causal para conseguir una buena indicación terapéutica por medio de la confirmación en el laboratorio, que no en todos los casos se realiza33,58,66,78,106.
Tratamiento de las dermatomicosis unguealesEn el tratamiento de las infecciones ungueales producidas por hongos dermatofitos son importantes los criterios de potencia o efectividad de los antifúngicos pero también se añaden otros, como son la edad del paciente, la forma clínica, la extensión y el tiempo de evolución de la infección y las posibles contraindicaciones33,49,53,61,64,67,74,78,89,95,98. El tratamiento de la infección depende, en alguna medida, del grado de aceptación de la pauta asignada y de la forma de administración del medicamento por parte del paciente66,74,89. Además del diferente grado de sensibilidad que muestran los diversos tipos de agentes etiológicos al abanico de sustancias, es necesario considerar el patrón de actividad in vitro de los antifúngicos y, en algunos casos, su reducida capacidad de penetración en la uña19,20,39,66,89. Desde el punto de vista de la infección, son decisivos los problemas derivados de la estructura de la uña así como, también, el área afectada. Ambos factores por sí solos influyen en la efectividad del tratamiento78. En la elección del tratamiento es importante valorar las características farmacodinámicas del antifúngico, ya que condiciona su capacidad, entre otros aspectos, de «inundar» completamente la estructura de la masa ungueal que en sí misma es irregular. El antifúngico debe permanecer retenido allí, en concentraciones que, como mínimo, sean fungistáticas para garantizar el cese de la actividad invasiva del hongo. La capacidad de desarrollar la actividad antifúngica varía entre las distintas familias químicas empleadas, puesto que algunos se comportan como fungicidas, mientras que otros sólo lo hacen como fungistáticos y se limitan simplemente a provocar el cese del desarrollo en lugar de destruir25. Al presentar los antifúngicos existentes una débil capacidad de penetración en los dermatofitomas, la elección estratégica de un tratamiento tópico vendrá dada por la capacidad del fármaco de difundirse en la lámina ungueal78. Esta propiedad depende especialmente del vehículo utilizado y de la vía de administración elegida78. Pero, además, si el antifúngico no alcanza completamente los bordes laterales de la uña y gran parte de la lámina ungueal, la efectividad del tratamiento también se reduce74,78.
La divergencia entre la curación clínica o desaparición de los síntomas y la curación micológica podría añadirse a las causas de los diferentes porcentajes de curación o de fracaso del tratamiento característico en este tipo de infección35,62,78,89. Por esto, puede ser acertado realizar un diseño previo del tratamiento que contemple los diversos factores limitantes de éste a la hora de conseguir un éxito terapéutico74,78.
Las principales líneas de trabajo sobre nuevos antifúngicos intentan, con diversa suerte, evitar problemas de toxicidad, seguridad y efectividad18,25. Básicamente, estas líneas se han centrado en el diseño de nuevas formulaciones de derivados azólicos (imidazoles triazoles) y de otros grupos químicos; la combinación de antifúngicos, y, también, nuevas familias de moléculas no azólicas25. Ciertamente se han conseguido antifúngicos con una mayor potencia, pero su uso terapéutico puede estar limitado por los efectos de toxicidad y las interacciones con distintas sustancias que pueden presentar8,22,58. En la mayoría de las infecciones superficiales, la dosis de antifúngico suministrada excede a las concentraciones mínimas inhibitorias que son necesarias para inhibir el desarrollo del hongo, pero pocos estudios establecen las concentraciones mínimas fungicidas. Sin embargo, en determinadas enfermedades o situaciones de resistencia intrínseca o primaria o pautas de tratamiento finalizadas anticipadamente a la curación micológica, los tratamientos resultan ineficaces.
Los métodos quirúrgicos de eliminación total o parcial de la uña se desaconsejan por los posibles problemas posteriores, como la afectación del crecimiento normal de la uña y, por lo tanto, el desarrollo de una uña con mayor predisposición a la infección fúngica y con tendencia a la reinfección, además del efecto antiestético que producen46,66,67. La avulsión o abrasión o desbridado de la uña por oclusión, por medio de métodos químicos indoloros con urea, junto con la aplicación de antifúngicos tópicos, se reserva para uñas distróficas y para pacientes con contraindicación a tratamientos con antifúngicos orales y como adyuvante de tratamientos tópicos; facilita la eliminación de una gran masa del hongo capaz de invadir7,33,40,53,67,80,104. Sin embargo, algunos estudios concluyen que la avulsión quirúrgica no aportaría nada efectivo en el tratamiento, contrariamente a la oclusión, aunque en este caso sin diferencia estadística al utilizar antifúngicos tópicos como ketoconazol y oxiconazol46. Hoy por hoy parece sensato pensar en la posibilidad de aplicar sistemas de liberación transungueal del antifúngico mediante dispositivos (parches) de administración semanal/mensual a la vista del balance coste-beneficio que los actuales tratamientos aportan8. Entre los más recientes están los de hidroxipropilcelulosa de aplicación tópica, itraconazol y alfatocoferol, y también los de sertaconazol ya mencionados97,102.
Antifúngicos de uso tópico (local)La preferencia por los tratamientos a base de formulaciones tópicas está asociada a las infecciones que no afectan a grandes áreas, y quedan reservados a algunos tipos de onicomicosis52,78. Algunos autores consideran la falta de eficacia de este tipo de tratamientos, si no es mediante su aplicación en los estados iniciales de la infección33. El 85% de las onicomicosis son incapaces de responder al tratamiento tópico5. En general, los resultados obtenidos mediante la administración tópica pueden mejorarse con la asociación con tratamientos orales o la avulsión por distintos procedimientos preferentemente químicos7,58,59,66,67,78,80. No obstante, la utilidad del tratamiento tópico está, en términos terapéuticos, en los casos de contraindicación de administración oral y también como profilaxis5,6,67.
La administración por vía oral de algunos antifúngicos empleados por vía tópica no es posible debido a la baja absorción de este tipo de sustancias. En otros casos, se requieren sustancias de mayor especificidad, seguridad y menor toxicidad34. Las formulaciones utilizadas preferentemente en las onicomicosis conocidas como «cosméticas» se basan en la utilización de un vehículo en forma de lacas incoloras, si bien otros métodos, como los apósitos, también están disponibles. Ésta es una alternativa útil en el caso de antifúngicos como tioconazol, amorolfina, ciclopiroxolamina y sertaconazol, entre otros.
AzolesEl mecanismo de acción de este grupo de antifúngicos se basa en la inhibición de la enzima lanosterol demetilasa, que induce un efecto fungistático que frena la proliferación del hongo, y se necesitan concentraciones mucho más altas para conseguir el efecto fungicida22. Los antifúngicos azólicos actúan más lentamente si se comparan con los poliénicos (anfotericina B, nistatina), y prevalece, entre los primeros, una mayor selectividad por las membranas fúngicas, en comparación con aquella sobre las membranas de las células de los mamíferos. Esta característica garantiza una menor toxicidad. Se trata, además, de moléculas con un marcado carácter lipófilo en algunos casos (itraconazol), lo que facilita la acumulación de moléculas activas en forma de reservorio dentro del estrato córneo de la piel94. Esta acumulación está directamente relacionada con factores físicoquímicos de la molécula y es superior en sustancias de menor peso molecular94.
TioconazolEl tioconazol es un antifúngico de amplio espectro de acción, activo frente a levaduras y hongos filamentosos dermatofitos y no dermatofitos, también Trichomonas vaginalis, Chlamydia spp., Gardnerella vaginalis, Corynebacterium minutissimun, Staphylococcus epidermidis y otras bacterias grampositivas2,42. Tiene un perfil de actividad superior al del miconazol3,42. Su absorción es muy reducida por vía cutánea, incluso si se emplea en concentraciones del 28%3,42. El tioconazol se revela especialmente eficaz para el tratamiento de micosis en la que existan sobreinfecciones por bacterias sensibles a este antifúngico. Si bien en la onicomicosis los tratamientos aplicados en forma de laca tienen reducidos efectos adversos, se han descrito algunas alergias de contacto atribuidas más a la alta concentración del antifúngico que a la laca96. Una de las formas de mejorar la formulación convencional de tioconazol es la utilización de este antifúngico en concentraciones del 28% en una solución alcohólica con ácido undecilénico68.
BifonazolEI bifonazol aporta, como ventaja, su amplio espectro de acción in vitro que incluye a levaduras, hongos dimórficos, dermatofitos y otros filamentosos y a Malassezia, a pesar de que algunos de estos casos no tienen una gran importancia en las onicomicosis2,3,42. Su lipofilia y también su reducida solubilidad en agua hacen que la eficacia esté relacionada con el elevado tiempo de retención cutánea que presenta y su biodisponibilidad tópica, unidas a una buena tolerancia como ventajas adicionales42. Sin embargo, en la onicomicosis, el rendimiento observado es menor al de otras micosis superficiales, excepto cuando está asociado con urea (40%). A pesar de su eficacia por medio del tratamiento oclusivo, los resultados de sensibilidad in vitro son netamente superados, no sólo por los nuevos antifúngicos triazólicos, sino también por otros antifúngicos de la familia que se utilizan por vía tópica frente a hongos dermatofitos, como es el caso de sertaconazol28. A pesar de que el tratamiento oclusivo es seguro, en especial en pacientes en edad pediátrica, se observan algunos efectos adversos, como erosiones, dolor y dermatitis atribuibles a los adhesivos; sin embargo, éstos ceden al cesar el tratamiento12,92,104.
SertaconazolEl sertaconazol aparece como una de las nuevas formulaciones específicas para el tratamiento de la onicomicosis en parches transparentes autoadhesivos, presentados en 3 tamaños diferentes (0,85; 1,5,–2,5cm2) que contienen una concentración de antifúngico de 1,65mg/cm297. Uno de los mayores beneficios es la posibilidad de realizar una única aplicación semanal en tratamientos que duran entre 6–12 meses23,97. Esto permite asegurar una mayor fidelidad del paciente al tratamiento y, como consecuencia, un incremento de las tasas de eficacia del antifúngico sin que exista absorción sistémica97. Las concentraciones obtenidas en la uña entre las 2–6 semanas después de las aplicaciones están comprendidas entre los 100–150ng/mg y se sitúan por encima de las necesarias para conseguir la inhibición de los hongos causantes de onicomicosis20,23,28,97.
Otros imidazolesOtros imidazoles tópicos como miconazol (polvo al 2%) se han utilizado como tratamiento posterior a la curación para evitar reinfecciones, pero debido al reducido número de pacientes los datos obtenidos no fueron significativos105. También se ha utilizado el miconazol en solución alcohólica para el tratamiento de onicomicosis por Candida spp11. También las formulaciones en crema (ketoconazol al 2% y oxiconazol al 1%) se han utilizado en estudios comparativos para establecer el beneficio de la avulsión quirúrgica conjunta con antifúngicos tópicos en el tratamiento, sin resultados positivos46.
Nuevas moléculas antifúngicasLa síntesis de nuevos derivados triazólicos como es el KP-103, con una buena actividad antifúngica in vitro, ha propiciado una alternativa para el tratamiento de infecciones fúngicas por vía tópica debido a la elevada cantidad de sustancia activa que permanece en la uña100. Algunos ensayos en modelos animales de Tinea unguium han revelado una actividad superior de esta molécula en comparación con la terbinafina oral y la amorolfina tópica, sin afectar a la queratina debido a su baja afinidad por ella y permaneciendo allí en forma activa100. Del mismo modo, el óxido de cariofilina, un terpenoide utilizado como conservante alimentario, también ha mostrado actividad en modelos animales de onicomicosis o también otras moléculas como AN-26909,108.
AlilaminasLos antifúngicos de esta familia tienen un mecanismo de acción basado en la inhibición de la síntesis de ergosterol, pero lo hacen interfiriendo una reacción enzimática distinta a la de los antifúngicos azólicos22,66. En especial, la terbinafina y la amorolfina son capaces de provocar una doble acción, tanto fungicida como fungistática, y esta actividad se ve favorecida en el tejido adiposo y epitelial gracias al carácter lipófilo de ambas moléculas66. Además, la vida media en las uñas es muy prolongada, importante para el tratamiento de este tipo de infecciones, a pesar de que la concentración alcanzada allí es inferior a la del tejido adiposo y la piel38. Esta acción genera un efecto protector que dificulta la aparición de recidivas. Entre los efectos adversos, se han descrito dermatitis de contacto e interacciones con la rifampicina y la cimetidina, entre otros fármacos por vía oral, que son reversibles13,53,66,78. La terbinafina tiene una elevada actividad frente a hongos dermatofitos, pero a la vez inferior frente a levaduras del género Candida20,21,78,86. Algunos estudios señalan una eficacia en la onicomicosis de hasta el 91%, que es superior a la eficacia de la griseofulvina, el itraconazol y el fluconazol en las uñas de los pies y con incidencias de efectos adversos del 5,5%13,50. El grado de satisfacción de los pacientes a los que se les prescribe este antifúngico se describe como elevado, especialmente en diversos grupos de pacientes entre los que se incluye a los pediátricos y geriátricos, los inmunodeprimidos, los diabéticos y los pacientes con síndrome de Down12,60,87. La formulación tópica de terbinafina contiene una sustancia que potencia la penetración en la uña y desarrolla una acción sobre modelos animales que es superior a la de ciclopiroxolamina (laca al 8%)60. El uso terapéutico de este antifúngico puede ser útil como apoyo al tratamiento oral y es eficaz en estudios experimentales realizados con modelos animales de dermatofitosis45,53.
La naftifina sólo es útil por vía tópica y es efectiva en infecciones causadas por levaduras y hongos dermatofitos; carece, además, de actividad frente a bacterias. Se acumula rápidamente en el estrato córneo y se transporta a la dermis, la epidermis y el tejido adiposo60. Se emplea como complemento de tratamientos orales.
Se han abierto nuevas formas de tratamiento de la onicomicosis mediante la aplicación transungueal de terbinafina en laca y rayos láser, basada en la producción de microperforaciones (fotoablación) en la uña, lo que facilita la penetración del antifúngico hasta la parte afectada en concentraciones que superan las CMI9080. Las perforaciones se sellan con el antifúngico en su interior mediante la aplicación de laca. Mediante este mecanismo el antifúngico puede llegar a las capas de la matriz ungueal de forma lateral y crear una redistribución en el tejido blando y el lecho ungueal mayor80. El grado de afectación de la uña condiciona el número de repeticiones del tratamiento. Esta administración reduce el número de aplicaciones del tratamiento convencional.
MorfolinasLa amorolfina es una sustancia de amplio espectro y elevada actividad antifúngica para el tratamiento de la onicomicosis, para la que se aplica en laca al 5%53,78,93. La amorolfina está recomendada en casos de onicomicosis superficial blanca en los que hay afectación del dorso de la placa ungueal, también en la onicomicosis subungueal distal lateral moderada y en las onicomicosis graves cuando se utiliza de forma combinada con itraconazol oral7,53. Las pautas de tratamiento con amorolfina (laca al 5%) consisten en aplicaciones (1 o 2 veces/semana) durante 6 meses en las uñas de la mano y durante 9–12 meses en las uñas de los pies78. El desbridado de la uña consigue mejorar la efectividad del tratamiento tópico con algunos antifúngicos78. Algunos ensayos clínicos ofrecen datos de curación que se sitúan entre el 60–76% en onicomicosis, superiores a los de ciclopiroxolamina y tioconazol53. El tiempo de permanencia de amorolfina en laca al 5% en las uñas es superior al de ciclopiroxolamina y tioconazol93. Sin embargo, su principal ventaja radica en la capacidad de actuar sobre estructuras de resistencia de los hongos en las uñas y, por lo tanto, reducir el riesgo de recidivas41.
CiclopiroxolaminaLa ciclopiroxolamina pertenece a un grupo químico de sustancias (hidroxipiridonas) que están consideradas como bloqueantes del inicio de la fase G1/S101. Existe una relación entre el mecanismo de acción, el de adherencia y el efecto antiinflamatorio y antialérgico característico de este antifúngico54,70. En sus formulaciones de crema o laca, su espectro de actividad cubre las levaduras, los hongos dermatofitos y otros filamentosos15,54,57,70,75,78,83,101. Se trata de un antifúngico de rápida absorción por vía oral y se elimina por vía renal101. La formulación en laca al 8% permite, tras la evaporación del solvente, concentrar en la uña cantidades de antifúngico superiores a las inhibitorias para una gran cantidad de hongos patógenos93. Estas concentraciones pueden llegar a la zona dorsal y al lecho de la placa ungueal hasta una profundidad de 0,4mm. Los rangos de curación micológica alcanzados con la formulación de ciclopiroxolamina en laca al 8% en períodos de tratamiento de 48 semanas se sitúan, en algunos estudios, entre el 29–36%, lo que aporta ventajas, como un coste menor que el tratamiento oral48–51,53,56,93. Estos resultados mejoran al practicar el desbridado de la zona interna de la uña por parte de personal cualificado, práctica recomendada incluso en tratamientos orales y en casos de onicomicosis múltiples7,53,93. Se han descrito diversos efectos adversos (7–9%), como eritema y un reducido porcentaje de sensación de quemazón en el lugar de la aplicación, y, en menor proporción, alteraciones de las uñas que desaparecen al cesar el tratamiento53,93. El uso de ciclopiroxolamina no debe superar los 6 meses de duración y se inicia con una aplicación cada 48h el primer mes de tratamiento, para reducir a 2 semanales en el segundo mes de tratamiento y a una semanal el tercer mes de tratamiento78. La ciclopiroxolamina está recomendada por su eficacia en casos no graves de onicomicosis superficial blanca en la que está afectado el dorso de la placa ungueal y en la onicomicosis subungueal distal lateral moderada7. Su utilización reduce el coste del tratamiento en comparación con los tratamientos orales47,50
Antifúngicos de uso oralEl tratamiento oral (monoterapia o combinada, secuencial o pulsada) está recomendado en aquellos tipos de onicomicosis que presenten una afectación superior al 50% de la lámina ungueal y respecto o no de la matriz ungueal, así como ante la existencia de fracaso terapéutico previo tras la administración convencional antifúngica por vía tópica que, además, puede ser difícil de seguir, y también para onicomicosis múltiples34,52,53,74,78,89. La asociación de antifúngicos no significa de forma obligatoria un aumento del espectro, ya que se utilizan cuando los 2 son activos sobre el microorganismo y buscan potenciar el efecto terapéutico. Se han descrito los tratamientos con itraconazol y terbinafina como los más efectivos por su balance positivo coste/beneficio7,56. La elección del tratamiento oral, por término medio de 9 meses de duración, produce mejores resultados que el tópico, aunque el coste económico es superior95. Uno de los puntos críticos es la eliminación por vía hepática y renal de muchos antifúngicos, lo que supone la recomendación de individualizar la selección del antifúngico más adecuado y la posterior supervisión de los parámetros analíticos de estos órganos durante el tratamiento oral7. Los valores de seguridad publicados difieren según se trate de tratamientos orales convencionales o pulsados, además del tipo de antifúngico administrado30. La incidencia de efectos adversos en la función renal es del 3,44% para la terbinafina (dosis oral de 250mg/día); del 1,96 y del 4,21% para el itraconazol (dosis oral de 100 y 200mg/día respectivamente), y del 1,51% para el fluconazol (50 dosis orales de 50mg/día)30. En particular, esos datos son algo diferentes en el tratamiento pulsado o intermitente (el 2,09% para la terbinafina; el 2,58% para el itraconazol, y del 1,98 al 5,76% para el fluconazol), lo que evidencia la influencia del cambio de dosis en los distintos casos (150mg/semana y 300–400mg/semana, respectivamente)49. Existen datos que avalan la mejora aportada por los tratamientos combinados (tópicos-orales) sobre las monoterapias, ya sea de tipo continuado o intermitente, mientras que los datos analizados de otros trabajos no presentan diferencias significativas entre ambos tratamientos5,6,62. De cualquier modo, el empleo de tratamientos basados en la combinación de antifúngicos puede incrementar el espectro antifúngico, al utilizar moléculas con sinergia y mecanismos de acción diferentes, como es el caso de la demostrada para las parejas posaconazol-terbinafina, anfotericina B-caspofungina y posaconazol-caspofungina, entre otras32.
GriseofulvinaSu mecanismo de acción, basado en la alteración de la síntesis de la pared celular del hongo, al que se añaden interferencias en la estructura y función de los microtúbulos, explica el efecto inhibitorio producido en la mitosis de células en fase reproductiva14. Posee una actividad fungistática y sólo es activa sobre hongos dermatofitos66–68. La griseofulvina se acumula preferentemente en células precursoras de queratina, en donde queda fijada, y aumenta la resistencia de esta proteína al ataque de los hongos queratinolíticos, pero no alcanza de forma satisfactoria la zona infectada de la uña, aunque sí llega a formar una barrera fungistática que evita el avance del hongo patógeno, al menos cuando se ha ensayado de forma tópica53,85. Este antifúngico no produce directamente la muerte celular, por lo que deja la responsabilidad de la eliminación total del patógeno al sistema inmunológico del paciente. Esta droga requiere la administración por vía sistémica cada 6h, a pesar de que la vida media es de 24–30h a causa de su absorción. Por esto, son necesarios tratamientos de 6–9 meses para las uñas de las manos y de 12–18 meses para las uñas de los pies33,66,85. El amplio abanico de efectos secundarios y elevada toxicidad, la baja tasa de cumplimiento del tratamiento y el fracaso terapéutico observado y de recurrencia cercano al 50% son motivos por los que su uso es reducido en el tratamiento de las onicomicosis33,53,66,68,69,78.
Antifúngicos azólicosKetoconazolEl ketoconazol fue el primer antifúngico imidazólico utilizado por vía oral, pero son numerosos los efectos secundarios que presenta, tanto como las interacciones con otros fármacos y su absorción, por lo que la irrupción de nuevas moléculas antifúngicas relegó al ketoconazol a un uso prácticamente como agente tópico33,53.
FluconazolEl fluconazol es un antifúngico de tipo triazólico de uso oral capaz de penetrar en las uñas a través del lecho ungueal y de la matriz con el que se alcanzan concentraciones elevadas que se mantienen durante varios meses78. Empleado por vía oral, se siguen pautas de tratamiento de 300–450mg/semana, a pesar de las bajas tasas de curación obtenidas en comparación con otros antifúngicos que oscilan entre el 12–37% en tratamientos de 6 y 12 semanas (para las uñas de las manos y de los pies, respectivamente). Se han descrito porcentajes del 21–32% de curación tras 48 semanas de tratamiento con dosis orales de fluconazol de 150mg/12 semanas y 150mg/25 semanas con un 56 y un 39% de fallos terapéuticos, respectivamente33. En este caso, las pautas de tratamiento intermitentes se realizan con dosis de 150–300mg semanales durante 3 meses para las uñas de las manos y durante 6 meses en las uñas de los pies53,78. La actividad in vitro de esta sustancia es reducida frente a hongos dermatofitos en comparación con la obtenida frente a levaduras del género Candida y, a su vez, es reducida de forma comparativa con otras sustancias; presenta, además, interacciones con otros fármacos10,31. Se han descrito problemas de resistencia intrínseca y adquirida, en especial entre algunas especies del género Candida, y un elevado número de hongos dermatofitos10,26,31. El fluconazol se absorbe de forma rápida tras su administración y la disponibilidad para las células es elevada, por tener una baja tasa de unión a proteínas plasmáticas, hecho que permite alcanzar grandes concentraciones cutáneas o ungueales. La acumulación en el estrato córneo de la piel y su baja eliminación permiten la administración de dosis elevadas y más espaciadas (intermitentes). Los efectos adversos son más reducidos y las interacciones prácticamente se reducen a la rifampicina, las sulfonilureas, la warfarina, la fenitoína y la teofilina109.
ItraconazolLa efectividad del itraconazol es, sin duda, superior a la del fluconazol, en tanto no aparezcan otras sustancias como voriconazol, posaconazol o ravuconazol que, al estar disponibles para uso clínico, aún no se destinan al tratamiento de micosis superficiales, a pesar de tener una actividad invitro superior19,33,39,66. El itraconazol aporta tasas de curación superiores al fluconazol, con pautas de tratamiento que permiten asegurar una mayor fidelidad por parte del paciente al tratamiento52,53,54. Los rangos de curación micológica descritos en formas distales de onicomicosis oscilan entre el 65–88%33,66,79. Una de las razones es la buena capacidad de penetración en la uña y la posibilidad de alcanzar concentraciones inhibitorias efectivas en las zonas distales de ésta68. Esas concentraciones se mantienen de forma eficaz durante varios meses pero se eliminan del plasma al cesar el tratamiento33,54,68,77,78. Se trata de una molécula que se fija muy bien a la queratina y alcanza niveles elevados en la mucosa, la piel y las uñas; estos niveles se mantienen durante al menos 3–4 semanas posteriores al término del tratamiento52,68,78. El itraconazol se incorpora a la matriz de la uña por difusión desde el lecho ungueal, en donde forma una barrera fungistática que evita la invasión del hongo. Este hecho ha permitido evaluar la buena efectividad de los tratamientos intermitentes en forma de pulsos (administración de 200mg/12h durante una semana por mes, seguido de 3 semanas sin tratamiento, durante 2 meses para las uñas de las manos y durante 3 meses para las uñas de los pies)53,64,68,78,79. Paradójicamente, estos tratamientos no siempre gozan de aceptación por parte del paciente103. Los efectos adversos del itraconazol se producen debido a su mecanismo de acción, que no es capaz de discriminar entre su diana de acción (enzimas dependientes del citocromo P-450), presente tanto en el hongo como en la célula de mamífero, y la interacción con otros fármacos66,78. Entre los efectos secundarios se han descritos náuseas, dolor abdominal, dispepsia y cefaleas, pero no importantes y en todo caso reversibles66, hasta la descripción de 2 casos de contracciones ventriculares prematuras en adultos asociados al tratamiento oral de la onicomicosis81. Tiene interacción con la fenitoina, los antiglucemiantes orales, anticoagulantes cumarínicos, la digoxina, la terfenadina, el astemizol y la ciclosporina, entre otros76. Este tipo de acciones origina graves efectos secundarios66. Se desaconseja su uso durante el embarazo66.
El itraconazol tiene un amplio espectro de acción y una moderada actividad frente a hongos dermatofitos en comparación con otras sustancias39. Su administración por vía oral está recomendada en casos de dermatofitosis extensas y algunas onicomicosis que llegan a cronificarse5,52,53. La asociación de itraconazol con ciclodextrina para su administración por vía oral en forma de suspensión/solución jarabe mejora diversos parámetros farmacológicos del antifúngico, como su absorción, su biodisponibilidad y su vida media, mientras que disminuye la interacción con otros fármacos52.
Nuevos derivados triazólicosLas nuevas moléculas triazólicas, entre las que destacan el voriconazol, el posaconazol, el isavuconazol, el albaconazol o el ravuconazol, tampoco tienen entre sus indicaciones preferentes el tratamiento de las dermatofitosis y, concretamente, onicomicosis, a pesar de que tienen una elevada actividad antifúngica in vitro frente a hongos dermatofitos1,24–27,39,44,53,65,71,84,88,91,107. Con la aparición de estos antifúngicos de actividad superior, otros como el itraconazol y el fluconazol han pasado a la categoría de «clásicos» en el tratamiento de estas infecciones.
AlilaminasTerbinafinaEs el antifúngico de elección ante hongos dermatofitos y en las onicomicosis que afectan a las uñas de los pies40. Los valores de las concentraciones obtenidas en la uña superan los valores de la actividad antifúngica frente a hongos dermatofitos52,71,90. Las tasas de curación obtenidas con terbinafina están situadas entre el 44–75% y el 79,3% con dosis de 250mg/día durante 12–16 semanas para las uñas de los pies y durante 6 semanas para las uñas de las manos33,53,56,64. Un rasgo característico de la terbinafina es la buena capacidad de penetración y el poder alcanzar concentraciones inhibitorias fungicidas efectivas en zonas distales de la uña, que se mantienen durante varios meses, pero que se eliminan del plasma al cesar el tratamiento66. Las pautas de tratamiento van desde los 250mg/día durante 4 meses y los 100–200mg durante 6 semanas, en administración oral, para las uñas infectadas en las manos y durante 12–20 semanas para las uñas de los pies66,78,79. También se han descrito pautas pulsadas de 250mg/12h administrados durante una semana/mes con 2–4 pulsos con porcentajes de curación del 79–87%62,78,79,89. El mecanismo de acción de este antifúngico no interfiere con enzimas dependientes del citocromo P-450 en las células de los mamíferos; por lo tanto, los efectos adversos de la utilización oral de terbinafina descritos con mayor frecuencia son alteraciones cutáneas, alteraciones del gusto y molestias gastrointestinales leves, aunque se han informado otras de mayor entidad, como disfunción hepática, por lo que no está indicado en pacientes con enfermedad hepática29,53,78,106. Por otro lado, tiene menos interacciones con otros fármacos que itraconazol53,66,78. Es posible encontrar niveles de terbinafina administrada por vía oral en uñas de 0,2μg/g de uña a los 90 días de finalizar el tratamiento39. Se han realizado ensayos clínicos sobre la eficacia del tratamiento pulsado con terbinafina, combinado con tratamientos tópicos con amorolfina al 5% y ciclopiroxolamina al 8%, sin que se aporten mejoras significativas con la combinación62. En el grupo de pacientes geriátricos, la efectividad de la terbinafina mejora con el desbridado de la uña como, en general, en pacientes con tratamientos orales, en especial cuando existe dermatofitoma53,79.
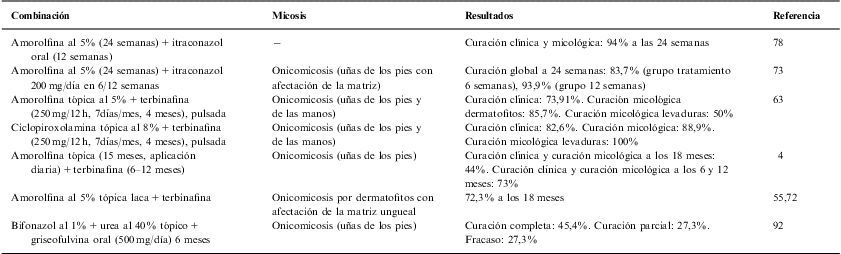
Tratamiento combinadoLa combinación de antifúngicos (tratamiento combinado) ha producido avances en el tratamiento de estas micosis, especialmente en las graves o múltiples5,6,37,53,54,59,62,63. Se han descrito asociaciones (tabla 1) de terbinafina e itraconazol oral administrados de forma no consecutiva58,78; tioconazol al 28% en administración tópica y griseofulvina oral78; isoconazol tópico al 1% e itraconazol o griseofulvina orales; amorolfina al 1% laca y terbinafina o itraconazol orales4,78; amorolfina al 5% laca o ciclopiroxolamina al 8% y terbinafina oral4,56,63,72,78; ciclopiroxolamina y terbinafina56; amorolfina laca e itraconazol oral o terbinafina oral72; amorolfina y griseofulvina82; itraconazol y amorolfina73; bifonazol-40% urea-griseofulvina92. Algunas de estas combinaciones desarrollan efectos sobre estructuras de resistencia de hongos dermatofitos de la queratina de las uñas, pero todos los casos aportan evidentes mejoras en la curación con respecto al tratamiento oral convencional con un solo antifúngico50,54,90. El tratamiento combinado puede administrarse de forma secuencial o también paralela82,78. Esta cuestión aun será más crítica al producirse la incorporación de los nuevos triazoles, aunque no siempre la combinación supone un peor balance económico que la monoterapia, como es el caso de amorolfina tópica+terbinafina o itraconazol oral63,64,72,86.
Comparación de los resultados obtenidos en diferentes tratamientos combinados
| Combinación | Micosis | Resultados | Referencia |
| Amorolfina al 5% (24 semanas)+itraconazol oral (12 semanas) | − | Curación clínica y micológica: 94% a las 24 semanas | 78 |
| Amorolfina al 5% (24 semanas)+itraconazol 200mg/día en 6/12 semanas | Onicomicosis (uñas de los pies con afectación de la matriz) | Curación global a 24 semanas: 83,7% (grupo tratamiento 6 semanas), 93,9% (grupo 12 semanas) | 73 |
| Amorolfina tópica al 5%+terbinafina (250mg/12h, 7días/mes, 4 meses), pulsada | Onicomicosis (uñas de los pies y de las manos) | Curación clínica: 73,91%. Curación micológica dermatofitos: 85,7%. Curación micológica levaduras: 50% | 63 |
| Ciclopiroxolamina tópica al 8%+terbinafina (250mg/12h, 7días/mes, 4 meses), pulsada | Onicomicosis (uñas de los pies y de las manos) | Curación clínica: 82,6%. Curación micológica: 88,9%. Curación micológica levaduras: 100% | |
| Amorolfina tópica (15 meses, aplicación diaria)+terbinafina (6–12 meses) | Onicomicosis (uñas de los pies) | Curación clínica y curación micológica a los 18 meses: 44%. Curación clínica y curación micológica a los 6 y 12 meses: 73% | 4 |
| Amorolfina al 5% tópica laca+terbinafina | Onicomicosis por dermatofitos con afectación de la matriz ungueal | 72,3% a los 18 meses | 55,72 |
| Bifonazol al 1%+urea al 40% tópico+griseofulvina oral (500mg/día) 6 meses | Onicomicosis (uñas de los pies) | Curación completa: 45,4%. Curación parcial: 27,3%. Fracaso: 27,3% | 92 |
A pesar de que la investigación sobre antifúngicos ha fructificado en la aparición de nuevas sustancias para el tratamiento, los actualmente disponibles están lejos de ser efectivos totalmente, por lo que es imprescindible continuar la investigación sobre nuevos fármacos, nuevas formulaciones y nuevas combinaciones, en especial aquellos con una mayor capacidad de penetración en la uña18,25,33,89. Ninguno de los esquemas de tratamiento existentes se ha mostrado altamente eficaz para el tratamiento de las onicomicosis, por lo que aún las tasas de curación están muy lejos de llegar al 100% y situar el coste económico del tratamiento de las infecciones producidas por hongos en las uñas en niveles reducidos5,25,33,52,63,64. Son especialmente innovadoras las alternativas a los tratamientos convencionales basadas en sistemas de liberación sostenida de antifúngicos, así como también la utilización de microabrasiones y la utilización del láser.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.