La candidemia es una de las micosis oportunistas más frecuentes en todo el mundo. El escaso número de estudios epidemiológicos llevados a cabo en América Latina indica que las tasas de incidencia en esta región son mayores que las descritas en el hemisferio norte. A menudo el diagnóstico de la infección se establece tardíamente, lo que afecta el inicio del tratamiento antimicótico. Por esta razón, para el diagnóstico y el manejo de la candidemia está justificada una estrategia más científica, basada en parámetros específicos.
Recomendaciones para el diagnóstico y manejo de la candidemia constituye una serie de artículos preparados por miembros del grupo Latin America Invasive Mycosis Network. Su objetivo es proporcionar las mejores evidencias disponibles para el diagnóstico y el manejo de la candidemia.
El presente artículo, Recomendaciones para el manejo de la candidemia en niños en América Latina, ha sido redactado con el objetivo de orientar a los profesionales de la salud en el manejo de los niños que padecen, o pueden padecer, candidemia.
Mediante la base de datos PubMed se emprendió una búsqueda informatizada de los estudios publicados. Los miembros del grupo revisaron y analizaron exhaustivamente los datos. El grupo también se reunió en dos ocasiones para proponer preguntas, abordar los puntos de vista conflictivos y deliberar sobre las recomendaciones terapéuticas.
Recomendaciones para el manejo de la candidemia en niños en América Latina está orientado al manejo de pacientes neutropénicos y no neutropénicos, e incluye aspectos sobre la profilaxis, la terapia empírica, el tratamiento de la candidemia confirmada, el seguimiento del paciente después del diagnóstico de la candidemia, la duración del tratamiento y el manejo del catéter venoso central.
Este manuscrito es el tercero de los artículos de esta serie dedicada al diagnóstico y tratamiento de las candidiasis invasoras. Otras publicaciones de esta serie son Recomendaciones para el diagnóstico de la candidemia en América Latina, Recomendaciones para el manejo de la candidemia en adultos en América Latina, y Recomendaciones para el manejo de la candidemia en neonatos en América Latina.
Este artículo está publicado en inglés en este mismo número. Puede encontrarlo enhttp://dx.doi.org/10.1016/j.riam.2013.05.010
Candidemia is one of the most frequent opportunistic mycoses worldwide. Limited epidemiological studies in Latin America indicate that incidence rates are higher in this region than in the Northern Hemisphere. Diagnosis is often made late in the infection, affecting the initiation of antifungal therapy. A more scientific approach, based on specific parameters, for diagnosis and management of candidemia in Latin America is warranted.
‘Recommendations for the diagnosis and management of candidemia’ are a series of manuscripts that have been developed by members of the Latin America Invasive Mycosis Network. They aim to provide a set of best-evidence recommendations for the diagnosis and management of candidemia.
This publication, ‘Recommendations for the management of candidemia in children in Latin America’, was written to provide guidance to healthcare professionals on the management of children who have, or who are at risk of, candidemia.
Computerized searches of existing literature were performed by PubMed. The data were extensively reviewed and analyzed by members of the group. The group also met on two occasions to pose questions, discuss conflicting views, and deliberate on a series of management recommendations.
‘Recommendations for the management of candidemia in children in Latin America’ includes prophylaxis, empirical therapy, therapy for proven candidemia, patient work-up following diagnosis of candidemia, duration of candidemia treatment, and central venous catheter management in children with candidemia.
This manuscript is the third of this series that deals with diagnosis and treatment of invasive candidiasis. Other publications in this series include: ‘Recommendations for the diagnosis of candidemia in Latin America’, ‘Recommendations for the management of candidemia in adults in Latin America’, and ‘Recommendations for the management of candidemia in neonates in Latin America’.
This article is also published in English in this issue. It can be found inhttp://dx.doi.org/10.1016/j.riam.2013.05.010
Existen algunas diferencias entre niños y adultos en cuanto a los factores de riesgo de sufrir candidemia u otras micosis invasoras. La edad es un factor de riesgo, por lo que los neonatos tienen un mayor riesgo de candidemia en comparación con niños y adultos. En los niños el cáncer es el principal factor de riesgo para una infección por Candida6. Existe un mayor riesgo de candidemia en los niños sometidos a tratamientos que producen neutropenia prolongada o mucositis severa, al igual que en otros grupos pediátricos, que incluyen pacientes sometidos a tratamiento de inducción de leucemia mieloide aguda (LMA), pacientes con linfoma no Hodgkin o recaída de leucemia aguda, pacientes en el primer período postrasplante alogénico de precursores hematopoyéticos (TPH) con un régimen mieloablativo, y pacientes con tumores sólidos con recaída o en estadio avanzado9,18.
La frecuencia global de la candidiasis invasora en niños con TPH o leucemia de alto riesgo oscila entre el 8 y el 10%. Un estudio llevado a cabo en Chile encontró una incidencia de enfermedad fúngica invasora del 5,8% en niños con neutropenia febril54. El cáncer en la infancia difiere biológicamente de los tumores en los adultos20; en cuanto a su terapia, los niños suelen recibir quimioterapia más intensa que los adultos53. Como resultado, los siguientes factores de riesgo para sufrir una candidemia tienen mayor prevalencia en el cáncer infantil: neutropenia, deficiencia de monocitos, uso de catéter venoso central (CVC) o dispositivos intravasculares (en un estudio llevado a cabo en Australia se atribuyó la candidemia a un dispositivo intravascular en el 70% de los niños infectados, en comparación con un 44% en los adultos)6, mucositis inducida por quimioterapia, duración más prolongada de la hospitalización, hospitalización en unidad de cuidados intensivos (UCI) antes de la infección, tratamientos prolongados con antibióticos de amplio espectro y uso terapéutico de corticoides, particularmente en la leucemia aguda25.
Factores de riesgo adicionales para la candidemia en niñosVarias alteraciones congénitas pueden conducir a un incremento del riesgo de candidemia en niños23. Es destacable el riesgo de los niños sometidos a cirugía cardiotorácica debido a una cardiopatía congénita, donde coinciden varios factores asociados, como cirugía amplia con bypass cardiopulmonar, incremento de la morbilidad postoperatoria, postoperatorio de tórax abierto y ventilación mecánica26,33. La nutrición parenteral total también representa un riesgo para la candidemia en niños, al igual que en adultos28. La duración de la estancia en UCI es otro factor de riesgo para sufrir candidemia; la mayoría de las infecciones fúngicas en niños se producen en el marco hospitalario y, particularmente, en pacientes ingresados en UCI30.
Las quemaduras extensas constituyen otro factor de riesgo significativo para la candidemia en niños5,14. En pacientes con quemaduras la candidemia es una significativa causa de morbilidad y una potencial causa de muerte. En un estudio retrospectivo de 5 años de duración, en el 14,4% de los pacientes pediátricos con quemaduras agudas se aisló Candida de uno o más sitios durante la estancia hospitalaria, y el 12,3% de estos pacientes desarrollaron candidemia52. En otro estudio, los factores que se asociaron de forma independiente con candidemia fueron la presencia de CVC y el uso de vancomicina o de agentes con actividad frente a microorganismos anaerobios durante más de 3 días en las últimas 2 semanas64.
Niños neutropénicosProfilaxis de infecciones por Candida en niños neutropénicosNo se han realizado estudios aleatorizados y controlados sobre la profilaxis de la candidemia en niños. La profilaxis debe ser considerada únicamente cuando los datos epidemiológicos locales muestran una mayor incidencia de infección fúngica invasora que la informada habitualmente en otros centros terapéuticos o en el pasado en el mismo centro18. Esto incrementa aún más la necesidad de mejorar la información epidemiológica en América Latina, tanto local como regional.
Profilaxis con fluconazol en niñosAnte la ausencia de estudios específicos se puede extrapolar la información sobre la profilaxis de Candida en adultos para los casos en niños. En general se utiliza fluconazol en pacientes con TPH12, y esta experiencia puede ser extrapolada a pacientes con LMA que tienen posibilidad de desarrollar neutropenia o mucositis grave. Por lo tanto, la primera elección para la profilaxis en niños neutropénicos debería ser el fluconazol. Una recomendación práctica es utilizar 6mg/kg/día en niños≤30kg y dosis de adulto (400mg/día) en niños con peso>30kg. El estado inmunitario no tiene efecto sobre la farmacocinética del fluconazol19,36,48.
Sumario de recomendaciones para la profilaxis deCandidaen niños neutropénicos:
- 1.
Considerar la profilaxis solamente en niños con alto riesgo de infección por Candida cuando los datos epidemiológicos locales muestran una elevada incidencia de infección fúngica invasora.
- 2.
Se recomienda fluconazol como primera elección para la profilaxis, a dosis de 6mg/kg/día en niños≤30kg y 400mg/día en niños>30kg.
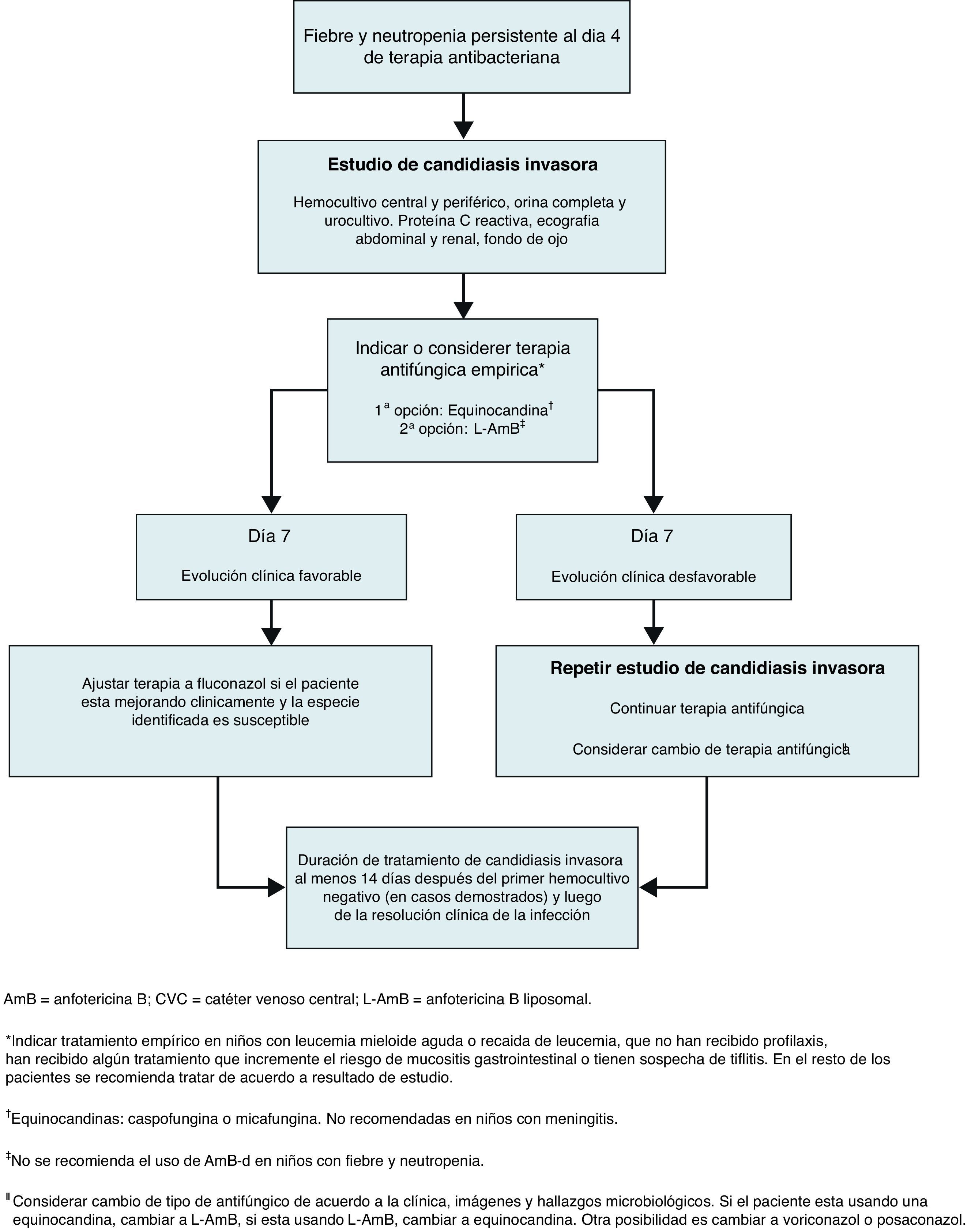
Se recomienda utilizar un abordaje racional basado en parámetros específicos para decidir si un paciente pediátrico neutropénico debe recibir tratamiento antifúngico empírico. Es muy importante realizar un estudio diagnóstico completo para candidiasis invasora en los niños con neutropenia y fiebre persistente. Esto incluye análisis clínico, hemocultivos periféricos y de CVC, urocultivo, proteína C reactiva cuantitativa, ultrasonografía renal y abdominal y examen oftalmológico (Fig. 1). Es recomendable comenzar con la terapia antifúngica después de 4 días de terapia antibacteriana si persisten la fiebre y la neutropenia en niños con LMA o recaída de leucemia, en los que no han recibido profilaxis antimicótica, en aquellos que han recibido algún tratamiento que incremente el riesgo de mucositis gastrointestinal, o si existe sospecha de tiflitis. Se ha aceptado el uso de terapia antifúngica anticipada (pre-emptive), de acuerdo con el resultado del análisis clínico, de laboratorio y de imágenes, como una alternativa a la terapia empírica en algunos pacientes adultos neutropénicos, con la idea de racionalizar el uso de antifúngicos en este tipo de pacientes17. Esta estrategia es considerada razonable por el grupo para el manejo de niños con fiebre y neutropenia, si bien se requieren investigaciones que evalúen la eficacia real y la seguridad de este abordaje en pediatría.
Para el tratamiento empírico en niños neutropénicos el Grupo de Trabajo recomienda una equinocandina (caspofungina o micafungina) como primera elección, seguida por anfotericina B liposomal (L-AmB) (Fig. 1). Se ha evaluado el uso empírico de distintos antifúngicos en estudios prospectivos, controlados y aleatorizados, en pacientes pediátricos neutropénicos29,44,57. En un estudio comparativo aleatorizado que incluyó adultos (n=134) y niños (n=204) con fiebre de origen desconocido, L-AmB fue más eficaz que anfotericina B-desoxicolato (AmB-d)44. Se concluyó que el uso de L-AmB, 3mg/kg/día, era significativamente más seguro que el empleo de AmB-d en niños y en adultos. En un estudio doble ciego multicéntrico de niños neutropénicos con fiebre persistente (2-17 años de edad), caspofungina (n=56) fue comparable a L-AmB n=25) en eficacia, seguridad y tolerabilidad, como terapia antifúngica empírica29. En un estudio multicéntrico aleatorizado que incluyó adultos y niños mayores de 12 años de edad con neutropenia febril, se evaluó el uso de voriconazol frente a L-AmB, mostrando que voriconazol era una alternativa comparable a L-AmB57.
Sumario de recomendaciones para el tratamiento empírico de la candidiasis invasora en niños neutropénicos:
- 1.
Realizar un estudio diagnóstico completo para candidiasis invasora en niños en los que persiste la fiebre y la neutropenia el día 4 de terapia antibacteriana.
- 2.
Instaurar una terapia antifúngica empírica en niños que continúan con fiebre y neutropenia y que tienen LMA o recaída de leucemia, que no han recibido profilaxis antifúngica, han seguido algún tratamiento que incrementa el riesgo de mucositis del tracto gastrointestinal o tienen sospecha de tiflitis.
- 3.
Primera opción: equinocandina (caspofungina o micafungina). Si no se dispone de equinocandinas, usar L-AmB.
- 4.
El tratamiento anticipado es considerado razonable por el grupo en los niños con fiebre y neutropenia. Se requieren investigaciones que evalúen la eficacia real y la seguridad de este abordaje en Pediatría.
Se han realizado pocos estudios comparativos de agentes antifúngicos en niños, y los que se han efectuado han tenido poco poder estadístico34,45. Con frecuencia, los pediatras deben basarse en los datos de estudios clínicos en adultos para el manejo de la candidiasis invasora infantil.
En la figura 1 se muestran las recomendaciones para el tratamiento específico de la candidiasis invasora en niños neutropénicos. El Grupo de Trabajo recomienda el uso de una equinocandina más que de fluconazol en este caso, prefiriendo un fármaco fungicida sobre uno fungistático61. Las equinocandinas que han sido evaluadas para el tratamiento de la candidiasis invasora en niños neutropénicos son caspofungina y micafungina. Un estudio pediátrico multicéntrico, prospectivo y abierto describió una tasa de respuesta global del 81% en niños con candidiasis invasora tratados con caspofungina63. Este resultado fue similar a la tasa de respuesta observada en adultos (aproximadamente 74-81%)11,35. Un estudio aleatorizado, doble ciego y multicéntrico investigó la eficacia de caspofungina en el tratamiento empírico de niños con neutropenia y fiebre persistente, utilizando L-AmB como comparador. En este estudio, caspofungina fue tan eficaz como L-AmB (46,4 versus 32%, respectivamente) y tuvo menos efectos colaterales29. En pacientes pediátricos con neutropenia febril e infección por Candida se recomienda administrar caspofungina con una dosis de carga de 70mg/m2 en el día 1 de tratamiento, seguida por 50mg/m2/día8 (tabla 1). La dosificación basada en la superficie corporal ha permitido una exposición consistente en todos los grupos de edad pediátricos; en cambio, la basada en el peso corporal provoca concentraciones plasmáticas subóptimas en niños55.
Recomendaciones de fármacos y dosis para el tratamiento de la candidiasis invasora en niños neutropénicos
| Antifúngico | Dosis recomendada | Información adicional |
| Caspofungina | Dosis de carga de 70mg/m2IV en el día 1 de tratamiento, seguida por 50mg/m2/día IV | Las equinocandinas no están indicadas en meningitis por Candida. Si con la dosis diaria de 50mg/m2 no se logra una adecuada respuesta clínica, puede aumentarse a 70mg/m2 (no superando la dosis diaria de 70mg) |
| Micafungina | 2mg/kg/día IV si el peso es≤40kg, o 100mg/día IV si el peso es>40kg | Si la respuesta del paciente es inadecuada, aumentar la dosis hasta 4mg/kg/día en pacientes con peso≤40kg, o 200mg/día en pacientes con peso>40kg3 |
| Anidulafungina | 1,5mg/kg/día IV | Dosis basada en un estudio multicéntrico de dosis ascendente en niños neutropénicos4 |
| L-AmB | 3-5mg/kg/día IV | No se requiere ajuste de la dosificación en esta población |
| Voriconazol | 14mg/kg/día IV, 2 veces al día, o 200mg vía oral, 2 veces al día | No se ha estudiado el uso en niños de 2 a 12 años de edad con insuficiencia hepática o renal. Su uso requiere la determinación de niveles plasmáticos |
| Fluconazol | 12mg/kg/día IV u oral |
L-AmB: anfotericina B liposomal; IV: por vía intravenosa.
Los resultados de un estudio preliminar evidencian que micafungina es una alternativa a caspofungina en el tratamiento de la candidiasis invasora en niños neutropénicos49, a dosis de 2-4mg/kg/día, que resultó bien tolerada y no asociada a efectos colaterales en niños (2-17 años de edad) neutropénicos con fiebre persistente. En otro estudio se comparó micafungina con L-AmB en pacientes pediátricos (n=48 y n=50, respectivamente). Se encontró que micafungina fue tan eficaz y segura como L-AmB para el tratamiento de la candidiasis invasora45. Los parámetros farmacocinéticos de micafungina en niños neutropénicos febriles son similares a los observados en los adultos49. La micafungina debe ser administrada a una dosis de 2mg/kg/día en niños con un peso corporal≤40kg o 100mg/día en niños con peso>40kg, con la opción de incrementar la dosis hasta 4mg/kg/día o 200mg/día, respectivamente16 (tabla 1). El incremento de la posología puede ser necesario en los niños de muy corta edad dado que la eliminación es mayor en estos pacientes49.
Se sabe poco acerca de la farmacodinamia, la farmacocinética y la seguridad de anidulafungina en pacientes pediátricos. Un estudio ha mostrado que anidulafungina es bien tolerada en niños neutropénicos4. Está en curso un estudio en fase iii para evaluar la eficacia, la seguridad y la tolerancia de anidulafungina en niños con candidiasis invasora; se estima que el estudio finalizará en junio de 201310.
Recomendaciones de tratamiento cuando no se dispone de equinocandinasSi no se dispone de una equinocandina, el Grupo de Trabajo recomienda el uso de L-AmB, AmB Lipid Complex (ABLC, «complejo lipídico de AmB») o voriconazol para el tratamiento de la candidiasis invasora en niños neutropénicos. No se recomienda el tratamiento con AmB-d en niños sometidos a quimioterapia, considerando la nefrotoxicidad tanto de AmB-d como de la quimioterapia21,37. Los datos de farmacocinética y seguridad de las formulaciones lipídicas de AmB en pacientes pediátricos muestran que no hay diferencias importantes en comparación con poblaciones adultas21. Algunos estudios avalan el uso de ABLC como un antifúngico efectivo en niños. En un estudio pediátrico abierto se observó respuesta terapéutica completa o parcial en 22/27 (81%) pacientes con diagnóstico de candidiasis58. En un estudio retrospectivo, el tratamiento con ABLC en niños con candidiasis tuvo una tasa de respuesta del 89% (17/19)22. En un estudio prospectivo que incluyó 56 centros, la eficacia y la seguridad de L-AmB fue evaluada en adultos (n=260), niños menores de 15 años de edad (n=242) y lactantes menores de 2 meses de vida (n=43) con sospecha de infección fúngica. En este estudio los lactantes toleraron la dosis diaria más elevada de L-AmB durante el período más prolongado de tiempo (2mg/kg/día por 16 días), seguidos por los niños (1,5mg/kg/día por 13 días) y luego por los adultos (1mg/kg/día por 12 días)1. Como alternativa de tratamiento, el Grupo de Trabajo recomienda el uso de 3-5mg/kg/día de L-AmB.
Un estudio que evaluó la seguridad, la tolerabilidad y la farmacocinética plasmática de voriconazol en pacientes pediátricos inmunodeficientes encontró que se requiere una posología más elevada en niños que en adultos para alcanzar similares concentraciones séricas a lo largo del tiempo (tabla 1)56.
Duración del tratamiento en niños neutropénicosEl tratamiento de la candidiasis invasora en niños neutropénicos se prolonga hasta 14 días después del primer hemocultivo negativo y hasta la resolución clínica de la infección41 (Fig. 1). El antifúngico puede ser cambiado por un agente de espectro más reducido, como fluconazol, si el paciente está mejorando, experimenta recuperación de los neutrófilos y los estudios de identificación micológica y sensibilidad antifúngica indican que la especie de Candida implicada es sensible a fluconazol. El volumen de distribución y la velocidad de eliminacion de fluconazol son mayores en los niños que en los adultos7, por lo tanto, a menor edad se requiere una dosis relativamente más alta de fluconazol31. A fin de alcanzar una concentración farmacológica similar a la lograda en adultos, la dosis diaria de fluconazol es de 12mg/kg en los niños de todas las edades. Se debe tener en cuenta que algunos niños de mayor edad pueden tener una tasa de eliminación similar a la de los adultos, y pueden, por tanto, requerir una dosis de adulto (400mg/día).
Sumario de recomendaciones para el tratamiento de la candidiasis invasora en niños neutropénicos:
- 1.
Se recomienda una equinocandina (caspofungina o micafungina) como tratamiento de primera elección para la candidiasis invasora en niños neutropénicos.
- 2.
Si no se dispone de equinocandinas, el Grupo de Trabajo recomienda el uso de L-AmB o voriconazol.
- 3.
No se recomienda el tratamiento con AmB-d en este grupo de pacientes.
- 4.
El tratamiento de la candidiasis invasora en niños neutropénicos debe prolongarse hasta 14 días después del primer hemocultivo negativo y hasta la resolución clínica de la infección.
- 5.
El antifúngico puede ser cambiado por un agente de espectro más reducido, como fluconazol; cuando el paciente mejora, experimenta recuperación de neutrófilos y la especie de Candida es sensible a fluconazol.
El Grupo de Trabajo recomienda obtener una imagen abdominal, examinar el fondo de ojo y realizar una ecocardiografía como base para el seguimiento del paciente con candidemia, a fin de buscar evidencias de invasión de órganos. Aunque la endocarditis es mucho menos frecuente en los pacientes neutropénicos que en los no neutropénicos, se debe considerar la ecocardiografía en los pacientes con candidemia persistente40. Algunos métodos de evaluación pueden presentar dificultades en la edad pediátrica, como los exámenes de tomografía axial computarizada (TAC), que en niños de corta edad requieren sedación, y los exámenes repetidos, que incrementan la exposición a radiaciones18.
Sumario de recomendaciones para la evaluación del paciente después del diagnóstico de candidemia en niños neutropénicos:
- 1.
El Grupo de Trabajo recomienda la obtención de una imagen abdominal, examen de fondo de ojo y la realización de una ecocardiografía con el propósito de buscar evidencias de invasión de órganos.
La decisión para el retiro del catéter se basa en la hipótesis de que la colonización de la piel cerca del sitio de inserción puede conducir a la colonización y subsiguiente infección del catéter por Candida60; sin embargo, en un estudio se encontró que la fuente primaria de infección era el intestino y no la piel15. En este estudio, se observó colonización de la materia fecal en todos los pacientes con infección con Candida parapsilosis, lo que precedió a la colonización cutánea. Una revisión de la literatura encontró que la fuente de la candidemia en los pacientes neutropénicos con cáncer tiende a ser primariamente de origen gastrointestinal más que cutáneo38.
Retiro temprano y tardio del catéter venoso centralLas evidencias para el retiro temprano del CVC en los pacientes pediátricos neutropénicos son escasas. En un estudio caso-control, la candidemia persistente (>3 días) en pacientes con CVC fue un factor de riesgo independiente para la enfermedad diseminada62. En un análisis multivariado se observó que no retirar el CVC también fue un factor de riesgo independiente para mortalidad temprana en pacientes pediátricos con candidemia. Sin embargo, en este estudio no se definió el punto temporal en el que los catéteres eran retirados42. En el mismo estudio se encontró que el retiro sistematico de los catéteres de los pacientes pediátricos con candidemia no redujo la mortalidad tardía (deceso a 8-30 días después del diagnóstico de candidemia). De acuerdo con el resultado de estos estudios, el Grupo de Trabajo no puede brindar una recomendación sólida para el retiro temprano del CVC en todos los niños neutropénicos con candidemia. Se recomienda el retiro temprano del CVC si hay evidencia de infección en el sitio del catéter. Sin embargo, si el CVC no es retirado tempranamente se aconseja el retiro tardio de este si se da alguna de las siguientes condiciones: el paciente no mejora después de 3 días de tratamiento, el paciente tiene hemocultivos positivos persistentes (especialmente si se detecta C. parapsilosis) o el paciente tiene una colonización en el trayecto del CVC.
Sumario de recomendaciones para el manejo del catéter en niños neutropénicos:
- 1.
De acuerdo con las evidencias actuales se recomienda el retiro temprano del CVC si hay certeza de infección en el sitio de inserción.
- 2.
Si el CVC no es retirado tempranamente, el Grupo de Trabajo recomienda el retiro tardio si el paciente no mejora después de 3 días de tratamiento, si tiene hemocultivos positivos en forma persistente o si existe colonización del trayecto del CVC.
Las complicaciones de candidemia observadas más frecuentemente en niños neutropénicos aparecen en localizaciones secundarias a la infección, como ojos, riñones, bazo, hígado, huesos y corazón9,54. Para el manejo de las complicaciones, ver el manuscrito Recomendaciones para el manejo de la candidemia en neonatos en América Latina47.
Manejo de la candidiasis diseminada crónica en niños neutropénicosFactores de riesgo para la candidiasis diseminada crónicaLa candidiasis diseminada crónica (CDC) puede ser una complicación de la candidemia en niños neutropénicos a pesar de la terapia antifúngica. En un estudio, los factores de riesgo para la CDC en niños fueron definidos como la existencia de hemocultivos positivos persistentes (>3 días) para Candida en pacientes con CVC (odds ratio [OR] 3,0; IC 95% 1,2-7,8; p=0,02) e inmunosupresión (OR 2,9; IC 95% 1,2-7,0; p=0,02)62. La neutropenia prolongada es el factor de riesgo más citado para la CDC32. Los pacientes de menor edad con leucemia aguda tienen más probabilidades de recibir una quimioterapia agresiva y, por lo tanto, de presentar períodos de neutropenia más prolongada y profunda, lo que implica un mayor riesgo de desarrollo de CDC32.
Recomendaciones de tratamiento para la candidiasis diseminada crónicaEl Grupo de Trabajo recomienda el uso de una equinocandina o de L-AmB como tratamiento inicial para la CDC en niños neutropénicos, seguido por fluconazol por períodos prolongados. No se ha definido la duración óptima de la terapia primaria. Típicamente se recomiendan varios meses de terapia antifúngica para la erradicación de la CDC27,46,59. El Grupo de Trabajo aconseja que se mantenga el tratamiento mientras las imágenes muestren evidencia de infección activa. Sin embargo, una limitación de las técnicas de imagen en el diagnóstico de la CDC es la incapacidad de visualizar lesiones fúngicas durante la fase neutropénica debido a la ausencia de una respuesta inflamatoria esencial para formar el infiltrado43,50. Se recomienda la repetición de los estudios después de la recuperación del recuento de neutrófilos. Las imágenes de resonancia magnética (RM) son de calidad superior a las de una TAC y a los ultrasonidos para la identificación de la CDC2,50,51. No obstante, el uso de la TAC o de los ultrasonidos son opciones válidas cuando los costos y la disponibilidad limitan el uso de la RM32.
Si el paciente no responde al tratamiento (es decir, continúa la fiebre, la pérdida de peso y falta de apetito), se recomienda la terapia con corticoides (prednisona, 1mg/kg/día) durante 3 semanas. La corticoterapia acelera la recuperación de la CDC24. En un estudio, la corticoterapia sumada a la terapia antifúngica fue beneficiosa para la respuesta inflamatoria y los síntomas clínicos relacionados con la CDC en adultos y niños. Los síntomas clínicos relacionados con la CDC desaparecieron tan solo un día después del inicio de la corticoterapia en casi todos los pacientes, y los marcadores inflamatorios disminuyeron en el plazo de una semana24.
Sumario de recomendaciones para el manejo de la CDC en niños neutropénicos:
- 1.
El Grupo de Trabajo recomienda el uso de equinocandinas o L-AmB como tratamiento inicial para la CDC en niños neutropénicos, seguido por terapia con fluconazol.
- 2.
Se debe mantener el tratamiento en tanto los estudios de imagen muestren evidencias de infección activa.
- 3.
Se recomienda la repetición de los estudios de imagen después de que se recupere el recuento de neutrófilos.
- 4.
Si un paciente no responde al tratamiento se recomienda la terapia con corticoides para acelerar la recuperación de la CDC.
No hay estudios aleatorizados y controlados sobre profilaxis de candidemia en niños no neutropénicos. Los factores de riesgo pueden ser utilizados para determinar la necesidad de profilaxis. Sin embargo, los niños no neutropénicos constituyen una población muy heterogénea y no hay factores de riesgo bien definidos. De acuerdo con estudios controlados y aleatorizados en adultos, se debe considerar la profilaxis con fluconazol en pacientes que han recibido un trasplante de hígado de alto riesgo y en quienes tienen perforaciones gastrointestinales recurrentes o filtraciones anastomóticas debido a cirugía abdominal mayor reciente13.
Sumario de recomendaciones para profilaxis de candidemia en niños no neutropénicos:
- 1.
Debe considerarse el uso de fluconazol en pacientes que han recibido un trasplante de hígado de alto riesgo y en quienes presentan perforaciones gastrointestinales recurrentes o filtraciones anastomóticas debido a cirugía abdominal mayor reciente.
No hay datos respecto al tratamiento empírico de la candidiasis invasora en niños no neutropénicos. Por lo tanto, no se pueden brindar recomendaciones de tratamiento. Debido a la falta de evidencia, actualmente la única opción es seguir las recomendaciones para los adultos (ver manuscrito Recomendaciones para el manejo de la candidemia en adultos en América Latina)39.
Tratamiento de la candidiasis invasora aguda en niños no neutropénicosSe ha realizado un único estudio clínico aleatorizado sobre el tratamiento de la candidiasis invasora en niños no neutropénicos. Dicho estudio comparó el uso de L-AmB (3mg/kg/día) con micafungina (2mg/kg/día), encontrándose una tasa de éxito terapéutico similar (76 versus 72%, respectivamente), con mayor incidencia de episodios adversos serios (9,3 versus 3,8%) y de pacientes que interrumpieron la terapia debido a un suceso adverso (16,7 versus 3,8%) en el grupo de L-AmB45. Estos resultados indican que se puede considerar tanto una equinocandina como L-AmB como primera opción de tratamiento en niños no neutropénicos con candidiasis invasora.
Como segunda opción de tratamiento, el Grupo de Trabajo recomienda otras formulaciones lipídicas de AmB (ABLC o dispersión coloidal de AmB) o AmB-d, y como tercera opción de tratamiento recomienda fluconazol. La desescalada terapéutica desde una equinocandina o una formulación de anfotericina B a un fármaco por vía oral es razonable; sin embargo, este abordaje no se ha validado en niños. Fluconazol es la primera elección para la desescalada terapéutica, especialmente en los casos en que los pacientes están mejorando y los estudios de identificación y sensibilidad antifúngica indican la presencia de especies de Candida sensibles al fluconazol.
Sumario de recomendaciones para el tratamiento de la candidiasis invasora en niños no neutropénicos:
- 1.
Primera opción de tratamiento: una equinocandina o L-AmB.
- 2.
Segunda opción de tratamiento: formulaciones lipídicas de AmB o AmB-d.
- 3.
Tercera elección de tratamiento: fluconazol.
- 4.
La desescalada terapéutica de una equinocandina o alguna formulación de AmB a una droga por vía oral, aunque no ha sido validada en niños, es una estrategia razonable.
- 5.
Se recomienda fluconazol como primera elección para el esquema de desescalada.
Se recomienda la obtención de una imagen abdominal, realización de fondo de ojo y de ecocardiografía después del diagnóstico de candidemia en niños no neutropénicos.
Duración del tratamiento en niños no neutropénicosEl tratamiento en niños no neutropénicos debe continuar durante 14 días tras el primer hemocultivo negativo y hasta que sea evidente la mejoría clínica de la infección.
Manejo del catéter en niños no neutropénicosNo se dispone de evidencias suficientes como para efectuar recomendaciones. Ver las recomendaciones para niños neutropénicos.
Manejo de complicaciones en niños no neutropénicosEn la diseminación de una candidemia se puede comprometer sistema nervioso central, ojos, corazón, riñones, bazo, hígado y huesos. Se han propuesto recomendaciones de tratamiento según el tipo de complicación. Ver el manuscrito Recomendaciones para el manejo de la candidemia en neonatos en América Latina47.
Conflicto de interesesA.L. Colombo ha recibido ayudas para la investigación de Pfizer, MSD, United Medical y Luminex, y ayudas para la formación médica de Pfizer, MSD, United Medical y Astellas. Además, ha ejercido como consultor para MSD, Pfizer y Gilead. J.A. Cortes ha recibido de Pfizer y MSD ayudas para la investigación y para la asistencia a charlas de formación médica. M. Nucci ha recibido ayudas para la investigación de Pfizer y MSD, y ha sido consultor y conferenciante para Pfizer, Merck, Astellas y Gilead. F. de Queiroz Telles ha participado en cursos de Formación Continuada en laboratorios de Astellas, MSD, Pfizer y United Medical, y en programas de investigación en laboratorios de Astellas, MSD y Pfizer. I.N. Tiraboschi ha sido conferenciante para Pfizer y Gilead. J. Zurita ha sido miembro del consejo asesor y consultor de Pfizer, y ha recibido ayudas para la investigación de Wyeth y MSD por su participación en el estudio SMART.
A Brigitte Teissedre, PhD, de Choice Healthcare Solutions, por su asistencia editorial, financiada por Pfizer. Los autores son responsables de las opiniones, conclusiones y recomendaciones.
Cómo citar este artículo: Santolaya ME, et al. Recommendations for the management of candidemia in children in Latin America. Rev Iberoam Micol. 2013;30:171–8.