La queratitis micótica es una de las principales infecciones oculares. Se necesita un tratamiento específico que depende de la naturaleza del microorganismo infectante. Su pronóstico suele ser grave y depende de un diagnóstico precoz y una terapia adecuada.
Caso clínicoSe describe un caso clínico de queratitis por Fusarium solani en un paciente procedente de un área rural, afectado entre mayo y octubre de 2011 por un traumatismo corneal causado por partículas de polvo en Valdivia, Chile. El examen directo del raspado corneal reveló, en dos ocasiones, la presencia de abundantes hifas septadas. Todos los cultivos fueron positivos para el mismo hongo, que fue identificado como Fusarium solani mediante técnicas fenotípicas y secuenciación de los genes nucleares ribosomales. El paciente fue tratado inicialmente con anfotericina B, y después, con voriconazol oral e intravenoso, tratamiento al que respondió exitosamente, aunque la opacidad corneal persistió.
ConclusionesAun cuando las queratomicosis en Chile son poco frecuentes, deben tomarse en consideración sus particularidades diagnósticas para poder instaurar el tratamiento más eficaz. Así, se hace indispensable la rápida visualización del hongo en la lesión, un eficiente aislamiento del agente etiológico en cultivo y una rápida identificación, lo que para el caso particular de las especies del género Fusarium requiere el empleo de técnicas moleculares de secuenciación.
Keratomycosis is one of the most prevalent ophthalmic infections, which needs a specific treatment depending on the nature of the infecting fungus. The prognosis is usually severe and depends on an early diagnosis and suitable therapy.
Case reportWe describe a case of keratitis due to Fusarium solani in a patient from a rural area, who, between May and October 2011, suffered a corneal trauma caused by dust particles in Valdivia, Chile. On two occasions, direct examination of eye scrapes revealed abundant septate hyphae. All cultures were positive for the same fungus, which was identified as Fusarium solani by phenotypic characterization and sequencing of ribosomal nuclear genes. The patient was initially treated with amphotericin B and afterwards successfully responded to a treatment with oral and intravenous voriconazole, although corneal opacity persisted.
ConclusionsAlthough keratomycosis in Chile is rare, its diagnostic particularities must be taken into consideration to establish the most effective treatment. Thus, a rapid visualization of the fungus in the lesion, an efficient isolation of the etiologic agent in pure culture is essential, as well as its rapid identification, which requires the use of molecular sequencing techniques in the case of Fusarium species.
Las queratitis micóticas son afecciones inflamatorias de la córnea producidas por la presencia de ciertos hongos patógenos oportunistas; suelen tener dos presentaciones clínicas diferentes según sean debidas a hongos filamentosos o a levaduras. Las primeras suelen presentarse como úlceras de bordes irregulares, levantados y firmes, extendiéndose las hifas más allá de dichos bordes, con infiltrados estromales granulares multifocales de color blanco grisáceo, mientras que las debidas a levaduras se asemejan a las queratitis bacterianas, con un defecto epitelial evidente, un infiltrado más discreto y una progresión más lenta. El principal factor predisponente en las queratitis debidas a hongos filamentosos es un trauma por elementos telúricos o restos vegetales, o por el uso de lentes de contacto o de corticoides3, mientras que en las infecciones por hongos levaduriformes dichos factores son una deficiente secreción lagrimal, defectos en el cierre palpebral, inmunodepresión de origen diverso (diabetes mellitus, uso de fármacos inmunosupresores), alteraciones preexistentes del epitelio corneal (como las queratitis por herpesvirus), o la abrasión por lentes de contacto28. Los factores predisponentes para las queratitis por hongos filamentosos determinan que estas infecciones se observen con mayor frecuencia en trabajadores agrícolas o mecánicos, preferentemente en regiones tropicales y subtropicales, y con una elevada humedad relativa ambiental2,4. Los síntomas generales son dolor, lagrimeo, fotofobia, disminución de la agudeza visual y edema de la córnea. La presencia de un hipopion debe alertarnos sobre la existencia de este tipo de micosis11.
La queratitis micótica es considerada una afección infrecuente, aun cuando se ha descrito un ligero incremento en su prevalencia1,26,28. Su incidencia por países es variable, representando alrededor del 50% del total de úlceras corneales en la India, el 38% en Ghana, el 36% en Bangladesh, el 35% en el sur de Florida (EE. UU.) y el 17% en Nepal9,15,17,30,35. En la actualidad, se han descrito más de 60 especies de hongos como agentes etiológicos de queratitis28, produciendo en algunos casos la pérdida de la visión o, incluso, del globo ocular. Por este motivo, es imprescindible realizar un diagnóstico preciso y rápido, que nos permita la pronta implementación de un tratamiento terapéutico adecuado4,11,24. Actualmente, los hongos más habituales implicados en estas infecciones son varias especies del género Fusarium, mayoritariamente Fusarium solani18.
Caso clínicoPaciente que vive en un entorno rural, de 34 años, tractorista, afectado de astigmatismo, miopía moderada y ambliopía. Acudió a la consulta de urgencia el 13 de mayo de 2011 por un cuadro en el ojo derecho de un mes de evolución, caracterizado inicialmente por picazón y disminución de la agudeza visual y, posteriormente, la aparición de opacidad corneal asociada a dolor significativo. Refiere como antecedente un cuadro similar en el mismo ojo, acaecido dos meses antes, en la región palpebral, que habría remitido espontáneamente.
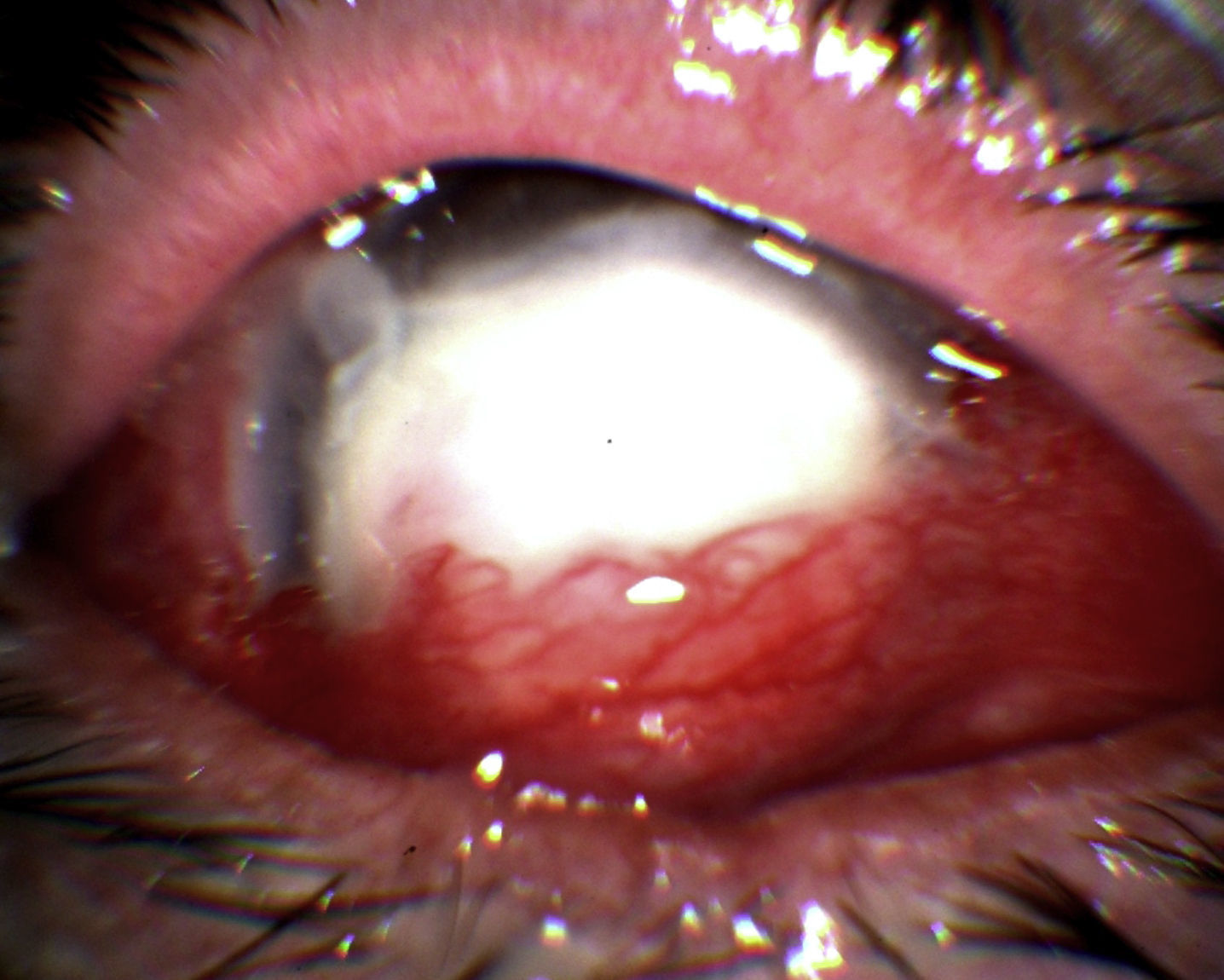
En el examen inicial se destaca una agudeza visual a 25cm en el ojo derecho y de 0,5 en el ojo izquierdo. El examen del ojo derecho mostró hiperemia conjuntival difusa con secreción blanca en fondo de saco inferior, y una úlcera corneal de bordes definidos, paracentral, circular, de 4mm de diámetro, con halo de infiltración simétrico, con compromiso del tercio anterior del estroma corneal, e hipopion de 2mm de altura. El fondo de ojo no fue evaluable por la opacidad corneal. El ojo izquierdo se mostró normal al examen, con un fondo de ojo miópico.
Por los antecedentes y el aspecto microscópico inicial se indicó colirio de hidrocloruro de moxifloxacino 5mg/ml (una gota cada hora), aciclovir 3% en ungüento (una aplicación cada cuatro horas) y solución de atropina 1% (una gota cada hora).
Asistió al control los días 14, 17 y 19 de mayo, refiriendo disminución del dolor. Al examen se observó una reducción del halo inflamatorio alrededor de la úlcera, así como del diámetro de esta, y un aumento de la agudeza visual, motivo por el cual se le citó a la consulta médica una semana después.
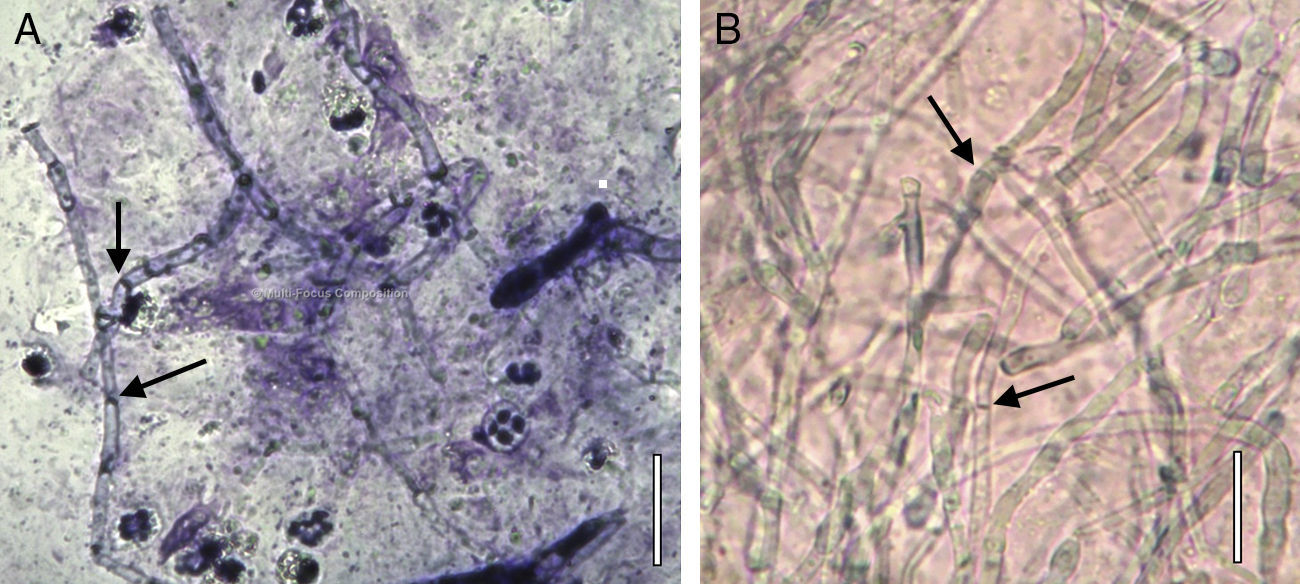
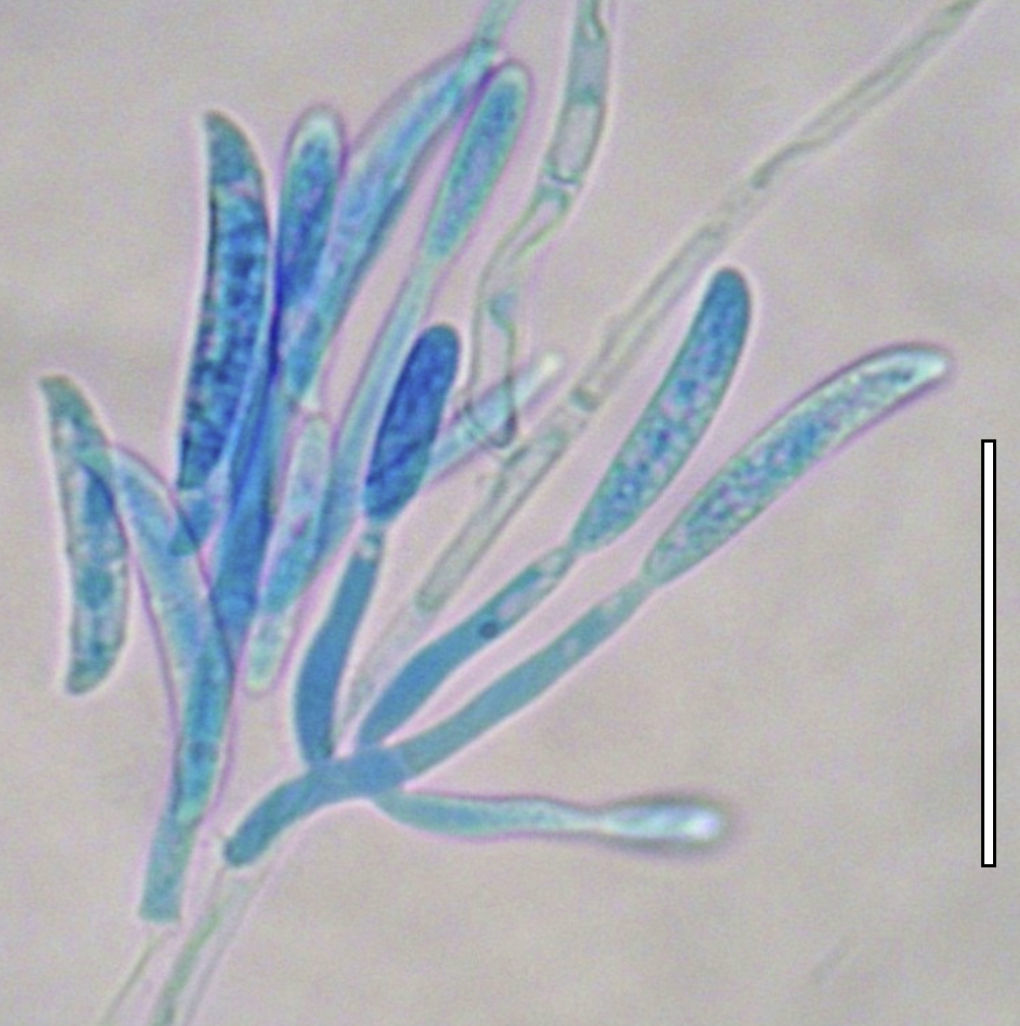
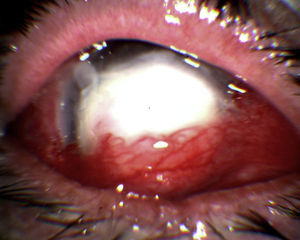
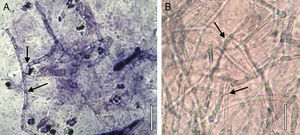
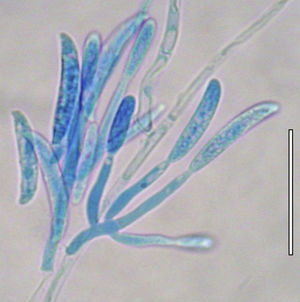
El paciente fue reevaluado y hospitalizado el 24 de mayo por agudización del dolor, disminución de la agudeza visual a la percepción de la luz y aumento de la opacidad corneal. En la evaluación se observó un gran aumento en el diámetro y en la profundidad de la úlcera (diámetro de 7,5mm y compromiso de hasta el tercio medio del estroma, así como la progresión del hipopion hasta alcanzar 4mm de altura) (fig. 1). Se realizó en el mismo día una cirugía de urgencia para colocar un recubrimiento conjuntival. Se tomó una muestra para su análisis microbiológico y se inició un tratamiento con fluconazol (150mg/día); se continuó al día siguiente con este antifúngico, pero en forma de colirio al 2%. A las 48h se constató una importante disminución del dolor, pero se produjo una dehiscencia de las suturas, por lo cual se realizó una nueva intervención a las 72h. La evolución posterior no mostró evidencias de mejoría. Se remitió una muestra al laboratorio para un estudio bacteriano, con resultado negativo. El 1 de junio se constató que el diámetro de la úlcera había aumentado y se había profundizado, con signos de melting (derretimiento) corneal central. Se tomó una nueva muestra por raspado de úlcera previa anestesia tópica con proparacaína al 0,5%, revelándose al examen microscópico directo la presencia de hifas hialinas tabicadas, indicativa de una infección fúngica por un hongo filamentoso hialino (fig. 2). Como resultado de la siembra de las muestras de raspado en agar glucosado de Sabouraud (Becton Dickinson, Nueva Jersey, EE. UU.), y posterior resiembra en agar con extracto de papa y glucosa (Becton Dickinson), se obtuvieron colonias que permitieron identificar al hongo como F. solani (fig. 3), mediante el examen con un microscopio de campo claro de las estructuras reproductivas. Esta identificación se corroboró con métodos moleculares mediante la secuenciación de la región ITS del ADN ribosomal; con la secuencia obtenida (de 478 pares de bases de longitud) se realizó mediante el programa BLAST37 una comparación con las secuencias depositadas en el GenBank, obteniéndose un porcentaje de similitud del 99% con diferentes cepas de referencia de F. solani. Se procedió a la intervención quirúrgica del paciente el 4 de junio debido la mala evolución y la alta probabilidad de perforación corneal; en la cirugía se amplió al 90% el recubrimiento de la superficie corneal y la totalidad de la úlcera. Conjuntamente con el Servicio de Infectología, conocido el resultado del examen directo, se decidió iniciar la terapia antifúngica con 400mg de voriconazol oral cada 12h durante las primeras 48h y, posteriormente, con 200mg cada 12h durante un mes. Paralelamente se inició una terapia con anfotericina B intravenosa, con la siguiente dosificación: primer día, 25mg/6h; segundo día, 50mg/6h; y del tercero hasta el séptimo día, 75mg/6h. La terapia coadyuvante consistió en hidrocloruro de moxifloxacino (5mg/ml, una gota cada 6h) y colirio de atropina al 1% cada 8h.
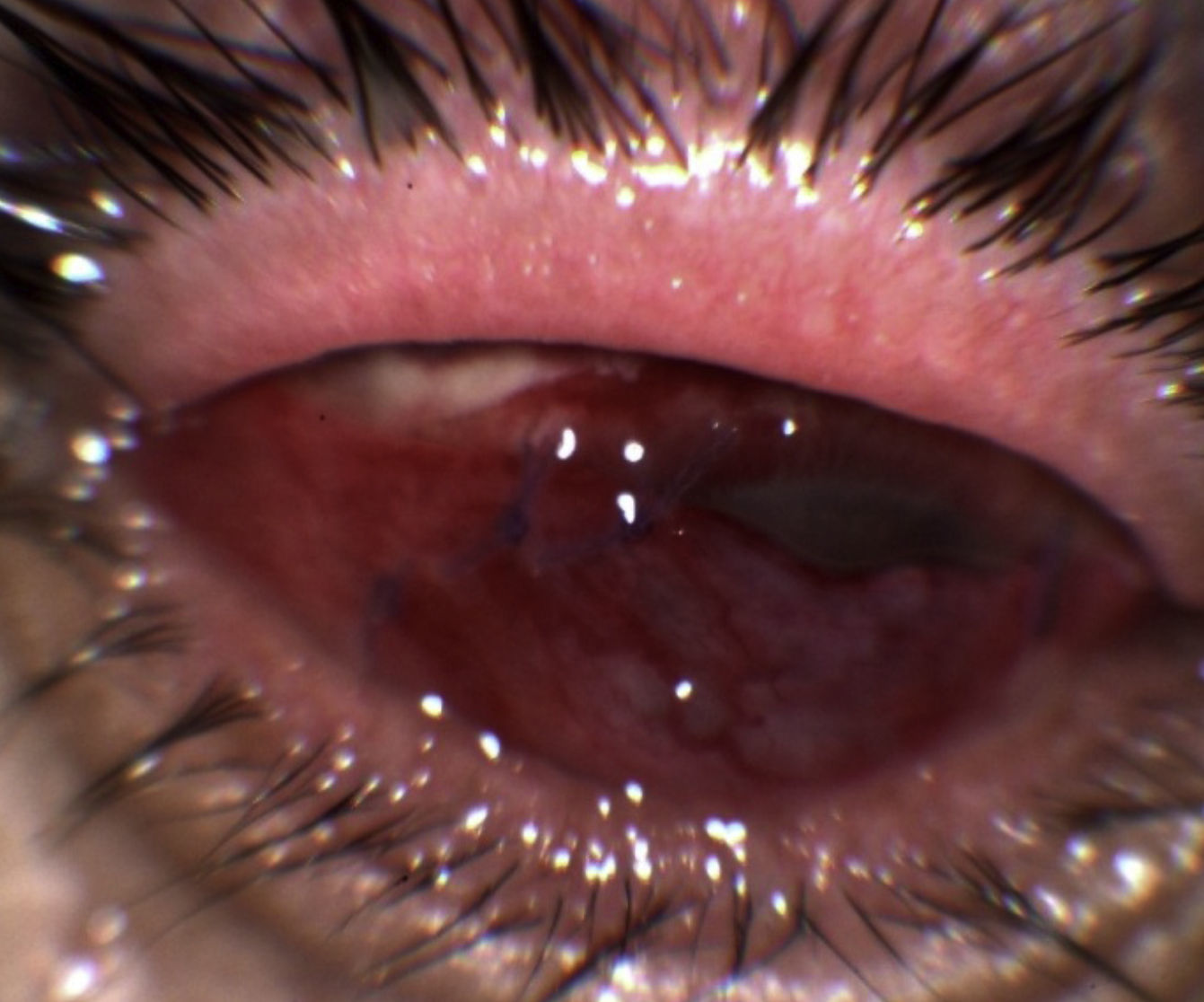
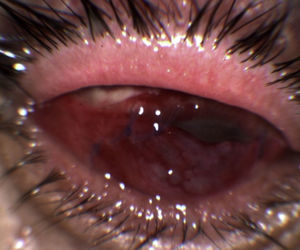
La evolución desde esa fecha fue satisfactoria al disminuir los síntomas, mantenerse el recubrimiento conjuntival vital y no aparecer signos de perforación corneal, de avance de la ulceración o de la endoftalmitis (fig. 4). En visitas control sucesivas hasta octubre de 2011 el paciente siguió evolucionando favorablemente, sin recidiva. Posteriormente fue remitido para una queratoplastia.
DiscusiónLa queratitis micótica es una infección de la córnea causada, más frecuentemente, por especies de los géneros Aspergillus y Fusarium, cuya incidencia varía de país a país, y que se origina a partir de la inoculación del hongo por un traumatismo de origen diverso. Se desarrolla con pérdida progresiva de la visión (hasta el extremo de provocar ceguera) y posible extensión a otros órganos26. Las infecciones por especies de Fusarium han aumentado en los últimos años, siendo necesaria la identificación de la especie implicada, ya sea por técnicas tradicionales o moleculares, debido a que las especies tienen distintos patrones de sensibilidad antifúngica12,25. Por este motivo la eficacia terapéutica es variable y tiene mal pronóstico si la infección es causada por F. solani, especie resistente a la mayoría de los antifúngicos actualmente comercializados5. Otras especies de este género, menos frecuentemente aisladas de casos de queratitis, son Fusarium verticillioides, Fusarium oxysporum y Fusarium dimerum10,20.
La queratitis micótica ha sido una afección muy poco frecuente, pero su prevalencia se ha incrementado levemente en los países en vías de desarrollo. Un diagnóstico precoz y el tratamiento con antifúngicos efectivos pueden prevenir la pérdida de la visión. Chang et al. refieren un brote de queratitis (164 casos confirmados) producido por F. solani y F. oxysporum en usuarios de lentes de contacto en los EE. UU., Singapur y China, entre junio de 2005 y julio de 2006, debido al uso de una solución de limpieza contaminada con dichos hongos3. A pesar de que estos brotes en usuarios de lentes de contacto son poco frecuentes, Donnio et al. informaron de otro brote de queratomicosis por F. solani atribuible a lentes de contacto con loción humectante8. Vemuganti et al. realizaron un estudio en India, donde analizaron 131 muestras de casos de queratitis, siendo especies de los géneros Aspergillus (42,74% de los casos) y Fusarium (32,82% de los casos) los principales agentes etiológicos32. Godoy et al. estudiaron en São Paulo (Brasil) un total de 152 casos de queratitis fúngicas, siendo el género Fusarium el principal responsable (44,7% de los casos), seguido de Candida albicans (16,4% de los casos)10. En España, concretamente en las Islas Canarias, Díaz Alemán et al. describieron un caso de queratitis micótica producida por Fusarium en una paciente tratada inicialmente con colirio de fluconazol y clorhexidina y, posteriormente, con un colirio de natamicina, con resolución del cuadro clínico7. Xuguang et al., en un estudio realizado en Pekín (China) entre los años 2001 y 2004, evaluaron 681 casos de queratitis: Fusarium fue el género aislado mayoritariamente (57,86% del total de casos), seguido de Aspergillus (17,03%)36. Wang et al. observaron una incidencia similar en la ciudad de Zhengzhou (China), con los géneros Alternaria, Aspergillus y Fusarium como los más frecuentemente aislados33.
En el sur de India los hongos más frecuentemente aislados en este tipo de afección son Fusarium (47,1%), Aspergillus (16,1%), Botryodiplodia theobromae (3,9%) y Curvularia (3,2%)27. Un resultado radicalmente diferente fue el reportado por Wilhelmus en EE. UU., quien refiere que 36 de 52 casos de queratitis micótica diagnosticados fueron debidos a Curvularia, y relacionó este hallazgo con condiciones ambientales favorables para la propagación y desarrollo de esta especie, ya que la mayoría de los casos descritos se registraban en los meses más cálidos y húmedos34.
Martínez et al. describieron un caso de queratoconjuntivitis por Rhinosporidium seeberi en un hombre de 68 años de edad portador de una prótesis ocular, en Santiago de Chile19. Kuster et al. publicaron 12 casos de micosis oculares en Santiago de Chile, de los que nueve correspondieron a queratitis micótica y tres a endoftalmitis posquirúrgicas14. En diez de ellos se aisló el hongo, correspondiendo cuatro de ellos a Fusarium, cuatro a Acremonium y dos a Candida. En ocho de estos casos el hongo fue observado al examen microscópico directo, y en los cuatro restantes solo en cultivo. En el 50% de los casos se documentó traumatismo previo, y en dos casos fue necesaria la enucleación del ojo. Díaz et al. comunicaron dos casos de queratitis micótica tras un trasplante de córnea; se aislaron Acremonium kiliense y otra especie de ese mismo género, y se produjo pérdida funcional del órgano en uno de los casos, y daño grave del ojo en el otro6. Los hongos no fueron observados en el examen microscópico directo. Reyes et al. describieron un caso de queratitis fúngica por Alternaria alternata posterior a un traumatismo con material vegetal22. El hongo fue observado en el examen microscópico directo y aislado en cultivo. El paciente respondió favorablemente al tratamiento con anfotericina B e itraconazol. Urbina y Mura estudiaron 30 casos de perforaciones corneales desde 1995 hasta 2003, y encontraron que el 10% de ellas tenían un origen micótico, sin indicar los resultados del examen microscópico directo ni del cultivo o del tratamiento31.
Reyes et al. describieron trece casos de queratitis micótica observados entre los años 2008 y 2010, diez con antecedentes de traumatismo ocular con material vegetal, uso de corticoides, antibióticos o antivirales durante un tiempo prolongado, y tres sin antecedentes23. En el examen microscópico directo se constató la presencia del hongo en el 100% de los casos. En cinco casos se identificaron Fusarium, Acremonium, Scedosporium apiospermum, Aspergillus fumigatus y Candida albicans, y en los cuatro restantes (30%) no se identificó el agente etiológico.
Una queratomicosis debe tomarse en consideración en toda lesión traumática de córnea, de origen vegetal o telúrico, más aún si no responde a terapia antibacteriana, como sucedió en el caso que presentamos. La correcta identificación del agente etiológico es importante porque la sensibilidad antifúngica varía según la especie fúngica implicada. El examen microscópico directo de una muestra de raspado corneal aporta gran información para el diagnóstico. En general, las coloraciones hematológicas son de utilidad porque permiten visualizar las células del tejido, la infiltración por polimorfonucleares, bacterias, amebas, hongos, etc., pero también debe hacerse una preparación con solución de KOH al 10% más tinta Parker negra permanente (3:1) que permite observar fácilmente el hongo en el tejido (fig. 2B). La muestra debe ser sembrada en medios de cultivo como agar glucosado de Sabouraud, agar con extracto de papa y glucosa o agar lactrimel, y en el caso en que se sospeche una infección por levaduras se debería sembrar también en CHROMagar™ Candida.
Las queratomicosis son difíciles de manejar desde la perspectiva de la terapéutica. Li et al. describen valores de CMI90 para Fusarium de 16μg/ml para la natamicina, 8μg/ml para la terbinafina, 16μg/ml para el itraconazol, más de 64μg/ml para el fluconazol y 4μg/ml para la anfotericina B16. Se observó sinergia entre la anfotericina B y la terbinafina para el 81,6% de las cepas, y entre la anfotericina B y el itraconazol en el 84,2%. Dichos autores también describen antagonismo entre la natamicina y los azoles, y entre la natamicina y la terbinafina, en el 52,6 y 60,5% de las cepas, respectivamente. Recientemente se ha utilizado el voriconazol como una alternativa frente a las infecciones producidas por especies del género Fusarium21. Kernt y Kampik no observaron toxicidad después de 30 días de tratamiento con voriconazol a dosis tan altas como 250μg/ml13. Según Tuli, el voriconazol sería el fármaco de elección en el tratamiento de las queratitis debido a su amplio espectro antifúngico y su buena penetración en la córnea29. En el caso que aquí presentamos, el paciente respondió bien al tratamiento con 400mg de voriconazol/12h durante 48h, y posteriormente, 200mg de voriconazol/12h durante un mes.
Aun cuando las queratomicosis en Chile son raras, eventualmente pueden ser subdiagnosticadas, debiéndose tomar en consideración sus particularidades diagnósticas para poder instaurar el tratamiento más adecuado.