Este trabajo fue parcialmente apoyado por FCT (Sapiens 43462/01, 36363/99; 42812/01, 35231/99; UMIB).
INTRODUCCIÓN
La espermatogonia representa la población stem cell diploide del testículo (46 cromosomas, 2N-ADN). Después de una fase proliferativa mitótica, se transforman en espermatocitos primarios leptoteno diploides, los cuales concluyen una replicación de ADN (46 cromosomas, 4N-ADN). Después de esto, entran en una larga profase meiótica que se caracteriza por el alineamiento de los cromosomas homólogos, ensamblaje del complejo sinaptonémico y emparejamiento de los homólogos (sinapsis) en cigoteno, recombinación recíproca (rotura de la cadena de ADN, intercambio de segmentos de ADN entre cromátidas homólogas y reparación del ADN) en el estadio de paquiteno, y formación del quiasma en el estadio de diplotene (quiasma son los puntos de los homólogos que permanecen adherentes después de la recombinación). Después de estos pasos, los espermatocitos primarios entran en la primera división meiótica, por la cual el quiasma conduce la segregación de los homólogos a polos opuestos del huso. El producto de la primera división meiótica son los espermatocitos secundarios (23 cromosomas, 2N-ADN). Éstos no replican el ADN e inmediatamente entran en la segunda división meiótica, en donde las cromátidas hermanas (de cada homólogo) se segregan a polos opuestos. La segunda división meiótica da lugar a las espermátides redondas, las primeras células germinales haploides (23 cromosomas, 1N-ADN). A partir de este estadio no se producen más divisiones celulares y las espermátides redondas se diferencian progresivamente hasta espermatozoide maduro1-4.
La ausencia de espermatozoides en el eyaculado causada por ineficiencia, deficiencia o ausencia de maduración de las células germinales se denomina azoospermia secretora (o azoospermia no obstructiva). El análisis histopatológico de la azoospermia no obstructiva mostró 3 síndromes principales: síndrome de células de Sertoli (SCOS), parada de la maduración (MA, maturation arrest) e hipoplasia (HP o hipoespermatogénesis). Estos síndromes pueden ir acompañados de cambios estromales, que incluyen hipoplasia o hiperplasia de las células de Leydig, esclerosis del tejido conectivo debido a un incremento en la deposición de colágeno, o engrosamiento de la lámina basal. Los 3 síndromes pueden ser idiopáticos, genéticos primarios (aberraciones cromosómicas tales como las trisomías sexuales y autosómicas, translocaciones cromosómicas, microdeleciones en el cromosoma Y, defectos en el proceso de la meiosis) o secundarios a endocrinopatías, enfermedades sistémicas, deficiencias nutricionales (vitamina A, cinc), terapia médica (fármacos, quimioterapia, radiación) y patología específica testicular5 (obstrucción de los conductos excretores, criptorquidia, varicocele, trauma, torsión del cordón, infección, tóxicos testiculares, calor).
El SCOS se caracteriza por la presencia de células de Sertoli, somáticas, nutrientes y de soporte del epitelio seminífero, y ausencia de cualquier tipo de célula germinal. La MA se caracteriza por interrupción en la maduración de las células germinales en cualquier tipo celular germinal, causando oligozoospermia (parada parcial) o azoospermia (parada total). La maduración de las células germinales se divide en 3 procesos principales: proliferación mitótica de la espermatogonia, meiosis y diferenciación de espermátides redondas en espermatozoides. La MA de las células germinales en la meiosis puede tener lugar en la fase de espermatocito primario (deficiencias en el emparejamiento de los homólogos, entrecruzamiento y formación de quiasma; separación prematura de los homólogos; no disyunción de los homólogos en la primera división meiótica) o en la fase de espermatocito secundario (no disyunción de las cromátidas en la segunda división meiótica). La HP se caracteriza por la presencia de todos los estadios de células germinales, cuyo número está disminuido en proporciones similares, desorganización espacial del epitelio seminífero, con desprendimiento de las células germinales, y subsiguiente disminución en la producción de espermatozoides5-7.
Con la introducción de la inyección intracitoplásmica de esperma (ICSI, intracytoplasmic sperm injection) se aplicó la biopsia testicular múltiple y bilateral (TESE) para buscar espermatozoides en pacientes en los que, en el análisis histopatológico previo, se diagnosticó ausencia total en la producción de espermatozoides. El motivo fue la suposición de que los pequeños fragmentos utilizados para el diagnóstico podrían no reflejar la situación general del testículo. En nuestra experiencia, la TESE permitió reclasificar la MA en 2 subtipos: los casos que presentan MA completa, caracterizados por una parada completa de la meiosis, y los casos con MA incompleta, en donde podrían encontrarse espermatozoides/espermátides tardías en al menos un fragmento8-10.
La infertilidad en varones con cariotipo y características sexuales secundarias normales y ausencia de patologías testiculares, endocrinopatías y microdeleciones en Yq11.2 puede ser debida a deficiencias en la cascada de genes de activación que controlan los procesos meióticos. Los estudios en knock-out mice han mostrado que la parada en la meiosis puede ser completa o incompleta, y que estas situaciones habitualmente se asocian con deficiencias en el emparejamiento de los cromosomas homólogos o recombinación recíproca3,5,11,12. La disminución en el emparejamiento se ha relacionado con defectos en los genes que controlan el ensamblaje del complejo sinaptonémico. Por el contrario, deficiencias en el sistema de reparación del ADN parecen asociarse con el emparejamiento o con la recombinación recíproca. Deficiencias en el emparejamiento de los homólogos producen MA en el espermatocito primario y activan el mecanismo de apoptosis para liberar las células germinales muertas en el ciclo celular. Cuando esta parada no es completa, la ausencia de formación de quiasmas conduce a la no disyunción durante las divisiones celulares y diferenciación del espermatozoide con aumento de las cifras de aneuploidía. Deficiencias en el sistema reparador del ADN pueden causar valores disminuidos de formación de quiasmas (dependiente en los episodios de recombinación) y no disyunción (dependiente en la formación del quiasma). El análisis de mutante de ratón ha mostrado que las mutaciones en el gen Atm (ataxia telangiectasia mutante) o del gen Scp3 no interfieren con la proliferación mitótica de la espermatogonia ni con la entrada meiótica del espermatocito, pero provocan una parada en el estado de cigoteno. Esta parada meiótica en el estadio de espermatocito primario fue causada por deficiencias en el requerimiento de proteína para formar el complejo sinaptonémico, con la consiguiente ausencia de emparejamiento entre los pares homólogos (asinapsis). Sin embargo, en mutaciones en Atm unas pocas células pueden superar el bloqueo meiótico, mientras que en mutaciones en Scp3 la parada meiótica es completa en cigoteno13-15. Los defectos en los genes del sistema de reparación de ADN también causan una situación heterogénea. Deficiencias en Pms2 originan pares de cromosomas anormales debido a deficiencias en el ensamblaje del complejo sinaptonémico, y en estos casos unas pocas células pueden superar el bloqueo meiótico y formar espermatozoides maduros16. Por el contrario, defectos en Mlh1 interfieren con recombinación recíproca, causando valores reducidos de formación de quiasma y la subsiguiente separación prematura (desinapsis) de los pares de cromosomas homólogos17.
Muchos estudios han probado citogenéticamente el proceso meiótico y/o la constitución cromosómica de los espermatozoides en pacientes infértiles con alteración de los parámetros seminales18-23. Sin embargo, en los pocos estudios sobre azoospermia secretora no se obtuvieron resultados consistentes al observar la etiología específica de la MA24-27. Para resolver esta cuestión, comparamos casos de MA completa e incompleta por hibridación in situ fluorescente (FISH) utilizando sondas para los cromosomas sexuales y para 2 autosomas. Para asegurar una correcta identificación de los diferentes estadios espermatogenéticos, se aislaron por micromanipulación poblaciones puras de células germinales por estadios específicos. Los resultados sugieren que mientras la MA incompleta se relaciona con deficiencias en el emparejamiento de homólogos, la MA completa parece asociarse con aneuploidías en las espermatogonias mitóticas y deficiencias en los episodios de recombinación recíproca que ocurren en la meiosis después del emparejamiento normal de los homólogos.
MATERIAL Y MÉTODOS
Selección de pacientes
Se seleccionaron como controles los pacientes con azoospermia obstructiva y espermatogénesis conservada (n = 7) confirmada por histopatología: 4 con obstrucción inflamatoria del epidídimo, 2 con ausencia congénita bilateral de los vasos deferentes y 1 con ausencia congénita unilateral de los vasos deferentes. Los pacientes con MA en el análisis histopatológico fueron separados en MA completa (parada en el estadio de espermatocito primario; n = 9) o MA incompleta (al menos un fragmento con espermátides maduras o espermatozoides; n = 11) tras la TESE en el ciclo de tratamiento ICSI. En todos los casos, los pacientes tenían cariotipo normal tras la alta resolución de la bandas GTG de linfocitos de sangre periférica28 y ausencia de microdeleciones en Yq11.2-AZF29. Las células utilizadas para las prácticas fueron las sobrantes en la placa después de la microinyección, de acuerdo con el consentimiento informado del paciente.
Aislamiento y cultivo de las células germinales masculinas
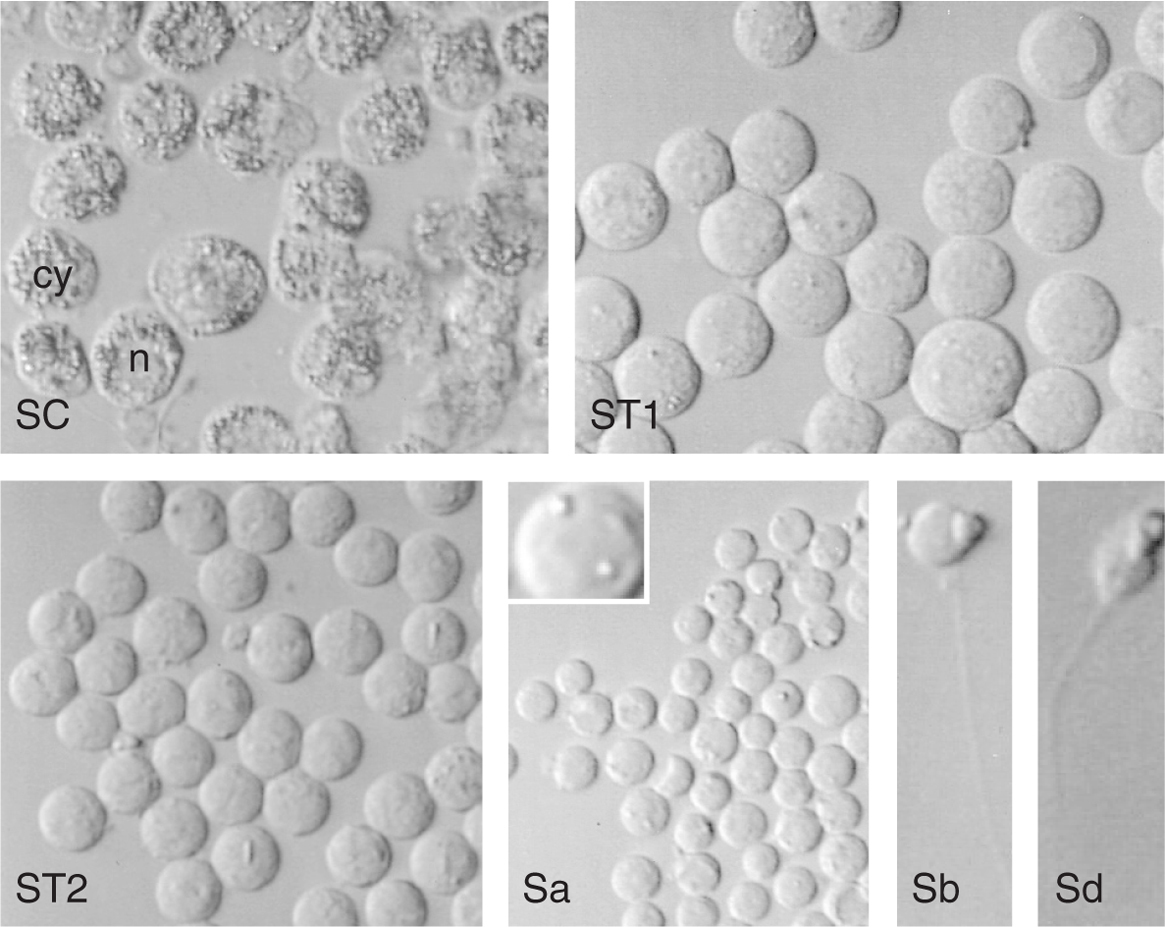
El tejido testicular fue recogido en medio de preparación de esperma (con Tampón, SPM; Medicult, Copenhague, Dinamarca) y dilacerado con agujas quirúrgicas. El fluido fue lavado con SPM (2 x 5 min, 1.000 revoluciones/min), incubado (5 min) con 2 ml de tampón de lisis de eritrocitos (155 mmol NH4Cl, 10 mmol KHCO3, 2 mmol de ácido etilendiaminotetraacético [EDTA] en agua; pH 7,2 con KOH; 0,2 μm filtrado; Sigma, Barcelona, España), lavado como anteriormente, disociago (1 h, 37 °C) con 25 μg/ml de DNasa y 1.000 U/ml de colagenasa-IV en SPM (0,2 μm filtrado; Sigma), lavado como antes e incubado (32 °C, 5% CO2) en medio IVF (Medicult) hasta su utilización10. Se diluyeron 10 μl de cada muestra en 60 μl SPM, y la muestra fue extendida en una placa de cultivo y recubierta con aceite mineral (Medicult). Las células de los distintos estadios fueron seleccionadas de acuerdo con los criterios morfológicos descritos previamente8,30,31 en un invertoscopio invertido Nikon, equipado con óptica Hoffman y calentado (32 °C), utilizando micromanipuladores Narishige (Nikon, Tokyo, Japón) y micropipetas de 15-20 μm de diámetro (SweMed, Frolunda, Suecia). Las células de cada estadio fueron transferidas a microgotas de 10 μl de SPM y cuidadosamente examinadas para eliminar cualquier célula contaminante o degenerada (fig. 1).
Figura 1. Células del epitelio seminífero por estadios después del aislamiento por micromanipulación (microscopio invertido de Hoffman). Células de Sertoli (SC) que muestran las gotas de lípidos en el citoplasma (cy) y la región nuclear clara (n). ST1: pool de espermatocitos primarios; ST2: espermatocitos secundarios; Sa: espermátides redondas tempranas; Sb: espermátides elongándose; Sd: espermátides elongadas.
Hibridación in situ fluorescente (FISH)
Las células fueron transferidas por micromanipulación a 3 μl de tampón de lisis (0,01 N HCl/0,1% Tween 20; Sigma) en portas recubiertos de Poly-L-Lysina (Sigma). Tras el aislamiento de los núcleos, los portas fueron secados, lavados (5 min) en agua y Phosphate-Buffered Saline (PBS, Sigma), rápidamente deshidratados (15 s) en una serie de etanol y almacenados (oscuridad, 20 °C) hasta su utilización. Los portas fueron incubados (20 min, 37 °C) con pepsina (100 μg/ml; Sigma), lavados, fijados (4 °C, 10 min) con 4% de paraformaldehído (Bio-Rad, Watford, Inglaterra), lavados y deshidratados. En cada porta se colocaron 10 μl de la mezcla (6 μl de tampón de hibridación, 1 μl de cada sonda centromérica ADN α-satélite, 1 μl de agua; Vysis Inc., Downers Grove, IL, EE.UU.). Las sondas fueron CEP 18 (región 18p11.1-q11.1, locus D18Z1; Spectrum Aqua), CEP 7 (región 7p11.1-q11.1, locus D7Z1; Violet: 0,5 μl Spectrum Orange + 0,5 μl Spectrum Green) y CEP X (bandas Xp11.1-q11.1, locus DXZ1; Spectrum Green)/CEP Y (bandas Yp11.1-q11.1, locus DYZ3; Spectrum Orange). Las sondas y el ADN nuclear fueron desnaturalizados (75 °C, 3 min) y después hibridados (37 °C, 4 h, en cámara oscura y humedad). Los lavados posthibridación contenían 60% de formamida (Fluka Chemika, Suiza)/2 x SSC/0,05% Tween 20 (42 °C, 5 min), 2 x SSC (42 °C, 5 min) y 4 x SSC/0,05% Tween 20 (5 min). Después de lavar, los portas fueron deshidratados, secados y montados en 10 μl de Vectashield antifade medium que contenía 1,5 g/ml de 4',6-diamidino-2-phenylindole (DAPI) para neutralizar el núcleo (Vector Laboratories, Burlingame, EE.UU.). La eficacia del proceso de FISH fue probada utilizando cromosomas en metafase e interfase y núcleos interfásicos del cultivo de linfocitos masculinos normales estimulados con fitohemaglutinina (Difco Laboratorios, Detroit, EE.UU.) y cultivados durante 72 h a 37 °C. Se examinaron un total de 100 linfocitos, y el 95% de ellos dieron señales positivas para el número esperado de copias. Las imágenes de FISH fueron recogidas en un microscopio Nikon (Eclipse, E-400) de epifluorescencia adaptado a una cámara CCD y un software apropiado (Cytovision Ultra, Aplicado a la Imagen Internacional, Sunderland, Reino Unido).
Criterios de emparejamiento
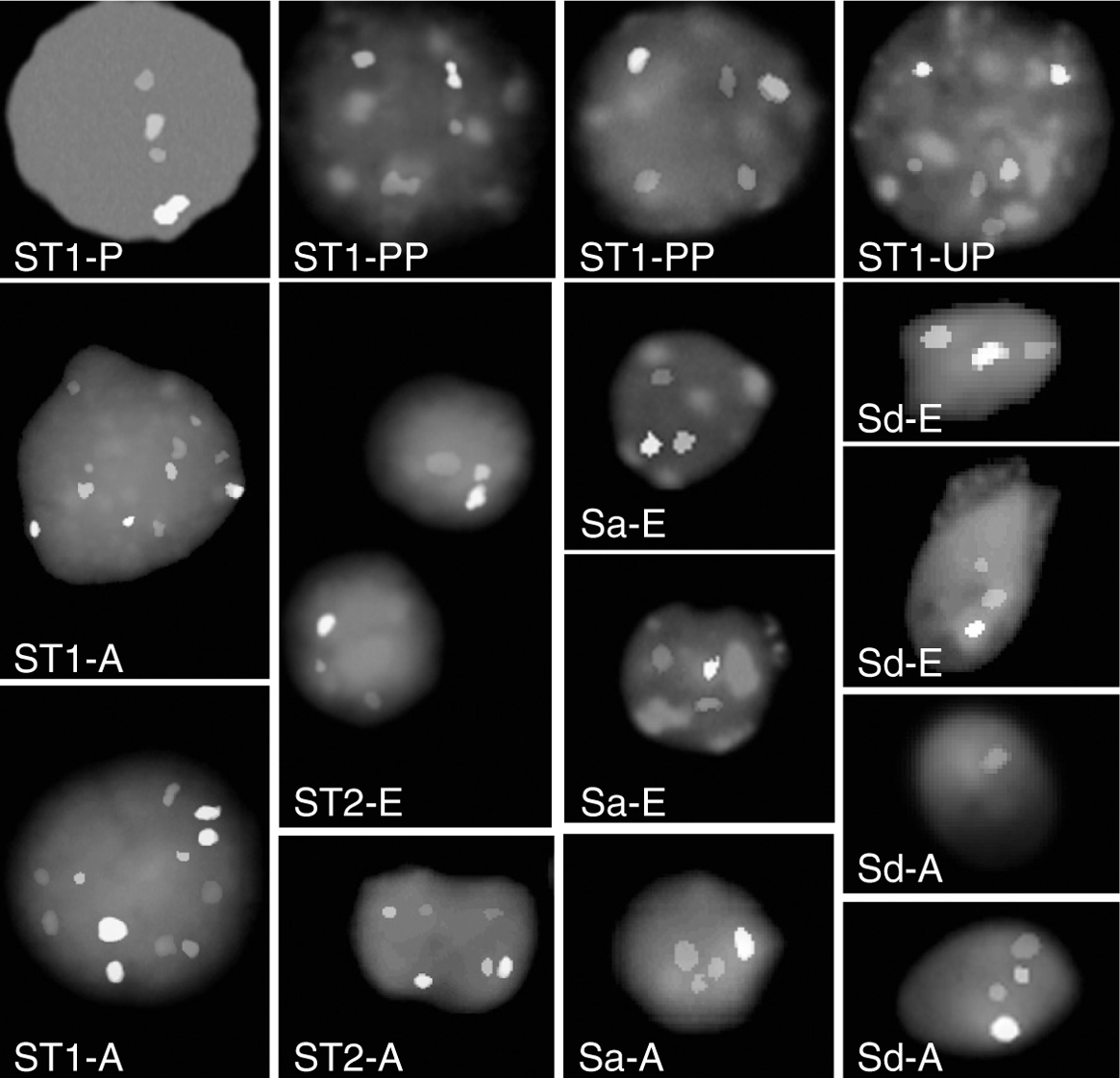
Las señales generadas por FISH se clasificaron como: no emparejadas, cuando los límites de las 2 señales estaban separados por más del diámetro de una de las señales; alineados, cuando los límites de las 2 señales estaban separados por menos del diámetro de una de las señales pero sin contacto; emparejados, cuando los límites de las dos señales contactaban o se fusionaban en una gran señal32. Esta clasificación se estableció tras aplicar el FISH a un cromosoma autosómico y a células germinales premeióticas identificadas por el estadio diploide y la localización en las secciones de parafina. Debido a que los criterios pueden no asegurar la correcta identificación de las células germinales, en este estudio hemos utilizado poblaciones celulares germinales aisladas y localización simultánea por FISH color-4 de los 2 cromosomas sexuales y de dos autosomas diferentes. Los resultados muestran que el emparejamiento de todos los cromosomas en los espermatocitos primarios es raro, y que en los casos de emparejamiento la mayoría es asíncrono, p. ej., ocurre en algunos pero no en todos los cromosomas a la vez (emparejamiento parcial). Debido a este hallazgo, hemos clasificado como emparejados todas las situaciones (emparejamiento + emparejamiento parcial) donde el emparejamiento o alineamiento alcanza al menos a un homólogo (fig. 2).
Figura 2. Hibridación in situ fluorescente con sondas para los cromosomas X, Y, 7 y 18. ST1: espermatocitos primarios; ST2: espermatocitos secundarios; Sa: espermátides redondas; Sd: espermátides elongadas; P: homólogos emparejados; PP: homólogos parcialmente emparejados; UP: homólogos no emparejados; E: núcleo euploide; A: núcleo aneuploide.
Estadística
Las señales de FISH fueron registradas por 2 citogenetistas independientes en un procedimiento doble ciego (no se dio información del tipo de azoospermia secretora ni del tipo de células analizadas). Se utilizó el test de la χ2 para comparar la significancia entre los dos grupos.
RESULTADOS
En este estudio, la FISH se realizó utilizando 2 sondas para los cromosomas sexuales (X, Y) y 2 sondas para los cromosomas autosómicos (7, 18). En total, 4.512 células se caracterizaron citogenéticamente por estadios específicos después de ser aisladas por micromanipulación de biopsias testiculares en fresco durante el tratamiento de TESE-ICSI de varones infértiles con espermatogénesis conservada (controles: azoospermia obstructiva; n = 7), MA incompleta (n = 11) y MA completa (n = 9). Las aneuploidías y el emparejamiento de los homólogos fue cuantificada en 863 células de Sertoli, 1.720 espermatocitos primarios, 755 espermatocitos secundarios, 553 espermátides redondas y 621 espermátides elongadas (tablas 1 a 3) (fig. 2).
Las aneuploidías encontradas en las células de Sertoli fueron 31/345 (9%) en los controles, 17/228 (7,5%) en la MA completa y 56/290 (19,3%) en los casos de MA incompleta, y sólo fueron significativamente superiores en los casos de MA incompleta.
En los espermatocitos primarios se encontraron aneuploidías en 8/225 (3,6%) de los controles, en 27/502 (5,4%) de los casos de MA incompleta y en 82/993 (8,2%) de los casos de MA completa, con un incremento significativo sólo en relación con la MA completa. Se encontró emparejamiento de los cromosomas homólogos en los espermatocitos primarios en 99/217 (45,6%) de los controles, un valor similar al encontrado en la MA completa (453/912, 49,7%). Por el contrario, en la MA incompleta (140/475, 29,5%) el emparejamiento de los homólogos fue significativamente menor.
Para los espermatocitos secundarios, se encontraron aneuploidías en 10/444 (2,3%) de los controles, habiendo un incremento significativo en la tasa de aneuploidías en la MA incompleta (9/311, 9%). En relación con las redondas (controles: 46/418, 11%; MA incompleta: 17/135, 12,6%) o espermátides elongándose y elongadas (controles: 29/442, 6,6%; MA incompleta: 13/179, 7,3%), no se encontraron diferencias significativas en las tasas de aneuploidía entre los controles y los casos de MA incompleta. Aunque no se pueden imaginar causas específicas, el análisis de los espermatocitos secundarios, espermátides redondas y elongadas reveló una diferencia significativa entre el porcentaje de los sexos femenino y masculino en las células germinales, tanto en controles como en casos de MA incompleta, con un ligero predominio del tipo femenino.
DISCUSIÓN
La azoospermia secretora (azoospermia no obstructiva) es la principal causa de infertilidad masculina. El análisis histopatológico en estos casos reveló 3 síndromes principales: células de Sertoli (SCOS), parada de la maduración (MA) e hipoplasia (HP). Con la aplicación del ICSI, se realizó la biopsia testicular bilateral y múltiple (TESE) para averiguar si se podían encontrar espermatozoides en el SCOS y MA, teniendo en cuenta que la biopsia simple tomada para histopatología podría no reflejar la situación global del testículo. Los ciclos de TESE-ICSI han demostrado que en algunos casos de SCOS y MA (SCOS incompleto o casos de MA incompleta) se puede encontrar al menos un fragmento con espermatozoides10.
La azoospermia secretora genética primaria puede ser debida a aberraciones cromosómicas28,33. En otros casos ha sido atribuida a microdeleciones en la región AZF localizada en Yq11.2. En estos últimos casos, las microdeleciones que abarcan la subregión más proximal AZFa se asociaron con SCOS35, la MA fue correlacionada con microdeleciones en la subregión central de la AZFb36,37, mientras que la oligozoospermia y la HP parecieron estar asociadas con microdeleciones que afectan a la subregión más distal AZFc29. Sin embargo, y alternativamente, se ha sugerido que las microdeleciones individuales en AZFc implicadas en la secuencia DAZ son propensas a desarrollar una lesión intratesticular en la diferenciación de espermátida causando oligozoospermia, y que este defecto puede además evolucionar con el tiempo causando HP, MA e incluso SCOS29.
En el caso de MA, los estudios de ratón mutados han apuntado otras causas genéticas3,5,12-17. La relación con anomalías del emparejamiento de los cromosomas (sinapsis) conduce a una parada meiótica y eliminación de los espermatocitos primarios bloqueados (apoptosis), así como la formación de espermatozoides aneuploides debido a errores de no disyunción. Asimismo, el emparejamiento normal y defectos en la recombinación recíproca causan parada meiótica debido a los niveles disminuidos de formación de quiasmas, separación precoz de homólogos/cromátidas o segregación anormal (no disyunción) de cromosoma/cromátida. Son pocos los estudios citogenéticos que se han realizado en espermatocitos primarios de varones azoospérmicos con MA. En un estudio, un varón con características secundarias sexuales normales y MA incompleta presentó un emparejamiento normal pero un fallo en la formación de quiasmas24. Por el contrario, se encontró emparejamiento anormal de cromosomas meióticos en biopsias testiculares de pacientes varones infértiles con causas variables de disfunción de la espermatogénesis25. Sin embargo, el tipo variado de pacientes estudiados no es capaz de atribuir este hallazgo a los casos de MA. Un estudio más reciente, en el que se utilizaron secciones de parafina de muestras de testículos extraídas de pacientes azoospérmicos durante el TESE-ICSI, comparó las aneuploidías sexuales entre pacientes controles con azoospermia obstructiva (OAZ) y espermatogénesis conservada, la HP y la MA incompleta y completa26. En OAZ, las aneuploidías sexuales se encontraron en un 2,9% de las células germinales premeióticas y en 26,2% de células germinales haploides, mientras que en la HP y en la MA incompleta y completa estos valores variaron entre el 9,9, el 9,1 y el 12,8% para las células germinales premeióticas y el 30,6, el 34,4 y el 26,2% para las células germinales haploides, respectivamente. Sin embargo, las células germinales haploides no habían sido detectadas en los casos de MA completa, mientras en la MA incompleta y la HP las células germinales haploides estudiadas incluían tanto espermatocitos secundarios como espermátides, lo cual hace difícil cualquier comparación estadística. Por el contrario, el reanálisis de estos datos en relación con las células germinales diploides (espermatocitos primarios) mostró que hay un incremento de aneuploidías en la HP (9,9%), la MA incompleta (9,1%) y la MA completa (12,8%) en relación con los controles (2,9%).
Sólo un estudio citogenético ha sido realizado en espermatocitos primarios de varones azoospérmicos que presentaban MA genética primaria, cariotipos normales y ausencia de microdeleciones en Yq11.2-AZF. El análisis de los cromosomas meióticos se realizó después de la extensión de células espermatogenéticas recogidas durante TESE-ICSI27. Los datos mostraron que el emparejamiento de los cromosomas sexuales en la MA completa disminuyó (23%) en relación con la HP (73%) y la OAZ (84%), y lo mismo ocurrió con emparejamiento de los cromosomas autosómicos (CEP 18) (60, 91 y 95%, respectivamente).
Para comparar mejor los backgrounds genéticos de los casos de MA completa e incompleta, se seleccionaron 27 pacientes azoospérmicos con cariotipo normal y ausencia de microdeleciones en Yq11.2-AZF (a, b, c). De éstos, 7 fueron utilizados como controles (OAZ), 9 tenían MA completa y 11 MA incompleta, como se confirmó tras TESE-ICSI. Para asegurar que la identificación de las células fuese correcta, las células germinales fueron aisladas por micromanipulación por estadio de acuerdo con los criterios morfológicos descritos8,31,38,39 y analizados por FISH 4-color simultáneo utilizando sondas centroméricas para los 2 cromosomas sexuales (X, Y) y para 2 cromosomas autosómicos diferentes (7, 18). Los datos mostraron que los casos de MA completa e incompleta difieren en su background genético tanto en la aneuploidía de las células germinales premeióticas como en el emparejamiento de los homólogos meióticos en los espermatocitos primarios.
Específicamente, la MA incompleta se caracterizó por valores incrementados de aneuploidías en las células de Sertoli (19,3% frente al 9% en controles) y disminución del emparejamiento de los homólogos en espermatocitos primarios (29,5% frente al 45,6% en controles). Las aneuploidías en las células de Sertoli se describen aquí por primera vez, y su incidencia incrementada en casos de MA incompleta sugiere un mecanismo general genético que favorece la disrupción del epitelio seminífero. Los bajos niveles de formación de espermátides tardías en estos casos de MA incompleta están, pues, relacionados con la parada meiótica inducida por una disminución del emparejamiento de los homólogos, lo cual se debe probablemente a deficiencias en el ensamblaje del complejo sinaptonémico. Por otro lado, las cifras incrementadas de aneuploidías encontradas en los espermatocitos secundarios (9% frente al 2,3% en controles) se explican por disminución del emparejamiento de los homólogos a favor de la no disyunción. Además, como la incidencia de aneuploidías en las espermátides elongadas (7,3%) no difiere de los controles (6,6%), postulamos un nuevo mecanismo de regulación por el cual las aneuploidías de los espermatocitos secundarios y de las espermátides redondas (12,6% frente al 11% en controles) son preferentemente reducidos en el testículo durante la diferenciación a espermatozoide.
En varones fértiles, la incidencia de aneuploidías en espermatozoides es < 0,5%, comparado con una frecuencia de 0,7% de anormalidades en la población general neonatal. Por el contrario, se encontró un incremento en la incidencia de aneuploidías en los espermatozoides en varones infértiles (2-14%), cerca del 2% en casos con anomalías mixtas de semen, 5% en oligozoospermia (en terato y astenozoospermia se han obtenido resultados no concluyentes) y 14% en azoospermia. Los valores incrementados de aneuploidías en espermatozoides de pacientes infértiles se han relacionado con la incidencia incrementada de anomalías cromosómicas (1%) en niños concebidos por ICSI23. Estas observaciones muestran que no hay diferencias significativas entre la incidencia de aneuploidía en las espermátides tardías, controles (6,6%) y MA incompleta (7,3%), lo que puede explicarse por el hecho de que en la azoospermia sólo unos pocos cientos de gametos son accesibles para el análisis de FISH, mientras que en las muestras de semen se estudian cerca de 1.000-10.000 espermatozoides por muestra. Alternativamente, los resultados podrían ser explicados si se asume que en pacientes con azoospermia obstructiva y espermatogénesis conservada también se observa una incidencia incrementada de aneuploidías en los gametos.
Por el contrario, la MA completa se caracterizó por emparejamiento normal (49,7%) y valores incrementados de aneuploidías en espermatocitos primarios (8,2% frente al 5,4% en MA incompleta y 3,6% en controles). Estos resultados sugieren un incremento en los errores de la no disyunción durante la proliferación mitótica de la espermatogonia, así como un incremento de las anomalías durante los acontecimientos postsinápticos, tales como recombinación y formación de quiasmas probablemente mediados por deficiencias en el sistema de reparación del ADN. En cualquier caso, ambos sucesos favorecen una parada meiótica completa e identifican un background genético diferente en comparación con los casos de MA incompleta.
Estos resultados abren la discusión de la tasa de emparejamiento normal de los homólogos cigoteno en la espermatogénesis humana normal. El análisis citogenético y el de FISH determinaron que la mayoría de las espermatogonias (86-91%) y espermatocitos leptoteno (96%) tienen homólogos no emparejados, y que la mayoría de los espermatocitos cigoteno (72%) y paquiteno (100%) muestran homólogos emparejados14,27. Sin embargo, nuestras observaciones mostraron que en OAZ con espermatogénesis conservada, el emparejamiento normal tiene lugar en cerca del 45,6% de los espermatocitos primarios. Otra observación llamativa fue que en la mayoría de las células el emparejamiento de los homólogos fue asincrónico (parcial) entre los diferentes cromosomas. Aunque tales diferencias podrían deberse a la presencia de un gran número de espermatogonias y espermatocitos leptoteno contaminantes en el pool de espermatocitos primarios seleccionado para este estudio, creemos que éste no es el caso, ya que en una muestra de testículo la mayoría de las células germinales premeióticas diploides son espermatocitos primarios en el estadio de paquiteno, que presentan un diámetro mayor. Así pues, las diferencias encontradas aquí se pueden deber a un examen más refinado. Primero, hemos seleccionado cuidadosamente las células por micromanipulación, mientras que otros estudios han utilizado secciones de parafina o extensiones en portas, y hemos distinguido los espermatocitos primarios paquiteno por su localización o criterios de diploidía. Segundo, hemos utilizado FISH 4-color simultáneo con sondas para los 2 cromosomas sexuales y 2 autosomas diferentes, mientras que otros estudios han utilizado sondas de cromosomas sexuales o/y una sonda autosómica simple.
AGRADECIMIENTOS
Agradecemos a los Dres. C. Oliveira, J.M. Teixeira da Silva, Profs. J. Beires, N. Montenegro (Ginecología) y Dr. L. Ferrás (Urología) por el trabajo clínico, al Dr. P. Viana por la asistencia técnica al laboratorio de FIV, y a los Dres. C. Ferrás, J. Marques, F. Carvalho y S. Fernandes por el cribado del cromosoma Y.