INTRODUCCIÓN
La espermatogenia es un proceso de mitosis y meiosis por el cual las espermatogonias dan lugar a espermátidas y espermatozoides maduros en los tubos seminíferos. Dentro de las espermatogonias, existe un tipo denominado célula madre espermatogonia (spermatogonial stem cell [SSC]) con capacidad de autorrenovarse y de producir células hijas diferenciadas que madurarán hasta espermatozoides. La caracterización de éstas es difícil, y no ha sido hasta el desarrollo del trasplante entre especies cuando se ha podido estudiar.
Las SSC son resistentes a una serie de agentes que pueden dañar los testículos, como es el caso de sustancias químicas o radiaciones en procesos de tratamientos oncológicos. En ocasiones, estas células sobreviven cuando otros tipos de células germinales son destruidas. Se supone que la menor frecuencia de división de las células madre es el motivo de su habilidad para sobrevivir bajo influencias que deterioran el resto de la población germinal.
La primera descripción de trasplante de células germinales con éxito en ratones fue presentada por Brinster y Zimmermann, en 19941, y por Brinster y Avarbock2, en 1994, por lo que fueron los pioneros en la técnica de trasplante de células germinales testiculares. Las células trasplantadas del donante generaron colonias en receptores que dieron lugar a la espermatogenia. Por definición, solamente las células madre pueden dar dicho resultado.
En seres humanos, Radford et al3, en 2002, comunicaron, previa experimentación en monos, la consecución de un embarazo tras autotrasplantar a 6 varones que habían congelado tejido testicular por enfermedad de Hodgkin. Antes de la generalización de esta técnica, los mismos autores plantean la dificultad de saber si los espermatozoides que consiguieron la gestación procedían de las células trasplantadas o de las células madre espermatogonias remanentes.
Tipos y función de las espermatogonias
Las espermatogonias son células diploides situadas en la base del epitelio seminal, que son el reservorio de células a partir del cual se producen las siguientes divisiones celulares que originarán finalmente los espermatozoides4. El modelo más estudiado es el modelo murino, si bien se han producido importantes avances tanto en humanos como en bovinos.
Ratón
En los mamíferos no primates, las espermatogonias As (single) son las consideradas SSC5-8. Al dividirse, estas células podrán originar, por un lado, 2 nuevas As, o bien, por otro, las llamadas espermatogonias Apr, que serán las células predeterminadas a originar el resto de células que conformarán la espermatogenia. De este modo, cada célula Apr originará, a su vez, 2 nuevas células unidas por un puente intercelular, que se mantendrá en su descendencia, para originar las espermatogonias Aal, o espermatogonias alineadas.
Desde hace algún tiempo se plantea la disyuntiva de si la división de las células madre espermatogonias es simétrica o asimétrica, esto es, si en cada división se producirán 2 nuevas células madre o 2 nuevas espermatogonias Apr, o bien, por el contrario, si en dicha mitosis se producirán 2 células hijas, una de cada tipo. Experimentos realizados con timidina tritiada parecen indicar que sería factible esta última posibilidad; sin embargo, aún no existen pruebas concluyentes a este respecto9. Recientemente, se ha asignado un papel clave al gen Zpf145 en el mantenimiento de SSC en el testículo de ratón, de tal manera que su expresión es clave para el mantenimiento y la autorrenovación de la reserva de SSC.
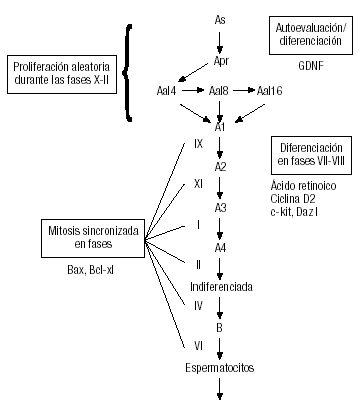
Las espermatogonias en la espermatogenia del ratón se distribuyen de la siguiente manera. En el estadio VIII, As, Apr y Aal están presentes, si bien esta última en un menor número. A partir del estadio X, comienzan a proliferar de manera que las 2 primeras permanecen más o menos constantes mientras que las Aal comienzan a aumentar en número. Alrededor de los estadios II-III, la proliferación se detiene y las células entran en fase G1-G0. En los estadios VII-VIII, casi todas las Aal comienzan una diferenciación al tipo espermatogonia A1, que entra en la fase S del ciclo celular, y alrededor del estadio IX se divide a A2, y para posteriormente originar las A3, A4, indiferenciada y B (fig. 1).
Figura 1. Diagrama del desarrollo de espermatogonias en la espermatogenia del ratón11. GDNF: factor neurotrófico derivado de las células de la glía.
En cuanto a los factores implicados en la regulación de la diferenciación de espermatogonia As a Apr, existe el factor neurotrófico derivado de las células de la glía (GDNF), que es secretado por las células de Sertoli, y cuyos receptores se expresan en las células madre9. Al contrario que en la formación de espermatocitos, que presenta unos mecanismos de regulación exhaustivos, la formación de SSC presenta un escaso control, lo que conlleva una distribución de espermatogonias A1 no homogénea en el testículo.
El control de la formación de espermatocito se debe a mecanismos de apoptosis de las A2, A3 y A4. En esta regulación de la densidad y la población celulares, intervienen moléculas de la familia de Bcl-2, como Bax y Bcl-xl9.
Bovino
En bovinos se ha sugerido una clasificación diferente para las espermatogonias tipo A, que se han dividido en BSC (basal stem cell), ASPC (agregated spermatogonial stem cell) y CSPC (commited spermatogonial precursor cell). Las BSC son células redondas con 3 nucleolos irregulares y se podrían comparar con las espermatogonias As y Apr del modelo murino (tabla 1).
Las ASPC son células de diferentes tamaños. Las CSPC son las espermatogonias más grandes. Presentan un nucleolo central grande, y se corresponden con las espermatogonias A1-A4 diferenciadas del modelo murino10.
Humano
Se distinguen 3 tipos de espermatogonias: espermatogonias oscuras (Ad), espermatogonias pálidas (Ap) y espermatogonias B (B). Las Ad, dentro de las cuales se encuentran las SSC, se sitúan en íntimo contacto con la membrana basal. Carecen de actividad proliferativa en circunstancias normales, pero entran en mitosis cuando el número de espermatogonias desciende drásticamente. Presentan una cromatina muy condensada y una parte central de la cromatina conocida como la vacuola nuclear, que presenta un tono más pálido. Los nucleolos son pequeños y se encuentran periféricamente situados, adyacentes a la membrana nuclear. Las mitocondrias se encuentran próximas al núcleo, y en el espacio existente entre ellas encontramos un material denso a los electrones. El aparato de Golgi está muy poco desarrollado y hay presentes agregaciones de gránulos de glucógeno. También encontramos cristaloides de Lubarsch, que son fibrillas y túbulos alineados a lo largo del axis de la estructura celular.
Las espermatogonias Ap tienen menor contacto con la membrana basal que las espermatogonias Ad. Presentan un núcleo ovalado y 1 o 2 nucleolos próximos a la membrana nuclear. No presentan la vacuola nuclear. Los nucleolos se encuentran en la periferia. Las mitocondrias rara vez forman agrupaciones perinucleares al tiempo que se suelen encontrar formando pares entre el material electrón-denso. Las agregaciones de glucógeno son infrecuentes; sin embargo, sí se observan cristales de Lubarsch. Al dividirse las Ap, se origina la espermatogonia B. Las B, que son las precursoras de los espermatocitos preleptotene, presentan un menor contacto con la membrana basal, tienen gránulos de cromatina muy condensada próximos a la membrana nuclear y su nucleolo se encuentra situado en la región central. Las mitocondrias se encuentran dispersas por el citoplasma y parecen presentar diferencias en cuanto al material intermitocondrial respecto a las espermatogonias tipo A.
Fenotipo SSC en modelo murino
Mediante el empleo de técnicas de citometrías de flujo e incubaciones con Hoechst 33342 y verapamilo, se ha conseguido obtener una serie de características fenotípicas propias de las SSC en testículo de ratón, de modo que podríamos decir que el fenotipo antigénico de superficie de SSC sería Thy-1+, fracción de integrina α6+, fracción de integrina β1+, CD24+, CD9+, MHC-I, c-kit, fracción de integrina αv, Sca-1, CD34, Daz I+, CyclinD2, Bcl2, Bax+ y Bcl Xl+.
En la tabla 2 se puede comprobar que, a pesar de que existen claras diferencias entre las SSC y otras células madre, éstas tienen características comunes con otras. Entre esas características comunes que comparten las SSC con otras células madre se encuentran la ausencia de antígeno de clase I del complejo mayor de histocompatibilidad y la presencia de Thy-1.
En cuanto a este último, es un marcador para los timocitos y algunas células neuronales. Pruebas realizadas en SSC mediante citometría de flujo demuestran que la expresión de Thy-1 es muy inferior a la que se encuentra en las células T y muy similar a aquella encontrada en las células madre hematopoyéticas. Además, las células Thy-1+ presentan asociados un fenotipo c-kit. La expresión de c-kit la encontramos en las espermatogonias diferenciadas. El c-kit es un protooncogén que se expresa en las espermatogonias A1-A4 diferenciadas. Mediante experimentos en los que con anticuerpos monoclonales se inhibía la función del c-kit, se descubrió que su expresión era fundamental para el desarrollo de la mitosis en las espermatogonias tipo A diferenciadas, mientras que las espermatogonias A indiferenciadas o las SSC no necesitarán de la expresión de c-kit para llevar a cabo sus divisiones11. Es posible, por tanto, que la regulación negativa de la expresión de Thy-1 y la positiva de c-kit ocurra en el proceso de diferenciación de las SSC en las espermatogonias. Una función que se sugiere para Thy-1 es, dada la baja tasa de división de las SSC, una inhibición en el crecimiento de dichas células, al igual que se sugirió para con las células neuronales12.
La familia de moléculas de las integrinas desempeña un importante papel en la biología de los diferentes tipos de células madre, concretamente en su migración y anclaje a las membranas. Las SSC migran tras realizar un trasplante a través de las uniones de las células de Sertoli para anclarse finalmente en la membrana basal de los tubos seminíferos. Las SSC presentan las fracciones de integrina α6 y β113.
La proteína CD9 es una molécula de adhesión, una glucoproteína de membrana cuya función actualmente no es conocida con exactitud y que pertenece a la familia TM4. Se ha demostrado que el CD9 aparece asociado a otras proteínas de superficie (como las integrinas α6β1, α3β1, α4β1 y α5β1) e influye en sus funciones, por lo que se encuentra relacionado con la adhesión y la migración celular14. Su expresión en las SSC es una característica común con otras células madre de diferentes tejidos15. La proteína Daz I se expresa en las espermatogonias y parece ser fundamental para la diferenciación espermatogénica.
La ciclina D2 parece desempeñar un papel importante en la diferenciación de espermatogonia Aal a A1, mientras que las proteínas Bcl2 Bax y Bcl-xl son proteínas apoptóticas que están implicadas en la regulación de la densidad de las células germinales9.
Las células SP (side population) son una población de células madre aisladas por primera vez en la médula ósea y, posteriormente, en otros tejidos (músculo) que presenta la particularidad de emitir fluorescencia con tinciones y diferenciarse en células de diferentes tejidos en humanos y roedores. Así, mediante citometría de flujo y tinción con Hoescht 33342, se puede seleccionar esta población celular que supone el 0,05% de la celularidad total de la médula ósea. Esta población SP tiene un considerable potencial de diferenciación e integración en otros órganos. En el testículo de ratón se identificó una población de células, y se creyó que se podría tratar de las SSC. Sin embargo, estudios con citometría de flujo, tinción de Hoescht 33342 y verapamilo permitieron definir el fenotipo de esta población SP testicular, un fenotipo Sca-1+, Thy-1, c-kit, CD34+/, CD43, CD45+/, MHC-I+, y comprobar que no compartían las características de una verdadera SSC.
Todos estos datos llevan a la conclusión de que las SSC y las SP son 2 poblaciones celulares diferentes, y que las SP testiculares no contienen SSC, como se puede comprobar tras experimentos de trasplante a túbulos seminíferos de ratón de una población de células SP y no observar actividad espermatogénica alguna, mientras que tras trasplantar células MHC-I y Thy-1+ se pudo ver actividad espermatogénica12.
Fenotipo SSC en el modelo bovino
La investigación en el modelo bovino está mucho menos avanzada que en el modelo murino, si bien se han conseguido caracterizar fenotípicamente las células madre espermatogonias, aunque de manera no tan exhaustiva. Tras experimentos en los que se aislaron y purificaron células espermatogonias tipo A, se desarrollaron mecanismos con los que caracterizar dichas células aisladas.
Así, se estudió la reacción de dichas células a la lectina DBA (Dolichos biflorus aggglutinin) y la expresión de c-kit. Las espermatogonias tipo A se caracterizan por reaccionar con la lectina DBA. Dentro de estas espermatogonias DBA+ se aislaron 2 poblaciones celulares, una más grande y otra más pequeña, con diferente número de nucleolos. De ellas, las de mayor tamaño presentan una fuerte reacción positiva ante c-kit, mientras que las segundas no. Esto indica que las células de mayor tamaño han iniciado un proceso de diferenciación, mientras que en las células de menor tamaño encontramos la presencia de células madre espermatogonias10.
Otra característica fenotípica de las SSC en bovinos es la influencia que sobre ellas tiene el GDNF, de modo que al añadir GDNF exógeno a un cocultivo de células aumenta el número de SSC16.
Enriquecimiento de SSC
Uno de los principales problemas a la hora de trabajar con SSC es discernir entre éstas y el resto de las poblaciones celulares circundantes. Para este propósito, recientemente se han desarrollado 2 sistemas de enriquecimiento de SSC:
Enriquecimiento in vitro
El aislamiento de espermatogonias tipo A de testículos inmaduros de ratón se consiguió con una pureza del 95% gracias a técnicas de centrifugación en gradientes de densidad17. Este proceso no es válido cuando se trata de aislar espermatogonias de testículo adulto debido a que existen muchas células germinales con similares características. Por ello se han desarrollado otras técnicas de selección de SSC basadas en el uso de anticuerpos monoclonales dirigidas a moléculas expresadas en la superficie de estas células. Los utilizados con mayor frecuencia han sido los anticuerpos monoclonales fijados a bolitas magnéticas dirigidas contra las fracciones de integrinas α6 y β113,18. También se han utilizado anticuerpos monoclonales frente a c-kit10.
Últimamente se ha conseguido la inmortalización de las espermatogonias tipo A, mediante transfecciones con SV40, con lo que se ha conseguido mantener vivas estas células durante aproximadamente una semana in vitro. Estos experimentos abren nuevas expectativas para estudiar y comprender mejor la espermatogenia, así como para modificar genéticamente e introducir estas células germinales en los túbulos seminíferos19.
Enriquecimiento in vivo
Se emplearon modelos de ratones infértiles y modelos experimentales de criptorquidias, puesto que, en ambos casos, se supone que están enriquecidos en células madre. Debido a que el testículo no desciende al escroto, se registra una temperatura testicular mayor, lo que provoca una destrucción de las células de la espermatogenia. Sin embargo, las SSC, que tienen una tasa menor de división, parece que son menos sensibles a este aumento de temperatura, hasta el punto que pueden sobrevivir en testículos con criptorquidia. De este modo se produce un enriquecimiento en SSC en estos testículos13.
Xenotrasplante y autotrasplante
Como ya se ha comentado, Brinster y Zimmerman, en 19941, encontraron los primeros indicios del restablecimiento de la espermatogenia tras el trasplante de células germinales. Las células aisladas de testículos de ratones colonizaron testículos de ratones estériles tras ser trasplantadas a los tubos seminíferos. Se produjeron células de características normales y espermatozoides maduros una vez reestablecida la espermatogenia.
En un experimento posterior, Brinster y Avarbock2 demostraron que, tras trasplantar células germinales con el gen LacZ a ratones estériles, éstos pasaban a ser fértiles, y además presentaban el gen LacZ en el 80% de las células de la progenie.
Posteriormente, Clouthier et al, en 199620, consiguieron el trasplante exitoso de células de testículos de ratas en animales inmunodeprimidos (ratones) y observaron espermatozoides con características fenotípicas propias de rata en los testículos de ratones meses después de la microinyección. Este hecho desbarataba la teoría de que las células de Sertoli, esenciales en la espermatogenia, no permitirían el desarrollo de células extrañas. Parece ser, por tanto, que el papel de las células de Sertoli en la espermatogenia es más flexible de lo que en un principio se pensó. De todos modos, no en todos los trasplantes se encontró un desarrollo cualitativo y cuantitativo completo de la espermatogenia.
Tres años después se realizaron xenotrasplantes de conejo y de perro a ratones inmunodeprimidos. En estos casos no se produjo un resultado tan satisfactorio como en el anterior. Las células trasplantadas, situadas en el compartimiento basal de los tubos seminíferos, permanecieron en esta situación y no proliferaron21.
Entre las experiencias realizadas con tejido humano, destaca el xenotrasplante de células espermatogénicas de varones humanos azoospérmicos obstructivos y azoospérmicos no obstructivos a ratones inmunodeprimidos, realizado por Reis et al, en 200022, en el que se obtuvieron resultados similares a los anteriores, de modo que al examinar, a los 150 días, los testículos de los ratones receptores, no se encontraron indicios de que se completase la espermatogenia con las células trasplantadas22.
Posteriores experimentos de xenotrasplante de células madre espermatogénicas humanas en testículos de ratones inmunodeprimidos dieron como resultado la localización de colonización espermatogénica humana en el 73% de los ratones. Dichas células sobrevivieron durante 6 meses en los testículos de dichos ratones, y durante el primer mes se observó proliferación. Sin embargo, no se encontraron indicios de espermatogonias diferenciadas, y la diferenciación meiótica tampoco ocurrió en los testículos de los ratones23.
En cuanto a autotrasplantes en humanos, Radford, en 2002, comunicó la consecución de un embarazo tras autotrasplantar tejido testicular de varones con enfermedad de Hodgkin3. Los últimos avances en autotrasplante fueron presentados por Sofikitis et al24 en el último congreso de la Sociedad Europea de Reproducción Humana, donde comunicaron la recuperación de la espermatogenia mediante autotrasplante de células germinales crioconservadas en 3 pacientes azoospérmicos que sufrieron una orquidectomía unilateral por cáncer testicular. Antes de la generalización de esta técnica, los mismos autores plantean la dificultad de saber si los espermatozoides generados procedían de las células trasplantadas o de las SSC remanentes3,25.
El desarrollo del autotrasplante de células de testículo parece clave en la conservación de la fertilidad en pacientes oncológicos. No obstante, su utilidad real y los límites de esta nueva técnica están aún por definir.