Introducción
El ensayo de la morfología de la cabeza del espermatozoide se encuentra dentro de la batería de ensayos de genotoxicidad, el cual permite determinar la inducción de daño genotóxico en las células germinales masculinas.
Esta técnica es sensible, rápida y económica, lo cual justifica su uso. Entre los sistemas que se emplean para evaluar los daños ocurridos en las células germinales, se encuentra el ensayo basado en los criterios morfológicos de Wyrobek y Bruce, éstos permiten el estudio y la clasificación de la cabeza del espermatozoide al incluir, dentro de las clasificaciones, cabezas normales y anormales, y entre estas últimas las que tienen morfología en forma de banana, los amorfos, sin gancho y con dos colas1. Esta herramienta, a su vez, permite evaluar cambios en la concentración espermática, y es capaz de detectar el daño irreversible que queda fijado por un periodo relativamente largo2.
Es de vital importancia en la evaluación genotoxicológica el uso de biomodelos experimentales eficientes. Por lo cual se hace necesario que estos expresen la menor frecuencia de aparición de cabezas morfológicamente anómalas, como parámetro medible del daño genotóxico.
Esto permitirá detectar, con el mínimo margen de error, la actividad genotóxica de una sustancia química o agente complejo en el material genético3. Al utilizarse en nuestros días diferentes líneas dentro de una misma especie indistintamente, es necesario conocer el biomodelo ideal a partir de obtener resultados de índices espontáneos bajos e inducidos altos.
A partir de esta problemática, surge la necesidad de realizar una comparación, en cuanto a la frecuencia basal e inducida con ciclofosfamida (CF), entre ratones machos de las líneas Balb/c, NMRI, OF-1 y C57BL/6/cenp en el ensayo de la morfología de la cabeza del espermatozoide, útiles como ensayo de genotoxicidad y como ensayo para determinar la fertilidad del macho. Para, de esta forma, identificar el mejor biomodelo experimental, lo cual pudiera aplicarse en estudios de otros fármacos o agentes no explorados en relación con el efecto genotóxico.
Materiales y métodos
Animales
Para este ensayo se utilizaron ratones adultos jóvenes machos (8-9 semanas), de las líneas Balb/c, NMRI, OF-1 y C57BL/6/cenp; cuyo peso corporal oscilaba en 26-30 g al término de la cuarentena. Los animales de ambas especies se mantuvieron en locales separados bajo condiciones controladas de temperatura (23 ± 2º C) y humedad relativa (60% ± 10%) y ciclos de luz-oscuridad de 12 horas. El acceso al agua y al alimento fue ad libitum. El alimento suministrado fue pienso para ratones, todo propósito y esterilizable, suministrado por el CENPALAB. Estas características eran comunes para todos los grupos experimentales evaluados en este ensayo. Durante todo el proceso experimental se respetaron los principios éticos establecidos para la investigación con animales de laboratorio4.
Administración y dosificación
En todos los grupos experimentales, la sustancia se administraba en el horario de 10.30-11.30 a.m., y las concentraciones se ajustaron semanalmente en función del aumento del peso corporal. Los animales se distribuyeron aleatoriamente (10 animales/grupo), para un total de 20 animales/grupo en las dos réplicas realizadas.
En el grupo experimental 1, utilizamos animales no tratados como control negativo. A éstos se les realizaba la técnica de entubación gástrica para que estuvieran expuestos a iguales condiciones de manejo que los demás grupos, durante un periodo de 35 días (duración del ciclo espermático)5.
En el grupo experimental 2, utilizamos Tween 65 al 2%, que fue el vehículo más utilizado en la mayoría de las preparaciones de sustancias oleosas, útil como agente tensoactivo (sustancia vehículo 1)6,7; en el grupo experimental 3, utilizamos NaCl al 0,9%, útil como disolvente de la mayoría de las sustancias que preparar (sustancia vehículo 2)8,9, ambas sustancias se administraron por vía oral a 2 ml/kg durante un periodo de 35 días, preparadas 2 horas antes de la administración5.
En el grupo experimental 4, se utilizó la CF (adquirida de la firma comercial mexicana Lemri S.A., bajo la marca Ledoxina), utilizada en dosis de 50 mg/kg5,10. La CF se administró por vía i.p. y se diluyó en disolución salina (NaCl) al 0,9%, administrada a razón de 10 ml/kg. Se administró durante 5 días consecutivos apenas preparada y luego no se administró 35 días5.
Observaciones clínicas
Se realizaron dos observaciones clínicas diarias, en el horario comprendido entre las 8.30 y las 10.30 a.m. y en el horario de la tarde, 3.00-4.30 p.m. Durante cada observación, se tuvo en cuenta el estado clínico general del animal, lo cual incluyó palpación para la detección de lesiones, posibles afecciones respiratorias, del sistema nervioso, cardiovascular, gastrointestinal, estado de la piel, pelo, coloración de las mucosas y ojos.
Eutanasia
La eutanasia se realizó por dislocación cervical con previa atmósfera de éter según establece la Unión Europea y AVMA11-13, en el caso de los grupos experimentales 1, 2 y 3 a las 24 horas de la última administración y en el grupo 4 la eutanasia fue a las 24 horas pasados los 35 días de reposo, para que los espermatozoides analizados fuesen los que estuvieron expuestos a las sustancias mutagénicas5,14.
Exámenes realizados
Ensayo de la morfología de la cabeza del espermatozoide. Este ensayo se realizó según las normas de la ICH, de 2005, sobre toxicología de la fertilidad del macho, y la Sociedad Británica de Toxicología y Mutagénesis Ambiental 199915,16. Para realizar este ensayo se procedió a extraer ambos epidídimos, los cuales se redujeron a pequeños fragmentos, y se depositaron en placas Petri que contenían 3 ml de solución isotónica de NaCl 0,9%12. La muestra se homogenizó con pipetas Pasteur5,17.
Recuento de espermatozoides. El contenido de la placa se colocó en un tubo graduado, al cual se le añadió 0,05 ml de tripsina al 0,25%, transcurridos 5 minutos de tripsinización se añadieron 2 ml más de NaCl 0,9%. Luego se realizó una dilución del homogeneizado tripsinizado en NaCl-formol al 1% (1:10) y se colocó en una cámara de Neubauer, contándose ambos lados de la cámara al microscopio Olympus BH-2, a 10 x 18.
Morfología del espermatozoide. Al tubo que contenía la dilución del homogeneizado ya diluido se añadieron 5 gotas de eosina al 1%, y se dejó reposar por 5 minutos. Posteriormente, se extendió una gota sobre una lámina seca y se colocó el cubreobjeto5. Se prepararon dos láminas por animal y se analizaron 500 espermatozoides con la ayuda de un microscopio Olympus BH-2, x40. Las observaciones fueron realizadas "a ciegas" por dos observadores independientes, para luego establecer un promedio entre ambos. El criterio de clasificación se basó en cabezas normales y anormales que incluye amorfas, banana, sin gancho y con dos colas5,18.
Análisis estadístico. Se procedió a verificar los supuestos para realizar el análisis de varianza, los resultados obtenidos están distribuidos normalmente (normalidad, según el test de Kolmogorov-Smirnov), existe dependencia entre las observaciones y presentan homogeneidad de varianzas (prueba de Levene). Por lo cual todos los resultados se analizaron mediante el método de análisis de varianza (ANOVA)5. El nivel de significación establecido fue α = 0,05. Todos los análisis se realizaron empleando el paquete estadístico Statsoft for Windows. StatSoft, Inc. (2003). STATISTICA (data analysis software system), versión 6.
Resultados
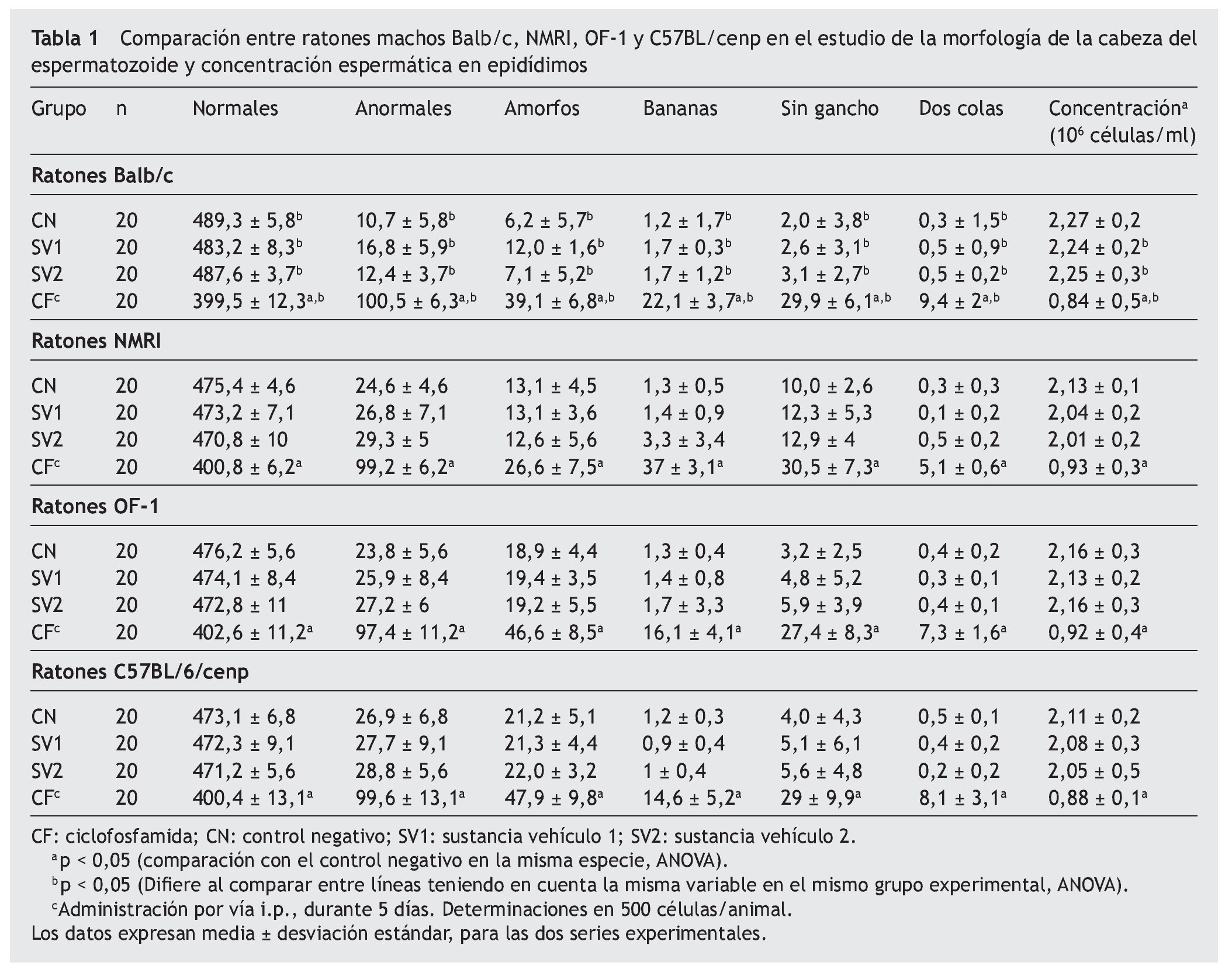
Al evaluar estás líneas en el ensayo de la morfología de la cabeza del espermatozoide (tabla 1), se obtuvo una concentración de espermatozoides espontánea en epidídimos en la línea Balb/c de 2,24-2,27 x 106 espermatozoides/ml. Tras la inducción con CF, se obtuvo una concentración de 0,84 ± 0,5 x 106 espermatozoides/ml. En un recuento de 500 espermatozoides/animal, se obtuvieron como promedio de forma espontánea de 480,9-489,3 espermatozoides normales y 10,7-19,1 espermatozoides anómalos. Al inducir con CF, esta frecuencia de anómalos aumentó, y se obtuvo como resultado 101,3 ± 7,4 espermatozoides con anomalías en la morfología de la cabeza, lo que hizo evidente la susceptibilidad de este biomodelo a las sustancias mutagénicas.
Teniendo en cuenta la línea NMRI, la concentración espermática normal estuvo entre 2,01-2,13 x 106 espermatozoides/ml. Al administrar la CF esta concentración disminuyó a 0,93 x 106 espermatozoides/ml. En el estudio de la morfología de la cabeza del espermatozoide, se obtuvieron resultados similares: 470,8-475,4 espermatozoides normales de un total de 500, y 24,6-29,3 espermatozoides anómalos. En el grupo en el cual se administró la CF, se obtuvo como promedio 99,2 ± 6,2 espermatozoides anómalos y 400,8 ± 6,2 espermatozoides normales.
Al evaluar la línea OF-1, se observó una concentración espontánea de 2,13-2,16 x 106 espermatozoides/ml, y al inducir daño con CF esta concentración bajó hasta 0,92 x 106 espermatozoides/ml, lo cual muestra que este biomodelo es sensible al mutágeno. Estos resultados de inducción son similares a los encontrados en la línea NMRI, pero se encuentran por encima de los obtenidos en la línea Balb/c. En el estudio de la morfología de la cabeza del espermatozoide se obtuvieron resultados espontáneos de cabezas normales que oscilan en 472,8-476,2, y el número de cabezas anómalas fue 23,8-27,2. En tanto, la CF indujo 97,4 ± 11,2 cabezas anómalas como promedio en un conteo total de 500 espermatozoides.
En la C57BL/6/cenp, se observó una concentración espermática espontánea como promedio de 2,05-2,11 x 106 espermatozoides/ml, además, se encontró que la CF indujo una disminución en la concentración a 0,88 ± 0,1 x 106 espermatozoides/ml. En esta línea de ratón, se observó, como promedio de forma espontánea, un número de cabezas anómalas de 26,9-28,8, resultados que se encuentran por encima de los obtenidos en la línea Balb/c y OF-1, pero por debajo de los obtenidos en la línea NMRI, teniendo en cuenta el número de aparición más alto. Al administrar la CF, se encontró un promedio de espermatozoides anómalos de 99,6 ± 13,1, resultados que al compararlos con los de las líneas OF-1 y NMRI se encuentran por debajo de estas. Pero al compararlos con los inducidos por la CF en ratones Balb/c, en estos la sensibilidad fue mayor. Se obtuvieron en la línea Balb/c resultados mayores de 100 espermatozoides promedio con anomalías visibles.
Discusión
Al realizar una comparación entre estas 4 líneas en ratones machos, en el estudio de la morfología de la cabeza del espermatozoide se obtuvo que la línea más eficiente nuevamente fue la Balb/c2,10,19. Esta línea difirió de forma significativa de las demás evaluadas, teniendo en cuenta que en ésta se obtuvieron los valores más altos de concentración espermática espontánea como índice de citotoxicidad y los valores más bajos de anomalías en la cabeza del espermatozoide como indicador de daño genotóxico2,10,19. De igual forma, fue la línea que mejor respondió al mutágeno evaluado10. Los resultados espontáneos obtenidos en ratones Balb/c son más bajos que los obtenidos por nosotros en el grupo control negativo (no administrado), de un estudio donde se utilizaron ratones OF-120.
Se demostró que la línea Balb/c presenta mayor concentración espermática y es más susceptible a los mutágenos, teniendo en cuenta esta variable al compararla con la NMRI. Además, presenta menor número espontáneo de espermatozoides anómalos, y la CF es capaz de inducir mayor número de espermatozoides anómalos en esta línea al compararla con la NMRI21.
Los resultados espontáneos e inducidos de cabezas anómalas en la línea de ratones OF-1 fueron inferiores al compararlos con la línea NMRI. Pero al comparar los resultados obtenidos en la OF-1 con la Balb/c, se observó mayor cantidad de cabezas anómalas espontáneas y menor número de cabezas inducidas por la CF en la OF-12.
El hecho de que los ratones Balb/c hayan resultado ser mejores biomodelos al tener en cuenta los índices endógenos evaluados pudiera estar dado por la baja tasa de variabilidad genética de esta línea al ser isogénica, lo cual constituye una ventaja al evaluar el efecto genotóxico de fármacos mediante este estudio, pero a su vez no obtendremos una respuesta heterogénea, que es típica en poblaciones humanas8.
Por otro lado, las diferencias encontradas en cuanto a la respuesta a la CF pudieran ser en respuesta a diferentes niveles de expresión de los genes que codifican para la enzima citocromo P-4501A1 en el hígado, ya que existen diferencias genéticas y epigenéticas entre líneas de ratones al tener en cuenta esta enzima hepática fundamental en la fase I del metabolismo de xenobióticos, que participa en el metabolismo de la CF en el hígado al utilizarse como fármaco citotástico22-25.
Estos resultados muestran que, genéticamente, la línea de ratones Balb/c en ambos sexos es más estable que las otras evaluadas, además de demostrar que presenta una respuesta aceptable a la acción de las sustancias mutagénicas. Esto la convierte en el biomodelo ideal para los ensayos de genotoxicidad y antigenotoxicidad in vivo, ya que permite detectar, en un estrecho margen de error, sustancias clasificadas de muy baja genotoxicidad. El hecho de que esta línea de ratón presente bajas tasas de daño genotóxico germinal confirma su mayor uso en estudios de toxicología de la fertilidad y teratogénesis.
En este estudio obtuvimos, como resultado final, que el mejor biomodelo experimental resultaron ser los ratones Balb/c, difiriendo significativamente con los resultados obtenidos en las demás líneas de ratones evaluadas, teniendo en cuenta los valores espontáneos e inducidos en la concentración espermática y la frecuencia de espermatozoides morfológicamente anómalos en epidídimos. Este estudio permitirá utilizar esta línea de ratón con mayor eficiencia en la evaluación genotóxica y de toxicología de la fertilidad preclínica de fármacos, vacunas y otros productos.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
*Autor para correspondencia.
Correo electrónico:darencibia@finlay.edu.cu (D.F. Arencibia-Arrebola).
Recibido el 27 de julio de 2011;
aceptado el 29 de agosto de 2011