Introducción
Se define la esterilidad como la incapacidad de una pareja sexualmente activa y sin medidas anticonceptivas para conseguir gestación en un año. A diferencia de la infertilidad, en la esterilidad la pareja no consigue la gestación en ningún momento, mientras que en aquella se logra la gestación pero acontece un aborto; a pesar de esta diferencia, ambos términos se utilizan con frecuencia como sinónimos en la literatura1-3. El 13-18% de las parejas en edad reproductiva llegan a presentar algún problema de fertilidad4.
Aproximadamente 16.000 parejas acuden cada año a centros de reproducción humana asistida. En un 20% la infertilidad se debe a un factor masculino exclusivo, y en un 30-40% de los casos lo es por factores de ambos sexos, por lo que el factor masculino está presente en la mitad de las parejas infértiles1,5.
La compleja maduración de la célula germinal masculina se produce a una temperatura de 32-35º C y tiene una duración de aproximadamente 74 días, completándose la maduración funcional con el paso del espermatozoide a lo largo del epidídimo, conductos deferentes y eyaculadores, durante un tiempo de 14 días más, y finaliza en el interior del aparato reproductor femenino, consiguiendo la capacidad de fecundar al óvulo cuando se encuentra con él6,7.
La oligozoospermia se define como la concentración espermática menor de 15 millones/ml, y su presentación de forma aislada es poco frecuente. La astenospermia o defecto en el movimiento de los espermatozoides se define cuando la movilidad progresiva A+B la presentan menos del 32% de los espermatozoides y, finalmente, la morfología espermática se considera normal cuando es mayor o igual al 4%, según los valores publicados para estos parámetros seminales en el manual de la Organización Mundial de la Salud (OMS) para el examen del semen humano y de la interacción del semen y del moco cervical, en su 5ª edición8. Estos defectos presentados de forma combinada, a menudo son consecuencia de varicoceles o idiopáticos; esta última causa representa el 25% de los pacientes, en quienes con un análisis de semen anormal no se pueden identificar las causas9.
El tratamiento médico empírico se ha recomendado para la oligoastenoteratozoospermia idiopática, pero salvo alguna excepción, no ha resultado eficaz. En un metaanálisis de estudios controlados sobre esterilidad masculina idiopática no se comprobó que los tratamientos disponibles fueran eficaces10, aunque en informes de casos aislados y series pequeñas de pacientes, se ha demostrado que algunos de estos tratamientos sí lo son11.
Uno de los tratamientos empíricos utilizados son los compuestos a base de vitaminas (A, E, C), oligoelementos, suplementos nutricionales (L-carnitina) y agentes antiinflamatorios (diclofenaco), basados en la actividad antioxidante, ya que las especies reactivas de oxígeno se asocian a causas de esterilidad masculina, así como de desnaturalización de la cromatina de los espermatozoides12,13. Sin embargo, no se ha podido demostrar en estudios controlados que sean eficaces, al desconocer en qué grado estos agentes se concentran en el aparato reproductor masculino. Igualmente, la L-carnitina, molécula que participa en el metabolismo de las mitocondrias al intervenir en el transporte de grupos acetilo y acilo a través de la membrana mitocondrial interna, generándose la energía necesaria para mejorar la producción y la movilidad de los espermatozoides, y a pesar de que estudios in vitro han demostrado que la adición de L-carnitina y de acetil L carnitina al semen mejora la movilidad de los espermatozoides14, tampoco ha demostrado relación directa entre las concentraciones seminales y la fertilidad, ni que la carnitina administrada por vía oral aumentara las concentraciones en el epidídimo15.
Material y métodos
El estudio se ha realizado sobre 40 varones con oligoastenoteratozoospermia idiopática, que acudieron al Centro Extremeño de Reproducción Humana Asistida (CERHA) para un tratamiento de fertilidad. A todos, tras la anamnesis y la exploración física, se les solicitó un estudio hormonal, cariotipo y microdeleciones del cromosoma Y, pruebas que fueron rigurosamente normales; ninguno de ellos presentó varicocele clínico, ni presentaron uro o seminocultivos positivos. A todos los pacientes se les pautó un tratamiento con Androferti®, 1 comprimido cada 12 horas, cuya composición es: L-carnitina 750 mg, coenzima Q10 10 mg, zinc 5 mg, ácido fólico 100 μg, selenio 25 μg, vitamina B12 0,5 μg, vitamina C 30 mg y vitamina E 5 mg. Se realizaron en todos los pacientes 2 seminogramas de control, a los 3 y 6 meses de comenzar el tratamiento. El estudio fue aprobado por el Comité de ética e investigación clínica de nuestro Hospital.
Se estudiaron los parámetros seminales de concentración, movilidad progresiva (A+B) y morfología, según los nuevos valores publicados en el último manual de laboratorio de la OMS para el examen del semen humano y de la interacción del semen y del moco cervical, en su 5ª edición8.
El análisis y tratamiento de los datos para evaluar si existieron diferencias significativas a lo largo del tratamiento fue realizado mediante software - R, licencia GNU.
Resultados
Resultados del análisis descriptivo
El siguiente análisis muestra el comportamiento de los datos para cada variable analizada (concentración, movilidad progresiva A+B, morfología, capacitación espermática) y en los periodos de tiempo analizado (antes de iniciar el tratamiento con Androferti®, a los 3 y a los 6 meses).
Concentración
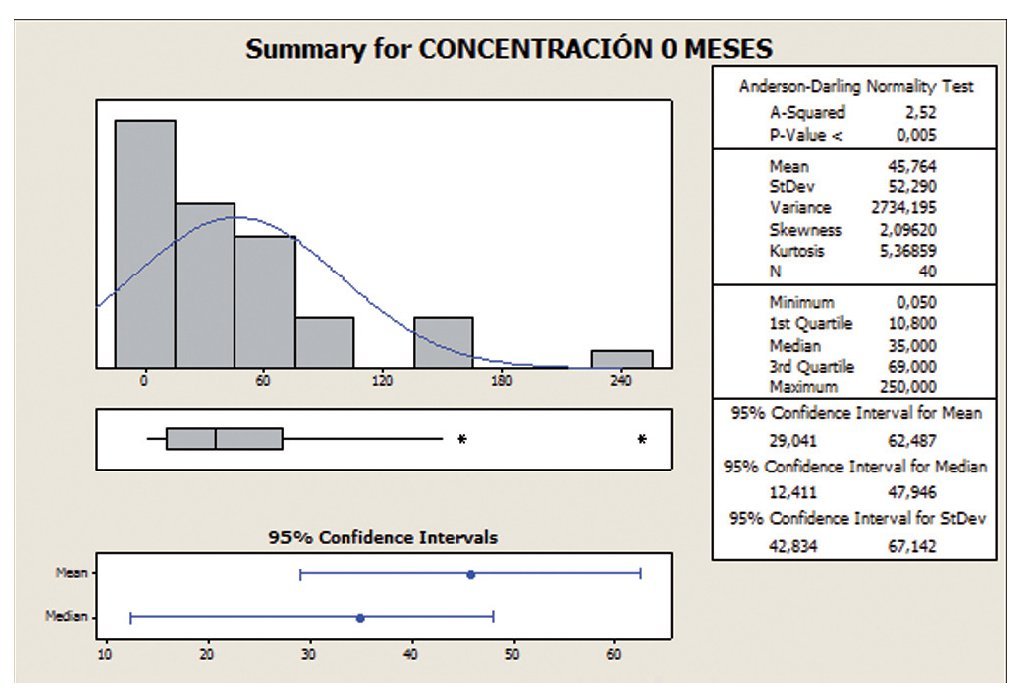
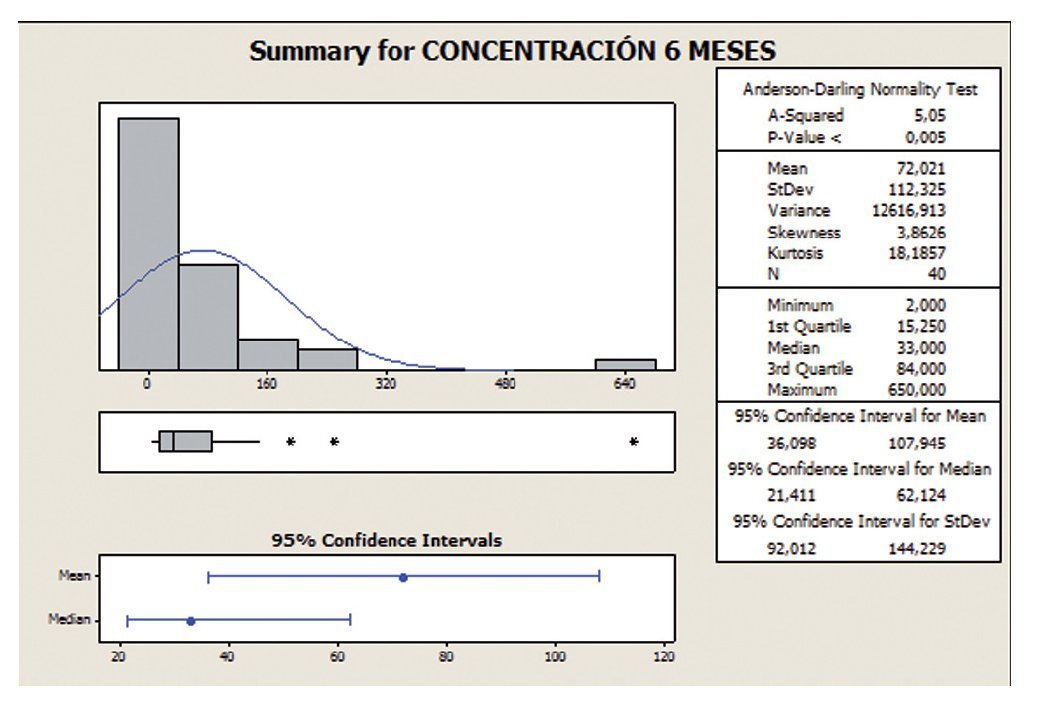
El análisis descriptivo (figs. 1 y 2) muestra que el intervalo de confianza (IC) se encuentra entre 10,8 y 69,0 a los 0 meses, mientras que los valores a los 6 meses se encuentran entre 15,25 y 84,0, con lo que se aprecia una mejoría entre los 0 y los 6 meses, llegando a ser significativa (en el test estadístico utilizado posteriormente).
Figura 1 Concentración espermática a 0 meses.
Figura 2 Concentración espermática a 6 meses.
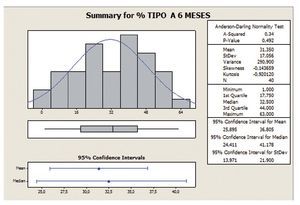
Porcentaje de movilidad tipo A
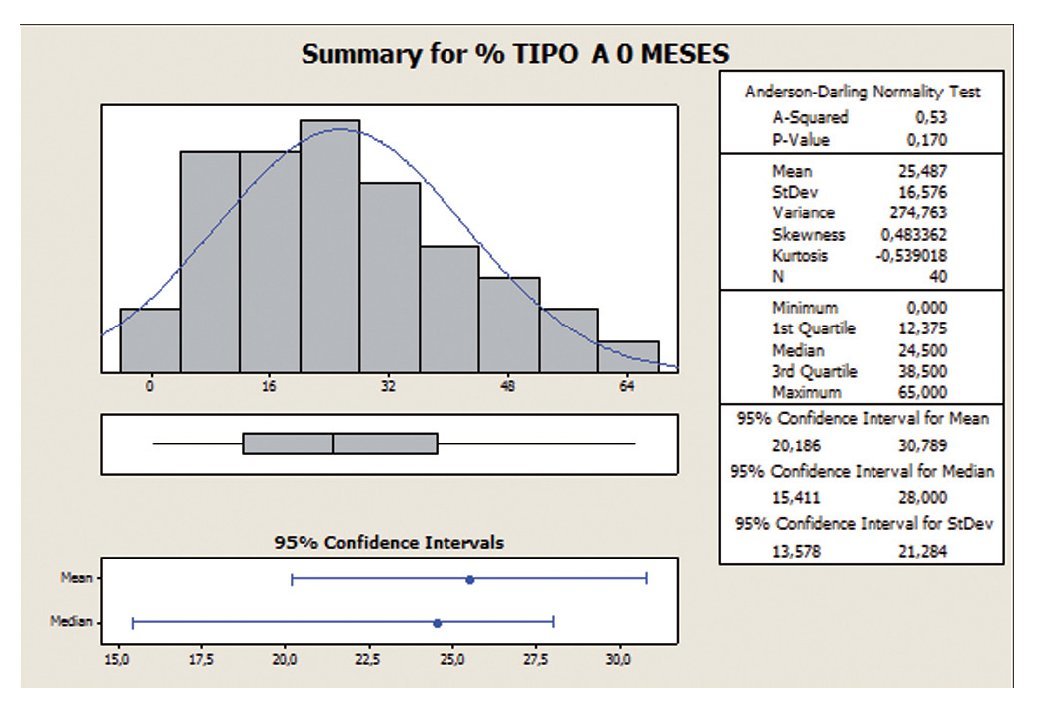
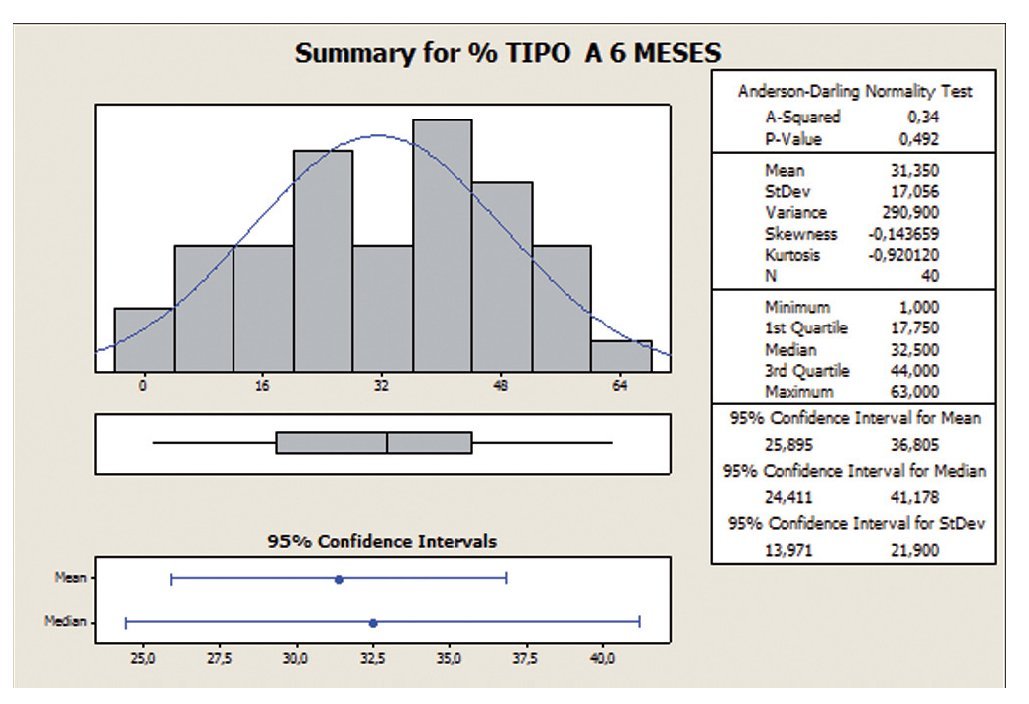
Los valores centrales y de dispersión se representan por la media, ya que los datos se ajustan a una distribución de probabilidad de tipo normal según el test de Anderson-Darling. Por lo tanto, el IC (25,49 ± 16,58) antes de empezar el tratamiento muestra una gran dispersión de los datos, con un 65% de desviación estándar relativa (RSD), reduciéndose a un 54% tras los 6 meses de tratamiento, así mismo se observa un incremento en el valor medio de un 23% (25,49 a 31,35) (figs. 3 y 4).
Figura 3 Porcentaje de movilidad tipo A a 0 meses.
Figura 4 Porcentaje de movilidad tipo A a 6 meses.
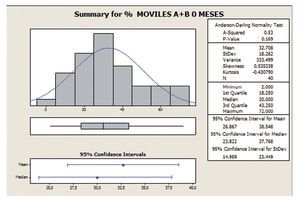
Porcentaje de movilidad progresiva (tipo A+B)
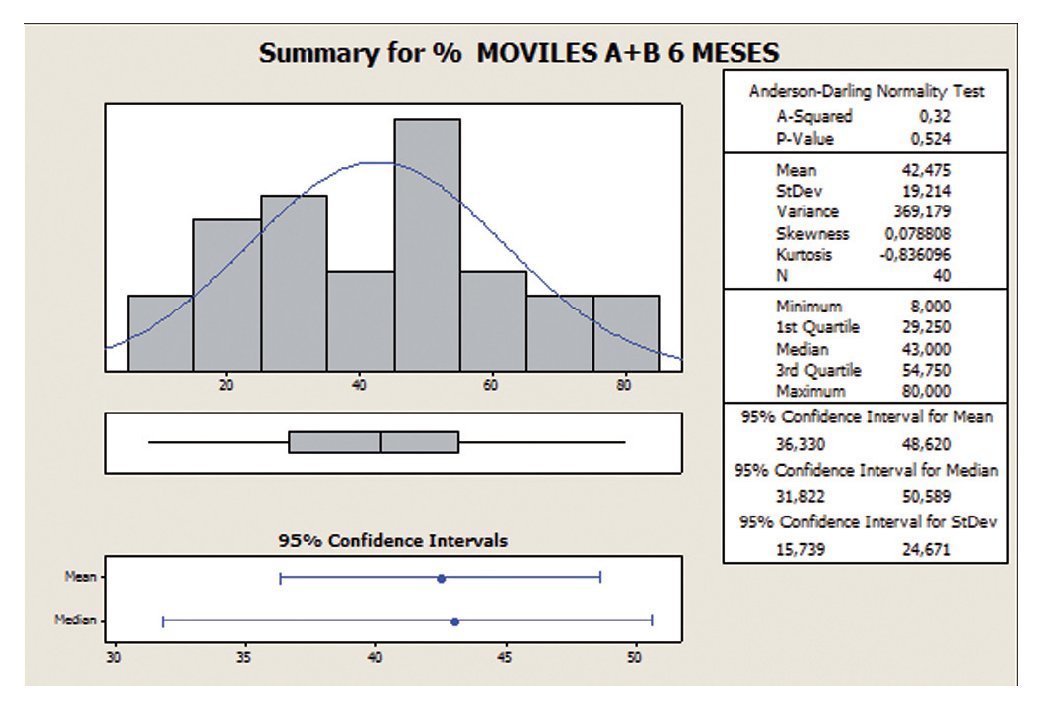
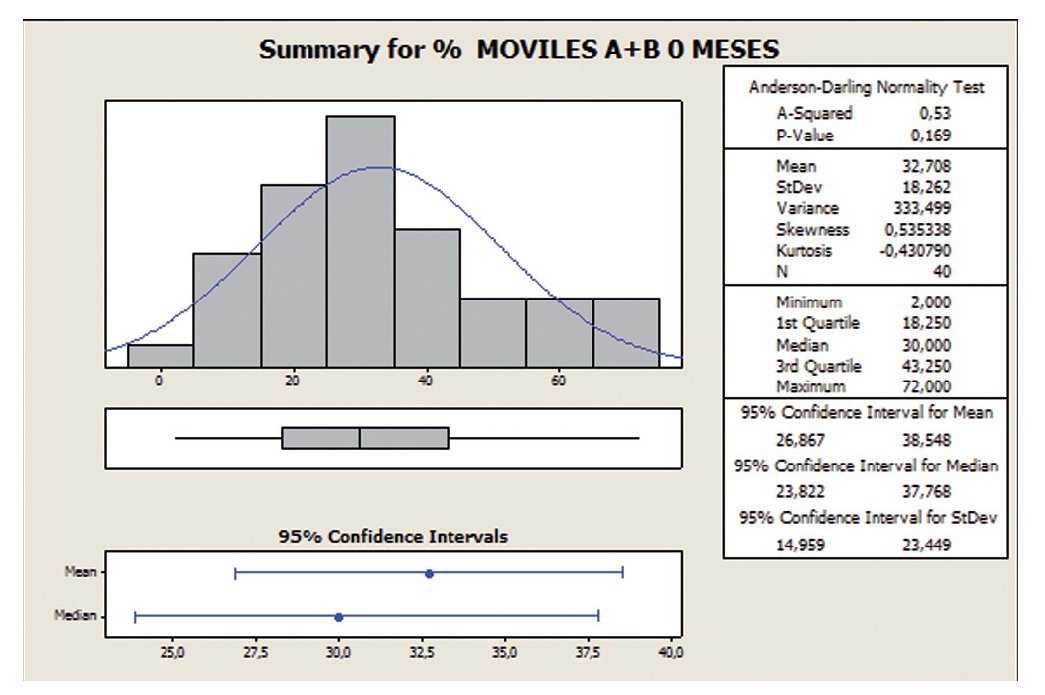
En este análisis, con la variable movilidad (tipo A+B) se observa que con la toma de Androferti® durante 6 meses, la dispersión se reduce de un 56 a un 45%, y la media aumenta de 32,7 a 42,47.
El IC es 32,7 ± 18,3 a los 0 meses, es decir, los datos se encuentran entre el rango 14,4 y 51, apreciándose una mejoría a los seis meses de tratamiento (IC 42,5 ± 19,2) (figs. 5 y 6).
Figura 5 Porcentaje de movilidad progresiva (tipo A+B) a 0 meses.
Figura 6 Porcentaje de movilidad progresiva (tipo A+B) a 6 meses.
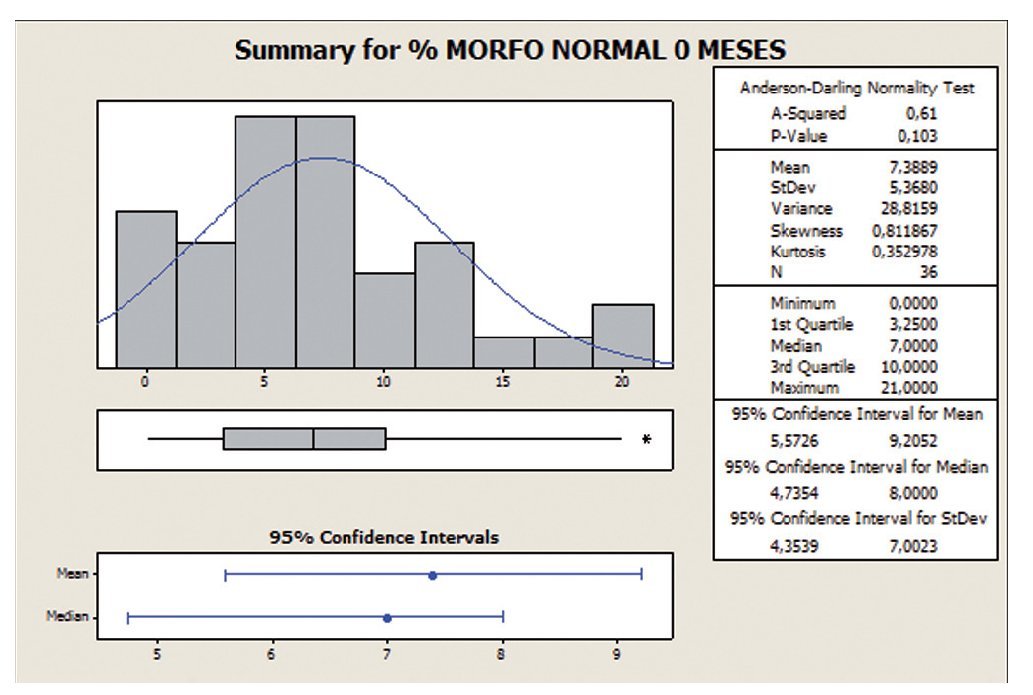
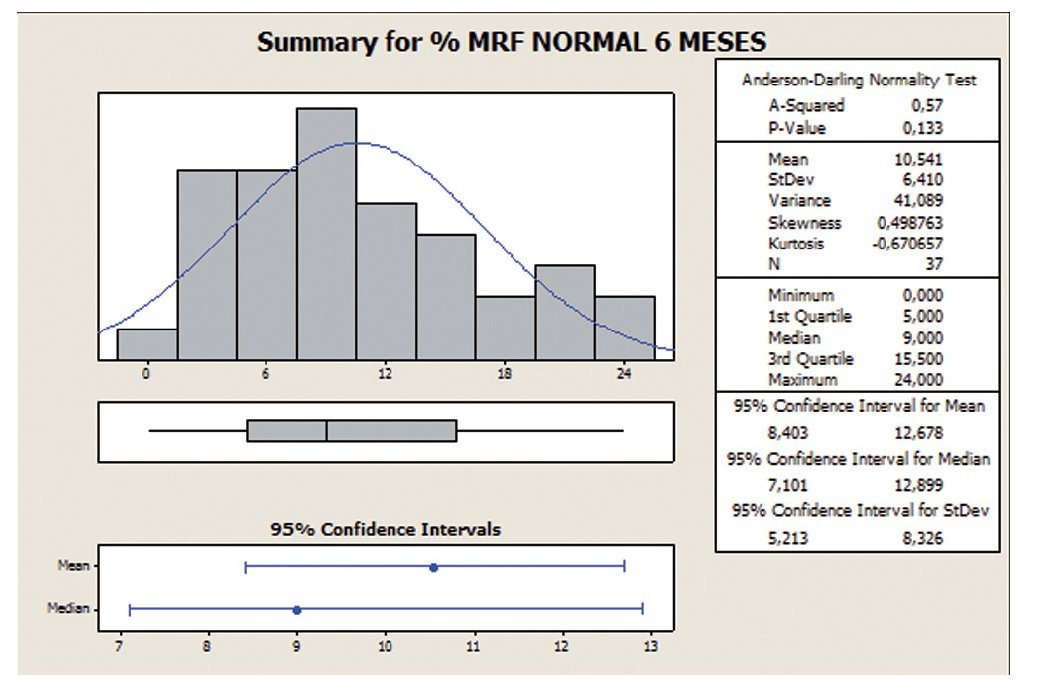
Porcentaje de formas normalesComo los datos se ajustan a una distribución de probabilidad de tipo normal, utilizamos como medida de centralización la media. En este análisis con la variable formas normales, apreciamos que con la toma de Androferti® durante 6 meses, la dispersión se reduce de un 72,6 a un 60,8%, y la media aumenta de 7,38 a 10,54 (figs. 7 y 8).
Figura 7 Porcentaje de formas normales a 0 meses.
Figura 8 Porcentaje de formas normales a 6 meses.
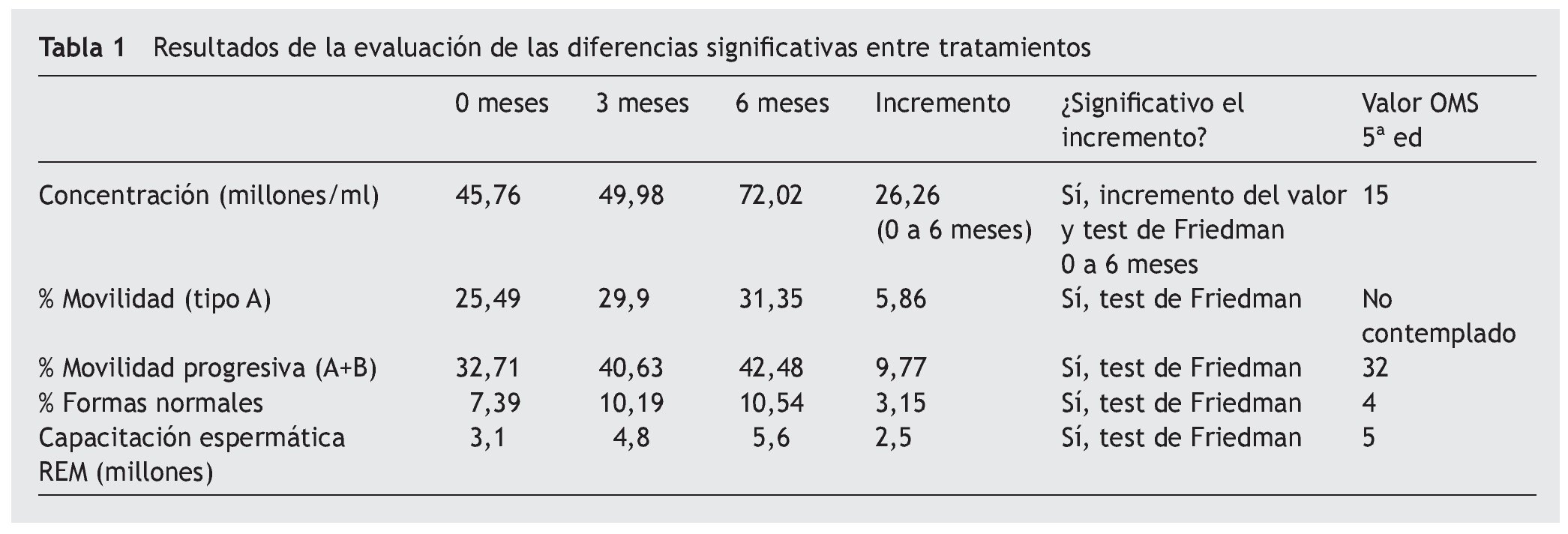
Resultados de la evaluación de las diferencias significativas entre tratamientos
Para la evaluación de las diferencias significativas se ha utilizado el test de Friedman. Este test, aunque es no paramétrico, se ha utilizado por la robustez de su cálculo ante valores muy dispersos, tal y como se ha presentado en el análisis descriptivo. Todos los resultados obtenidos muestran que la hipótesis nula del test de Friedman, es decir μ0 = μ3 meses = μ6 meses, no se cumple (p-valor inferior a 0,05), por lo que se observa que existen diferencias significativas entre los valores obtenidos en el intervalo de tiempo del tratamiento, tal y como muestran los datos de los valores centrales (tabla 1), hallando diferencias significativas en todos los casos.
Discusión
Las especies reactivas de oxígeno (ROS) son radicales libres derivados del metabolismo del oxígeno, lo cual sucede a nivel celular. Pequeñas cantidades de ellos, en el aparato genital masculino, intervienen en funciones del espermatozoide16. Sin embargo, cantidades excesivas de los mismos, en relación a la capacidad antioxidante, son responsables del estrés oxidativo, y ello conlleva daños por dos mecanismos diferentes: fragmentación del ADN, al romper las cadenas únicas y dobles, y daño en la peroxidación de los lípidos de la membrana plasmática del espermatozoide, alterando con ello la movilidad espermática17.
Los antioxidantes inactivan de forma constante a las ROS, y en nuestro organismo ello se consigue de 3 formas: a través de los antioxidantes endógenos (coenzima Q-10, ácido úrico), antioxidantes de la dieta (vitaminas C y E, carotinoides, flavonoides) y proteínas fijadoras de metales (albúmina, transferrina, ferritina, etc.)16.
Entre los diagnósticos que ocasionan mayor estrés oxidativo podemos citar al varicocele, enfermedades sistémicas (diabetes mellitus, cáncer, problemas cardiovasculares) y las infecciones del aparato reproductor masculino, así como otros factores tales como el consumo de alcohol y tabaco, la exposición a altas temperaturas y la contaminación ambiental18-22.
Los antioxidantes de la dieta se encuentran presentes en frutas y verduras. Sin embargo, una dieta rica en ellas, no ha demostrado en el estudio de Silver et al.23 relación entre la ingesta de antioxidantes de la dieta y el grado de fragmentación del ADN espermático, si bien sí se ha observado una relación positiva con la mejoría de los parámetros seminales24.
La vitamina C se encuentra en concentraciones elevadas en el plasma seminal, es detectable incluso en los espermatozoides y elimina radicales de hidroxilo, superóxido y peróxido de hidrógeno. En un estudio de Dawson et al.25 realizado en 75 fumadores fértiles, los 2 grupos que recibieron suplemento con vitamina C presentaron una mejoría significativa de los parámetros seminales de concentración, vitalidad y morfología, aunque en el estudio controlado y randomizado de Rolf et al.26, no se demostró ningún efecto.
La vitamina E, que ejerce un efecto protector de la membrana espermática, en el estudio de Suleiman et al.27 mejoró la movilidad de los espermatozoides, aunque en otro estudio como el realizado por Rolf et al.26 doble ciego, controlado y randomizado, no se obtuvo esta mejoría, por lo que los resultados son contradictorios al evaluar la mejoría de los parámetros seminales.
La coenzima Q-10, se encuentra en las mitocondrias de la pieza media del espermatozoide. Baleria et al.28 han mostrado en su estudio sobre 22 varones con oligozoospermia idiopática una mejoría significativa de la movilidad, en comparación a los resultados previos al tratamiento.
La carnitina elimina al acetil Coa extracelular tóxico responsable de las ROS mitocondriales, y se encuentra en altas concentraciones en epidídimo. Aunque existen estudios no controlados como el de Costa et al.29 donde se obtuvo una mejoría de la movilidad espermática, los estudios controlados y randomizados no han mostrado un aumento concluyente de la movilidad o del número de espermatozoides30,31.
En nuestro estudio, tras el análisis estadístico de los parámetros de concentración, movilidad progresiva (A+B) y morfología, se halló un incremento significativo en el seminograma realizado a los 6 meses respecto del seminograma inicial y del realizado a los 3 meses desde el inicio del tratamiento. Igualmente, el REM mejoró a los 3 y 6 meses, alcanzando los mayores valores al final del tratamiento.
Por ello, la utilización de compuestos antioxidantes a base de vitaminas y oligoelementos, al mejorar los parámetros citados en nuestro estudio, permite mejorar el REM, lo cual puede ser determinante a la hora de indicar la técnica de reproducción asistida que pueda beneficiar más a la pareja.
Conclusiones
La utilización del compuesto Androferti® ha conseguido la mejoría de los parámetros seminales considerados de forma significativa tras el estudio realizado, careciendo de efectos adversos. La mejoría hallada en el REM a los 6 meses de tratamiento en el estudio estadístico permite concluir que es útil para mantener o mejorar las opciones de la pareja al tratamiento mediante técnicas de reproducción asistida. Dada la variabilidad de los análisis de semen y el desarrollo de embarazos en algunas parejas más allá del tratamiento, es necesario realizar estudios controlados con placebo, aleatorizados, doble ciego y cruzados para determinar la eficacia terapéutica de los tratamientos médicos empíricos, donde el resultado a considerar debería ser la tasa de embarazos; hasta entonces, la indicación de los antioxidantes debe considerarse puramente empírica; si bien, futuros estudios permitirán conocer si su utilización mejorará otros parámetros en técnicas de reproducción asistida como la calidad del embrión o los fallos de implantación.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
* Autor para correspondencia
Correo electrónico: jemablanjaro@hotmail.com
Recibido el 5 de julio de 2011;
aceptado el 25 de julio de 2011-08-31