INTRODUCCIÓN
En el actual mundo industrializado, y también en los países en desarrollo, hay una creciente preocupación por el aumento de la contaminación química ambiental y el efecto nocivo que ésta puede ocasionar en la reproducción animal y humana1,2.
Nuestro interés se centra en el compromiso del factor masculino, dado que muchas de estas sustancias tienen acción como tóxicos testiculares, correspondiendo principalmente a riesgo laboral (uso de agropesticidas) o consumo de fármacos o medicamentos sin control adecuado.
Hay alrededor de 100.000 productos químicos de uso habitual, y anualmente se manufacturan del orden de 200 millones de toneladas. Algunos productos han sido designados como "contaminantes emergentes", porque se sospecha su toxicidad, aunque aún no hay ensayos suficientes. Una parte de los contaminantes actúan como disruptores endocrinos, y su efecto deletéreo se ejerce por alteración del eje hipotálamo-hipófisis-testículo, o por acciones que modifican otros sistemas regulatorios orgánicos (inmunológico, nervioso)3.
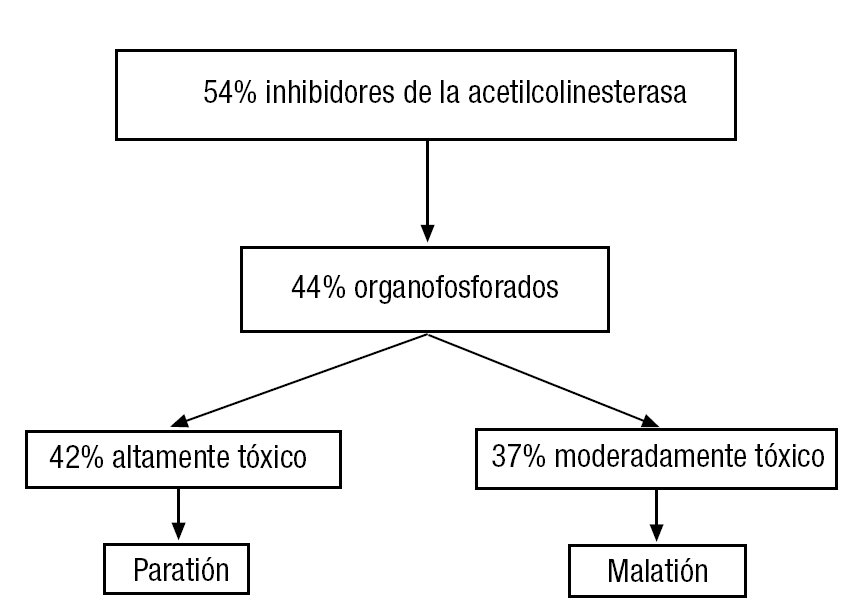
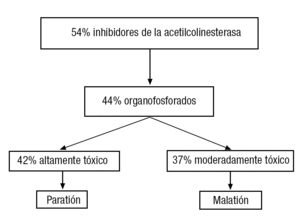
Debido al alto número de especies químicas contaminantes, y por razones de costes, muy pocas de ellas se han analizado respecto a su toxicidad reproductiva o durante el desarrollo, como lo muestran los porcentajes presentados en la tabla 1.
Aun cuando muchos tóxicos, como por ejemplo agroquímicos del grupo de los organofosforados, han sido declarados no utilizables por el alto riesgo que representan para la salud humana y animal, su uso ilegal o no controlado sigue constituyendo un serio problema (fig. 1).
Figura 1. Intoxicaciones agudas por plaguicidas en Chile, año 2002.
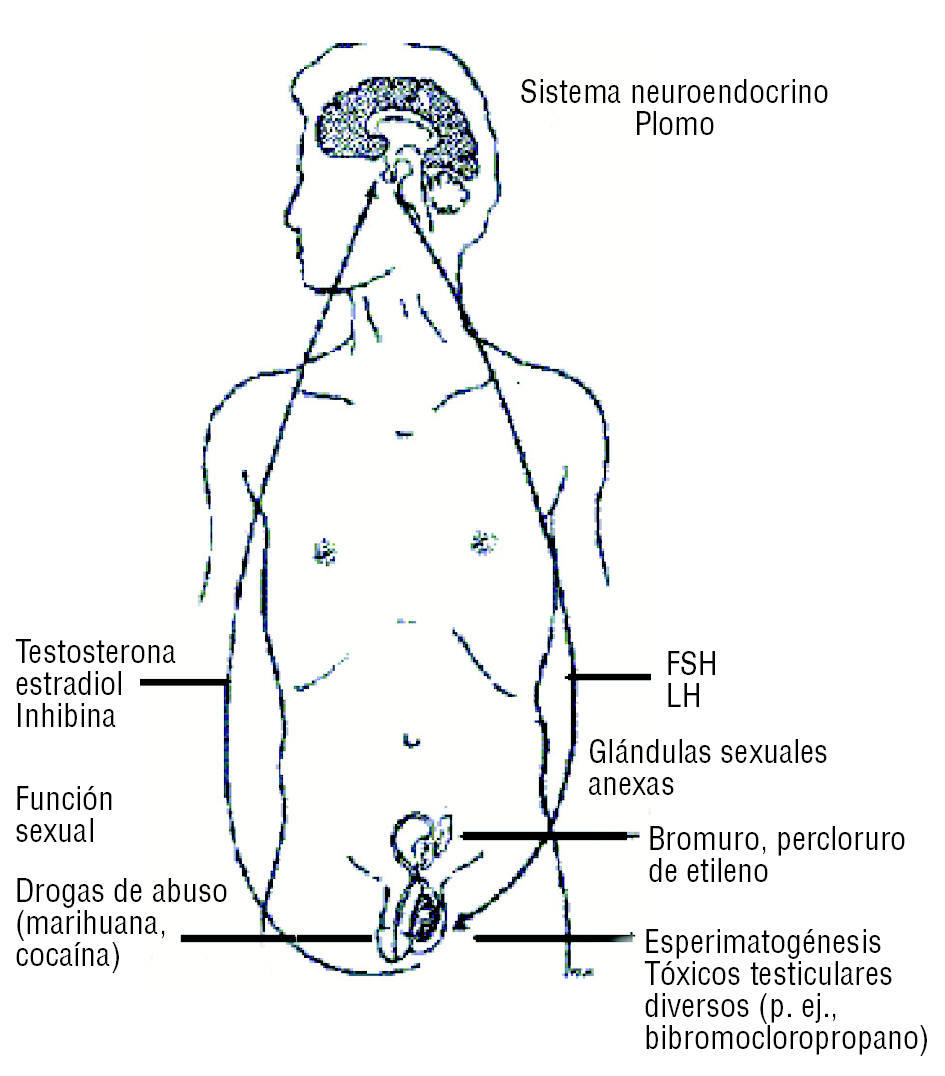
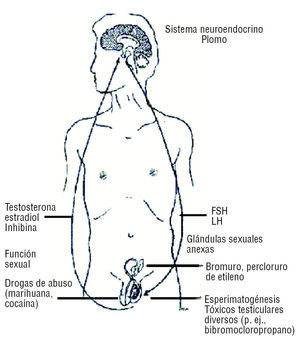
La acción de distintos tóxicos se ejerce a diferentes niveles del sistema reproductivo masculino (fig. 2), lo que complica el análisis del daño reproductivo.
Figura 2. Esquema que indica los sitios de acción y ejemplos de compuestos químicos que a cada nivel interfieren con la función reproductiva del varón.
Nuestro laboratorio presenta aquí un modelo animal (ratón)1 de análisis del daño testicular ocasionado por organofosforados, y un ejemplo de que este daño se puede monitorizar por alteraciones similares registradas en un organismo biocentinela de contaminación ambiental del suelo, como lo es la lombriz roja californiana (Eisenia foetida)4.
MÉTODOS
Modelo ratón5
Se utilizan ratones de la cepa CF-1 adultos jóvenes (3 meses de edad), mantenidos en bioterio con régimen de luz 12L/12D, alimentados con pellet comercial y agua ad líbitum. Grupos de 8 animales controles y 8 inyectados intraperitonealmente con paratión puro (Sigma, Saint Louis, Missouri, USA), en dosis de 1/3 DL-50, se sacrifican a intervalos de 8,3 días hasta completar 33,2 días (duración de 1 ciclo del epitelio seminífero y espermatogénesis completa). Se realiza análisis histopatológico de cortes de testículo por técnicas de rutina y de inmunohistoquímica, utilizando la técnica de TUNEL para detección de apoptosis. Se estudian los espermatozoides de cauda epididimaria, usando anaranjado de acridina y observación en epifluorescencia.
Modelo Eisenia foetida4
En terrarios de condición normal, con humedad controlada y adición de estiércol de equino, se crían ejemplares de E. foetida hasta su maduración sexual (presencia evidente de clitelo). En otros terrarios se adicionan dosis crecientes del organofosforado diazinon a intervalos de 1, 7, 10, 15 y 30 días. Mediante técnicas morfológicas se examina la morfología gonadal (E. foetida es un organismo hermafrodita dicógamo), testicular y la calidad de la cromatina de los espermatozoides obtenidos de la vesícula seminal.
En terrarios de animales intoxicados se agregó también melatonina (en dosis de 10 mg/kg de tierra), reconocido agente neutralizador de especies reactivas del oxígeno, para analizar su efecto protector.
RESULTADOS
Ratón5
En la bibliografía hemos propuesto un modelo de ensayo en ratones, útil para analizar el daño tóxico del testículo frente a contaminación con agropesticidas organofosforados. Así se ha comprobado que 1 dosis única de paratión ocasiona disminución del recuento de espermatozoides en cola del epidídimo, lo que implica daño de las células espermatogénicas en proliferación en el testículo6, en observaciones hechas durante el período de espermatogénesis completo (33,2 días en el ratón)7,8. Igualmente incrementa la necrospermia y teratozoospermia9, principalmente del flagelo, apareciendo células apoptóticas y vacuolización del epitelio seminífero, situación que no se recupera completamente aun a los 50 días postexposición10.
También hay daño de la cromatina, con espermatozoides aneuploides, que muestran viraje metacromático en epifluorescencia con la tinción de anaranjado de acridina, lo que demuestra ADN presente en forma monofilar7.
El metabolito paraoxón ha demostrado ser igualmente tóxico, y todavía más los preparados comerciales de paratión o malatión de uso agrícola.
Eisenia foetida4
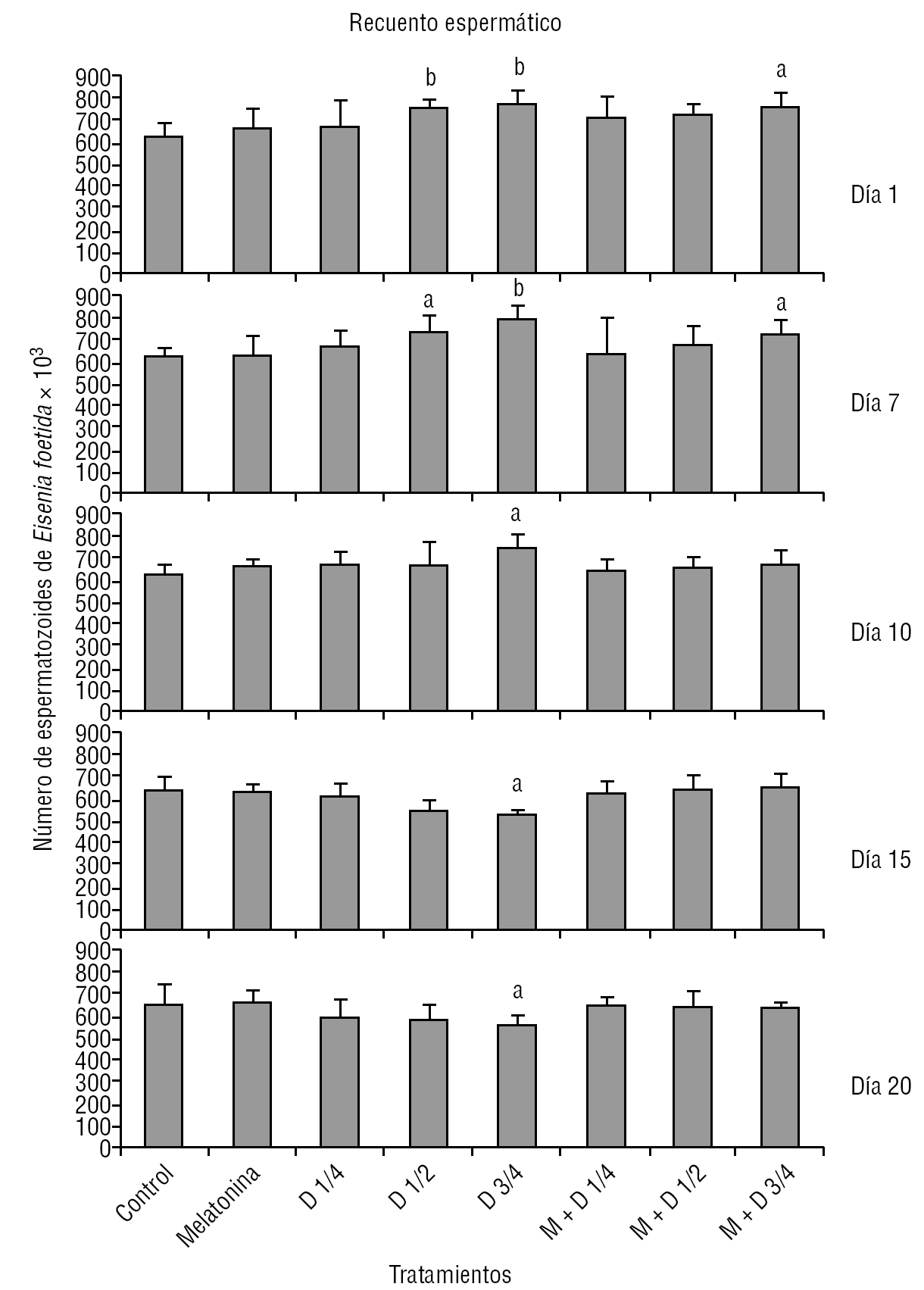
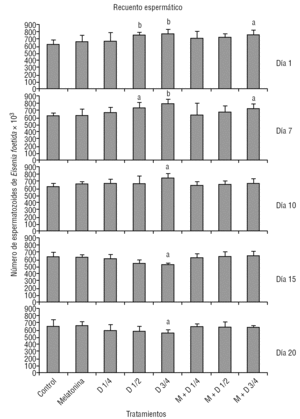
En la figura 3 se presentan los resultados del recuento de espermatozoides de E. foetida, expresado en miles, para cada intervalo de tiempo en presencia de distintas dosis de organofosforados (diazinón), con o sin adición de melatonina, y su comparación con los controles. Se observa disminución del recuento con las dosis más altas de diazinón, y un efecto protector, aunque sin alcanzar los valores control, en los animales tratados con melatonina.
Figura 3. Recuento espermático de Eisenia foetida para cada intervalo de tiempo y tratamiento. D representa la aplicación de diazinón, en dosis de 14, 12 y 34 de la DL (dosis letal)-50, y M: melatonina (dosis: 10 mg/kg de tierra). ap < 0,05. bp < 0,01.
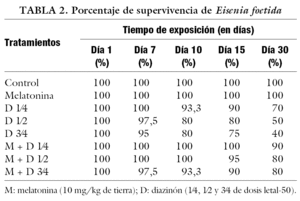
La viabilidad de los individuos también demuestra el efecto protector de melatonina, ya que la sobrevida de éstos se asemeja al control, registrándose alta mortalidad dependiente de la dosis en los gusanos tratados con diazinón (tabla 2).
DISCUSIÓN
Hay numerosos estudios que analizan los efectos tóxicos de los organofosforados y el testículo como órgano afectado. Dado que la espermatogénesis es un proceso complejo que comprende proliferación y diferenciación celular, el daño y los mecanismos involucrados son difíciles de establecer1. El daño se ha establecido tanto en ratones adultos como en ratones inmaduros11, en que se constata disminución del diámetro tubular y de la altura del epitelio seminífero. Este efecto puede revertirse parcialmente por la administración de un extracto acuoso de la raíz (tubérculo) de Lepidium meyenii (maca), una planta brassicácea que se cultiva en el Altiplano peruano. Esta propiedad ha sido reportada por Gonzales et al (2001 y 2003)12,13, en que dicho extracto protege del daño espermatogénico ocasionado por hipoxia de altura y de los cambios debidos a senescencia de los animales. Nuestro grupo ha observado que el extracto de maca protege de los efectos deletéreos para el testículo ocasionados por el malatión14,15.
Respecto al uso de la lombriz de tierra como bioindicador de contaminación química del terreno, es posible afirmar que si bien las tasas de supervivencia muestran claramente el impacto de los organofosforados en este organismo, se sabe que este parámetro es menos sensible desde un punto de vista ecotoxicológico, ya que puede haber efectos subletales de importancia. Por lo tanto, crecimiento y reproducción son indicadores que pueden resultar más útiles, como se discute en la bibliografía16,17. Hemos demostrado que el número de cápsulas que se producen y de lombrices que nacen en terrarios expuestos a concentraciones crecientes de paratión comercial decrece en relación directa con la concentración del pesticida4. Una situación similar se registra respecto a la pérdida de peso observada a los 5, 15 y 30 días después de la exposición, lo que se acompaña de apoptosis detectada por el ensayo de cometa en los núcleos de células germinales de E. foetida. El recuento espermático parece ser uno de los marcadores más sensibles, así como la tasa de apoptosis secundaria a la intoxicación, denotando acción genotóxica del pesticida.
En resumen, los parámetros reproductivos de la lombriz son bioindicadores útiles, que denotan contaminación del terreno.
En consecuencia, E. foetida resulta ser una especie biocentinela adecuada, en la cual el estudio de parámetros reproductivos refleja fielmente la polución química de su ambiente.
Correspondencia: Dr. E. Bustos-Obregón.
Laboratorio de Biología de la Reproducción.
Facultad de Medicina. Universidad de Chile.
Casilla 70061. Santiago 7. Chile.
Correo electrónico: ebustos@med.uchile.cl