INTRODUCCIÓN
La glándula pineal es un derivado temprano del epitálamo diencefálico. Su hormona, la melatonina, como transductor neuroendocrino transfiere la señal neural en una señal endocrina1. Los ritmos biológicos en las funciones fisiológicas están dirigidos por el sistema circadiano y sincronizados por ciclos externos a través de varias estructuras sensoriales2.
Una de las funciones endocrinas más importantes de la glándula pineal es la síntesis y secrección de melatonina, que permite modular el paso del tiempo a través de los ritmos biológicos (circadiano y/o circanual)3,4. Las oscilaciones moleculares circadianas se generan por un complejo formado por un reloj que funciona sobre la regulación de la transcripción génica y sus productos proteicos5.
La glándula pineal secreta indolaminas, melatonina, bajo el control del núcleo supraquiasmático, que participa en la regulación de la actividad reproductiva en animales que presentan regulación fotoperiódica6-8. Otras funciones asignadas a la melatonina de la glándula pineal son la ritmicidad de muchas funciones9, efectos antitumorales10, regulación del sueño11, propiedades antienvejecimiento y un rol en el eje neuroinmunológico12.
En la especie humana, la glándula pineal mide de 5 a 8 mm de longitud y de 3 a 5 mm de ancho. Presenta una forma cónica y una cápsula formada por derivaciones de la piamadre y un tejido conectivo laxo. Esta cápsula se encuentra interrumpida en la región basal por un pequeño espacio ventricular. Estructuralmente, la glándula pineal está constituida por células propias llamadas pinealocitos y células intersticiales, no está claro si las células intersticiales también contienen melatonina13. Las células gliales representan diferentes tipos celulares fácilmente distinguibles de los pinealocitos, principalmente por la densidad de sus núcleos14.
En el presente estudio se describe la glándula pineal humana de distintas edades a través de evaluaciones morfométricas (diámetro lobulillar, área nuclear de pinealocitos), celularidad (proliferación y apoptosis celulares) y presencia específica de células c-kit positivas, a través de métodos inmunohistoquímicos.
MATERIAL Y MÉTODOS
Glándula pineal humana
Se obtuvieron glándulas pineales humanas durante los procedimientos de autopsias de varones fallecidos por causas desconocidas y sin evidencia o registros de patologías asociadas al sistema nervioso central. Las glándulas se obtuvieron durante las primeras 24 h post mórtem, desde el Instituto Médico Legal, y bajo todas las consideraciones bioéticas aceptadas por la Facultad de Medicina de la Universidad de Chile para los trabajos con tejidos humanos. Las glándulas obtenidas se distribuyeron de acuerdo a los siguientes rangos de edad: a) grupo 1, de 1 a 6 años, n = 6; b) grupo 2, de 12 a 17 años, n = 3; c) grupo 3, de 20 a 30 años, n = 3, y d) grupo 4, de 35 años de edad, n = 3.
Las muestras de glándulas pineales fueron inmediatamente fijadas en formol tamponado (pH 7,2), donde permanecieron durante 48 h. Luego, las muestras fueron impregnadas en parafina (punto de fusión entre 56 y 58 °C). Finalmente, una serie de secciones de 5 µm de espesor se montaron en portaobjetos silanizados para el posterior desarrollo de las tinciones correspondientes: hematoxilina y eosina (para la descripción histológica y morfometría, áreas y diámetros) e inmunohistoquímica específica (IHQ) para la identificación de células c-kit, ki-67 y apaf-1 positivas.
Las imágenes se digitalizaron y procesaron con el programa Image J del National Institute of Health. Los resultados se representan en fotografías y gráficos de barras. Mientras que los trabajos estadísticos de análisis de las diferencias de promedios se desarrollaron a través de la prueba de la t de Student, con un p ≤ 0,05.
Protocolos de inmunohistoquímica
CD-117/c-Kit (DAKO A4502); ki-67 y apaf-1 (Vector datasheet). Revelado a través de diaminobencidina (DAB).
Las tinciones de IHQ se desarrollaron según las hojas técnicas de cada laboratorio comercial para cada anticuerpo primario de tejidos fijados en formol e impregnados en parafina. Las evaluaciones se desarrollaron a través de los registros de células positivas por área tisular (0,17 mm2).
Los anticuerpos primarios se usaron a una dilución de 1:250 y se revelaron con DAB (color marrón)15 o aminoetilcarbazol (AEC, color rojo). Se desarrollaron procedimientos para la recuperación de antígeno a través del pasaje de las secciones por una solución de tampón citrato a pH 6,0 y una concentración de 0,1 mM durante 30 min a temperatura de 98 °C (uso de Vaporera Oster).
RESULTADOS
Histología de la glándula pineal humana
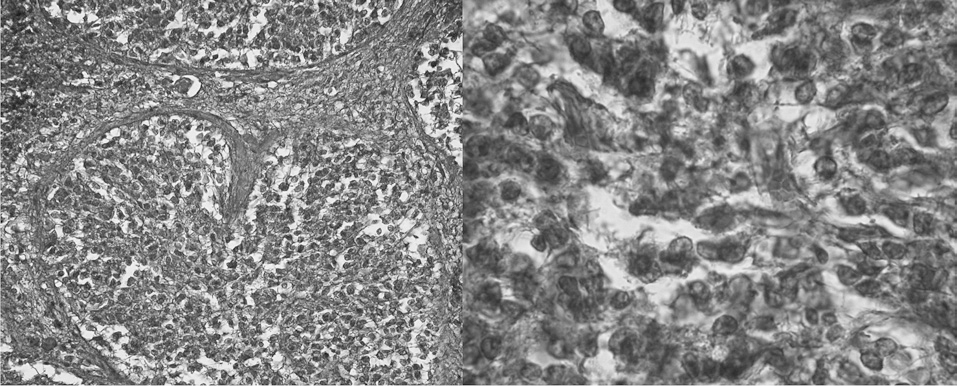
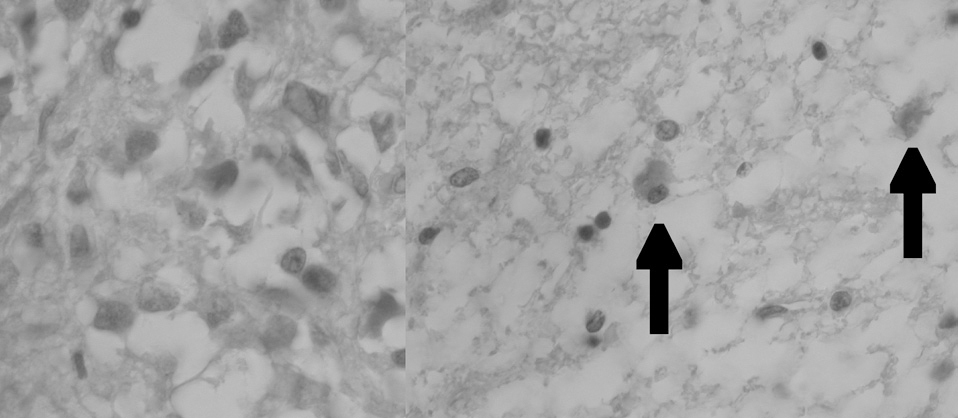
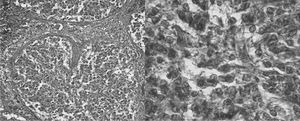
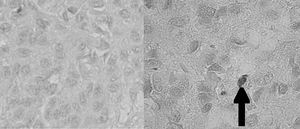
La glándula pineal humana se organiza en lobulillos glandulares endocrinos donde los pinealocitos son ordenados al interior en conjunto con una fina red de estroma formada por tejido conectivo. En el espacio interlobulillar se distribuye una diversidad celular formada principalmente por células derivadas desde la glía pial, y acompañada de una abundante irrigación. Los pinealocitos se reconocen fácilmente por presentar un núcleo redondeado, basofilia de intensidad variable, forma oval pleomórfica y tamaño variable (fig. 1).
Figura 1. Microfotografía que muestra la histología de la glándula pineal con tinción de hematoxilina-eoxina (grupo 2), a distintos aumentos: lobulillos (x400); núcleos de pinealocitos (x1.000), respectivamente.
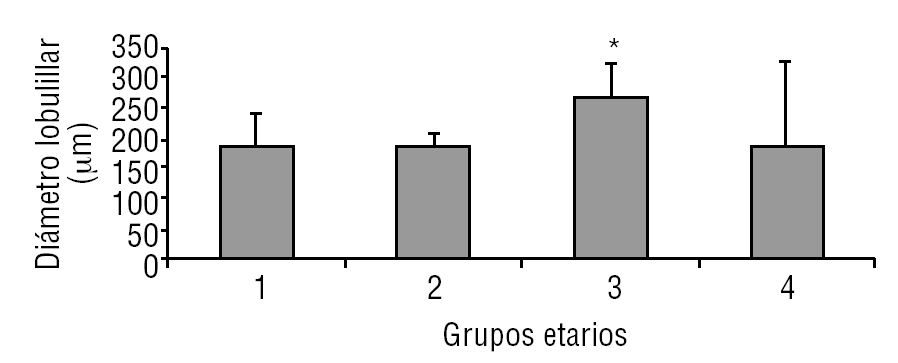
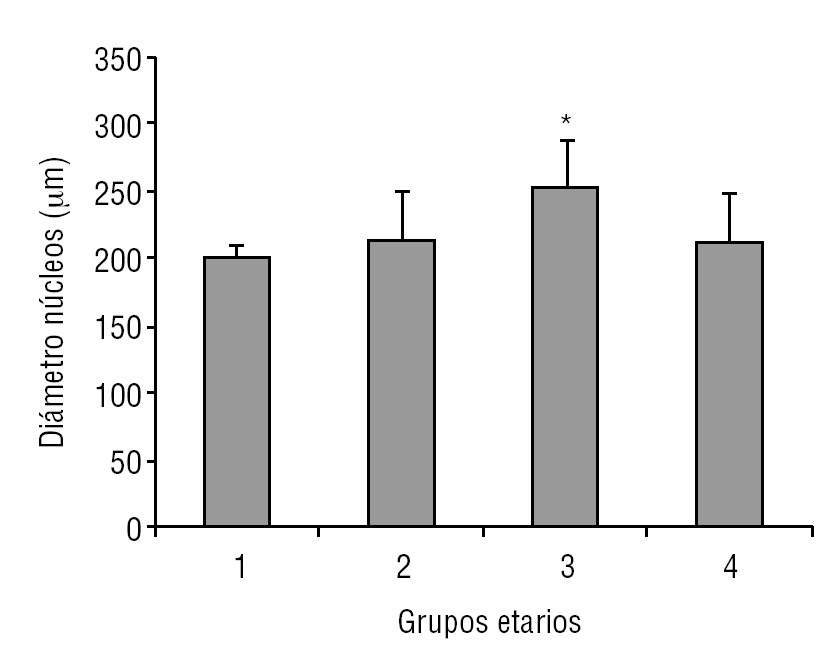
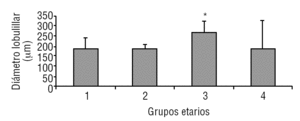
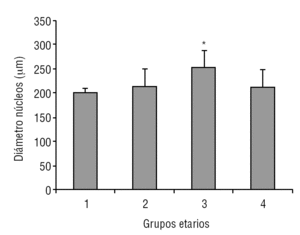
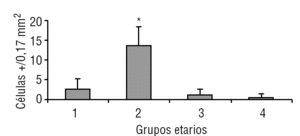
La glándula pineal presenta modificaciones estructurales de manera dinámica durante toda la vida del individuo. En la figura 2 se observa que el diámetro ocupado por la organización lobulillar de los pinealocitos es similar en todos los grupos evaluados, con excepción del grupo 3 (adulto joven), que muestra un aumento ligeramente significativo estadísticamente (p ≤ 0,05). También se observa que esta característica se hace mucho más variable a edades mayores (grupo 4). De modo similar, en la figura 3 se muestra el área alcanzada por el núcleo de los pinealocitos, describiéndose un aumento significativo (p ≤ 0,05) en el grupo 3, adulto joven, con respecto a los grupos anteriores.
Figura 2. Desarrollo del diámetro lobulillar en la glándula pineal humana. El gráfico de barras muestra los promedios y desviaciones estándar del diámetro lobulillar (µm) del parénquima de la glándula pineal humana, evaluadas a diferentes edades (*p ≤ 0,05).
Figura 3. Dinámica comparativa del área de los núcleos de pinealocitos. El gráfico de barras muestra los promedios y desviaciones estándar del área de los núcleos de los pinealocitos (mm2) del parénquima de la glándula pineal humana, evaluados a diferentes edades (*p ≤ 0,05).
Células intersticiales de Cajal: c-kit
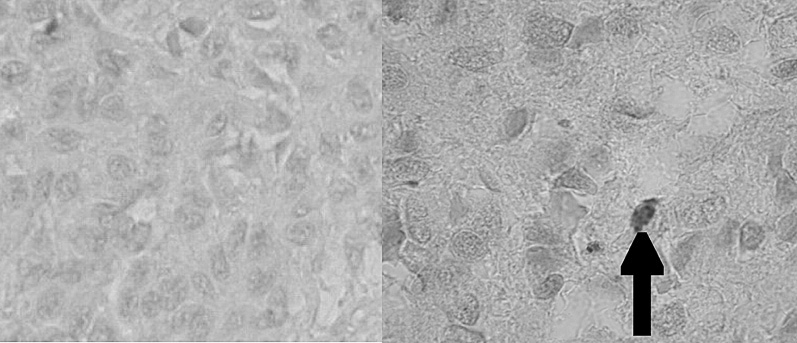
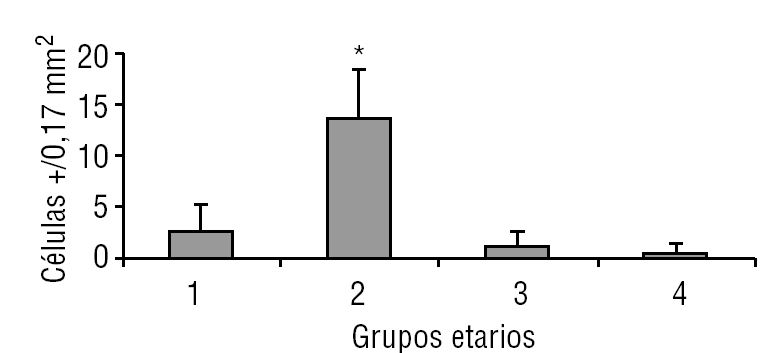
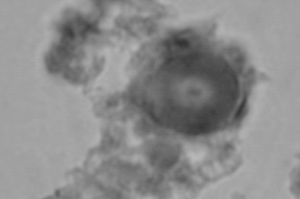
En la figura 2 se observan células inmunohistoquímicamente reactivas con el anticuerpo específico para reconocer el marcador de membrana CD-117 que corresponde a la expresión del gen c-kit. Por lo tanto, esto permite demostrar la presencia de las células intersticiales de Cajal (ICC), que expresan la proteína de membrana c-kit, distribuidas en el intersticio de la glándula pineal humana. Cuantitativamente las células c-kit son escasas (una cada 3 a 4 campos de 0,17 mm2) y se distribuyen en íntima adherencia a la cápsula conectiva de los lobulillos glandulares. En la figura 4 se observan las células c-kit+ y cargadas con el cromógeno (AEC), que muestran un color rojo intenso en su citoplasma y un núcleo elíptico de difícil definición.
Figura 4. Microfotografía que muestra la reacción de inmunohistoquímica para c-kit+ (control negativo y experimental c-kit+, respectivamente, grupo 3). La flecha indica una célula c-kit+ (cromógeno aminoetilcarbazol [AEC]).
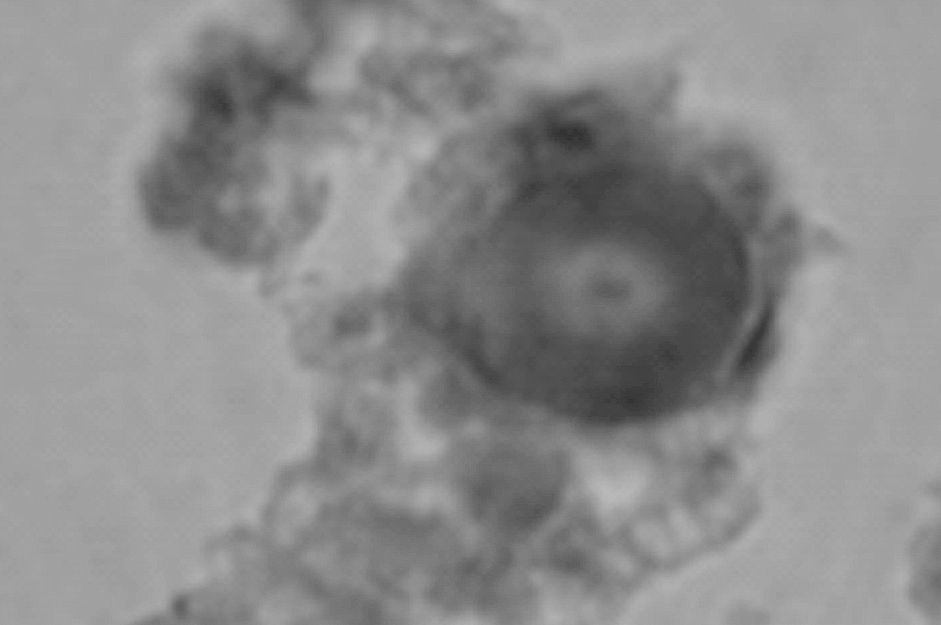
Aparentemente, la cantidad de células c-kit+ aumentan en forma paralela con la edad, aunque sin un patrón definido. Adicionalmente, en el grupo 4 (varones mayores de 35 años), se observaron estructuras acelulares conocidas como acérvulos cerebrales (fig. 5).
Figura 5. Microfotografía que muestra las concreciones calcáreas (grupo 4). Cuerpos arenáceos (3400).
Celularidad de la glándula pineal humana. Proliferación celular: ki-67, y apoptosis: apaf-1
El péptido ki-67 aparece cuando las células se encuentran en alguna etapa del ciclo celular y no en G0. Por ello, al detectar la presencia de ki-67 en una célula significa la presencia de un estado de proliferación celular activo. De modo similar ocurre con los procesos intracelulares de apoptosis, apaf-1, donde se desarrolla la interacción de la proteína apoptosoma con el citocromo c, conduciendo a la activación de los sistemas de caspasas.
Normalmente, la maduración del sistema nervioso ocurre durante la primera infancia del individuo, mientras que en el adulto aún permanece la plasticidad neuronal.
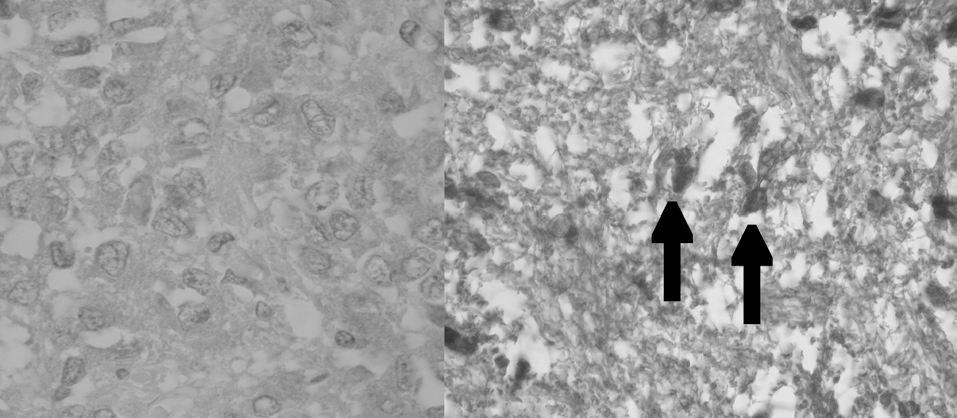
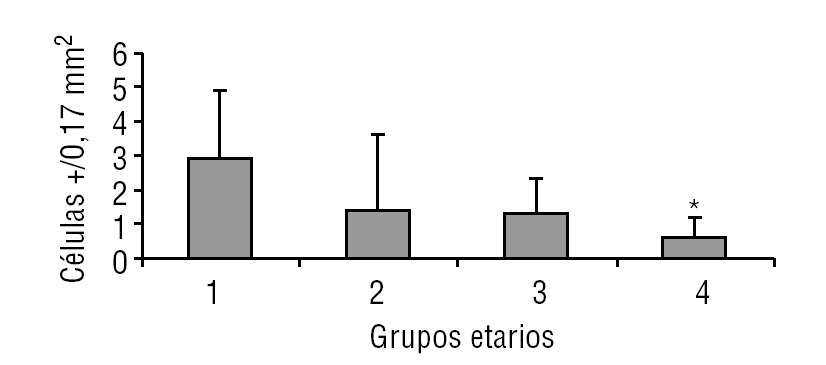
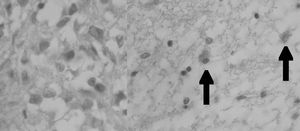
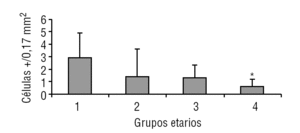
Aparentemente, y a juzgar por los resultados presentados en este estudio, la glándula pineal presenta un patrón de proliferación celular durante toda la vida del individuo. Como se observa en las figuras 6 y 7, la glándula pineal humana presenta un aumento proliferativo estadísticamente significativo (p ≤ 0,05) en el grupo 2, que corresponde a las edades entre 12 y 17 años. Sin embargo, la apoptosis (figs. 8 y 9) es máxima durante los primeros años de vida (grupo 1), para luego disminuir progresiva y sostenidamente a través de la edad (grupos 2, 3 y 4), llegando a ser estadísticamente significativa en el grupo 4 con respecto al grupo 1 (p ≤ 0,05).
Figura 6. Microfotografía que muestra la reacción de inmunohistoquímica para ki-67+ (control negativo y experimental ki-67+, respectivamente, grupo 2). Las flechas indican células ki-67+ (cromógeno diaminobenzidina [DAB]).
Figura 7. Proliferación celular en la glándula pineal humana. El gráfico de barras muestra los promedios y desviaciones estándar de la cuantificación de células ki-67+ por área (0,17 mm2) en la glándula pineal humana, evaluadas a diferentes edades (*p ≤ 0,05).
Figura 8. Microfotografía que muestra la reacción de inmunohistoquímica para apaf-1+ (control negativo y experimental apaf-1+, respectivamente, grupo 1). Las flechas indican células apaf-1+ (cromógeno diaminobenzidina [DAB]).
Figura 9. Presencia de apoptosis en la glándula pineal humana. El gráfico de barras muestra los promedios y desviaciones estándar de la cuantificación de células apaf-1+ por área (0,17 mm2) en la glándula pineal humana, evaluadas a diferentes edades (*p ≤ 0,05).
Paralelamente, se observa la presencia de estructuras tipo cuerpos arenáceos acelulares (fig. 5) en el grupo de individuos de mayor edad (grupo 4).
DISCUSIÓN
El principal regulador de la generación de melatonina en la glándula pineal es el ciclo de luz/oscuridad, que actúa a través de la activación neuronal del hipotálamo anterior vía los axones de las células gangliorretinales que corren por el nervio óptico y por la formación del tracto retinohipotalámico. El sistema nervioso central está conectado a la glándula pineal a través del núcleo paraventricular y neuronas simpáticas preganglionares; la inervación por el ganglio cervical superior con neuronas simpáticas postsinápticas suplementa la glándula pineal. La noradrenalina liberada por las fibras simpáticas posganglionares sobre la membrana plasmática de los pinealocitos provoca la estimulación de los b1-adrenorreceptores para la activación de la proteína G-adenilato ciclasa16. Los mediadores intracelulares de los pinealocitos pueden ser AMPc, fosfoinositol, calcio, diacilglicerol y proteincinasa C17,18.
Morfológicamente, el cuerpo de la glándula pineal humana es una estructura sólida, parenquimatosa y de forma cónica (figs. 1-3 y 5). En el adulto es frecuente encontrar cuerpos microscópicos calcificados, gliosis y formaciones quísticas (fig. 5), probablemente como una característica de la involución del órgano después de la pubertad (figs. 7 y 9)19. Esta glándula degenera progresivamente con el avance de la edad. La cápsula de la glándula está formada por tejido conectivo que se extiende en tabiques hacia el parénquima de la glándula llevando la irrigación a través de capilares de distinto calibre, formando la estructura lobular característica. Citológicamente los pinealocitos no mostraron signos de atrofia ni signos de hiperplasia en ninguno de los grupos etarios analizados (figs. 1 y 6).
Según Golan et al20, el tamaño de la glándula pineal humana varía de forma importante con la edad, donde las medidas mayores del ancho y alto de la glándula se observaron en individuos menores de 30 años; mientras que el espesor mínimo se observó en individuos mayores de 40 años. Observación similar a la descrita en el presente trabajo al considerar el diámetro de los lobulillos parenquimatosos y del área nuclear de los pinealocitos, donde los promedios más altos se obtuvieron en el grupo 3, con diferencias significativas con respecto a los grupos de individuos más jóvenes (figs. 2 y 3).
De acuerdo con los resultados mostrados en el presente trabajo, durante la vida, la glándula pineal humana básicamente mantiene su celularidad y desarrolla varios cambios adaptativos según la edad, pero nunca se ha observado una mayor abundancia del tejido conectivo y/o vascularización. Esta característica es importante para las funciones que se le adscriben a la glándula pineal, incluso sus propiedades oncostáticas.
La glándula pineal es un órgano que se desarrolla desde muy temprano en el embrión a partir de la placa neural, durante el segundo mes de gestación. En el adulto es de ubicación media y única, mientras que en el embrión a menudo aparece doble, se extiende desde la comisura habenular y la evaginación de la raíz del diencéfalo. El neuroepitelio prolifera para formar el parénquima glandular que en un principio se organiza a modo cordonal y folicular rodeado por tejido conectivo pial embrinario14.
Las células neuroepiteliales de la glándula pineal constituyen el parénquima, formado principalmente por pinealocitos y células neurogliales (figs. 1 y 4). La estroma de la glándula está formada por un sistema de tabiques y trabéculas alrededor y en el interior de los lóbulos glandulares, que se continúan con la estructuración de la cápsula del órgano. Estos tejidos conectivos de la cápsula y tabiques son derivados del mesénquima meníngeo y una vasta contribución desde las células de la cresta neural (fig. 4) y vascular (mesodermo intermedio).
En mamíferos la glándula pineal crece desde la infancia hacia la adultez principalmente por un aumento del tamaño de los pinealocitos y, en menor grado y más variablemente, por un ligero aumento en las células gliales y estromales. En la glándula pineal humana se observa un aumento de área de los núcleos de los pinealocitos y del tamaño de los lobulillos hacia la edad del adulto joven, grupo 3 (figs. 2 y 3).
En el presente estudio, al analizar la celularidad intersticial, se observó que las células c-kit+ estaban ausentes en las edades más tempranas (grupo 1), lo que probablemente signifique que la glándula aún se encuentra en estado de diferenciación.
Según Carvajal et al21, en la glándula pineal de la rata durante la primera semana después del nacimiento el porcentaje de células en fase "S" del ciclo celular disminuye desde el 9 al 1,3%. Disminución que se repite durante la segunda semana de vida, que llega a un 0,5%. Por lo que numéricamente la cantidad de pinealocitos disminuye progresivamente durante todo el primer mes de vida. Sin embargo, en el presente estudio la cantidad de pinealocitos en proliferación aumenta drásticamente en el grupo 2, que corresponde a la edad de adolescencia, con valores promedios estadísticamente significativos con respecto a cualquiera de los otros grupos (figs. 6 y 7). Aparentemente, la celularidad del parénquima de la glándula pineal quedaría definida durante la adolescencia.
Estos resultados permiten sugerir que la glándula pineal humana presenta una fuerte expansión celular previa a la maduración morfológica y funcional, idea que permanece abierta para investigaciones futuras considerando la relación entre función y procesos proliferativos21.
En la glándula pineal de muchas especies de mamíferos es posible encontrar una variedad de cuerpos neuronales. A través de marcadores celulares es posible identificar la presencia de astrocitos en porcentajes entre 10 y 20 de las células de la glándula pineal.
Según los resultados inmunohistoquímicos que se muestran aquí, es posible describir la presencia de un nuevo tipo celular en el espacio intersticial de la glándula pineal humana identificada a través de la presentación del receptor de membrana conocido como receptor c-kit (transmembrane kinase III like receptor). Normalmente las células que expresan la proteína c-kit se han descrito como ICC, y como marcadores de membrana se han denominado CD-117 (figura 2). Aquí, en individuos menores de 6 años (grupo 2) no fue posible encontrar células c-kit+. Mientras que en el grupo de adolescentes (grupo 2) ya aparecieron las células ICC. Estas células se encuentran en muy escasa cantidad y se distribuyen en los espacios interlobulillares, cercanas a los vasos sanguíneos.
Estas células presentan un núcleo oval y de escaso citoplasma, dando la apariencia de una organización citoplasmática con múltiples proyecciones (estrelladas) dirigidas hacia las células vecinas, posiblemente haciendo un puente intercelular entre los capilares sanguíneos y los pinealocitos (fig. 4).
Es posible que la presencia de las ICC represente la organización estructural de la función de control de los impulsos nerviosos a través de la transducción de señales inhibitorias y excitatorias22, que puede participar en la regulación de la síntesis y secreción de la melatonina.
En primates, las fibras parasimpáticas en la glándula pineal harían sinapsis con las células ganglionares parasimpáticas de la estroma de la glándula, lo que estaría asociado a la presencia de receptores nicotínicos y muscarínicos colinérgicos23,24, por lo que se puede especular y explicar su relación con las inervaciones de las células de Cajal en otros sitos, como el plexo mioentérico.
La organización histológica podría corresponder a la compensación estructural y funcional para reforzar la funcionalidad de la glándula pineal, considerando que en mamíferos la glándula pineal pierde la función de sus fotorreceptores progresivamente durante la evolución25. Aún así la glándula pineal continúa siendo estimulada por la luz a través de los núcleos supraquiasmáticos26,27. Según Daniel y Berezin28, las ICC serían de origen mesenquimático con características de fibras musculares primitivas.
Paralelamente, las concreciones calcáreas presentes en la glándula pineal de individuos de mayor edad (grupo 4) (fig. 5), así como también en bovinos, posiblemente tengan un origen glial o de la estroma de la glándula14.
Por lo tanto, la glándula pineal humana es una estructura dinámica que manifiesta todas sus características morfofuncionales hacia la pubertad, precisamente en los momentos donde más se requiere de su integración funcional dado que se inicia y establece la actividad reproductiva de la especie.
CONCLUSIONES
La glándula pineal humana se organiza en un sistema parenquimatoso lobulillar, donde el diámetro de los lobulillos y el área ocupada por el núcleo de los pinealocitos alcanzan su mayor expansión al alcanzar la etapa de adulto joven. Mientras que la proliferación celular alcanza su máxima expresión durante la pubertad. Paralelamente, durante la niñez se observan tasas altas de apoptosis, cuyos valores disminuyen progresivamente a través de la vida. Por lo tanto, la glándula pineal humana alcanza una gran organización morfofuncional durante la pubertad y la edad de adulto joven, momentos que coinciden con la adquisición de las mejores aptitudes reproductivas de la especie humana. Mientras que luego aparecen manifestaciones de carácter degenerativo, hacia edades mayores (adulto), que coincide con una disminución de las aptitudes reproductivas de la especia humana.
Correspondencia: Prof. Dr. H. Rodríguez.
Laboratory of Histoembriology.
Anatomy and Development Biology Program.
Faculty of Medicine. University of Chile.
Avda. Independencia, 1027. Santiago. Chile.
Casilla 70070.
Correo electrónico: hrodrigu@med.uchile.cl