INTRODUCCIÓN
El déficit androgénico prolongado, característico del hipogonadismo masculino, produce diversos cambios en la composición corporal, entre los que destaca la obesidad1. La obesidad y la resistencia a la insulina son trastornos estrechamente relacionados entre sí y constituyen los elementos clave del llamado síndrome metabólico (SM)2,3, un conjunto de factores de riesgo cardiovascular de origen metabólico que se consideraron en conjunto por vez primera por Reaven, que acuñó el término de síndrome X4. En la descripción original, Reaven no incluía la obesidad, que es un elemento clave del SM, término mucho más usado en la actualidad5.
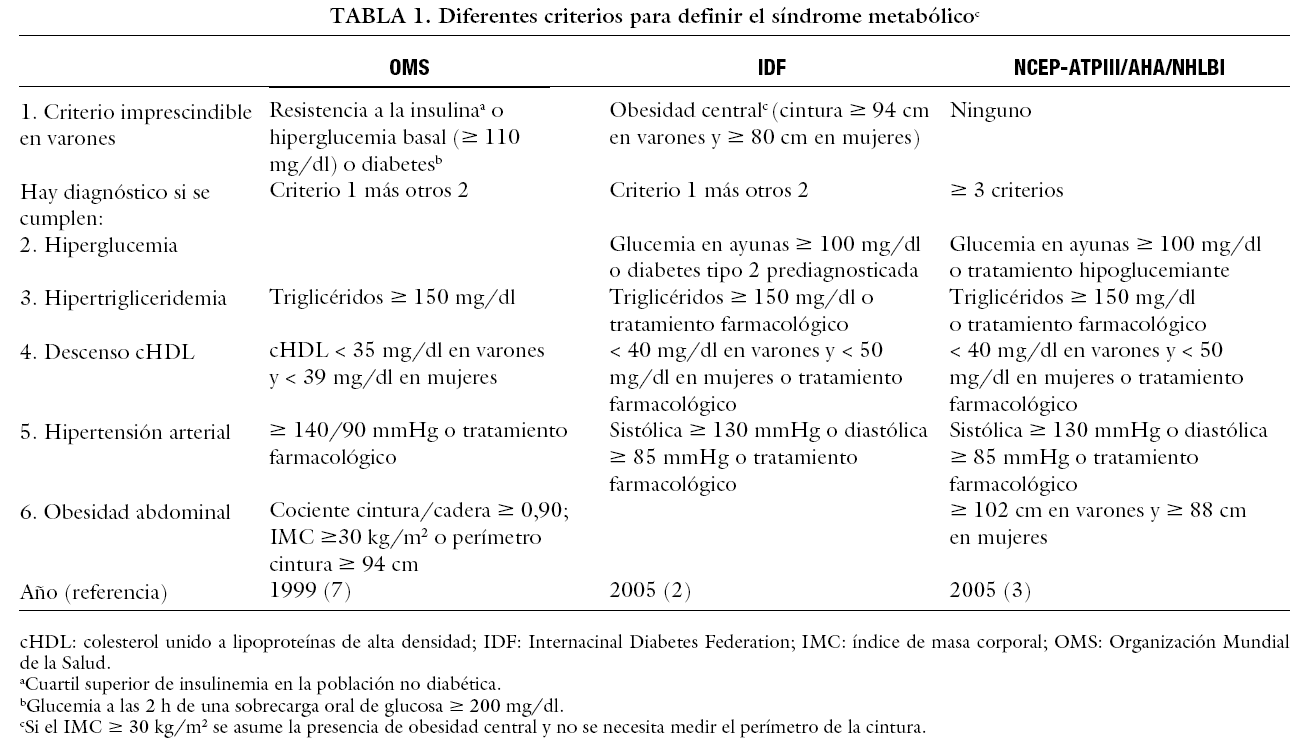
El SM incluye entre sus componentes: obesidad central o visceral, hipertrigliceridemia, descenso de los valores séricos de colesterol ligado a las lipoproteínas de alta densidad (cHDL), hipertensión arterial e hiperglucemia. Los criterios que permiten su identificación varían discretamente entre los emitidos por la International Diabetes Federation (IDF)2 y los correspondientes a la reactualización de la American Heart Association/Nacional Heart, Lung, and Blood Institute (AHA/NHLBI)3 de los criterios emitidos en el año 2001 por la National Cholesterol Education Program, Adult Treatment Panel III (NCEP-ATP III)6, si bien sus componentes son esencialmente los mismos2,3,7 (tabla 1). Hay un SM, según criterios de la IDF, cuando hay una obesidad central determinada al medir la circunferencia de la cintura o bien cuando el índice de masa corporal es > 30 kg/m2 más otros 2 factores de riesgo2. Según la AHA/NHLBI3 hay SM cuando se detectan al menos 3 de los factores de riesgo considerados en la tabla 1. Aunque hay otras clasificaciones y criterios diferentes para definir el SM, los criterios de la IDF y los de la NCEP actualizados son los más difundidos y populares.
La importancia del SM deriva de varios factores. Por una parte, de la elevada prevalencia del trastorno en la población, que afecta a un 26,8% de los varones y a un 16,6% de mujeres, al principio de un amplio estudio que incluía 3.323 participantes del Framingham Heart Study8. Por otra parte, de las múltiples consecuencias que derivan de él, entre las cuales se encuentran la enfermedad cardiovascular aterosclerótica, la diabetes mellitus tipo 2, la enfermedad gotosa, el síndrome del ovario poliquístico, el síndrome de apnea del sueño, la esteatosis hepática y algunas formas de lipodistrofias3,9.
A continuación se considera el papel que el déficit androgénico desempeña en el desarrollo del SM, y hay que tener en cuenta que la patogenia de este síndrome es compleja, mal conocida y abarca tanto a otros factores no hormonales, como el estilo de vida, determinantes genéticos, trastornos inflamatorios e inmunológicos, medicamentos, el propio envejecimiento, como a factores hormonales distintos a los esteroides sexuales entre los que se encuentran las hormonas de los ejes hipotálamo-hipófiso- adrenal y somatotropo, y el señalamiento intracelular de la insulina5.
DÉFICIT ANDROGÉNICO Y COMPONENTES DEL SÍNDROME METABÓLICO
Obesidad
Se ha demostrado que hay unas relaciones inversas entre las concentraciones séricas de testosterona en el varón y la grasa visceral10. El índice de masa corporal está correlacionado significativamente de forma inversa con los valores séricos de testosterona total y libre, y se ha observado que las concentraciones de testosterona están descendidas en proporción con el grado de obesidad11. También se ha demostrado en varones una asociación entre valores bajos de testosterona total con el índice de masa corporal y la proporción del perímetro de la cintura/perímetro de la cadera12.
Resistencia a la insulina
Aunque estrictamente no forma parte de los criterios del SM ni para la IDF2 ni para el NCEP-ATP III3, constituye un elemento esencial en la patogenia de los factores de riesgo que lo integran, por lo que se ha considerado, junto con la obesidad, como factor de riesgo subyacente para el desarrollo del SM5. Hay una dicotomía específica del sexo entre los valores séricos de testosterona y el riesgo de presentar diabetes mellitus de tipo 2, una consecuencia de la resistencia a la insulina. Así, mientras que en la mujer valores elevados de testosterona tienden a asociarse con la diabetes mellitus tipo 2, en el varón se encuentra el efecto contrario, es decir, constituyen un elemento protector, de manera que altos valores de testosterona reducen el riesgo de diabetes mellitus13.
Haffner et al14 han demostrado que un descenso de las concentraciones plasmáticas de testosterona y de dehidroepiandrosterona sulfato (DHEAS) se asocia con un incremento en las concentraciones de insulina y de glucosa en varones no diabéticos. En una población diferente a la del estudio previo, Haffner et al15 observaron que la elevación del cociente cintura/cadera y el descenso de los valores de testosterona se asociaban estrechamente con un descenso en la utilización corporal de la glucosa. En otros estudios se ha encontrado que los varones con bajos valores de testosterona total tenían unas concentraciones plasmáticas de glucemia y de insulina en ayunas y a las 2 h de una sobrecarga oral de glucosa significativamente mayores que los que tenían concentraciones normales de testosterona12.
En una serie de 400 varones de 40 a 80 años de edad, Muller et al16 encontraron que la sensibilidad a la insulina guardaba una relación directa con los valores séricos de testosterona. En otro estudio, realizado en 9 sujetos con tolerancia normal a la glucosa, 9 con intolerancia y 3 con diabetes mellitus, Pitteloud et al17 analizaron la resistencia a la insulina mediante la técnica del clamp euglucémico-hiperinsulinémico tras la inducción de un hipogonadismo previo con antagonistas de GnRH, y apreciaron que un incremento en la resistencia a la insulina estaba asociado con un descenso en la secreción de testosterona por las células de Leydig.
Hiperglucemia
En el estudio Telecom, un estudio de caso control en el que se comparaban los factores de riesgo cardiovascular en varones sanos con concentraciones medias normales de testosterona total en plasma (5,7 ± 0,2 ng/ml), respecto a varones de la misma edad y etnia con valores de testosterona por debajo de los normales (2,9 ± 0,1ng/ml), en este último grupo se observaron valores significativamente más elevados de glucemia plasmática en ayunas y a las 2 h de una sobrecarga oral de glucosa12. Estos resultados se han reproducido en otro estudio, el de Pitteloud et al18, en el que se observaron concentraciones medias de glucemia en ayunas significativamente más altas en sujetos con valores de testosterona total < 2,8 ng/ml que en los que tenían valores ≥ 2,8 ng/ml, 135 frente a 100 mg/dl, respectivamente. En un estudio epidemiológico realizado en 775 varones de 55 años o más, se apreciaba una asociación inversa entre los valores de testosterona total y las glucemias en ayunas19. Igualmente, otros estudios han mostrado correlaciones inversas entre los valores de testosterona total y libre con la glucemias10,14,15.
Analizando las relaciones entre el déficit androgénico y las glucemias mediante otro modelo diferente, el hipogonadismo profundo inducido en varones con cáncer de próstata, Braga-Basaria et al20 han observado que la deprivación androgénica a largo plazo induce un incremento en la prevalencia de hiperglucemia.
Dislipemia (hipertrigliceridemia y descenso del cHDL)
En el estudio Telecom12, antes mencionado, los varones con bajos valores de testosterona (< 3 ng/ml) presentaban valores de triglicéridos significativamente más elevados y concentraciones más bajas de cHDL que los que tenían valores normales. También se ha observado que las concentraciones de triglicéridos están inversamente correlacionadas con los valores séricos de testosterona total21. En el seguimiento durante 13 años de los participantes en el MRFIT se apreciaba que, conforme se reducían las concentraciones séricas de testosterona con la edad, aumentaban las de triglicéridos22.
En 10 de 13 estudios realizados en varones de edad media se han encontrado correlaciones directas significativas entre las concentraciones de testosterona y las de cHDL23. En estudios realizados en varones diagnosticados de cáncer de próstata sometidos a deprivación androgénica productora de un hipogonadismo profundo se han encontrado valores de triglicéridos significativamente superiores a los observados en controles20.
Hipertensión arterial
En sujetos ancianos se ha demostrado la presencia de relaciones inversas entre los valores séricos de testosterona total y la presión arterial sistólica24. Asimismo, en el estudio Rancho Bernardo se encontraron relaciones inversas entre los valores de testosterona endógena y la presión arterial en una población de 1.009 varones de 40 a 79 años de edad25. Recientemente, el grupo de Nieschlag analizaba las relaciones entre los valores séricos de testosterona total y los riesgos metabólicos en 434 sujetos consecutivos de más de 50 años y observaba que los pacientes con hipertensión arterial tenían valores séricos de testosterona más bajos que los normotensos26.
EL DÉFICIT ANDROGÉNICO Y EL SÍNDROME METABÓLICO EN SU CONJUNTO
Si bien la asociación o relación del déficit de testosterona con todos y cada uno de los componentes del SM hacía presuponer su relación con éste, sólo recientemente se han comenzado a presentar evidencias que apoyan la relación entre bajos valores de testosterona y el SM en su conjunto. Así, en un estudio diseñado para evaluar las relaciones entre los valores de hormonas sexuales endógenas y su posible asociación con el SM, Muller et al16 apreciaban que conforme se reducían los valores de testosterona aumentaba la prevalencia de los factores de riesgo componentes del SM; el incremento de 1 desviación estándar (DE) de los valores medios de testosterona suponía una reducción el riesgo de presentar SM con una odds ratio (OR) ajustada de 0,43 a 0,58. Así, por cada incremento en el valor de testosterona total de 1 DE, es decir, 1,5 ng/ml sobre la media (5,3 ng/ml), se reducía el riesgo de SM de un 57 a un 42%, respectivamente. En otro análisis de la contribución relativa del descenso de los valores de testosterona total en el desarrollo del SM, se apreciaba que la frecuencia porcentual de varones que presentaban 3 o más rasgos del SM aumentaba conforme descendían los valores de testosterona21.
En un estudio reciente de diseño cruzado, que incluía 71 pacientes con síndrome de Klinefelter, un 44% de ellos presentaba SM, de acuerdo con los criterios del NCEP ATP III27; los autores concluían que la prevalencia del SM estaba aumentada notablemente, mientras que la sensibilidad a la insulina estaba reducida en el síndrome de Klinefelter27. La deprivación androgénica inducida en el tratamiento del cáncer de próstata se asocia con una prevalencia del SM de un 50%20.
Otro trabajo, realizado en un medio sociocultural parecido al nuestro, que incluía 452 pacientes de más de 65 años de edad, mostraba que la testosterona total y la SHBG (sex hormone binding globulin) estaban asociados con el SM28.
DÉFICIT ANDROGÉNICO Y CONSECUENCIAS DEL SÍNDROME METABÓLICO
El déficit androgénico no sólo se asocia con el SM, tanto en lo relativo a los factores de riesgo que lo integran como en su conjunto, sino que también parece asociado a las principales consecuencias del SM, es decir la diabetes mellitus tipo 2 y la enfermedad cardiovascular28.
Numerosas investigaciones23,29, en las que se incluye una de nuestro grupo30, muestran que los pacientes con diabetes mellitus tipo 2 tienen concentraciones séricas de testosterona significativamente más bajas que controles de la misma edad. Nosotros encontrábamos que un 20% de pacientes con diabetes tipo 2 con una edad media de 63 años tenía déficit parcial androgénico30. Otros estudios utilizando criterios diferentes (incluyen la medición de la testosterona libre calculada) encontraban una tasa de hipogonadismo de un 33%31. En nuestra experiencia, un 54,5% de varones con diabetes tipo 2 tiene cifras infranormales de testosterona libre30.
En cuanto a la aterosclerosis y sus complicaciones, también hay evidencias que indican una correlación inversa entre los valores séricos de testosterona y la aterosclerosis carotídea evaluada midiendo el grosor de la íntima-media carotídea por ecografía32. El Rotterdam Study ha encontrado una asociación inversa entre los valores de testosterona y aterosclerosis carotídea, independientemente de otros factores de riesgo cardiovascular33.
NEXOS DE CAUSALIDAD ENTRE EL DÉFICIT ANDROGÉNICO Y EL SÍNDROME METABÓLICO
El establecimiento de unas relaciones entre el déficit de testosterona y los componentes o el propio SM no indica la dirección de causalidad. ¿Qué aparece primero, el déficit de testosterona y, por consiguiente, el SM es una consecuencia del trastorno hormonal, o bien el SM genera la aparición y/o la magnificación del déficit androgénico? De la respuesta depende, entre otras cosas, la aproximación profiláctica o terapéutica, plenamente justificada por las consecuencias que acarrea el SM. Para averiguarlo se dispone de 2 tipos de instrumentos, uno los estudios longitudinales donde se analizan secuencialmente los efectos con el tiempo del déficit de testosterona y de la presencia del SM y, en segundo lugar, los efectos del tratamiento del déficit de testosterona, es decir los estudios de intervención.
¿El déficit de testosterona es una causa del síndrome metabólico?
En este momento se dispone de varios estudios en los que se han analizado el riesgo que tiene un descenso de las concentraciones séricas de testosterona total para el desarrollo ulterior del SM. Haffner et al34, en 1996, apreciaron que bajos valores de testosterona sérica y de SHBG predecían el desarrollo de diabetes mellitus tipo 2 en vrones en el MRFIT. Los resultados del Massachusetts Male Aging Study, un estudio longitudinal con 1.709 varones, mostraban que bajos valores de testosterona encontrados al principio del estudio eran predictivos del desarrollo del SM 15 años después, particularmente en varones de edad media y con menos de 25 kg/m2 de índice de masa corporal35. Además, en esta misma cohorte de sujetos, se ha demostrado que un descenso de los valores de testosterona libre suponía un incremento en el riesgo de presentar diabetes a los 7-10 años en varones de edad media36. En otro trabajo de un grupo distinto se encontraba que concentraciones bajas de testosterona predecían, independientemente de otros factores, el desarrollo del SM y de diabetes mellitus en 702 varones de edad media seguidos durante 11 años37.
Si valores bajos de testosterona endógena aumentan el riesgo de presentar SM, también se ha demostrado lo contrario, es decir, que un incremento de los valores endógenos de testosterona aumentan la sensibilidad a la insulina y reducen el riesgo de SM16.
Estos datos parecen sugerir que el déficit androgénico es un importante factor causal del SM. Sin embargo, parece que el camino desde el déficit androgénico hasta el SM es uno de ida y vuelta, como veremos a continuación.
¿El síndrome metabólico produce un déficit androgénico?
La obesidad es un importante determinante de los valores séricos de testosterona. Siguiendo directrices institucionales, 1 de cada 7 obesos sería tributario de tratamiento con testosterona, mientras sólo lo sería 1 de cada 30 no obesos38. Se ha observado que las concentraciones de testosterona están descendidas en proporción con el grado de obesidad11.
En un análisis longitudinal acerca de los factores que contribuyen a un descenso de los valores de testosterona con el envejecimiento, se encontraba que un incremento de 4 a 5 kg/m2 de índice de masa corporal producía un descenso de los valores de testosterona total comparable al producido por 10 años de envejecimiento39. Otros estudios recientes evaluaban si la presencia basal del SM predecía el desarrollo de hipogonadismo 11 años después en 651 fineses de edad media, y observaban que los varones con SM tenían un incremento en el riesgo de desarrollar hipogonadismo de 2,6 veces40. En este estudio se apreciaba que el descenso de las concentraciones de testosterona durante los 11 años de seguimiento era mayor en varones con SM que en varones sin él y concluían que el SM predispone al desarrollo de hipogonadismo en varones de edad media40.
Aunque el mecanismo por el cual el SM desciende los valores de testosterona probablemente sea multifactorial, en el que estén implicados factores como la resistencia a la insulina y sus efectos sobre la SHBG, leptina, adipocinas y tratamientos múltiples para los componentes del SM, lo importante es que el déficit de testosterona no sólo es causa sino también consecuencia del SM40.
ESTUDIOS DE INTERVENCIÓN
Puesto que se ha demostrado que el SM es una consecuencia del déficit de testosterona, han surgido corrientes de opinión que postulan que hay una oportunidad para intervenir mediante tratamiento sustitutivo androgénico y prevenir, así, el SM y sus consecuencias41.
En tal sentido se dispone de abundante información acerca de los efectos del tratamiento sustitutivo con testosterona en los componentes del SM; en cambio, no hay estudio alguno en el que se haya evaluado prospectivamente la eventualidad de que un tratamiento con testosterona en varones con hipotestosteronemia sea capaz de evitar el desarrollo ulterior del SM. En lo relativo a los efectos del tratamiento sustitutivo con testosterona sobre las principales consecuencias del SM, se dispone de alguna información relativa a la diabetes tipo 2 y a la cardiopatía isquémica.
Hay estudios bien diseñados, pero realizados en un número pequeño de pacientes hipogonádicos con diabetes mellitus tipo 2, que demuestran que el tratamiento sustitutivo con ésteres de testosterona mejora la resistencia a la insulina, el control glucémico y la adiposidad visceral42. En otro estudio, realizado en 24 pacientes de edad media, con diabetes tipo 2 asociada con obesidad visceral e hipogonadismo leve, un tratamiento con un decanoato de testosterona por vía oral durante 3 meses descendía discretamente el peso corporal y llamativamente los valores medios de hemoglobina A1c desde un 10,4 hasta un 8,6%; si bien el diseño del estudio no podía excluir que dicho cambio se debiese en mayor o menor medida a la medicación antidiabética que recibían concomitantemente todos los pacientes43.
El efecto aparentemente positivo del tratamiento sustitutivo con testosterona sobre el metabolismo de la glucosa y la sensibilidad a la insulina no está apoyado por otros estudios. Así, en varones eugonádicos no diabéticos, bajos valores de testosterona biodisponible no eran capaces de predecir de forma independiente la resistencia a la insulina, la disfunción de la células beta pancreáticas o la exportación hepática de glucosa44. Otros autores, analizando los efectos del tratamiento con varias dosis de enantato de testosterona sobre la sensibilidad a la insulina en hombres jóvenes sanos, no encontraban cambios en la sensibilidad a la insulina, incluso aunque algunas de las dosis ensayadas eran suprafisiológicas45. Tampoco el tratamiento con hormona coriónica gonadotrópica recombinante en varones ancianos con valores de testosterona sérica < 4,3 ng/ml modificaba la sensibilidad a la insulina evaluada por varios métodos ni la función de las células beta pancreáticas46. En un trabajo reciente con diseño aleatorizado, doble ciego y controlado con placebo, el tratamiento con parches transdérmicos de testosterona a la dosis de 5 mg/día durante 2 años, en varones no diabéticos con testosterona mediana de 3,57 ng/ml, no mostraba efecto alguno sobre la sensibilidad a la insulina47. Nuestro grupo, en un estudio de intervención en el que se trataba con enantatato de testosterona a pacientes con diabetes de tipo 2 con déficit parcial androgénico durante 6 meses demostró un efecto neutro sobre el control glucémico30.
Con respecto a los efectos del tratamiento con testosterona sobre la enfermedad cardiovascular hay varias evidencias que sugieren un efecto beneficioso. La administración intracoronaria a corto plazo de concentraciones fisiológicas de testosterona inducía vasodilatación coronaria y aumentaba el flujo sanguíneo coronario en varones con enfermedad coronaria48. En otro trabajo del mismo grupo, la administración intravenosa aguda de testosterona en varones con enfermedad coronaria estable y bajos valores de testosterona retrasaba el comienzo de los signos electrocardiográficos de isquemia miocárdica en un 20%49. Dosis bajas de testosterona en varones con angina crónica estable reducían la isquemia miocárdica inducida por el ejercicio50. Asimismo, la administración a corto plazo de testosterona producía un efecto beneficioso sobre la isquemia miocárdica inducida por el ejercicio en varones con enfermedad coronaria, un efecto que se atribuyó a un efecto relajante directo de la hormona sobre las arterias coronarias51.
En resumen, hay evidencias obtenidas a través de diversos modelos de déficit androgénico en el varón que sugieren una relación bidireccional entre el hipogonadismo y el SM. No obstante, se carece de información suficiente capaz de sugerir el empleo experimental de testosterona en el SM, entre otras razones porque aún no hay estudios en los que se demuestre que dicho tratamiento sea eficaz en pacientes con SM. Aún está por estudiar la importancia relativa del déficit de testosterona sobre el desarrollo del SM y sobre sus consecuencias.
Correspondencia: Dr. J.J. Corrales Hernández.
Servicio de Endocrinología. Departamento de Medicina.
Hospital Clínico Universitario.
Paseo de San Vicente, 58. 37007 Salamanca. España.
Correo electrónico: corrales@usal.es