INTRODUCCIÓN
El control de los valores de la fragmentación del ADN espermático (FAE) en muestras de semen que se utilizarán en cualquier proceso de reproducción asistida, es un tema de interés en el campo de la andrología y son múltiples los trabajos que indican que una frecuencia elevada de espermatozoides afectados en un eyaculado tiene consecuencias negativas en la fertilidad. De hecho, distintas revisiones apoyan la veracidad de este punto de vista1-3. Sin embargo, la esencia de los procesos que están implicados en generar una molécula de ADN no ortodoxa y transportable por un gameto, las consecuencias directas que un ADN alterado genera sobre el desarrollo de los embriones o simplemente el tempo con el que la degradación del ADN ocurre en el semen tras la eyaculación, por desconocidos, son la semilla de todo tipo de controversias y polémicas. Así, se encontrarán resultados en los que el papel de la FAE se relega a un segundo plano, ya que, por ejemplo, no se encuentra una relación directa entre valores de fragmentación elevados y la fertilidad. De tal forma que, individuos con índices de fragmentación fuera de la normalidad, son capaces de generar embarazos a término4,5. Pero este tipo de situaciones, fuera de suponer un elemento de polémica y desencuentro, debiera ser un espacio de consenso, dado que en el campo de la biología el establecimiento de los dogmas, por una o por otra parte, no suele ser buen terreno de cultivo para en-tender toda la verdad que subyace detrás de cualquier proceso. De esta forma, las discrepancias que se suelen encontrar en este sentido pueden llegar a ser comprensibles cuando se analiza con detalle la multifactorización que canaliza el hecho final que una muestra de semen pueda tener “buena” o “mala” calidad; es decir, que sea capaz de generar descendencia normal
o no frente a un oocito normal. Ante una situación en la que diversos factores que abarcan desde el fondo genético del individuo en cuestión, la mayor o menor habilidad del esperma para enfrentarse a los procesos redox, la capacidad de resistencia a infecciones, el nivel de afectación de los individuos por la polución, el régimen alimenticio y un largo etcétera, es prácticamente imposible encontrar situaciones –en este caso sujetos– que se les suponga con el suficiente grado de homogeneidad en los factores que inciden en la producción de espermatozoides, para que los resultados obtenidos sobre la fertilidad sean comparables. Adicionalmente, cada uno de estos factores puede tener un efecto bien unilateral sobre la calidad del ADN en el espermatozoide o bien actuando en sinergia. Hecho que complica mucho más la situación y genera toda suerte de situaciones en las que enfrentar a la FAE frente a la fertilidad. En el presente trabajo, se quiere llamar la atención acerca de este aspecto general utilizando un modelo experimental que demuestra cómo el plasma seminal procedente de donantes puede influir de forma distinta sobre un parámetro de eficacia seminal, como la calidad que el ADN mantiene en los espermatozoides.
Normalmente, en los laboratorios de reproducción asistida humana, los espermatozoides, tras la eyaculación, se mantienen en el plasma seminal y éste se capacita posteriormente para ser utilizado en técnicas de reproducción asistida. El proceso incluye varios pasos que, básicamente, están encaminados a la eliminación del plasma seminal y su sustitución por un ambiente homogéneo (diluyente/medio de cultivo) en el que el semen es mucho más estable y nos permite, por ejemplo, realizar procesos de coincubación semenoocito durante varias horas para realizar una fertilización in vitro (FIV)6,7. La metodología para la capacitación, si bien varía entre laboratorios, la pauta común a todos ellos, es la del cambio de temperatura que experimenta el espermatozoide dado que cuando el espermatozoide se mantiene en el plasma seminal se encuentra a temperatura ambiente, mientras que el proceso de capacitación se recupera los 37 ºC.
Nuestro grupo de trabajo ha demostrado recientemente que el proceso de la FAE no sólo no es un proceso estático y fruto de cuyo análisis se le pueda asignar a cada individuo un valor inamovible para los valores de fragmentación, todo lo contrario, es un proceso dinámico y muy correlacionado con el tiempo que transcurre desde el momento de la eyaculación. El resultado es que hay una tendencia hacia un aumento del ADN dañado y en espacios de tiempo relativamente cortos. En determinados donantes se ha podido comprobar que los valores de fragmentación en espermatozoides descongelados de donantes con fertilidad probada pueden llegar a duplicarse tras 2 h de incubación a 37 ºC8,9. La tendencia hacia un incremento más o menos rápido es un comportamiento común en otros mamíferos9,10.
El objetivo del presente trabajo es analizar el comportamiento que presenta la dinámica de la FAE en muestras de semen procedentes de un mismo eyaculado antes y después de la capacitación, en un intento de entender el efecto que juega el plasma seminal en este proceso. La hipótesis de partida asume que habrán mayores diferencias en la dinámica de la FAE entre las muestras de semen antes de la capacitación dado que los individuos son distintos y las condiciones fisiológicas de su plasma seminal también lo serán, mientras que tras la capacitación, la tendencia hacia el incremento esperado será más homogénea debido a que se ha generado un medio idéntico para el mantenimiento de los espermatozoides.
MATERIAL Y MÉTODOS
El estudio se ha llevado a cabo analizando 5 muestras seminales de donantes, procedentes del banco de semen de la Clínica Tambre (Madrid, España); en to-dos los casos se mantuvo una abstinencia de 3 a 5 días. De estas muestras se ha estudiado la FAE en 2 situaciones experimentales distintas: a) muestra de semen en fresco y analizada en su valor basal de fragmentación (T0) después de que la muestra hubiera licuado, y b) muestra criopreservada durante 24 h, descongelada y capacitada mediante la utilización de un gradiente de densidad. El modelo experimental que se ha seguido consistió en mantener las muestras de semen fresco (con el plasma seminal correspondiente de cada individuo) a temperatura ambiente. En el caso de las muestras seminales capacitadas, éstas se incubaron a 37 ºC tras su capacitación. El diseño del experimento debería cubrir 2 objetivos: a) analizar la respuesta dinámica de la fragmentación cuando una muestra de semen se mantiene a temperatura ambiente y sin capacitar, y b) analizar la respuesta dinámica de la fragmentación tras capacitación e incremento de temperatura. El sistema experimental trata de emular, en parte, las condiciones en las que se maneja el semen normalmente, si bien los tiempos de incubación se forzaron hasta que se produjo la fragmentación total de la muestra. En ambos casos se realizó un estudio dinámico de la fragmentación tomando muestras de semen desde el tiempo basal hasta un máximo de 72 h. Para el estudio de la dinámica de fragmentación del ADN se han obtenido alícuotas a tiempo 0 (T0), 30 min (T30), 1,5 h (T1,5 ), 4,5 h (T4,5) , 6 h (T6), 24 h (T24), 48 h (T48) y 72 h (T72).
De cada muestra de semen obtenida en fresco se utilizó 1 ml que se distribuyó en 2 lotes. Uno se mantuvo a temperatura ambiente y en ausencia de luz, y el otro se criopreservó en nitrógeno líquido y posteriormente se descongeló en un tubo de fondo cónico de vidrio estéril en un baño a 37 ºC durante 5 min. La muestra se capacitó mediante la técnica de gradientes en densidad y se incubó en una estufa a 37 ºC y con una tensión de CO2 de un 5%, también en ausencia de luz. La valoración de la fragmentación se realizó de forma paralela y se recogieron submuestras de cada lote de 30 µl a los tiempos anteriormente mencionados.
La determinación de la fragmentación del ADN, tanto en semen fresco como en el capacitado, se realizó mediante la técnica sperm chromatin dispersión (SCD) (Halosperm; Halotech-DNA S.L., Madrid, España). Las muestras de semen, para su análisis con Halosperm, se diluyeron hasta alcanzar una concentración de entre 5 y 10 millones de espermatozoides/ml. Las muestras procesadas con Halosperm se tiñeron para ser visualizadas con microscopia de campo claro utilizando como colorante Diff-Quick. El conteo se realizó en 300 espermatozoides utilizando un microscopio motorizado Leica DMLB que elegía los campos en un microscopio al azar según un movimiento de coordenadas predefinido. Los datos se procesaron en Excell (Microsoft, Estados Unidos) y los análisis estadísticos se realizaron con Stat-Graphics Plus 5.1 (Academic Enterprise, StatPoint Inc., Herndon, Virginia, Estados Unidos).
RESULTADOS
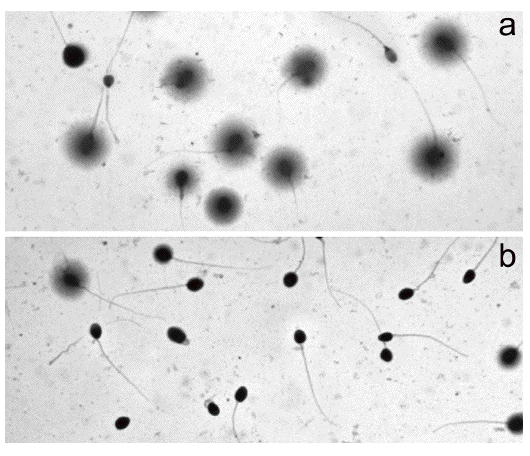
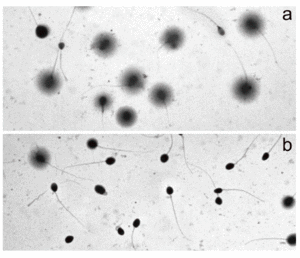
De acuerdo con la morfología de halos que genera Halosperm tras tinción para microscopia de campo claro, la identificación y discriminación de los espermatozoides que contienen ADN fragmentado (presencia de halo de dispersión de la cromatina) de los que lo presentan fragmentado es evidente (fig. 1A). De hecho, a tiempos cortos de incubación, la mayoría de los espermatozoides muestran un halo de dispersión (fig. 1A), mientras que éste desaparece cuando los tiempos de incubación se maximizan (fig. 1B).
Figura 1. Espermatozoides tratados con Halosperm tras tinción con Diff-Quick. A) Muestra seminal procesada a T0, en la que se observa que prácticamente todos los espermatozoides muestran un halo de dispersión de la cromatina y que se relacionan con espermatozoides con ADN no fragmentado. B) Muestra seminal procesada a T72, en la que se observa que prácticamente todos los espermatozoides no muestran un halo de dispersión y que se relacionan con espermatozoides con ADN fragmentado.
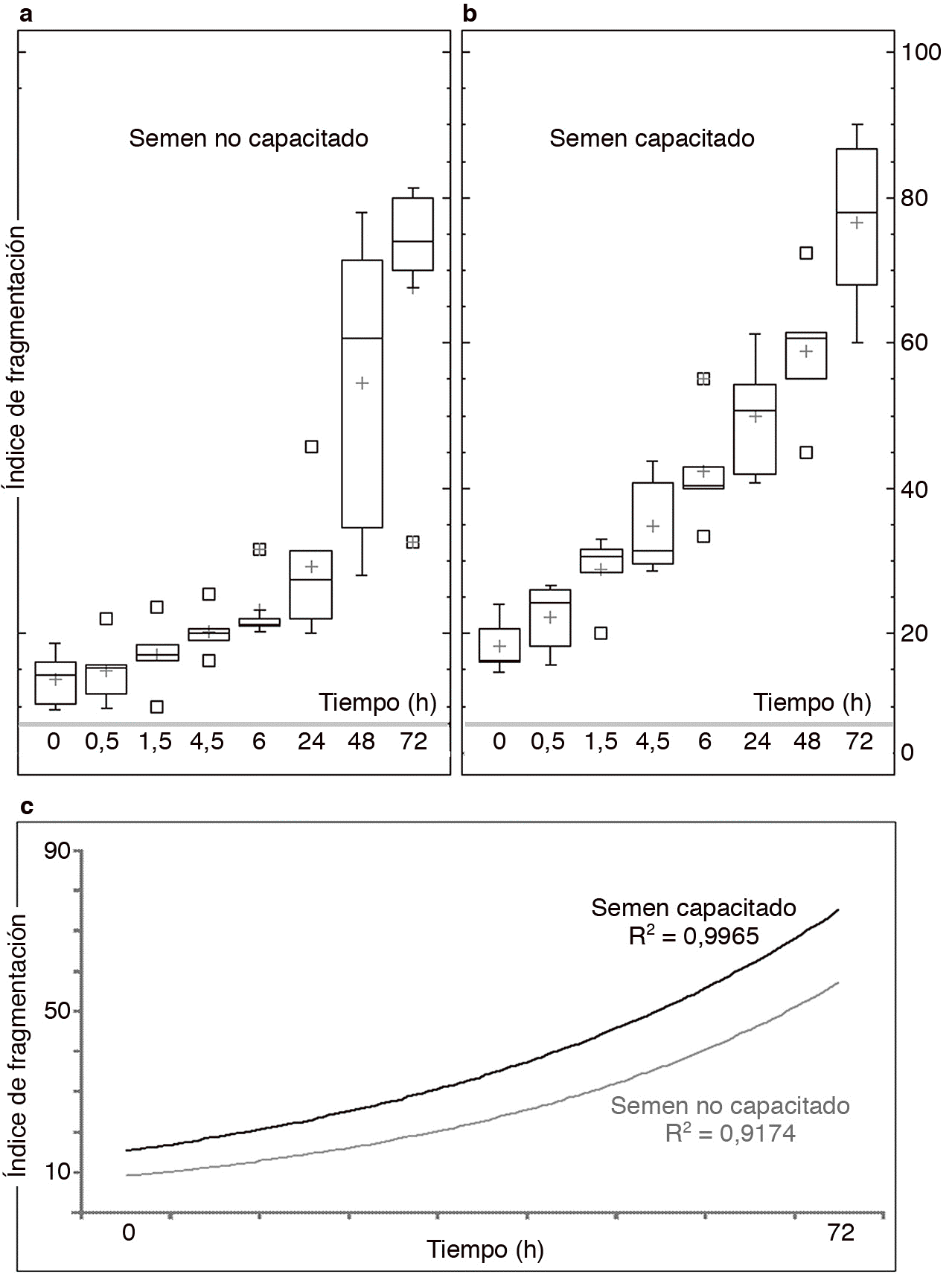
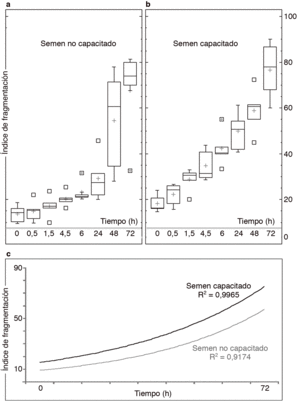
Los resultados del análisis dinámico de la fragmentación del ADN en los 5 donantes estudiados muestran una clara tendencia hacia el incremento de la fragmentación en todos los casos (fig. 2A y B). Las medias de los índices de fragmentación estimadas para los 2 grupos que se establecen al inicio del experimento (T0) son distintas (no capacitados 13,7 ± 4,3; capacitados 18,3 ± 3,2). Iniciado el proceso de lectura y determinado el valor basal de fragmentación, el proceso de degradación de la cadena de ADN es continuo, y transcurridas 72 h de incubación prácticamente todos los espermatozoides tienen afectado su ADN (fig. 1). Si bien una incubación llevada hasta 72 h no tiene ningún sentido en ART, dado que se supone que la muestra de semen debería estar afectada en este y en otros parámetros, en el presente experimento se utilizó esta medida para analizar la longevidad comparada de la muestra para el carácter analizado. Se pueden obtener algunas conclusiones interesantes de esta comparación, como que en ambas situaciones de incubación algunos donantes presentan una muestra seminal de características más longevas y mantiene índices de fragmentación menos elevados que otros donantes (la distribución de valores para la estadística descriptiva se muestra en la figura 2). Es interesante resaltar que en ambas situaciones experimentales hay una tendencia de tipo exponencial hacia el incremento de los índices de fragmentación con unos ajustes para R2 muy elevados (fig. 2C). La variación de los índices de fragmentación explica un porcentaje muy alto de la variación total observada en los índices de fragmentación (no capacitados, R2 = 0,91; capacitados, R2 = 0,99). En el caso del semen capacitado los valores de la media son ligeramente más elevados en todos los tiempos de incubación. Sin embargo, los datos obtenidos muestran un mejor ajuste final, con valores para R2 superiores. Este hecho indica que los valores de ascenso del índice de fragmentación están más agrupados en el caso del semen capacitado que en el no capacitado. Hecho que se observa en la fura 2 al comparar los diagramas de cajas y bigotes o en el resumen de las tendencias que se muestra en la figura 3F.
Figura 2. Estadística descriptiva utilizando una representación de cajas y bigotes en la que se muestra la distribución de los índices de fragmentación para los 5 individuos analizados en muestras de semen no capacitado (A) y capacitado (B). C) Curvas de ajuste exponencial y los valores de R2 obtenido sobre las medias de los índices de fragmentación derivadas para los valores acumulados en cada tiempo de incubación.
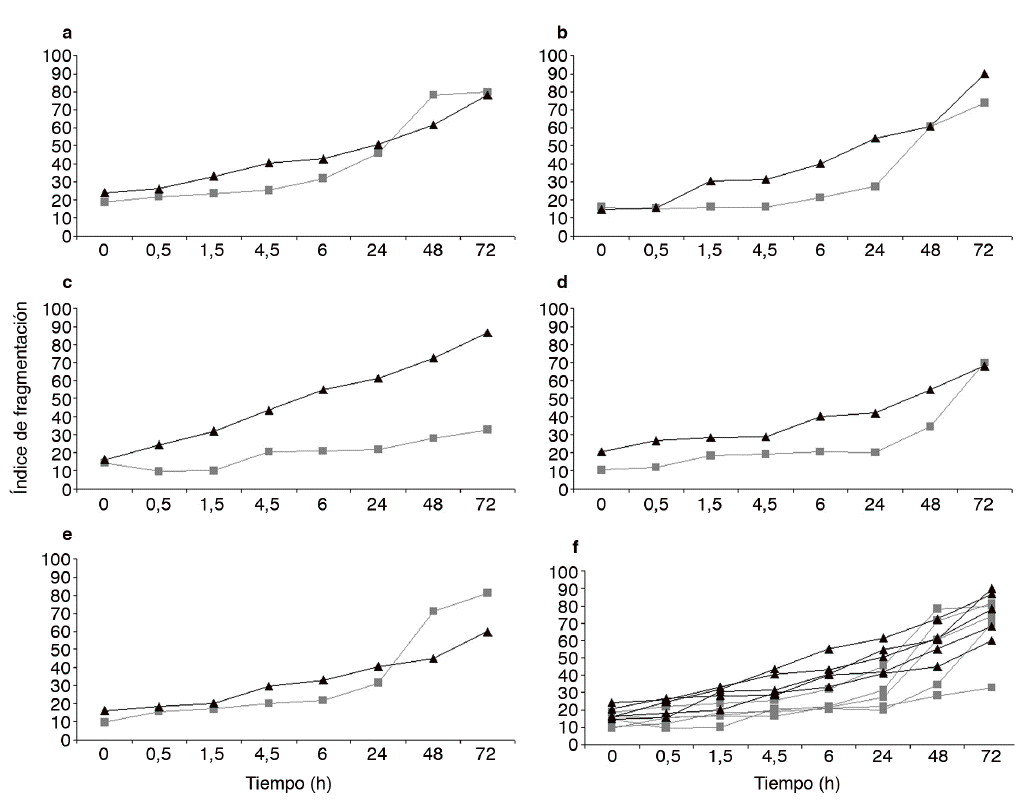
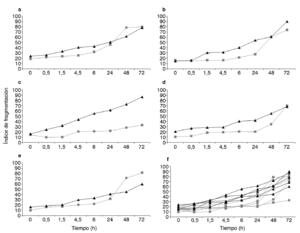
Figura 3. Representación de los distintos valores para los índices de fragmentación obtenidos en cada uno de los individuos analizados (AE). Nótese que en todos los casos el semen capacitado (líneas negras) ofrece valores superiores a los obtenidos con el semen no capacitado (líneas grises). F) Valores tanto para los capacitados como para los no capacitados. Nótese que las líneas correspondientes a la dinámica del semen capacitado están mucho más agrupadas que las obtenidas con el semen no capacitado.
Los datos registrados para la dinámica de la fragmentación pre y poscapacitación en cada uno de los donantes se recogen el la figura 3 y en todos los casos se observa que la tendencia hacia el incremento de la fragmentación es ligeramente superior tras el proceso de capacitación.
DISCUSIÓN
Uno de las conclusiones que se desprenden del presente trabajo es que los valores de fragmentación basales (estimados a T0) y procedentes de muestras idénticas, son diferentes y más elevados en las muestras de semen después de ser capacitadas. Aun tratándose de una muestra pequeña como la que se incluye en este trabajo, la tendencia se observa en todos los casos y en termino medio supone un incremento de 5 puntos lineales en el índice de fragmentación. Este incremento del daño en el ADN se deriva directamente del manejo de las muestras para su capacitación.
Por otra parte, es interesante resaltar que el comportamiento dinámico del índice de fragmentación muestra unos valores de R2 para un ajuste de tipo exponencial menores en las muestras no capacitadas que en las capacitadas; lo que refleja una mayor tendencia a la dispersión de los datos en cada fracción de tiempo en la que se obtuvieron medidas de la fragmentación. Sin embargo, cuando el plasma seminal se sustituye por un diluyente, los valores de R2 son más altos, lo que indica un mayor ajuste en la curva resultante. Es decir, el hecho que la dinámica de la fragmentación de las muestras capacitadas sea más homogénea entre donantes distintos que el observado en las muestras no capacitadas, indica un posible efecto del plasma seminal sobre el control o el disparo del proceso de fragmentación del ADN. En relación con otros parámetros de calidad seminal, se ha comprobado que la presencia o las concentraciones de determinados oligoelementos como el aluminio, el cinc, el magnesio o el plomo en el plasma seminal son fuertes condicionantes de la calidad seminal11,12. Por otra parte, es bien conocida la relación entre la capacidad antioxidante del plasma seminal y la capacidad fertilizante13. De hecho, se han utilizado elementos antioxidates tipo vitaminas C y E14 tratando de paliar este efecto dañino de los radicales libres que se pueden generar y que dañan, en primera instancia, los lípidos de la membrana15 y posteriormente el ADN16 . Si bien, y como era de esperar, los resultados del efecto que ejercen este tipo de sustancias sobre los parámetros de calidad seminal son dispares, la explicación también reside en las diferencias de composición que presenta el plasma seminal de individuos distintos. Por último, cabe señalar que la calidad de los espermatozoides y su capacidad fertilizante son modulables17, hecho que concuerda plenamente con los resultados obtenidos en el presente experimento. Por lo tanto, los resultados obtenidos muestran que el plasma seminal de cada uno de los individuos es determinante en el momento de generar una dinámica característica de fragmentación para ese individuo. Esta tendencia varía cuando ese mismo semen se capacita y globalmente tiende a ser más homogéneo entre los distintos individuos cuando el medio en que se conservan los espermatozoides se homogeneiza. Esta tendencia a la homogeneización en la dinámica de la fragmentación tras la capacitación, es el resultado de la eliminación del plasma seminal, que según estos resultados, es claramente distinto y propio de cada individuo y canaliza un ritmo particular para cada individuo en lo que se refiere al daño que se genera en el ADN. La eliminación del plasma seminal conlleva, por ejemplo, la eliminación de posibles radicales libres que puedan afectar a los espermatozoides y adicionalmente hay una clara inhibición del crecimiento bacteriano. De hecho en 2 de las muestras analizadas, tras 24 h incubación, en semen fresco mostró trazas de crecimiento de algunas bacterias.
Los resultados presentados en este trabajo indican que el aumento de los índices de fragmentación se relaciona con el tiempo de incubación que transcurre desde que se obtiene la muestra seminal, y los resultados obtenidos en las 2 situaciones experimentales ponen de relieve la necesidad de procesar y utilizar las muestras tan pronto como sea posible. Una mala práctica en este sentido tiene un efecto negativo en la fertilidad cuando las muestras se utilizan para FIV y la inyección intracitoplasmática de espematozoides7,18. De acuerdo con los resultados obtenidos resulta casi imperativo que esto sea un práctica corriente dado que, adicionalmente, la fecundación no se produce inmediatamente después de la inseminación. De hecho, en algunos mamíferos, la ovulación tiene lugar generalmente entre 4 y 10 h después de la inseminación19,20 y por lo tanto la sincronización entre el momento de ovulación y el momento de la inseminación con muestras seminales procesadas de forma rápida, es muy importante. Por ello, las características del semen consideradas como suficientes para la fertilización en el inicio del transporte de los espermatozoides en el tracto femenino, pueden variar rápidamente entre la inseminación y la fertilización y, de algún modo, hay que ser conscientes de la longevidad de las muestras que manejamos para poder ser más efectivos en la fertilización en el momento en que el espermatozoide llegue al oocito.
Otro aspecto de mucho interés y que se está analizando en este momento son las implicaciones que tie-ne la congelación en las posibles variaciones de la fragmentación8,21, dado que los espermatozoides son muy sensibles a las variaciones en su régimen normal de temperatura. Este aspecto es de enorme interés y tendrá que ser analizado con un diseño experimental propio, pero parece indicar que si bien los valores basales de FAE no se ven afectados por el hecho propio de la congelación, y los índices de fragmentación antes y después de congelación serían similares, su dinámica de fragmentación sí que resulta afectada. Hecho que se ha constatado en otras especies de mamíferos como el caballo21 o los carneros10. En este momento se están generando los datos que nos ofrecerán una visión mucho más completa del papel que juega el plasma seminal, las variaciones de temperatura y el efecto de la criopreservación sobre las variaciones en la dinámica de la fragmentación.