Describir y comparar las alteraciones ultraestructurales que puede provocar la inmovilización espermática previa a la microinyección intracitoplasmática de espermatozoides, así como los daños en el ADN y el estado del acrosoma en espermatozoides de sujetos teratozoospérmicos y normozoospérmicos.
Material y métodosSe utilizaron 15 muestras seminales procedentes de donantes normozoospérmicos y 20 muestras de pacientes teratozoospérmicos del Instituto Bernabeu de Alicante. Para el estudio con microscopia electrónica de transmisión se utilizaron ovocitos humanos como receptáculo de los espermatozoides. La fragmentación del ADN se valoró mediante la técnica TUNEL, y el estado del acrosoma, utilizando la lectina Pisum sativum conjugada con FITC. El análisis estadístico entre los diferentes grupos se realizó mediante un test ANOVA.
ResultadosLos resultados mostraron que, tras la inmovilización, los espermatozoides procedentes tanto de sujetos normozoospérmicos como de teratozoospérmicos sufrieron las mismas alteraciones ultraestructurales a nivel de la membrana plasmática y acrosomal. Tras valorar la fragmentación de ADN mediante TUNEL observamos que en los espermatozoides inmovilizados el porcentaje de espermatozoides con ADN fragmentado era similar en ambos grupos (normozoospérmicos vs. teratozoospérmicos). En cambio, el porcentaje de espermatozoides con reacción acrosómica fue significativamente más elevado en los inmovilizados que en el grupo control, tanto en los sujetos normozoospérmicos como teratozoospérmicos.
ConclusiónLos resultados de este estudio evidencian que los daños estructurales provocados por la inmovilización, en espermatozoides procedentes de sujetos normozoospérmicos y teratozoospérmicos, son independientes de la morfología espermática. Y además, dicho proceso no provoca fragmentación del ADN. Sin embargo, la inmovilización tanto en el grupo de los sujetos normozoospérmicos como teratozoospérmicos provoca una inducción mecánica de la reacción acrosómica.
To describe and compare the ultrastructural alterations, DNA fragmentation and acrosome status that could cause sperm immobilisation prior to intracytoplasmic sperm injection, in samples from normozoospermic and teratozoospermic males.
Material and methodsFor this study we used 15 sperm samples from consenting normozoospermic donors and 20 samples from teratozoospermic males, submitted for assisted reproduction at Instituto Bernabeu of Alicante. To assess the ultrastructural alterations induced by immobilisation, human oocytes were used as containers for spermatozoa and then observed by transmission electron microscopy. DNA fragmentation was assessed using TUNEL and acrosome status using fluorescein isothiocyanate-conjugated Pisum sativum agglutinin. The control group consisted of sperm without manipulation. Statistical analysis between groups was performed by ANOVA.
ResultsThe results showed that immobilised spermatozoa presented the same damage in plasma and acrosomal membranes in the samples from both normozoospermic and teratozoospermic subjects. After assessing DNA fragmentation in the cells from normozoospermic and teratozoospermic patients by the TUNEL technique, we observed that the percentage of spermatozoa with DNA fragmentation did not increase in the immobilised group compared with the control group. However, the percentage of acrosome-reacted sperm was significantly greater in immobilised spermatozoa than in the control group in both normozoospermic and teratozoospermic males.
ConclusionThe results of this study show that the structural damage caused by immobilisation in spermatozoa from teratozoospermic and normozoospermic males is independent of sperm morphology. In addition, the immobilisation does not cause DNA fragmentation. However, the percentage of acrosome-reacted sperm was greater in the immobilised group than in the control group, in both normozoospermic and teratozoospermic subjects.
La esterilidad afecta al 10-15% de las parejas1, siendo el factor masculino responsable en aproximadamente el 50% de los casos2. La incorporación de la microinyección intracitoplasmática de espermatozoides (ICSI)3,4 como técnica de rutina supuso una enorme revolución en el campo de la medicina reproductiva, al solucionar la mayor parte de las causas de esterilidad debidas a un factor masculino.
Actualmente, la ICSI es la técnica de reproducción asistida por excelencia, empleada en la mayoría de los tratamientos de infertilidad por todo el mundo. No obstante, y a pesar de que es una técnica de reproducción más invasiva que la fecundación in vitro convencional y que la micromanipulación de los gametos, podría inducir determinados riesgos genéticos y epigenéticos5. Su uso se está efectuando en muchas clínicas de reproducción asistida de manera indiscriminada. Entre los años 1999 y 2004 el empleo de la ICSI se incrementó de forma drástica pasando de un 11,0 a un 57,5%, mientras que el porcentaje de parejas con esterilidad atribuida a un factor masculino se mantuvo estable6,7.
La inmovilización del espermatozoide, previa a la ICSI, es un paso esencial para que ocurra la fecundación8,9, ya que permite la desestabilización y permeabilización de la membrana plasmática10,11. Algunos autores han observado que la inmovilización espermática y la permeabilización de la membrana plasmática mejoran los porcentajes de fecundación12,13, ya que esta manipulación facilita la descondensación nuclear tras la inyección del espermatozoide9, así como la liberación del hipotético factor espermático soluble, que induce la activación del ovocito14. La inmovilización espermática se realiza, generalmente, mediante procedimientos mecánicos o físicos. Sin embargo, la técnica más utilizada en ICSI suele ser la inmovilización mecánica conocida como convencional o squeezing12,15–17, que consiste en dar un golpe, con la pipeta de microinyección, en el flagelo del espermatozoide. En este sentido, diversos estudios muestran que la inmovilización mecánica es una técnica invasiva, ya que contacta directamente con el espermatozoide aplicando la fuerza sobre la pieza intermedia, lo que podría generar importantes alteraciones a nivel celular. Nosotros hemos descrito algunas de estas alteraciones producidas en los espermatozoides humanos, inmovilizados mediante la técnica convencional o squeezing, utilizando la microscopia electrónica de barrido y la microscopia confocal18.
Está demostrado que en casos en los que existe un factor masculino severo, azoospermia con espermatozoides de biopsia testicular, criptozoospermia, oligozoospermia, astenozoospermia, teratozoospermia, con la ICSI se obtienen muy buenos resultados19. En todas estas afecciones, la inmovilización de los espermatozoides, previa a la ICSI, se realiza utilizando la misma metodología, sin tener en cuenta las características citomorfológicas de las muestras. En base a esto, el objetivo principal de este trabajo fue describir los daños ultraestructurales, fragmentación del ADN y estado del acrosoma que la inmovilización espermática, previa a la ICSI, provoca en los espermatozoides procedentes de sujetos teratozoospérmicos y normozoospérmicos. Pero uno de los inconvenientes que nos encontramos a la hora de estudiar pocas células con el microscopio electrónico de transmisión (MET) es la forma de visualizarlos. Para ello, y de forma novedosa, en este trabajo empleamos ovocitos humanos como receptáculos de los espermatozoides inmovilizados para asegurarnos su visualización al MET.
Material y métodosLas muestras de semen que se incluyeron en el estudio se obtuvieron de 15 donantes voluntarios normozoospérmicos y de 20 pacientes teratozoospérmicos, del Instituto Bernabeu (Alicante, España). Las muestras fueron obtenidas tras 3-5 días de abstinencia, y el diagnóstico de las mismas fue evaluado siguiendo las normas de la OMS. Todos los pacientes firmaron previamente el consentimiento informado.
Para cada muestra se establecieron 2 grupos de entre 100 y 200 espermatozoides móviles, capacitados mediante la técnica de Swim-up y ajustados a una concentración final de 3×106 espermatozoides/mL. Los espermatozoides fueron inmovilizados mediante squeezing en su pieza principal del flagelo (grupo inmovilizados). El grupo control consistió en espermatozoides móviles, que no habían sido manipulados, pero hay que resaltar que estuvieron a las mismas condiciones experimentales (tiempo, temperatura) que los espermatozoides del grupo anterior durante el proceso de inmovilización.
Para poder visualizar los espermatozoides en el MET se usaron como receptáculos ovocitos humanos, inmaduros o de fallos de fecundación in vitro (los cuales no presentaron evidencias de pronúcleos después de las 48h de la fecundación). Los ovocitos se obtuvieron de mujeres incluidas en el programa de reproducción asistida del Instituto Bernabeu de Alicante. Todas las pacientes firmaron previamente el consentimiento informado.
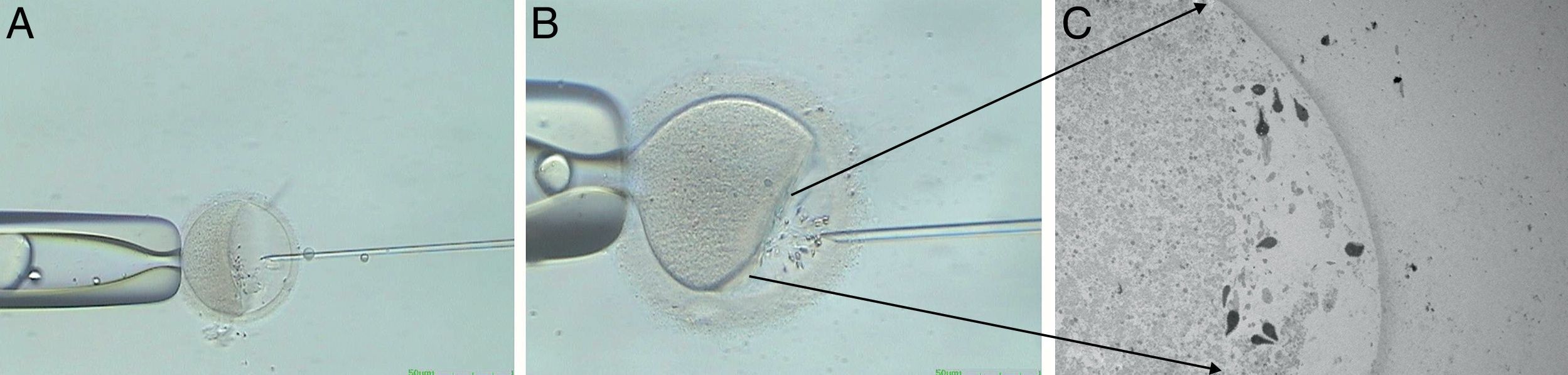
Aproximadamente 200 espermatozoides de cada muestra, previamente inmovilizados, fueron aspirados en una pipeta de ICSI y microinyectados en el espacio perivitelino de los ovocitos. El mismo número de espermatozoides del grupo control fueron inyectados en los ovocitos de la misma forma, pero sin la manipulación previa. Dicho procedimiento puede observarse en la figura 1.
Procedimiento experimental donde se ilustra la microinyección de los espermatozoides en el espacio perivitelino de los ovocitos humanos. A y B) Microfotografías de microscopia óptica de ovocito humano metafase i con espermatozoides en el espacio perivitelino, x50 y x100. C) Microfotografía de microscopia electrónica de transmisión de ovocito metafase i con espermatozoides en espacio perivitelino, x970.
Después de la inyección, los ovocitos fueron fijados al 2% de glutaraldehído e incluidos en resina LR White™. Los bloques fueron cortados en un ultramicrotomo Leica Ultracut UCT® (Leica Mickrosysteme GmbH, Viena, Austria), con cuchilla de diamante. Las rejillas fueron teñidas con acetato de uranilo y examinadas con MET (Philips Tecnai™ 12, Ámsterdam, Países Bajos).
El estado de fragmentación del ADN espermático fue evaluado mediante la técnica TUNEL20 (In Situ Cell Death Detection Kit, Fluorescein, Roche Biochemicals, Mannheim, Alemania). El porcentaje de espermatozoides capacitados con fragmentación de ADN se determinó usando un microscopio confocal (Leica DM IRBE2, Solms, Alemania), empleando un objetivo con aceite de inmersión 1000X. Cada muestra fue analizada por duplicado y en cada experimento se realizaron controles positivos y negativos. Los resultados se expresaron como porcentajes (%) de espermatozoides con fragmentación de ADN.
Para la valoración de la reacción acrosómica, los espermatozoides fueron fijados y permeabilizados en metanol. A continuación se incubaron durante 30min con la lectina Pisum sativum conjugada con FITC (PSA-FITC; Sigma Chemical Company, St. Louis, MO, EE. UU.), tras realizar 3 lavados en PBS, las preparaciones se montaron con el medio VECTASHIELD® (Vector Laboratories, Inc., Burlingame, CA, EE. UU.) y fueron observadas con un microscopio confocal (Leica DM IRBE2). Se contaron 200 células en cada uno de los casos y se establecieron 2 patrones: espermatozoides reaccionados y espermatozoides sin reaccionar21.
Una vez comprobado que los resultados obtenidos se ajustaban a una distribución normal se realizó un análisis de la varianza para comparar las posibles diferencias. Todos los análisis fueron realizados utilizando el paquete estadístico SPSS® 15.0 (SPSS Inc., Chicago, IL, EE. UU.).
ResultadosAlteraciones ultraestructurales observadas con microscopio electrónico de transmisiónDe cada uno de los casos, se introdujeron entre 100-200 espermatozoides en el interior de los ovocitos; al procesarlos y visualizarlos al MET, la media de espermatozoides analizados fue de entre 50-60 células.
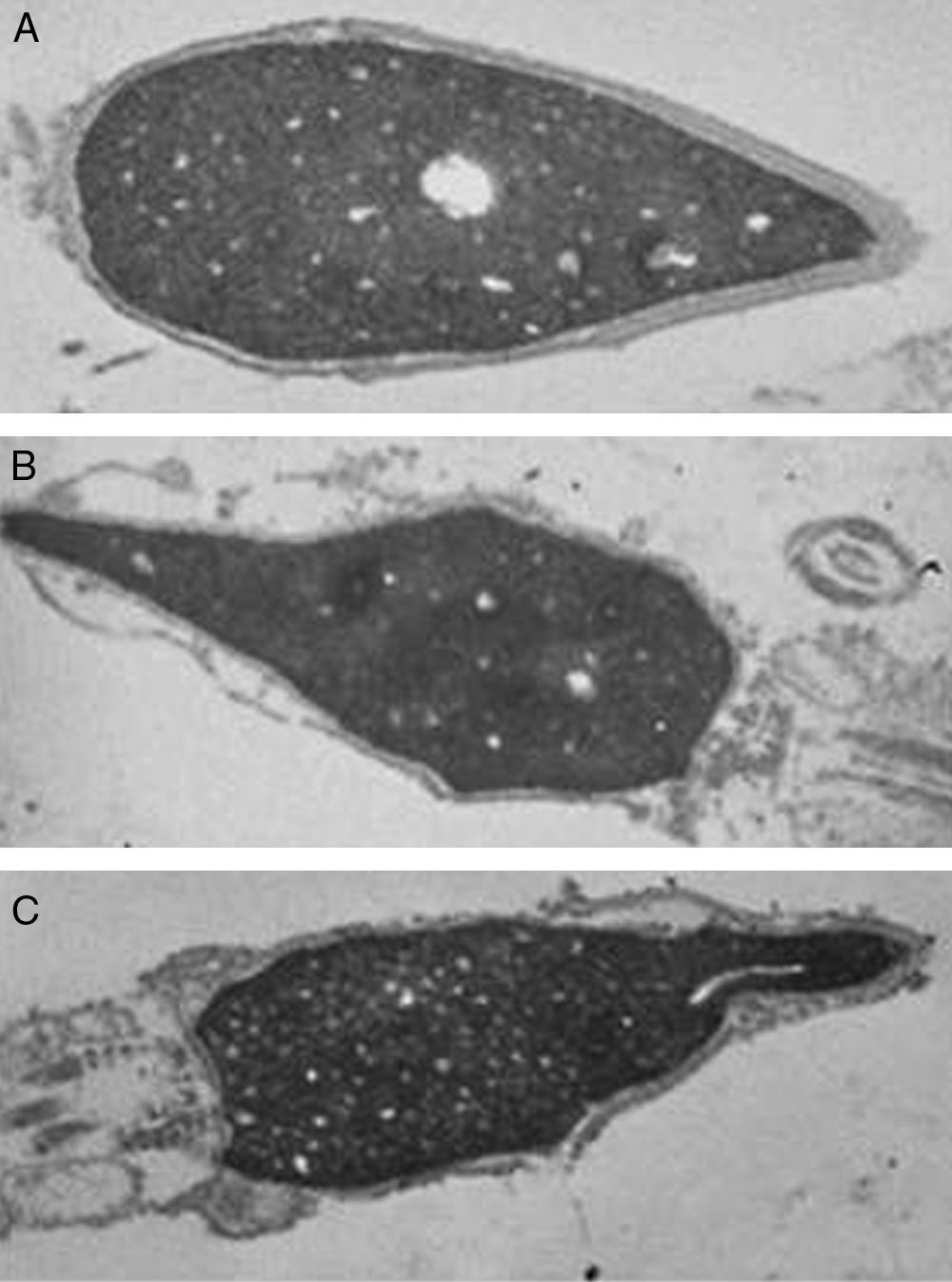
En el grupo control, tanto en sujetos normozoospérmicos como teratozoospérmicos, en el 100% de las células espermáticas analizadas no se observaron alteraciones a nivel ultraestructural. Tal y como se muestra en la figura 2A, la cabeza espermática de dichos gametos presentó la membrana plasmática íntegra, el acrosoma intacto, una envoltura nuclear normal y un núcleo sin fragmentación aparente. En las secciones donde pudimos visualizar la pieza intermedia, comprobamos que su estructura no presentaba ninguna alteración. De la misma forma, a nivel del axonema pudimos observar que la organización de los microtúbulos fue correcta, al igual que la disposición de la vaina fibrosa.
Las alteraciones ultraestructurales provocadas por la inmovilización de los espermatozoides procedentes tanto de los sujetos normozoospérmicos como teratozoospérmicos fueron las mismas. El 90% de las células estudiadas presentaron daños a nivel de la membrana plasmática, así como de las membranas acrosomales (fig. 2B y C). La mayoría de estos gametos presentaron acrosomas alterados. A nivel del núcleo, en la disposición de los microtúbulos y/o fibras densas, no se observaron alteraciones. Sin embargo, algunas células espermáticas sí mostraron una disposición anormal de las mitocondrias en la pieza intermedia, aunque el porcentaje de células con este tipo de alteración no fue significativo.
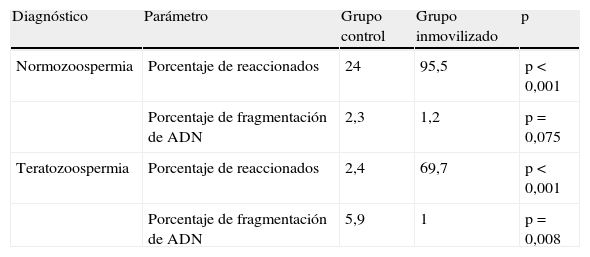
Fragmentación del ácido desoxirribonucleicoCon el fin de comprobar a nivel molecular si la inmovilización provoca la fragmentación del ADN, empleamos la técnica TUNEL. Observamos que en el caso de los normozoospérmicos, el porcentaje de espermatozoides con ADN fragmentado fue del 2,3% en el grupo control y del 1,2% en el grupo de espermatozoides inmovilizados. Al realizar el análisis estadístico, no encontramos diferencias significativas entre ambos grupos. Sin embargo, en los sujetos teratozoospérmicos el grupo control mostró un porcentaje de espermatozoides con fragmentación de ADN significativamente superior al observado en el grupo de espermatozoides inmovilizados (5,9 y 1%, respectivamente; p=0,008) (tabla 1).
Medias del porcentaje de espermatozoides con fragmentación del ácido desoxirribonucleico y espermatozoides reaccionados en sujetos normozoospérmicos y teratozoospérmicos
| Diagnóstico | Parámetro | Grupo control | Grupo inmovilizado | p |
| Normozoospermia | Porcentaje de reaccionados | 24 | 95,5 | p<0,001 |
| Porcentaje de fragmentación de ADN | 2,3 | 1,2 | p=0,075 | |
| Teratozoospermia | Porcentaje de reaccionados | 2,4 | 69,7 | p<0,001 |
| Porcentaje de fragmentación de ADN | 5,9 | 1 | p=0,008 |
En cuanto al acrosoma, en los sujetos con teratozoospermia se observan diferencias significativas en el porcentaje de espermatozoides que habían sufrido reacción acrosómica entre el grupo control (2,4%) y el grupo de espermatozoides inmovilizados (69,7%). En estudios previos de nuestro grupo17, encontramos diferencias significativas entre el grupo control y el grupo de espermatozoides inmovilizados en sujetos normozoospérmicos (24% y 95,5%, respectivamente) (tabla 1).
DiscusiónLa inmovilización espermática previa a la ICSI es necesaria para poder incrementar, de forma significativa, el porcentaje de fecundación9,13,22,23. Es importante conocer si los daños producidos tras la inmovilización espermática son más acusados en aquellas muestras que presenten alguna alteración citomorfológica, ya que actualmente este procedimiento se realiza utilizando la misma metodología en todos los casos. Entre las diferentes afecciones espermáticas, decidimos incluir en este estudio las muestras teratozoospérmicas, ya que parecen ser las muestras patológicas más vulnerables22,24. Estudios anteriores han mostrado que la inmovilización espermática puede causar alteraciones en las células espermáticas a nivel de la membrana plasmática, citoesqueleto y acrosoma en muestras normozoospérmicas18,25. En nuestro trabajo se comparan de forma novedosa las alteraciones a nivel ultraestructural que puede provocar la inmovilización previa a la ICSI en sujetos teratozoospérmicas frente a normozoospérmicos, concluyendo que los daños son similares en ambos grupos. Otra de las ventajas que ponemos de manifiesto es el poder utilizar la MET con un número relativamente bajo de células y empleando el espacio perivitelino de los ovocitos como receptáculos.
Del estudio mediante microscopia electrónica podemos concluir que uno de los orgánulos más afectados es el acrosoma. La mayoría de las células espermáticas a las que hemos sometido a inmovilización presentan el acrosoma alterado, lo cual se correlaciona perfectamente con los datos obtenidos de reacción acrosómica mediante el uso de la lectina PSA-FITC. Estos resultados confirman que la inmovilización induce la reacción acrosómica en los gametos de los sujetos teratozoospérmicos, pero si comparamos los resultados con los obtenidos por nuestro grupo en trabajos previos18, podemos ver que en el caso de los sujetos normozoospérmicos, la inmovilización induce la reacción acrosómica en un porcentaje mayor de células. Esto concuerda con resultados de otros autores, que encontraron una disminución del porcentaje de espermatozoides reaccionados, en presencia de zonas pelúcidas solubilizadas, al comparar sujetos normozoospérmicos y con teratozoospermia severa26.
A nivel ultraestructural, observamos que el proceso de inmovilización realizado previamente a la ICSI no parece inducir alteraciones a nivel del núcleo espermático, en ninguna de las muestras analizadas. Sin embargo, mediante la técnica TUNEL observamos que el porcentaje de espermatozoides con ADN fragmentado es mayor en el grupo control que en el grupo de inmovilizados, tanto en sujetos normozoospérmicos como teratozoospérmicos, siendo estas diferencias significativas en los sujetos con alteración de la morfología. Nuestros resultados del grupo control están en concordancia con los porcentajes mostrados previamente en otros estudios27–30. En uno de estos trabajos27, los autores encontraron valores de fragmentación de ADN por debajo del 4% en la mayoría de las muestras analizadas, tras la capacitación espermática. Aunque es conocido que el Swim-up selecciona los espermatozoides con mejor motilidad, morfológicamente normales y con menos daños a nivel del ADN31–33, en el caso de las muestras teratozoospérmicas, esta selección espermática puede ser menos eficaz, y por ello nosotros encontramos en estos casos diferencias significativas entre los espermatozoides del grupo control y los manipulados, ya que en estos últimos hemos realizado una segunda selección morfológica, por parte del micromanipulador, antes de realizar la inmovilización.
ConclusionesPor lo tanto, y coincidiendo con otros autores34, podemos afirmar que el proceso de inmovilización espermática previa a la ICSI, tanto en sujetos con parámetros seminales normales como en aquellos con alteración de la morfología espermática, no provoca fragmentación del ADN. Estos hallazgos reafirman que la cromatina espermática está altamente compactada gracias a la sustitución de las histonas por las protaminas y al incremento de los enlaces disulfuro, durante la espermiogénesis35.
Sin embargo, la inmovilización tanto en el grupo de los sujetos normozoospérmicos como teratozoospérmicos provoca una inducción mecánica de la reacción acrosómica y, por lo tanto, rotura de la membrana plasmática y acrosomal externa. Pudiendo este hecho favorecer la salida de factor(es) citosólico(s) del espermatozoide encargados de activar al ovocito36. Nuestros resultados por tanto revelan que los daños provocados por la inmovilización son independientes de las características seminales y además reafirman el éxito de la técnica ICSI en reproducción asistida.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónEste trabajo ha sido subvencionado por el proyecto de Investigación Emergente de la Universidad de Alicante (GRE08-P08) y el Vicerrectorado de Investigación de la Universidad de Alicante (VIGROB-137).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.