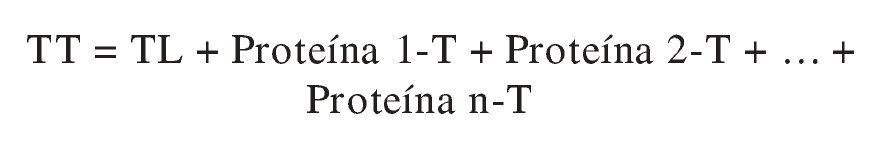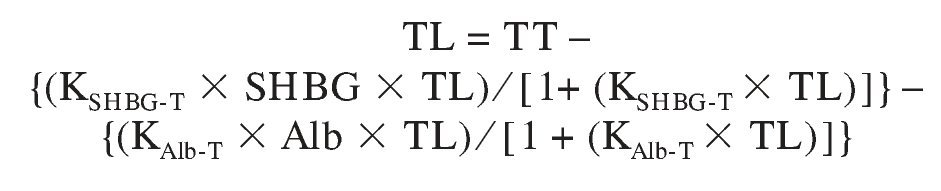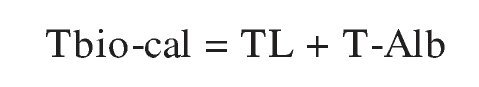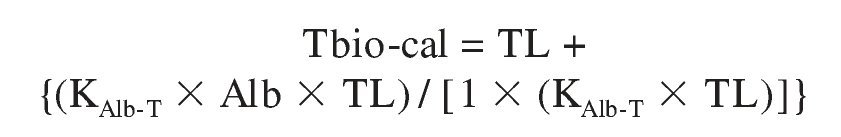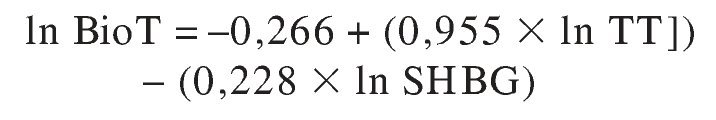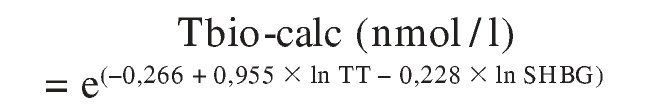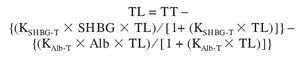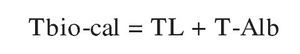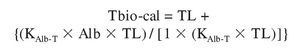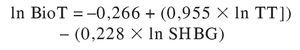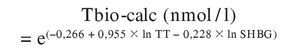INTRODUCCIÓN
La determinación fiable, y asequible a los laboratorios clínicos, de los valores plasmáticos de testosterona (T) tiene una demanda creciente tanto en el campo andrológico como en el ginecológico. En el primero, trasciende a su empleo tradicional en la confirmación diagnóstica y el seguimiento del tratamiento de los casos relativamente infrecuentes de hipogonadismo masculino clínicamente manifiesto en sujetos jóvenes. A ello se suma ahora el reconocimiento del mucho más común síndrome de déficit androgénico asociado al envejecimiento, como una entidad nosológica susceptible de ser aliviada mediante reemplazo hormonal con testosterona. Su diagnóstico y su eventual tratamiento se basan en la concurrencia de un conjunto de síntomas y signos clínicos indicativos con la constatación inequívoca de unos valores plasmáticos reducidos de testosterona o de sus fracciones funcionalmente activas1-3. Esto se debe a que sus manifestaciones clínicas consideradas más características son relativamente inespecíficas, comunes a diversos trastornos frecuentes en edades avanzadas, y la mayoría se basan en la apreciación subjetiva del paciente. Igualmente, la evaluación del tratamiento exige el control de los valores de T obtenidos con éste.
En la actualidad existe una variada oferta de técnicas analíticas empleadas por diversos laboratorios clínicos para medir valores plasmáticos de T. Sin embargo, no todas ellas tienen la misma validez. El propósito de este ensayo es revisar sucintamente los métodos disponibles para, basándose en las recomendaciones de diversas organizaciones internacionales reputadas, ofrecer al clínico una idea lo más clara posible de qué determinaciones se deben usar, y según qué pautas, en el diagnostico y el seguimiento del tratamiento del hipogonadismo masculino.
PRODUCCIÓN, MECANISMO DE ACCIÓN Y TRANSPORTE EN EL PLASMA DE LOS ANDRÓGENOS
La producción diaria de T en el varón joven es de unos 4-7 mg/día, de los que el 95% son secretados por las células de Leydig testiculares bajo el estímulo fundamental de la hormona luteinizante (LH). En varias especies se ha descrito una influencia moduladora de la respuesta de las células de Leydig a la LH por parte de numerosos péptidos circulantes (incluidas la hormona foliculostimulante [FSH] y el factor de crecimiento similar a la insulina 1 [IGF-1]) y señales paracrinas derivadas de los túbulos seminíferos (entre otros activina e inhibina B)4-5, si bien en el ser humano parece ser poco significativa en relación con el estímulo fundamental que proporciona la LH6. La corteza adrenal contribuye al valor de T circulante en los varones jóvenes con unos 0,5 mg secretados en forma de T o de precursores que se transforman en aquella a nivel periférico.
El mecanismo de acción de las hormonas esteroides y tiroideas más establecido y aceptado implica su difusión inespecífica, por su alta liposolubilidad, a través de las membranas celulares. Si en interior de las células encuentran receptores específicos a la hormona (es decir son "células diana") disponibles, se unen a ellos. El complejo hormona-receptor emigra entonces al núcleo donde modifica la expresión de determinados genes7. Un corolario de éste es la llamada "hipótesis de la hormona libre" (free hormone hypothesis) que propone que las concentraciones intracelulares de la hormona, y por tanto su actividad biológica, dependen de la concentración plasmática de la hormona en forma libre, más que de la unida a proteínas plasmáticas8. Esto es de especial relevancia cuando dicha unión a proteínas transportadoras se hace con gran afinidad. De ahí que se haya dedicado mucha investigación a caracterizar la cinética de dicho transporte9-12.
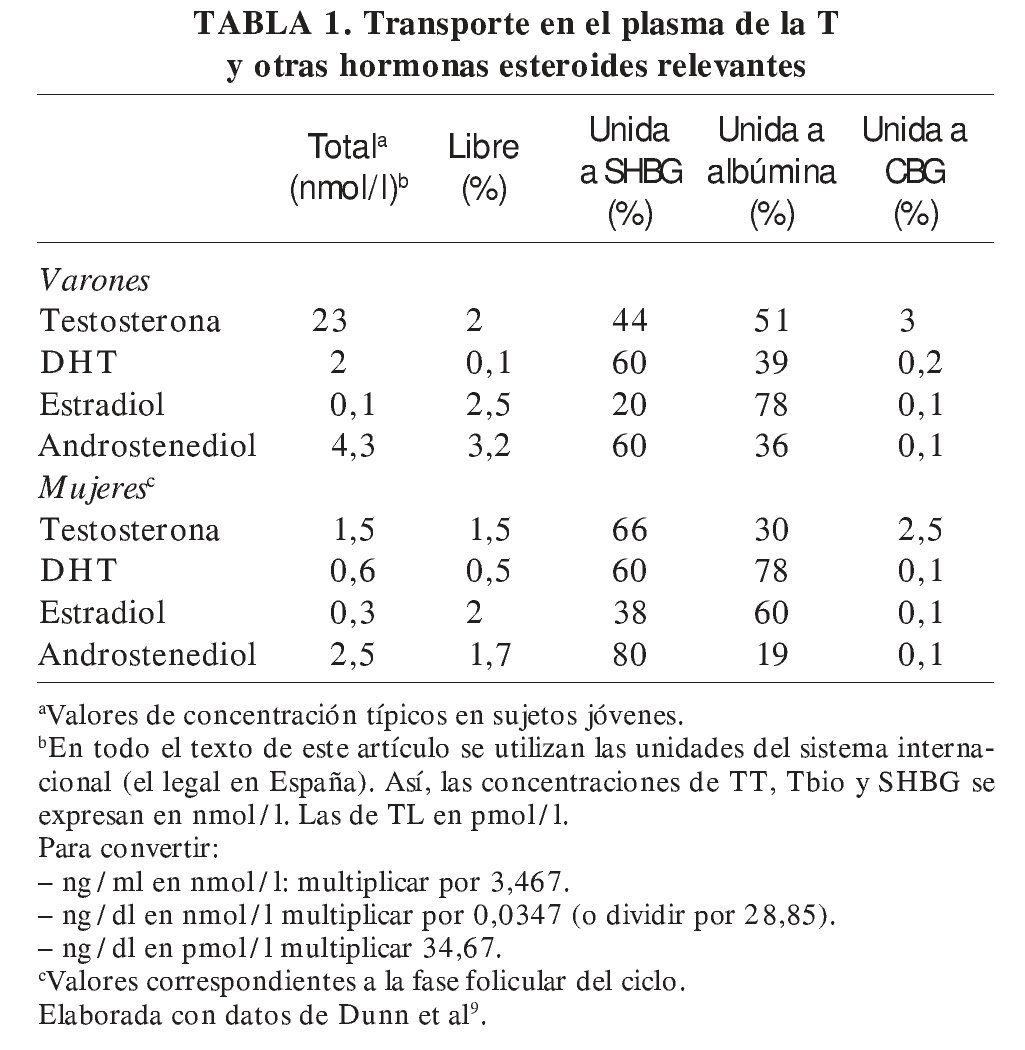
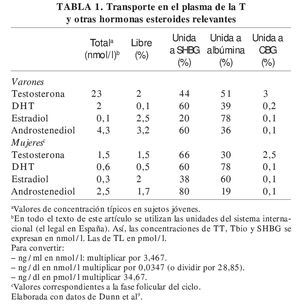
La T, como los demás esteroides no conjugados, circula en la sangre unida a proteínas plasmáticas; sólo ≈ 2% se encuentra disuelta en el plasma en forma libre (TL) (tabla 1). Las proteínas plasmáticas que transportan la mayor parte de la T son fundamentalmente la albúmina y una globulina β llamada globulina ligadora de hormonas sexuales (sex hormone binding globulin [SHBG], abreviatura que se utilizará en este artículo), también llamada globulina ligadora de esteroides sexuales (SSBG), o globulina ligadora de T (TeBG). Una pequeña fracción (≈ 3%) de la T plasmática es transportada por la globulina ligadora de corticosteroides (CBG)10.
La SHBG es una glicoproteína dimérica de unos 95 kDa. Su gen se localiza en el brazo corto del cromosoma 17 (17 p12-p13)13 y da lugar a 2 proteínas diferentes. Una es la SHBG propiamente dicha, secretada por el hígado, aunque ahora se sabe que también se expresa en otros tejidos diana de los andrógenos y los estrógenos, como los epitelios prostático y mamario14, así como en los espermatozoides, donde se concentra en el acrosoma15. El otro producto del gen de la SHBG es la proteína ligadora de andrógenos (androgen binding protein [ABP]) producida por la células de Sertoli, que se diferencia de aquélla fundamentalmente en los oligosacáridos que contienen16,17.
La SHBG liga con gran afinidad algunas (no todas) de las principales hormonas sexuales, como T, dihidrotestosterona (DHT), y estradiol (E2). Lo hace en una relación equimolar, es decir, cada molécula de SHBG liga una sola molécula de esteroide16. Los esteroides compiten entre sí por unirse a la SHBG, y la proporción en que lo haga cada uno de ellos resultará de la combinación de su grado de avidez por dicha unión, definida por su constante de asociación (K SHBG-esteroide, que sería DHT > T = androstenediol > E2) y su concentración relativa en el plasma, aspecto en el que, en el varón, es claramente predominante la T (tabla 1). De este modo, los sitios de unión de esteroides del conjunto de la SHBG circulante en el varón están ocupados esencialmente por T (≈ 40%) a la vez que un 45% de ellos están sin ocupar; el resto de los esteroides circulantes ocupan ≈ 15% de la SHBG. De ahí que, al menos en el varón, esté justificado el uso del nombre de "globulina fijadora de testosterona" señalado anteriormente.
En la mujer la situación es diferente, ya que, al ser bastante menor la concentración de T, los sitios de unión de la SHBG se reparten más entre los distintos esteroides; de hecho, el principal ligando parece ser el androstenediol (≈ 5%), y la T ocupa la mitad de sitios que éste. Esto se debe a que, como se ha indicado anteriormente, la afinidad por la SHBG del androstenediol es similar a la de la T y su concentración plasmática en mujeres viene a ser el doble de ésta (tabla 1). La concentración plasmática de SHBG en las mujeres suele ser bastante mayor que en los varones, lo que da lugar a que en ellas un 80% de los sitios de unión de esteroides de esta proteína estén normalmente sin ocupar9.
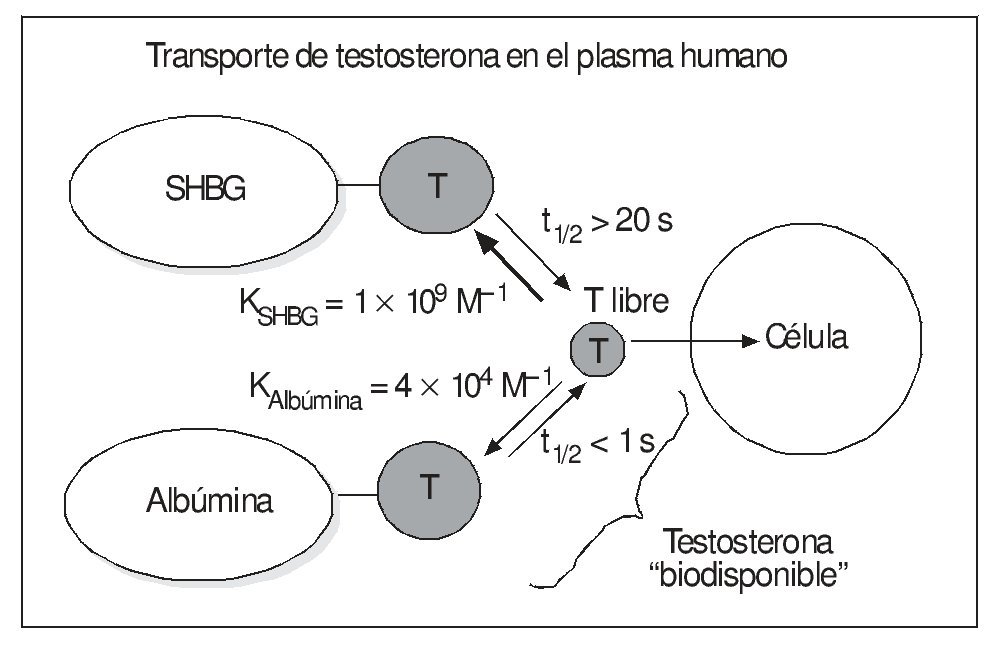
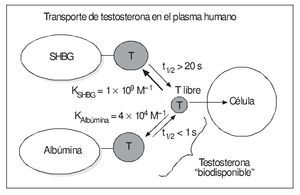
La SHBG liga la T con alta afinidad (KSHBG-T ≈ 1 × 109 M-1)9,12, y el complejo tiene un largo tiempo de disociación (t1/2 T-SHBG > 20 s), bastante más largo que el tiempo de tránsito de la sangre en los capilares, que va de < 1 a 10 s, dependiendo del tejido (más lento en los sinusoides hepáticos) y las circunstancias fisiológicas (como el gasto cardíaco o el grado de vasodilatación de cada órgano) (fig. 1). Sin embargo, su capacidad se ve limitada, especialmente en el varón, por su relativamente baja concentración, además de la mencionada equimolaridad de la unión SHBG-T16.
Figura 1. Equilibrio de la testosterona plasmática e "hipótesis de la hormona libre".
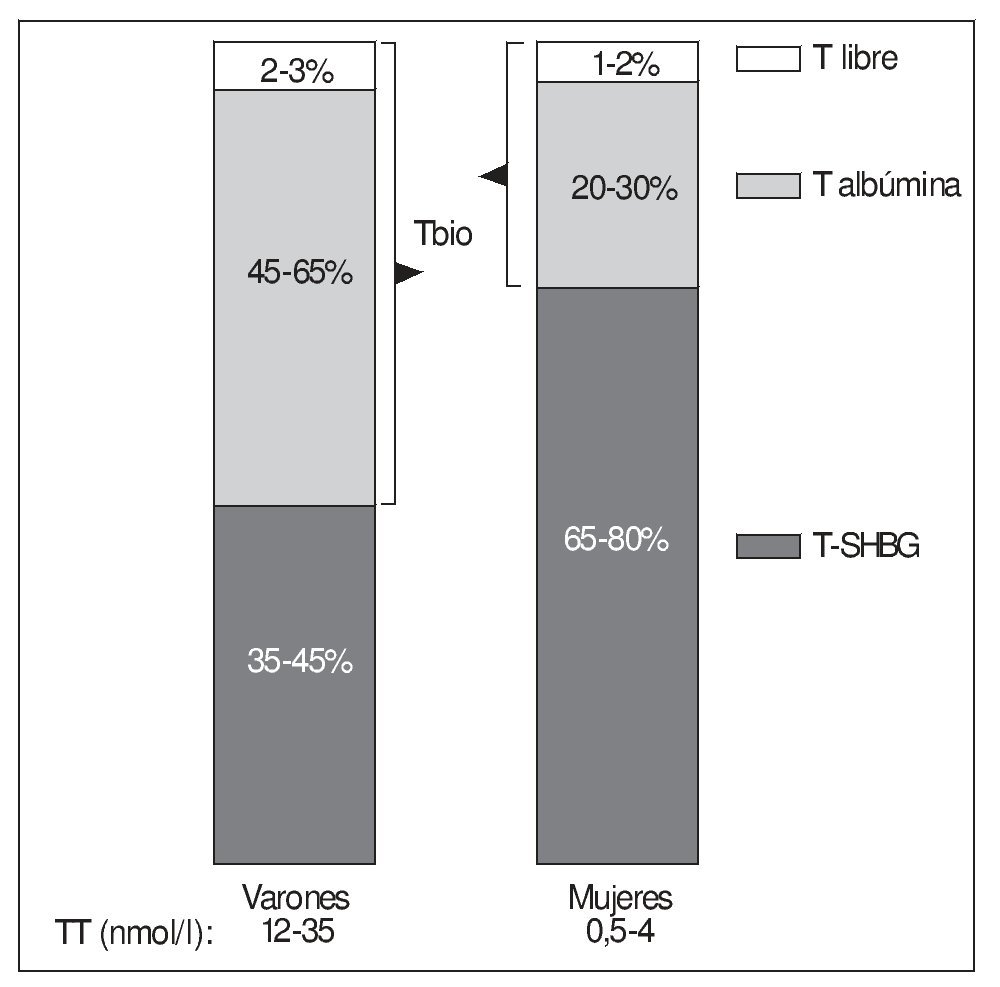
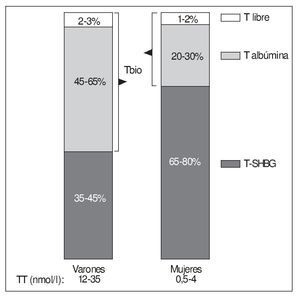
Así, la proporción de la T total circulante (TT) unida a SHBG en el varón es del 35-60% (fig. 2).
Figura 2. Distribución porcentual de la testosterona plasmática en sus principales fracciones en varones y mujeres jóvenes. Obsérvese que la T biodisponible (Tbio en el diagrama) representa en los varones la mitad aproximadamente de la T total (TT). Con frecuencia se atribuye, en revisiones y presentaciones, a los varones una distribución de la T más propia de las mujeres.
Por lo que respecta a la albúmina, hay que destacar su enorme capacidad de transporte de todas las hormonas esteroides (no sólo las gonadales), por su elevada concentración plasmática (es la proteína más abundante en éste, con diferencia) que es, aproximadamente, de 0,5 mmol/l (10-3 M), es decir, mucho mayor que la de la SHBG, que en varones viene a ser de 10-80 nmol/l (10-9 M) (en mujeres puede ser hasta el doble y en el embarazo mucho más). De tal modo, normalmente el 99% de los sitios de unión de hormonas esteroides que tiene la albúmina se encuentra sin ocupar, incluso en situaciones como el embarazo, cuando los valores de muchas de estas hormonas se elevan considerablemente9. Sin embargo, la unión a la albúmina se hace con baja afinidad. Así, en el caso de la T, su constante de asociación con la albúmina (KAlb-T ≈ 3,5 × 104 M-1)10-12 es 5 órdenes de magnitud menor que la correspondiente a la SHBG, comentada anteriormente, y su tiempo de disociación de aquella es rápido (t1/2 T-Alb < 1 s), lo que permite la liberación de buena parte de la T unida a la albúmina a su paso por los capilares. Esto ha llevado al concepto de fracción biodisponible de la T (bioavailable testosterone [Tbio]) que incluye, junto con la T libre, la T unida a la albúmina, ya que ésta, al disociarse tan rápidamente, quedaría libre en una alta proporción durante su paso por los capilares y lista para entrar en las células18. La albúmina transporta la mitad o más de la TT en los varones (menos proporción en las mujeres) (fig. 2).
Las funciones que tradicionalmente se atribuyen a estas proteínas transportadoras incluyen la de facilitar la distribución de las hormonas esteroides por todo el organismo, servir de reservorio circulante, protegerlas relativamente de su metabolismo hepático alargando su vida en el organismo y amortiguar las acusadas variaciones que se producen en su tasa de secreción. Se debe tener presente también que se ha descrito un sistema de señalización hormonal alternativo basado en la asociación de la SHBG a las membranas celulares de algunos órganos diana tan relevantes como la próstata. La SHBG no unida a hormonas, de origen circulante o producida por el propio tejido, se deposita en la membrana celular, donde puede ligar a los andrógenos o estrógenos; se inicia entonces una cascada de señalización que implica al adenosín monofosfato cíclico (AMPc) y la proteín cinasa A, que amplificaría los efectos de la vía "clásica" (genómica) mencionada anteriormente19, o tendría los suyos propios. Así, en líneas celulares de cáncer de próstata humano se ha observado que la DHT y el estradiol estimulan su crecimiento por la vía del AMPc mediante su unión a SHBG en la membrana celular, mientras que no lo hacen en ausencia de esta proteína20. La importancia relativa de estos mecanismos alternativos es todavía objeto de debate.
En todo caso parece claro que los valores de TL y Tbio correctamente estimados con frecuencia ofrecen una mejor asociación con diversas manifestaciones funcionales del estado androgénico que los valores de TT21-24. Por ello, hay consenso general en reconocer la utilidad de incluir su determinación, junto con la de la TT en la evaluación clínica de la función androgénica.
Se debe insistir en que las mujeres presentan unas proporciones de las distintas fracciones de T muy diferentes, con una fracción de Tbio sustancialmente menor, debido a que generalmente tienen en su plasma una mayor concentración de SHBG (fig. 2). Es importante tener en cuenta este hecho, pues con frecuencia en revisiones y presentaciones sobre el tema se atribuye erróneamente a los varones una distribución de las fracciones plasmáticas de T propias de la mujer.
MÉTODOS DE DETERMINACIÓN DE LOS VALORES PLASMÁTICOS DE TESTOSTERONA Y SUS FRACCIONES
Este artículo se centra en los métodos que se emplean habitualmente en los laboratorios clínicos en la actualidad. Se basan, por lo general, en el uso de plataformas automatizadas y kits comerciales, que permiten el manejo de cantidades grandes de muestras con un coste razonable. Al inicio de cada sección se hace referencia de los procedimientos considerados como "patrón oro" (gold standard) para la determinación de que se trata. Si bien son poco aplicables a las determinaciones clínicas rutinarias por su complejidad y dificultad, representan el patrón con el que idealmente se deberían comparar las técnicas habituales25.
Testosterona total
Método de referencia
El método de referencia es el de espectrometría de masas (MS) con dilución isotópica previa extracción con solventes y separación mediante cromatografía (C-MS) que puede ser de gases (GC) o líquida (LC)25-27. En la actualidad se está imponiendo como procedimiento de detección más idóneo la MS en tándem (conlleva 2 espectrómetros conectados en serie) con separación previa por LC (LC-MS/MS)28-31. Es fácil inferir que suponen equipos costosos, personal altamente especializado y bastante tiempo de trabajo, por lo que no son fácilmente aplicables en la rutina clínica, aunque todos los laboratorios deberían contrastar sus resultados con los de laboratorios de referencia que utilicen estos métodos.
Inmunoanálisis
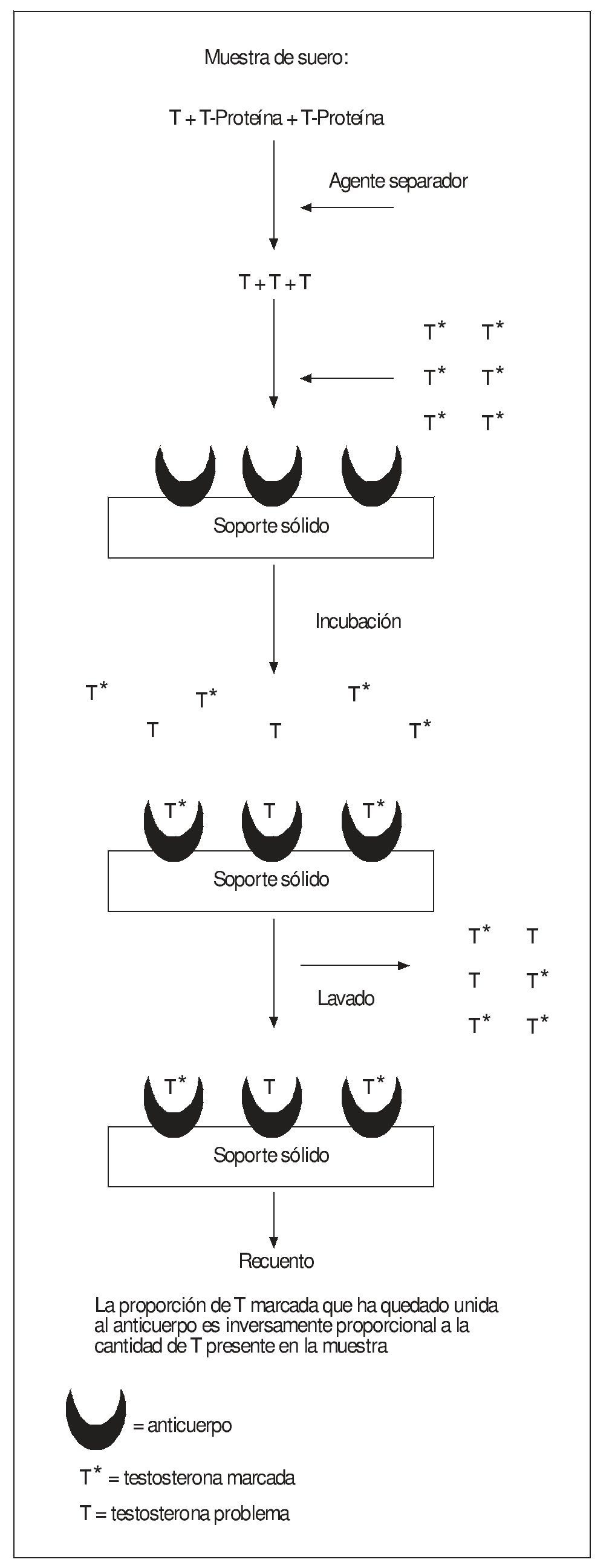
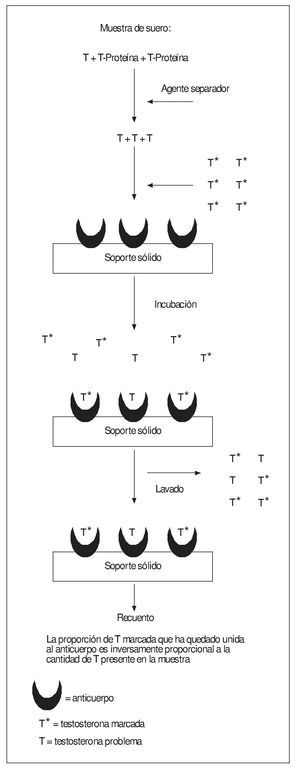
En el ámbito clínico la TT plasmática se suele medir mediante diversos tipos de inmunoanálisis competitivo, muchos de ellos susceptibles de ser automatizados (fig. 3). Se basan en la competición entre la hormona presente en la muestra y una cantidad conocida y constante de la misma hormona marcada por unirse a una cantidad limitada de anticuerpo (Ac) obtenido frente a dicha hormona. El Ac debe estar suficientemente diluido para que el número de sus sitios de unión a la T sea inferior al de las moléculas de la hormona marcada y sin marcar, para que éstas compitan entre sí por unirse al Ac. Otro aspecto importante es el que la T contenida en la muestra que esté unida a proteínas (como se ha visto la mayor parte de la TT) debe ser primero liberada pues, de otro modo, siendo una molécula pequeña, no podría reaccionar con el Ac. Esto se logra añadiendo a la muestra algunos esteroides sintéticos, como danazol, que desplazan a la T de su unión a la SHBG pero no reaccionan con el Ac. Tras la incubación, se separa el anticuerpo con las moléculas de hormona (marcadas y "frías") que hubiese ligado y se mide la cantidad de marcador que ha retenido. Como resultado de dicha competición, la concentración de hormona marcada unida por el Ac será inversamente proporcional a la concentración de hormona "fría" en la muestra problema, cuyo valor final se obtiene por comparación con una curva de calibración hecha con soluciones de concentración conocida de hormona sin marcar25,27.
Se pueden usar distintos procedimientos para marcar la T. El más clásico es mediante radiactividad (3H en la propia molécula de T o bien 125I en otra molécula orgánica, como yodohistamina, acoplada a la de T), en tal caso se trataría de un radioinmunoanálisis (RIA). Este tipo de marcador está siendo desplazado progresivamente de su uso clínico a medida que se va disponiendo de otros no radiactivos, más manejables y susceptibles de empleo en autoanalizadores. Así, la T se puede marcar con una enzima, como la fosfatasa alcalina, la peroxidasa o la galactosidasa, y se cuantifica mediante una reacción colorimétrica que se inicia al añadir sus correspondientes sustratos tras la incubación y lavado; es el enzimoinmunoanálisis (EIA/ ELISA). Alternativamente, la molécula de T puede marcarse con una sustancia fluorescente, como el europio, que se mide con un fluorímetro tras completar la reacción y la separación; es el fluoroinmunoanálisis (FIA). Hay sistemas que marcan la T con sustancias quimioluminiscentes (en algunos, su generación es provocada por una enzima acoplada a la T) como acridinio, rutenio, derivados de luminol o adamantil dioxetano, que se miden con un fotomultiplicador (CLA)25,27-28,30-34.
Los resultados de muchas de estas técnicas se han contrastado con los obtenidos por C-MS (método de referencia, como se ha comentado anteriormente) en varios estudios28,30,32,34. Han encontrado, en general, coeficientes de correlación y líneas de regresión satisfactorios entre todas estas técnicas y la de referencia dentro del intervalo de concentraciones de T propios de varones adultos. No obstante, se han detectado notables defectos de precisión en las diversas técnicas, con diferencias sustanciales entre sus resultados, y se han mostrado sesgos hacia arriba o abajo respecto a los obtenidos con la C-MS. Los problemas se acentúan en la medición de valores bajos de T. Se concluye que las técnicas de rutina examinadas permiten diferenciar valores eugonadales de hipogonádicos en varones, siempre que cada laboratorio haya establecido sus propios intervalos de referencia. Sin embargo, se cuestiona la validez de dichos métodos rutinarios para cuantificar valores muy bajos de T como los encontrados en mujeres o en niños.
Testosterona libre
Métodos de referencia
Hay 2 métodos de referencia: la diálisis y la ultrafiltración. En el primero el suero (dializando) se pone en un compartimiento separado de otro que contiene una solución tampón (dializado) por medio de una membrana semipermeable, que permite el paso a la TL pero no a las proteínas (ni a la T unida a ellas). Así, las moléculas de T libre difundan hasta el compartimiento del dializado, hasta equilibrar su concentración con la presente en el suero. Su determinación, entonces, en el dializado por un método válido de los comentados anteriormente, generalmente RIA, daría la concentración de TL. También se puede obtener indirectamente conociendo la concentración de TT y el porcentaje de T-3H previamente añadida que se recupera en el dializado25,35-36. Si bien se considera el procedimiento de referencia principal para medir la TL, es costoso en tiempo (varias horas) y está sujeto a errores técnicos, lo que requiere un personal muy especializado. El método de ultrafiltración (una especie de "diálisis forzada") se basa en centrifugar la muestra de suero a través de una membrana semipermeable, como en la diálisis, de modo que solo la TL (con otras moléculas pequeñas) se encuentre presente en el ultrafiltrado, donde de nuevo se puede determinar por RIA o por la recuperación de T marcada previamente añadida. Tiene la ventaja de que dura menos que la diálisis (< 1 h) y hay dispositivos comerciales (p. ej., sistema de micropartición de Millipore) que la simplifican25. Ambos procedimientos tienen el problema inherente de que el equilibrio entre T unida a proteínas y TL presentes en el suero se altera a medida que ésta pasa al otro compartimiento (dializado o ultrafiltrado), por lo que se disocia más de aquella. Por ello, aunque las técnicas tratan de minimizar dicho efecto, en propiedad sus resultados se deben considerar aproximados.
Medida directa por RIA con análogo
Se ha intentado cuantificar directamente la TL en el plasma mediante diversos métodos. En la figura 3 se puede observar que, si se eliminase el primer paso, la liberación de la T unida a las proteínas, sólo la TL estaría disponible para unirse al Ac. El problema está en que a medida que esta se une al Ac se va disociando T unida a las proteínas. Para evitar este problema se puede combinar el uso de un Ac muy diluido, de modo que tenga muy pocos sitios de unión disponibles, con el estudio de la proporción de T marcada preañadida que capta el anticuerpo y la concentración de TT, de lo que se deduce que es un procedimiento laborioso y complicado que exige varios pasos y separaciones25.
Figura 3. Esquema general del fundamento de los métodos de inmunoanálisis comúnmente utilizados por los laboratorios clínicos para medir la TT en plasma.
La TL se ha intentado medir de un modo más simplificado y eficiente por el llamado método de RIA con análogo (TL-RIA-a). Se basa en usar como marcador una sustancia (el "análogo" de la T) que tenga las propiedades de competir con la TL por unirse al Ac y, a la vez, de no unirse a las proteínas transportadoras. Esto ha dado lugar a varios kits comerciales que dicen medir la TL directamente y han alcanzado gran popularidad entre los laboratorios clínicos. Actualmente están en retroceso, con buen fundamento. Efectivamente, varios estudios que han comparado los resultados de TL medida con el RIA con análogo y con un método de referencia (diálisis) han encontrado discrepancias sustanciales, tanto en varones36-38 como en mujeres39. Una explicación plausible es que una parte variable del "análogo" (cuya naturaleza no suelen declarar los fabricantes de los kits) en realidad sí se una a las proteínas transportadoras (como se indicó arriba, la SHBG tiene una alta proporción de sitios de unión de T sin ocupar; y la albúmina muchísimos más). Por ello, la práctica totalidad de autoridades en el campo, tanto individuales12,36-42 como corporativas43-45, recomiendan el abandono de esta técnica.
"Indice de T libre"
Este índice (free testosterone index [FTI] o free androgen index [FAI]) se calcula mediante la fórmula: 100 × TT/SHBG, lo que requiere medir las concentraciones de TT y de SHBG para hacer la operación. Se usa desde hace tiempo, especialmente en el campo ginecológico para la evaluación del hiperandrogenismo, aunque también hay publicaciones, incluso en reputadas revistas, que lo emplean en el varón diciendo medir con tal índice la TL44. En realidad, como se puede apreciar en la fórmula, a pesar de su nombre, sería una estimación no de la TL sino de la T que no está unida a la SHBG, es decir lo que aquí se define como Tbio (TL + T albúmina). Por ello, se ha escrito anteriormente su nombre entrecomillado y su inclusión en esta sección (y no en la subsiguiente sobre Tbio) se ha hecho pensando que tan peculiar nombre haya estado desorientando al clínico en el pasado sobre la realidad de lo que estaría midiendo.
Su empleo es muy criticable, especialmente en el varón46. En primer lugar, carece de dimensiones (es decir, de unos valores concretos en unidades de concentración). Además, matemáticamente sólo daría una estimación fiable de la Tbio (que no de la TL) cuando la capacidad de unión de la SHBG excediese con mucho a la concentración de T12,36,46. Esa circunstancia no se da en el varón, donde la concentración de SHBG es de 1,5 a 3 veces la de TT y, como se ha mencionado anteriormente, sólo tiene la mitad de sus sitios de unión a esteroide sin ocupar. De hecho, cuando se ha comparado en varones tanto con la TL como con la Tbio medidas por métodos de referencia36,37 o calculadas por los métodos descritos más abajo48, muestra una pobre concordancia con ellas. En las mujeres la situación es diferente, pues sus concentraciones de T son unas 20 veces inferiores a las de los varones y las de SHBG generalmente más elevadas, y además el porcentaje de sitios libres en la SHBG es el doble (véase anteriormente). En ellas sí se cumple, por tanto, la condición de un amplio exceso de capacidad de unión de la SHBG respecto a la T total. Congruentemente con ello, el FAI sí se ha encontrado en las mujeres bien correlacionado con los métodos de referencia39.Por tanto, se puede concluir que el cálculo del FAI o FTI carece de validez para aplicarse a los varones, aunque la mantiene en las mujeres. Sin embargo, puesto que requiere la medición tanto de la TT como de la SHBG, como se discute posteriormente, con estos valores se pueden calcular las concentraciones molares de TL y Tbio, lo que ofrece un resultado más informativo y contrastable; por ello, es aconsejable que este cálculo sustituya definitivamente al del FTI o FAI47.
Testosterona libre calculada
La concentración de TL se puede calcular a partir de los valores de TT y de los de sus principales proteínas transportadoras. Se han propuesto 2 modos de hacerlo. El más usado (método estequiométrico) se basa en la Ley de acción de masas. El fundamento es el siguiente la TT es la suma de la TL más la T unida a las diversas proteínas transportadoras:
Esta ecuación se puede resolver para TL si se conocen las concentraciones de TT y de las proteínas transportadoras relevantes, así como sus constantes de asociación.
Una primera fórmula fue propuesta por Sodergard et al11. Es más bien compleja, pues, además de las concentraciones de TT, SHBG y albúmina y sus respectivas constantes de asociación, incluye las de otros esteroides que pueden competir con la T por su unión a SHBG, como DHT, androstenediol, androstanediol y estradiol.
Posteriormente Vermeulen et al36 propusieron una versión más simplificada, con un sólo esteroide (T) que ha alcanzado gran popularidad. Su empleo en el varón parece bien justificada porque, como se ha discutido anteriormente, es esta hormona la que transporta la SHBG en cantidad mucho mayor que cualquier otra y la albúmina tiene una inmensa mayoría de los sitios de unión sin ocupar por ningún esteroide. De este modo, salvo que se elevasen enormemente las concentraciones de los esteroides mencionados anteriormente, no suponen una competición significativa para el transporte de T. Así, la TL se puede calcular mediante la ecuación:
(modificada de Sodergard et al11, Vermeulen et al36 y Lepage42, para obtener la expresión más concisa e informativa posible), donde TT, TL, SHBG y Alb son las concentraciones medidas de estas sustancias y KSHBG-T y KAlb-T las constantes de afinidad de dichas proteínas con la T.
La fórmula de Vermeulen et al se encuentra implementada en el calculador ofrecido libremente por la International Society for the Study of the Aging Male (http://www.issam.ch/freetesto.htm). Introduciendo en éste las concentraciones medidas de TT, SHBG y albúmina (si no se dispone de esta última, el calculador ofrece un valor por defecto de 43 g/l [0,62 mmol/l]) se obtienen la concentración de TL calculada (TL-calc) y también la de Tbio calculada (Tbiocalc) (véase posteriormente).
Los valores de T-calc obtenidos con el mismo se han encontrado altamente correlacionados con los medidos por diálisis36,37,39 (en Morley et al37 a la TL-calc por este método se le llama "índice de T libre", lo que puede inducir a confusión al lector no avisado). Este algoritmo de cálculo está creciendo en popularidad y, de no disponerse de uno de los de referencia bien validado, es recomendado expresamente por varias guías y autoridades2,42,46,47.
Sin embargo, esta aproximación a los valores de TL mediante cálculo, no está exento de limitaciones. En primer lugar, al depender de los valores medidos de 2 o 3 variables (TT, SHBG, albúmina) las imprecisiones de la medida de cada una de ellas se combinan (matemáticamente el error que conlleva dicha combinación es la raíz cuadrada de la suma de los cuadrados de los errores de las determinaciones individuales). Por otra parte, los valores de constantes de asociación que se usen condicionan de modo importante el cálculo, especialmente la de la SHBG. Aunque hay consenso general en que KSHBG-T es del orden de n × 109 M-1 y KAlb-T unas 10.000 veces menor, hay discrepancias en los valores exactos (el multiplicador n) descritos por diversos investigadores y utilizados en distintas fórmulas. Así, para la constante de asociación de la SHBG los valores de n comunicados por diversos autores varían desde 0,6 a 212,42, dependiendo probablemente de diferencias técnicas en su determinación. La utilización de uno u otro valor de KSHBG-T afecta de modo importante al resultado del cálculo de la TL; a menor valor de n, mayor cantidad de TL-calc obtenida12. Esto explica por que los valores de TL-calc obtenidos en las mismas muestras con la ecuación de Sodergard et al (n = 0,6) son sistemáticamente mayores (10-20%) que con la de Vermeulen et al (n = 1)48,49. A este respecto, se debe advertir que muchos autores confunden ambas ecuaciones (y sus correspondientes resultados); el lector debe tener presente que son parecidas pero no idénticas. Por otra parte, si bien todos los estudios concuerdan en que los valores de TL-calc obtenidos con las ecuaciones de Sodergard et al o de Vermeulen et al se correlacionan muy bien con los de TL medida por diálisis o ultrafiltración, algunos de ellos sugieren, a su vez, que ambas ecuaciones sobreestiman en alguna medida los valores de TL49-51. Para obviar el problema de la definición de la constante de asociación, algunos autores han empleado la estrategia inversa: determinan los valores de TT y TL (mediante un método de referencia) y modifican en las ecuaciones precedentes las constantes de asociación para que los valores calculados se ajusten óptimamente a los medidos50,51. A esta aproximación se le ha objetado, con lógica, que no se pueden cambiar las constantes de asociación a voluntad12. Efectivamente, la constante de asociación entre una hormona y una determinada proteína es una propiedad fisicoquímica inherente a la estructura de ambas; el problema, sin embargo, radica en que por el momento no hay acuerdo en su valor exacto. Obviamente hay necesidad de un consenso basado en datos sólidos en este punto. Mientras tanto es recomendable que cada laboratorio obtenga su propio intervalo de referencia con las técnicas que utilice42,49.
Por su baja afinidad por la T las variaciones de la concentración de albúmina dentro del intervalo en que se suelen encontrar en la mayoría de los pacientes afectan poco el resultado de TL-calc12. Por esto en el calculador www.issam.ch se permite la omisión de su valor medido, asumiendo un valor prefijado de ésta. Sin embargo, una disminución importante del valor de albúmina circulante, como se encuentra en el síndrome nefrótico, en la cirrosis hepática o en la malnutrición severa, sí puede afectar significativamente el valor de TL-calc12,49. La contribución de la concentración de albúmina gana importancia en el cálculo cuando la proporción de TT no unida a la SHBG está muy reducida (generalmente porque la concentración de SHBG está elevada), por ejemplo, en las mujeres, en el hipertiroidismo o en varones de edad avanzada; en estos casos se recomienda la medición de sus valores reales49. En el caso de los varones ancianos estaría doblemente indicado puesto que con la edad avanzada se elevan los valores plasmáticos de SHBG a la vez que descienden los de albúmina24,52.
Testosterona biodisponible
Método de referencia
En sentido estricto no hay un método de referencia universalmente aceptado para calcular la fracción de la TT no unida a la SHBG, también llamada Tbio. Lo que más se aproximaría a ello es la medición tras precipitar la fracción de las globulinas plasmáticas con sulfato amónico al 50% (SA). Se puede obtener mediante el estudio del reparto de una cantidad trazadora de T-3H añadida a la muestra entre la fracción precipitada y en el sobrenadante, midiendo el porcentaje que representan de la TT (que hay que medir también). La que permanece en el sobrena-dante representaría la Tbio. Alternativamente, se puede prescindir de la adición del trazador radiactivo y medir la concentración de T en el sobrenadante, lo que se ha hecho generalmente por RIA25,42,53. Estos procedimientos, aparentemente sencillos, presentan importantes problemas prácticos. Hay muchos detalles críticos que requieren gran precisión, como la concentración exacta de SA puesto que si es insuficiente provocará una precipitación incompleta de la SHBG mientras que un exceso provoca la precipitación de una parte de la albúmina (con la T que lleve ligada), la temperatura y el tiempo de incubación53. Por otra parte, la medición de la T en el sobrenadante no parece ser fácil de cuantificar en los autoanalizadotes comúnmente usados en los laboratorios clínicos (la solución de SA en alta concentración interfiere con la medida); de hecho, cuando se ha logrado hacerlo, ha sido midiendo la existente en el precipitado reconstruido con el tampón del sistema automático54. Todo ello indica que se trata de un procedimiento laborioso, que requiere habilidad técnica; en definitiva, poco práctico para la rutina clínica.
T biodisponible calculada
Una alternativa atractiva es usar un procedimiento de cálculo similar al empleado para la TL-calc. La ecuación sería:
(adaptada de Sodergard et al11, Vermeulen et al36 y De Ronde et al49).
lo que, de acuerdo con la Ley de Acción de Masas, se puede expresar como:
El arriba referido calculador http://www.issam.ch/ freetesto.htm ofrece, simultáneamente al valor de TL-calc, el de Tbio-calc tras introducir las concentraciones de TT, SHBG y, opcionalmente, albúmina.
Los valores de Tbio-calc obtenidos por dicho método se han encontrado altamente correlacionados con los de Tbio medidos, es decir los de T no unida a la SHBG obtenidos por precipitación con SA (método "de referencia" discutido arriba)36,37,55,56. Por otra parte, su descenso asociado al envejecimiento masculino parece más acusado que el de TT24,57 e incluso que el de TL-calc24; asimismo, se correlacionan mejor con indicadores psicofisiológicos de éste que los antedichos parámetros hormonales24.
Con respecto a las limitaciones de este método, son similares a las comentadas a propósito de la TL-calc. Algunos estudios, aun confirmando la buena correlación de sus resultados con los de precipitación con SA, encuentran una desviación sistemática de sus valores, como en la TL-calc, en la dirección de sobrestimación55,56. Al igual que con la TL-calc, se ha propuesto modificar las constantes de asociación para obtener un ajuste óptimo55,56, procedimiento al que se le puede hacer la misma crítica conceptual que cuando se usa para obtener aquella12. Alternativamente, se han propuesto fórmulas que ajusten, el valor de Tbio-calc al de Tbio medida tras precipitación por SA prescindiendo de las constantes de asociación. Así, Morris et al58 han propuesto la siguiente ecuación:
o lo que es igual:
donde TT y SHBG son sus correspondientes concentraciones nanomolares. En un estudio de comparación de algoritmos sobre las mismas muestras los valores medios de Tbio-calc obtenidos con esta fórmula equivalieron al 67 y el 52% de los obtenidos con las de Vermeulen et al y Sodergard et al, respectivamente49.
El valor de Tbio-calc con frecuencia mantiene una relación fija con el de TL-calc (de 20 a 24 veces el de ésta, según Vermeulen et al12,36). De hecho, el calculador www.issam.ch, si no se introduce una concentración de albúmina medida, obtiene el valor de Tbio-calc multiplicando el valor que ha obtenido de TL-calc por una constante de esa magnitud (× 23,43). Por ello, cabe plantearse si es redundante el utilizar ambos parámetros. La respuesta es que, si se mide realmente la concentración de albúmina, el uso de los 2 parece justificado porque, como se ha apuntado anteriormente, el valor de Tbio-calc puede asociarse con datos demográficos y biológicos con fuerza distinta que el de TL-calc; además, hay situaciones en que dichos parámetros pueden variar en sentido opuesto. Así, si hay un descenso importante de los valores de albúmina (como suele ocurrir en el envejecimiento24,52 o más aun en las situaciones clínicas comentadas anteriormente), la fracción de TL tiende a aumentar mientras que la de Tbio disminuiría12. Además, la obtención de ambos indicadores tiene el mismo coste que la de uno solo de ellos.
Medida de los valores de SHBG
Para poder determinar los índices discutidos arriba (TL-calc y Tbio-calc) se necesita una medición lo más fiable posible de los valores plasmáticos de TT y de SHBG. Sin embargo, no existe ningún método de referencia para la medición de esta proteína. Idealmente debería estimarse por la capacidad de unión de una cantidad trazadora de T o DHT marcada12,47.
En la práctica, la medición de la SHBG en la clínica se ha venido haciendo manualmente mediante diversos inmunoensayos como RIA o ELISA, o bien métodos inmunométricos que conllevan un ensayo en sándwich sobre un soporte sólido con 2 anticuerpos27. Este es un método aplicable para medir moléculas grandes (proteínas como la que nos ocupa y hormonas peptídicas grandes, como las gonadotropinas). Esencialmente consiste en provocar primero la unión de la proteína analizada con un anticuerpo de "de captura" y añadir entonces un segundo "anticuerpo marcador" (marcado con radiactividad, con enzimas, etc.) que reacciona con una parte de la molécula diferente a la ocupada por el primer Ac. La proteína analizada queda así "emparedada" entre el "Ac de captura" y el "Ac-marcador", de ahí el nombre de "sándwich". El complejo "Ac captura"-proteína-"Ac marcador" se separa y se cuenta la cantidad de marcaje en éste. En este caso, a diferencia de los inmuonoanálisis de competición descritos para la medición de la T, la cantidad de marcador contada es directamente proporcional a la concentración de proteína analizada. De este modo, se obtiene la concentración molar de la SHBG en el plasma. Dada la relación equimolar entre T y SHBG para su unión16, teóricamente la medida de la concentración de SHBG se correspondería directamente con la de su capacidad de unir T. Recientemente se han introducido versiones automatizadas de éstos que han alcanzado gran popularidad, aunque no se dispone todavía de evaluaciones comparativas de su eficacia42. La precisión de los análisis manuales ha sido, sin embargo, objeto de debate. Algunos estudios han encontrados notables diferencias en los valores de concentración de SHBG obtenidos en las mismas muestras según el inmunoanálisis que se emplee, posiblemente por diferencias en el comportamiento de los distintos anticuerpos59, mientras que otros los encuentran bastante reproducibles y precisos42. En todo caso, debería exigirse que los diversos inmunoanálisis de SHBG para uso clínico, manuales o automáticos, se hubiesen contrastado con la capacidad real de unión de la T, lo que no es frecuente. Todo ello impone cautela en la comparación de resultados de distintos laboratorios y refuerza la necesidad, como en los demás parámetros discutidos, de establecer un programa de validación externa de los métodos para determinación de T plasmática e indicadores relacionados.
Los valores plasmáticos de SHBG se ven influidos de modo importante por diversas hormonas y fármacos (tabla 2). Estos efectos hormonales explican el que los valores de SHBG de las mujeres jóvenes sean generalmente mayores que los de los varones; también explican su gran elevación durante el embarazo (por lo que aunque aumentan los valores de TT, los de TL conservan valores similares o incluso inferiores a los encontrados en mujeres no embarazadas). Asimismo, los valores de SHBG cambian en situaciones clínicas relevantes para el hipogonadismo masculino, como son las disminuciones encontradas en la obesidad y el hipotiroidismo y los aumentos asociados al adelgazamiento y el hipertiroidismo52. Esto refuerza la importancia de disponer de métodos fiables de determinación de este importante parámetro.
Algunas cuestiones prácticas
Hora de la toma de la muestra
Está claramente demostrado que la tasa de secreción T experimentan notables fluctuaciones. En los sujetos jóvenes se ha comprobado una importante variación circadiana de la TT plasmática, con valores máximos a primeras horas de la mañana y mínimos a última hora de la tarde, aunque en sujetos de edad avanzada tal fluctuación parece atenuarse considerablemente60. Por ello, en aras de la mayor consistencia posible de los resultados, la práctica totalidad de las guías y recomendaciones sobre esta materia recomiendan se haga la extracción de sangre por la mañana (al menos antes de las 11 h)1,2,43,44.
Secuencia de determinaciones
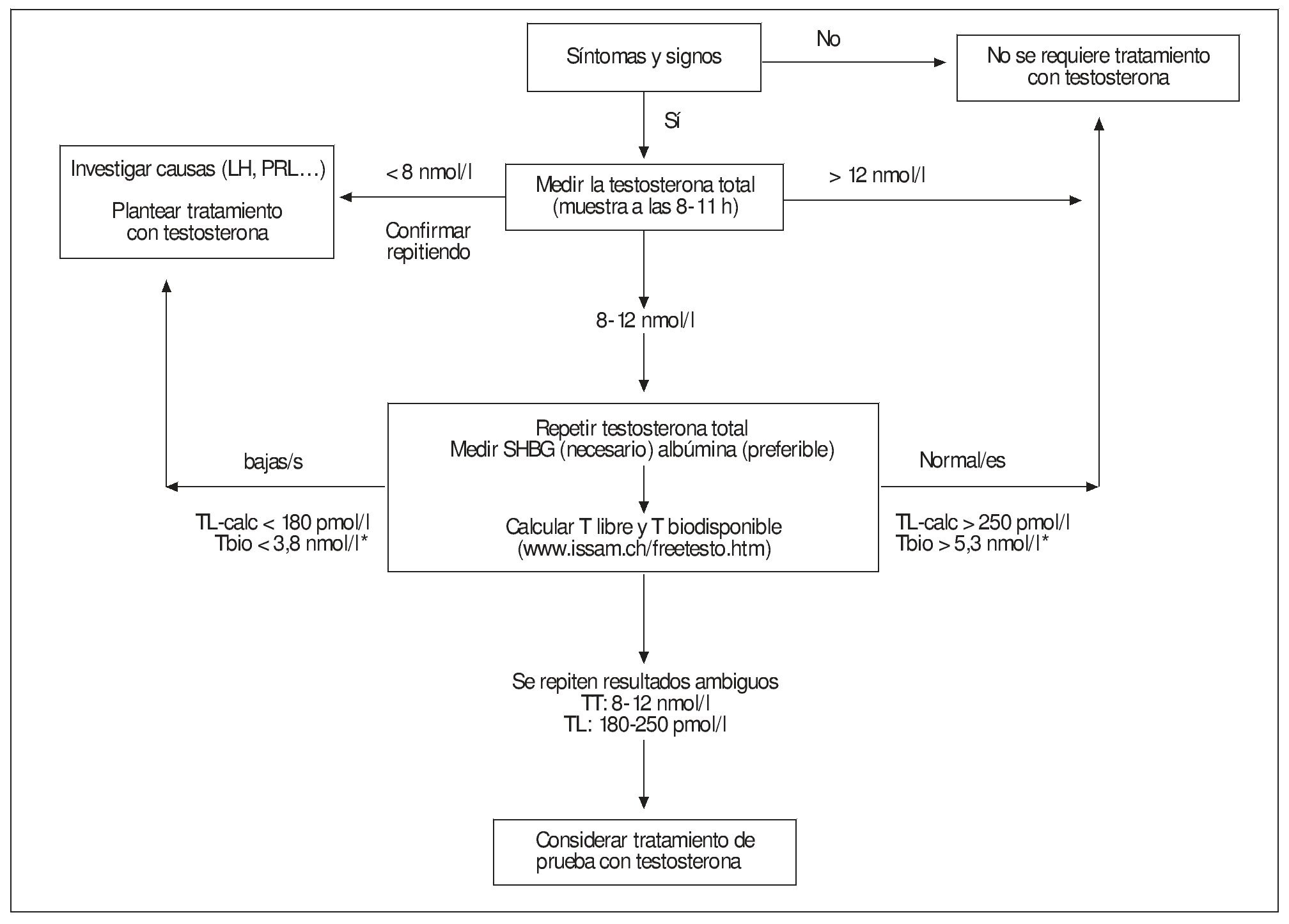
El principal pilar bioquímico para el diagnóstico del hipogonadismo masculino sigue siendo la determinación de TT plasmática por un método fiable1,2,43,44.
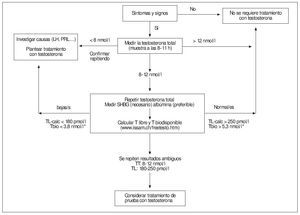
Unos valores claramente por debajo del intervalo propio de la población normal, comprobado en al menos una determinación adicional, o inequívocamente dentro de aquél, confirmarían el diagnostico del hipogonadismo masculino o su exclusión, respectivamente, en muchos de los pacientes, siempre que coincidan con la clínica. En tales casos, la medición adicional de SHBG, para obtener los valores de Tbio-calc y TLcalc parece redundante60. Estos resultan, sin embargo, útiles para el diagnóstico en los casos en que la TT muestra unos valores dudosos o cuando no concuerdan con la clínica y se han excluido otras causas que pudiesen explicar los síntomas1,43,44,61. Todo lo anterior se puede resumir en el esquema de la figura 4 (modificada de Mas62). Dada la variabilidad de los resultados de las diversas técnicas y entre diferentes laboratorios es importante que los análisis de confirmación y seguimiento terapéutico se hagan en el mismo laboratorio.
Figura 4. Esquema del protocolo para la evaluación bioquímica del hipogonadismo basado en las recomendaciones de las ISA-ISSAM-EAU1. *Éstas no especifican valores de corte para la T biodisponible; se han adoptado los recomendados por Vermeulen. (Modificada de Mas62.)
Valores de corte
Es difícil poder definir unos valores de corte nítidos y absolutos de los parámetros bioquímicos discutidos en este artículo. Esto se debe, por una parte, a la variabilidad e imprecisiones de las técnicas analíticas disponibles, discutidas anteriormente. También a que cada vez se está documentando más la existencia de una sustancial variabilidad interindividual en cuanto a los valores de andrógenos plasmáticos por debajo de los cuales se presenten los síntomas de déficit de éstos63, así como el que haya umbrales de andrógenos plasmáticos diferentes para la aparición de distintos tipos de síntomas64. Efectivamente, la actividad androgénica en un determinado sujeto está condicionada no sólo por los valores de T plasmática y de sus proteínas transportadoras, con la posible interferencia con las mismas de otras hormonas presentes en cantidades anormales o de algunos fármacos, sino también por las características funcionales de sus receptores androgénicos y su actividad de transcripción y traducción tras ligar la T o la DHT7, todo lo cual está sometido a grados importantes de variabilidad individual de la que no puede dar cuenta la simple determinación de los valores plasmáticos de T o sus fracciones.
Por todo lo anterior hay que aclarar que los valores de corte que se indican en la figura 4 (los recomendados por la ISA-ISSAM-EAU1) deben considerarse orientativos. Así, los intervalos de la "zona gris" o "de duda" ofrecidos por diversos investigadores y documentos de consenso son algo diferentes (8-12 nmol/l1, 6,9-11,1 nmol/l43, 8-15 nmol/ml44, 6,5-13 nmol/l61). Todas las guías recomiendan que cada laboratorio utilice métodos bien validados y establezca correctamente con ellos sus propios intervalos de referencia. El grado en que dicho ideal se alcanza en la realidad es muy dudoso. Por esto los resultados analíticos, por muy valiosos que sean si han sido bien obtenidos, no podrán reemplazar al buen juicio clínico.
CONCLUSIONES
Los métodos de medida de TT y sus fracciones funcionalmente activas considerados de referencia (C-MS para T, diálisis para TL y precipitación con sulfato amónico para Tbio) no son por el momento aplicables a la práctica clínica habitual.
Las diferentes técnicas usadas por los laboratorios clínicos para la determinación de TT y de SHBG (necesaria para el cálculo de Tbio y TL) presentan una importante variabilidad en sus resultados y en los intervalos de los valores normales que se obtienen con ellas. Por esto los valores de concentraciones de T que se sugieren para el diagnóstico en las diversas guías publicadas deben considerarse orientativos. Es necesario que cada laboratorio determine sus propios intervalos de referencia en varones sanos con la técnica específica que use. También es importante que las eventuales repeticiones analíticas, para el diagnóstico y el control del tratamiento se hagan en el mismo laboratorio.
Se desaconseja expresamente el empleo en el varón de las determinaciones de FAI (o FTI) y, en ambos sexos, de TL-RIA-a. Las determinaciones de TL-calc y Tbio-calc parecen ser mejores indicadores de dichas fracciones. Sin embargo, su validez dependerá de la fiabilidad de las determinaciones de TT y SHBG en que se basan. Igualmente es importante que, al comunicar sus valores, se especifique el algoritmo que se ha utilizado, ya que los existentes arrojan diferencias notables en sus resultados. Las determinaciones de TL y Tbio (calculadas o medidas) pueden resultar superfluas cuando los valores obtenidos de TT están claramente por encima o por debajo de los límites inferiores de normalidad. Su principal utilidad se encuentra cuando los valores de TT están en la "zona gris" intermedia y no permiten clasificar con certeza al paciente.
El hallazgo de unos valores bajos de T debe confirmarse con una nueva muestra antes de iniciar tratamiento sustitutivo. Las muestras de sangre deben obtenerse a primera hora de la mañana.
Hay una importante variabilidad individual en los umbrales de T circulante para la aparición de los síntomas de hipogonadismo. Asimismo, distintos síntomas parecen presentarse con diferentes valores de T. Ello refuerza la importancia del mejor juicio clínico para una interpretación ponderada de los datos bioquímicos.
La implementación de un eficiente programa nacional de validación y estandarización de los procedimientos analíticos para la evaluación de la función androgénica usados por los distintos laboratorios clínicos debería ser una misión prioritaria de la Asociación Española de Andrología, Medicina Sexual y Reproductiva.
Correspondencia:
Prof. M. Mas.
Departamento Fisiología CESEX. Facultad de Medicina. Universidad de La Laguna. 38071 La Laguna. Tenerife. España.
Correo electrónico: mmas@ull.es