Introducción
La histamina (HA) es, sin duda, una de las aminas biógenas más importantes en medicina y biología. Se sintetiza por descarboxilación del aminoácido L-histidina, en una reacción catalizada por la enzima L-histidina descarboxilasa (HDC). Es una molécula extremadamente versátil con una amplia gama de funciones fisiológicas, que incluye, entre otras, la contracción del músculo liso, regulación de la permeabilidad vascular, estimulación de la secreción de ácido gástrico, neurotransmisión, inmunomodulación y regulación de la proliferación celular1. La versatilidad fisiológica de la HA reside en su capacidad para activar al menos cuatro subtipos de receptores de membrana diferentes (H1, H2, H3 y H4). Todos ellos pertenecen a la superfamilia de receptores acoplados a proteínas G, y desencadenan la activación de diversas cascadas de señalización en respuesta a la unión del ligando2,3.
La mayoría de las funciones fisiológicas de la HA descritas en el párrafo anterior se han atribuido a los subtipos de receptores mejor caracterizados: H1 y H2 (H1R y H2R, respectivamente), para los cuales se han desarrollado potentes agonistas y antagonistas. Sin embargo, los trabajos de investigación tendentes a identificar nuevas funciones para dichos receptores no cesan. Con referencia particular al sistema reproductor masculino, aunque las evidencias acumuladas en las últimas tres décadas sugerían fuertemente la existencia de H1R y H2R funcionales4-6, no fue sino hasta muy recientemente cuando se demostró la expresión de estos receptores en tipos celulares específicos. Al respecto, se han identificado H1R y H2R en células germinales y peritubulares del testículo, como así también en macrófagos y células de Leydig7-10.
A la fecha, existen buenas razones para suponer que la HA contribuye al funcionamiento normal del sistema reproductor masculino: a) la HA cumple un papel como modulador autocrino y/o paracrino de la esteroidogénesis en células de Leydig de diversas especies in vitro4,7,9,11. Asimismo, existe evidencia de que la HA regula la síntesis de esteroides testiculares in vivo. Pap et al han descrito que la deficiencia de HA en ratones que tienen anulada la expresión de la enzima histidina descarboxilasa (HDC-KO) conduce a una alteración en los niveles de esteroides testiculares y séricos en comparación con ratones de genotipo salvaje, sin que se observen diferencias en la expresión del ARNm de GnRH hipotalámico12; b) se ha demostrado que la HA es capaz de inducir erección peneana6; c) Safina et al han sugerido que las células germinales son capaces de sintetizar HA. Sus observaciones indican que la HA podría ser producida en el acrosoma13; d) la HA ha sido implicada en la regulación del comportamiento sexual. En este sentido, Pár et al han descrito alteraciones de la reproducción en ratones HDC-KO, debidas principalmente a una disminución de la conducta de apareamiento en los machos14. A su vez, se observó reducción del comportamiento reproductivo, y del peso testicular, en ratas macho expuestas perinatalmente a astemizol, un antagonista H1R15.
Esteroidogénesis
Con respecto a la esteroidogénesis específicamente, se demostró muy recientemente que el efecto modulador de la HA depende de su concentración y es bifásico, al menos en células de Leydig de ratón, rata y lagarto: mientras que HA 1 nM es capaz de estimular la producción basal de esteroides y aumentar significativamente la respuesta de las células a la hormona luteinizante/gonadotrofina coriónica humana (LH/ hCG), HA 10 μM ejerce un efecto inhibitorio y reversible7,9,11. Estos resultados difieren parcialmente de los obtenidos por Mayerhofer et al en hámster dorado, dado que en dicho modelo experimental concentraciones nanomolares de HA no tuvieron efecto sobre la esteroidogénesis, mientras concentraciones de orden micromolar mostraron un efecto estimulatorio4. Podría postularse que las células de Leydig de hámster tienen una sensibilidad más baja a la HA que las de ratón, rata o lagarto, y por lo tanto solo responden a concentraciones más elevadas de la amina. Sin duda, se requiere de trabajos de investigación adicionales para confirmar esta hipótesis. Desde un punto de vista fisiológico, al tener efectos opuestos sobre la esteroidogénesis, la HA podría contribuir al control homeostático de los niveles de esteroides en el testículo. Cabe destacar que la HA también ejerce efectos bifásicos en otros tipos celulares no esteroidogénicos16,17.
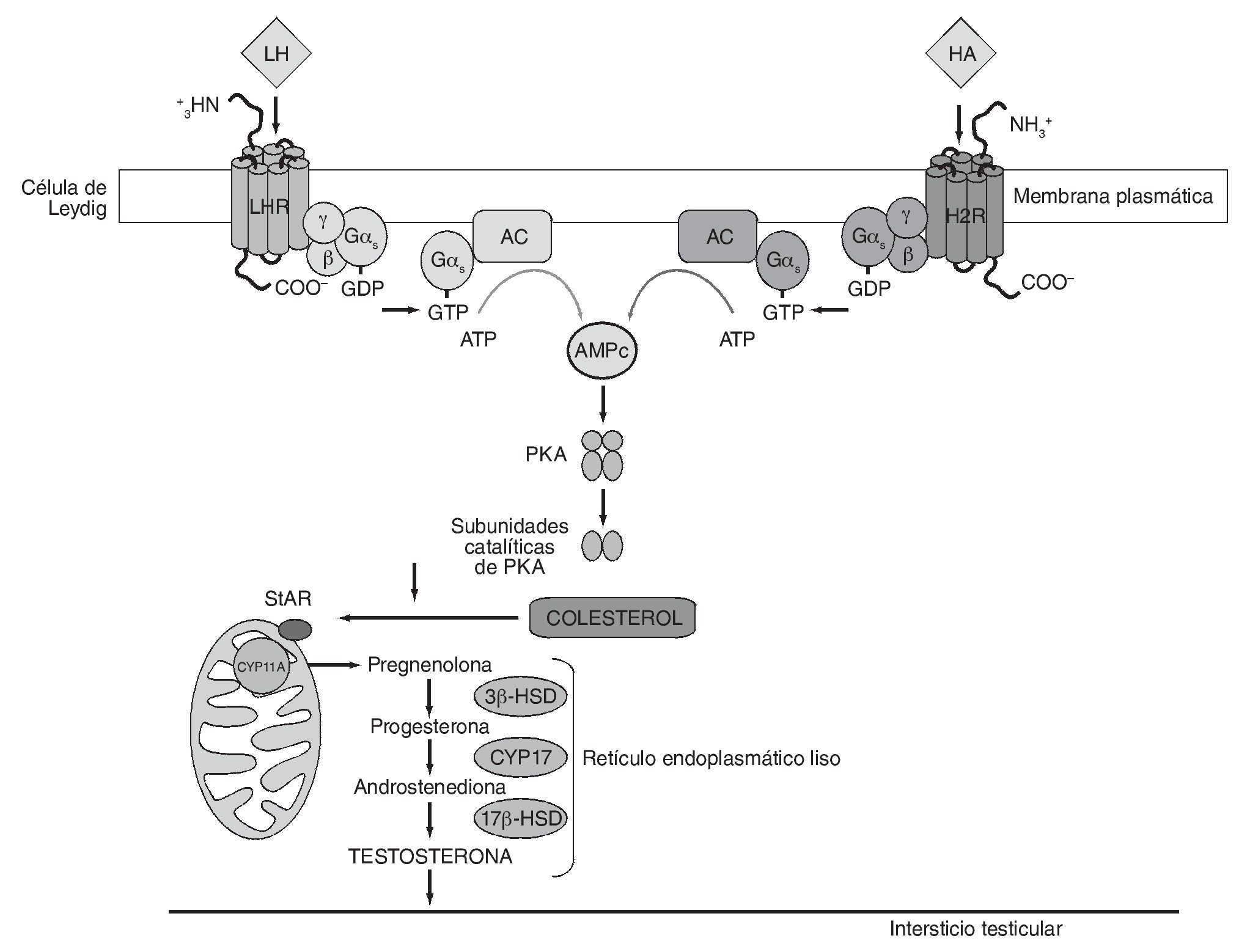
Estudios recientes empleando agonistas y antagonistas selectivos para H1R y H2R en modelos experimentales en mamíferos y no mamíferos han arrojado luz sobre el mecanismo de acción de la HA en células de Leydig7,9,11. Sobre la base de estos estudios, la respuesta a concentraciones de HA estimuladoras de la esteroidogénesis estaría mediada principalmente por H2R. Se ha demostrado que la activación de dicho receptor por un agonista específico conduce a un aumento en la producción de AMPc intracelular, lo cual sugiere el acople de H2R al sistema adenilato ciclasa (AC). Teniendo en cuenta que el AMPc es el principal segundo mensajero en la acción de LH/hCG sobre la esteroidogénesis, el incremento en la concentración de AMPc inducido por el agonista explicaría, al menos en parte, el potente efecto estimulador de la HA sobre la síntesis de esteroides basal y estimulada por gonadotrofinas. En concordancia, se ha reportado que la HA estimula la producción de progesterona en folículos preovulatorios de rata a través de la activación de H2R y el aumento en los niveles intracelulares de AMPc18. La figura 1 muestra una representación esquemática del mecanismo de transducción de señales propuesto para explicar el efecto estimulatorio inducido por la HA sobre la esteroidogénesis a través de H2R.
Figura 1 Mecanismo propuesto para explicar el efecto estimulatorio inducido por la histamina sobre la esteroidogénesis a través de H2R. 3β-HSD: 3β-hidroxiesteroide deshidrogenasa-Δ/Δ4 isomerasa; 17β-HSD: 17β-hidroxiesteroide deshidrogenasa; AC: adenilato ciclasa; AMPc: adenosina-3',5'-monofosfato cíclico; CYP11A: enzima que escinde la cadena lateral de colesterol, dependiente de citocromo P450; CYP17: 17α-hidroxilasa/17-20 liasa, dependiente de citocromo P450; Gαs: subunidad α de la proteína G estimulatoria; H2R: receptor histaminérgico subtipo 2; HA: histamina; LH: hormona luteinizante; PKA: proteína cinasa dependiente de AMPc; StAR: proteína reguladora de la esteroidogénesis aguda.
El efecto inhibitorio de la HA (10 μM) sobre la síntesis de esteroides se debería fundamentalmente a la activación de H1R7,9,11. H1R está acoplado a la enzima fosfolipasa C (PLC) a través de la proteína de unión a GTP Gq en una amplia variedad de tejidos19. En concordancia, la activación de este receptor induce un aumento en la producción de inositol 1,4,5-trifosfato (IP3) en células de Leydig MA-107,11. Más aún, trabajos recientes señalan que la vía PLC/IP3 juega un papel importante en la inhibición de la función esteroidogénica inducida por HA en dichas células, dada la capacidad del inhibidor específico de PLC U73122 para bloquear completamente el efecto inhibitorio de la HA sobre la esteroidogénesis basal o estimulada por gonadotrofinas11. A su vez, la activación de H1R disminuye los niveles de AMPc estimulados por LH/hCG en células MA-10 y Leydig de rata7,11. Estas observaciones indican una interacción negativa con la vía de señalización AMPc/PKA activada por LH/hCG, lo cual ofrece una posible explicación para el efecto inhibitorio de la HA sobre la esteroidogénesis estimulada por gonadotrofinas. Actuando a través de H1R, la HA también antagoniza la acción de LH/hCG en sitios posteriores a la formación de AMPc. Al respecto, se ha demostrado que la HA disminuye la expresión de la proteína reguladora de la esteroidogénesis aguda (StAR) inducida por db-AMPc en células MA-10, lo que afecta el transporte de colesterol hacia el interior de la mitocondria. Además, la HA es capaz de inhibir reacciones catalizadas por enzimas dependientes de citocromo P450 en el camino esteroidogénico, principalmente la conversión de colesterol a pregnenolona por la enzima que escinde de la cadena lateral del colesterol (CYP11A)11.
Óxido nítrico
El óxido nítrico (NO) es un radical libre inorgánico gaseoso, esencial para una amplia gama de actividades biológicas20. Se sintetiza a partir de L-arginina por acción de la NO sintasa (NOS), una enzima que existe en tres isoformas: NOS neuronal (nNOS o NOS I), NOS endotelial (eNOS o NOS III) y NOS inducible (iNOS o NOS II)21,22. Entre sus numerosas y diversas acciones biológicas, se ha demostrado que NO regula varias funciones del sistema reproductor masculino, tanto en condiciones fisiológicas como patológicas23. Con particular referencia al testículo, se ha reportado que NO inhibe reversiblemente la esteroidogénesis inducida por LH/hCG en células de MA-10 y Leydig de rata, actuando directamente a nivel de las enzimas dependientes de citocromo P450 implicadas en el camino esteroidogénico, principalmente la enzima CYP11A24. Además, trabajos recientes han mostrado inhibición de la expresión de la proteína StAR mediada por NO en células de Leydig25,26.
Resulta de especial interés el hecho de que el inhibidor de la NOS NG-nitro-L-arginina metil éster (L-NAME) es capaz de atenuar considerablemente los efectos inhibitorios de la HA sobre la síntesis de esteroides basal y estimulada por hCG. Por otra parte, el tratamiento de las células MA-10 con HA 10 μM aumenta significativamente la actividad de la NOS11. Sobre la base de estas observaciones, se ha propuesto que el incremento en los niveles intracelulares de NO inducido por HA podría explicar, al menos parcialmente, los efectos inhibitorios de la HA sobre la expresión de la proteína StAR, como también sobre la actividad de CYP11A. Por el contrario, es probable que la importante disminución en la producción de AMPc estimulada por LH/ hCG que induce la HA en células MA-10 y Leydig de rata no esté mediada por NO, dado que el gas no modifica los niveles de AMPc basales o estimulados por hCG en células MA-1024. En todo caso, dicha disminución en la producción de AMPc podría ejercer alguna contribución al efecto inhibitorio de la HA sobre la esteroidogénesis estimulada por hCG independientemente de la activación de NOS. En células endoteliales y neuronas, la activación de la vía PLC/ IP3 conduce a un incremento en la síntesis de NO27,28. Las isoformas NOS I y NOS III se expresan en células de Leydig29-31. Por lo tanto, es probable que un camino similar pueda ser responsable del aumento en la actividad de la NOS inducido por HA en estas células.
Guanilato ciclasa
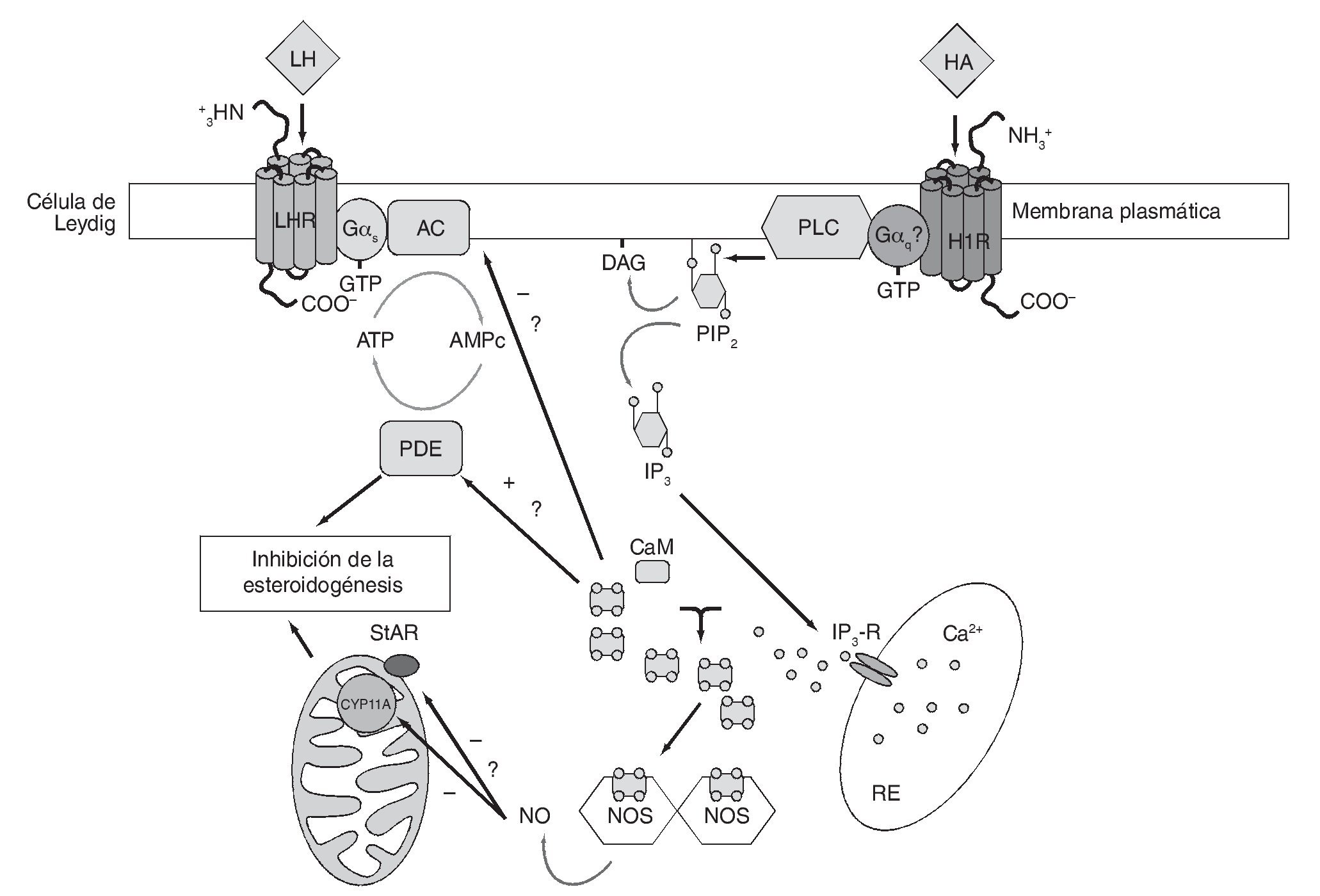
En diversos tipos celulares, NO activa una guanilato ciclasa soluble (GC), incrementando los niveles de GMPc. Se ha propuesto que este último podría estimular la acción de una fosfodiesterasa específica en células de la zona glomerulosa de la adrenal, disminuyendo así los niveles de AMPc y aldosterona32. Sin embargo, análogos de GMPc son incapaces de inhibir la síntesis de esteroides en la línea celular MA-1024 o en células de Leydig de rata33. Más aún, compuestos liberadores de NO no elevan los niveles de GMPc en la línea MA-1024. Sobre la base de estas evidencias, es improbable que el efecto inhibitorio de HA sobre la producción de AMPc estimulada por hCG anteriormente descrito se deba a la activación de una fosfodiesterasa en respuesta al incremento en los niveles de NO inducido por la amina. Además, si bien el inhibidor de la NOS L-NAME atenúa el efecto de HA sobre la síntesis de esteroides inducida por hCG, no es capaz de revertirlo completamente11. La figura 2 muestra una representación esquemática del mecanismo de transducción de señales propuesto para explicar el efecto inhibitorio inducido por la HA sobre la esteroidogénesis a través de H1R.
Figura 2 Mecanismo propuesto para explicar el efecto inhibitorio inducido por la histamina sobre la esteroidogénesis a través de H1R. AC: adenilato ciclasa; AMPc: adenosina-3',5'-monofosfato cíclico; CaM: calmodulina; CYP11A: enzima que escinde la cadena lateral del colesterol, dependiente de citocromo P450; DAG: diacilglicerol; Gαq: subunidad α de la proteína Gq; Gαs: subunidad α de la proteína G estimulatoria; H1R: receptor histaminérgico subtipo 1; HA: histamina; IP3: inositol 1, 4, 5-trifosfato; IP3-R: receptor de IP3; LH: hormona luteinizante; N: núcleo; NO: óxido nítrico; NOS: óxido nítrico sintasa; PDE: fosfodiesterasa; PIP2: fosfatidilinositol 4, 5-bifosfato; PKA: proteína cinasa dependiente de AMPc; PLC: fosfolipasa C; RE: retículo endoplasmático; StAR: proteína reguladora de la esteroidogénesis aguda.
Hormona luteinizante/gonadotrofina coriónica humana
Se demostró recientemente que LH/hCG incrementa significativamente los niveles de expresión de los genes H1R y H2R en células de Leydig8. Este hallazgo refuerza las evidencias aquí descritas que señalan a la HA como modulador local de las acciones de LH sobre la esteroidogénesis. A su vez, resultados obtenidos a partir de experimentos empleando ratones HDC KO sugieren fuertemente que la HA también sería capaz de contribuir a la regulación de la diferenciación de las células de Leydig inducida por LH. En este sentido, Pap et al12 han indicado que los ratones HDC KO presentan niveles de esteroides testiculares y séricos elevados, y testículos de tamaño significativamente menor a los de ratones de genotipo salvaje, tanto en edad adulta como prepuberal. Además, en los ratones KO la ultraestructura de las células de Leydig se encuentra severamente alterada desde los 7 días de edad, cuando los testículos no han descendido aún desde el abdomen. También se ha descrito que presentan un alto contenido de inclusiones lipídicas en el citoplasma, sumado a otras características morfológicas de las células de Leydig inmaduras. Cabe mencionar que en estos ratones la incorporación de HA en la dieta no reemplaza la falta de producción local de la amina. Más aún, células de Leydig aisladas a partir de ratones HDC KO y mantenidas en cultivo muestran una menor respuesta esteroidogénica a hCG, producen niveles de testosterona significativamente inferiores a los producidos por células de Leydig de ratones de genotipo salvaje, y hCG no es capaz de inducir la expresión de los genes H1R y H2R8. En conjunto, estas observaciones sugieren que la deficiencia prolongada de HA en ratones HDC KO afecta a la fisiología de la células de Leydig, interfiriendo con el desarrollo sexual normal.
Mastocitos testiculares
Los mastocitos testiculares constituyen la fuente principal de HA en la gónada10. En el testículo normal de la rata adulta, los mastocitos residen bajo la túnica albugínea, rodeando los vasos sanguíneos. En el hombre, se localizan más bien en la región intersticial34,35. El papel preciso de estos mastocitos en condiciones fisiológicas no ha sido dilucidado. Sin embargo, Gaytan et al han descrito la proliferación y diferenciación simultánea de precursores de mastocitos y precursores de células de Leydig en testículo de rata, sugiriendo la existencia de interacciones dinámicas entre los dos tipos celulares36. A su vez, se ha descrito un incremento progresivo en el número de mastocitos testiculares durante la etapa peripuberal en el mono, hámster y humano37,38. Estos hallazgos refuerzan la idea de que la HA estaría involucrada en la regulación del desarrollo testicular. Dado que la LH es capaz de inducir degranulación de mastocitos en el ovario39, podría postularse que existe una situación similar en la gónada masculina. Así, la HA producida por los mastocitos testiculares actuaría de manera paracrina para modular las acciones de LH sobre las células de Leydig. También se ha detectado la síntesis de la HA en macrófagos testiculares9,10,13, como así también en células germinales13. Dado que estas células se localizan en cercanía con las células de Leydig, podrían también ser fuente de HA para regular la diferenciación de las mismas y/o la función esteroidogénica. El modelo planteado tendría numerosas semejanzas con lo observado en la glándula mamaria de ratón, donde existen dos pools de HA: HA asociada a células epiteliales que expresan HDC, y HA asociada a mastocitos. En el útero también se ha postulado un modelo similar40,41. Para complicar aún más el panorama, Lima et al han descrito que bajas concentraciones de testosterona en ratas prepúberes pueden estimular la proliferación y/o diferenciación de mastocitos peritoneales, mientras que la hormona en concentraciones elevadas tendría un efecto inhibitorio sobre dichas células42. Así, si bien es sabido que los mastocitos de distintos tejidos pueden responder de manera diferente a los mismos factores, los hallazgos de Lima suscitan el siguiente interrogante: ¿podrían las células de Leydig, a través de la síntesis de testosterona, contribuir a la regulación de la población mastocitaria testicular, modulando así de manera indirecta la secreción de HA y sus acciones sobre la diferenciación y/o la esteroidogénesis? Al respecto, resulta interesante el hecho de que existirían factores inhibitorios de la proliferación de mastocitos en el intersticio testicular de ratas adultas, pero no de ratas prepúberes, donde predominan células de Leydig inmaduras y los niveles de testosterona son relativamente bajos. Más aún, se ha demostrado que dichos factores podrían ser producidos por las células de Leydig, una vez que estas han completado su diferenciación43. En concordancia con estas evidencias, la concentración de HA testicular en ratas prepúberes es considerablemente más elevada que en animales adultos44.
Frungieri et al han descrito que en primates, el incremento en el número de mastocitos testiculares, característico de la etapa prepuberal, se acompaña de niveles séricos bajos de testosterona y niveles elevados de LH, de igual modo que en las ratas. Sin embargo, a diferencia de lo indicado para estas últimas, en primates y humanos no se observa disminución en el número de mastocitos intersticiales en el testículo adulto, aunque los niveles séricos de testosterona se incrementan en forma progresiva después de iniciada la pubertad37. Así, a pesar de la discrepancia descrita, las observaciones de Frungieri et al podrían estar aportando evidencias a favor de un efecto dual de HA sobre la síntesis de esteroides en células de Leydig.
En el contexto de los hallazgos expuestos, es razonable especular que concentraciones elevadas de HA puedan ejercer una función de importancia en el testículo inmaduro, contribuyendo al proceso de diferenciación de las células de Leydig y/o modulando la síntesis de testosterona por dichas células, para mantener niveles mínimos del andrógeno en etapas prepuberales. A su vez la HA también jugaría un papel importante en el testículo adulto, incrementando los niveles de testosterona producidos en respuesta a concentraciones submáximas de LH y asegurando, de este modo, el mantenimiento de caracteres sexuales secundarios y el normal desarrollo del proceso espermatogénico. Al menos en rata y ratón, esto último se observaría en presencia de concentraciones nanomolares de HA.
Discusión
Dada la diversidad de síndromes asociados a la HA, en los últimos años se ha introducido en terapéutica una gran variedad de compuestos antihistamínicos en el tratamiento de los mismos, particularmente antagonistas H1R y H2R. Sin embargo, la probada participación de la amina en múltiples funciones fisiológicas hace pensar que el uso frecuente de estas fármacos podría tener efectos secundarios a largo plazo, y comprometer los diversos órganos blanco de acción de la HA. Con particular referencia al testículo, la cimetidina, poderoso antagonista H2R extensamente utilizado en el tratamiento de úlceras gástricas, induce apoptosis en células peritubulares de ratas macho, afectando en consecuencia el proceso espermatogénico45. Sin duda, el nuevo papel de la HA como modulador dual de la esteroidogénesis testicular atraerá la atención hacia nuevos efectos colaterales potenciales del uso de antihistamínicos, que podrían alterar el equilibrio local, incrementando o disminuyendo la producción de andrógenos en las células de Leydig.
Cuanto más avance el conocimiento acerca de los receptores de HA y sus múltiples funciones, más oportunidades surgirán para el diseño racional de medicamentos. En este sentido, la identificación de los receptores H3 y H4 (H3R y H4R, respectivamente) hace algunos años contribuyó a renovar el interés por la HA en biología y medicina clínica, al exponer nuevos blancos terapéuticos potenciales. Sin embargo, aún se sabe muy poco acerca de la expresión de H3R o H4R en el sistema reproductor masculino. Hasta el momento, solo se ha indicado la expresión de ARNm de H4R en homogeneizado de testículo de rata46. Esto último constituye la única evidencia de la existencia de H4R en la gónada masculina.
Conclusiones
Considerando que la HA ha sido implicada en el proceso espermatogénico, la erección peneana y el comportamiento sexual además de la esteroidogénesis, es razonable especular que la amina desempeña un papel integral en la regulación de la función reproductiva masculina, que requiere una investigación más exhaustiva. A su vez, los mastocitos han sido asociados a diversas condiciones patológicas en el testículo adulto47,48, y existen evidencias que indican que la concentración de HA testicular puede aumentar de forma significativa en condiciones de estrés49,50. En este contexto, no debiera descartarse un posible papel de la HA en dolencias testiculares asociadas con infertilidad.
Conflicto de intereses
Los autores declaran que no tienen ningún conflicto de intereses
Agradecimientos
Al Dr. Omar Pedro Pignataro, director del laboratorio de Endocrinología Molecular y Transducción de Señales del Instituto de Biología y Medicina Experimental (IByME-CONICET). A la Fundación Alberto J. Roemmers, Agencia Nacional de Promoción Científica y Tecnológica (ANPCyT), CONICET, Universidad de Buenos Aires y al Ministerio de Salud de la nación, por el sostenido apoyo económico. Al bioquímico Ramiro Vázquez, por la lectura crítica del manuscrito.
Correo electrónico:carolina.mondillo@gmail.com
Recibido el 18 de marzo de 2011;
aceptado el 1 de abril de 2011