La neoplasia testicular intratubular es una lesión premaligna testicular asociada a tumores germinales primarios gonadales y extragonadales. La prevalencia de neoplasia testicular intratubular en pacientes infértiles llega al 2% en diferentes estudios. Presentamos el caso de un paciente azoospérmico con diagnóstico incidental de neoplasia testicular intratubular bilateral en la biopsia testicular realizada durante la recuperación quirúrgica de espermatozoides. En pacientes infértiles, las técnicas de recuperación espermática deben incluir el estudio anatomopatológico de parénquima testicular para descartar enfermedad maligna asociada. Los pacientes con alteración de la espermatogénesis tienen mayor riesgo de presentar otras alteraciones del desarrollo gonadal (neoplasias, hipogonadismo, entre otros) en el contexto de un síndrome de disgenesia testicular.
Testicular intraepithelial neoplasia is a premalignant lesion associated to gonadal and extragonadal germ cell tumors. Testicular intraepithelial neoplasia prevalence in infertile men has reached 2% in some studies. This report presents the case of an azoospermic man with an incidental diagnosis of bilateral testicular intraepithelial neoplasia after testicular sperm extraction. In infertile men, sperm retrieving techniques have to include histological analysis of testicular tissue, to discard any chance of malignant component. Patients with spermatogenesis alterations have an increased risk to present other disruptions in gonadal development (neoplasms, hypogonadism, among others) in the context of testicular dysgenesis syndrome.
La neoplasia intratubular testicular (TIN, por sus siglas en inglés) es una atipia celular intratubular que no sobrepasa la membrana basal del túbulo seminífero. Se considera una lesión premaligna precursora de tumores de células germinales, con algunas excepciones como el seminoma espermatocítico (típico de ancianos) y tumores germinales infantiles. El 50% de las TIN progresan a tumores invasivos a los 5 años y casi el 100% en un periodo de seguimiento más largo1,2.
Entre el 5 y el 6% de los pacientes con tumor testicular tendrá TIN en el testículo contralateral1,2. Existen diferencias importantes entre los protocolos terapéuticos con relación a esta evidencia. Las guías de la Asociación Europea de Urología recomiendan realizar biopsia del testículo contralateral al tumor en el momento de la orquiectomía solo en pacientes de alto riesgo: volumen testicular<12mL, antecedentes de criptorquidia y defectos en la espermatogénesis (Johnsen Score 1-3)3,4,. En países con elevada prevalencia de cáncer de testículo, como Alemania o Dinamarca, se realiza biopsia contralateral de forma estandarizada2.
Skakkebaek describe por primera vez en 1972 la presencia de TIN en biopsias testiculares de 2 pacientes infértiles, que en el futuro desarrollaron tumores germinales5; posteriormente otros numerosos estudios han asociado la presencia de TIN a infertilidad. En pacientes infértiles, se ha descrito una prevalencia de TIN del 0-2%6. Pareciera que la astenozoospermia y teratozoospermia aumentan en 20 veces el riesgo de tumor testicular7.
Caso clínicoPresentamos el caso de un hombre de 39 años con una pareja de 33 años que consultan por esterilidad primaria de un año de evolución. El estudio del factor femenino para infertilidad no demuestra ningún hallazgo patológico.
Como antecedentes personales se destaca la existencia de criptorquidia bilateral resuelta quirúrgicamente en la infancia. En la exploración física se observan caracteres sexuales secundarios normales. Pene elongable, sin fibrosis. Meato ortotópico. Solo destacan testículos con volumen de 8ml bilateral de consistencia algo disminuida. Se palpan ambos conductos deferentes y epidídimos. No se evidencia varicocele de forma bilateral.
Se solicita un seminograma, donde se observa volumen seminal de 4mL, un pH de 7,7 y ausencia de espermatozoides. Posteriormente, se solicita un segundo seminograma que corrobora la azoospermia tras centrifugación a 1.000g durante 5min. Se sigue el protocolo de estudio de azoospermia. La determinación de FSH es de 29UI/l (14-18,1UI/l) y la testosterona total es de 4,6ng/ml (2,41-8,27ng/ml). En el estudio genético destaca un cariotipo 46XY y ausencia de microdeleciones del cromosoma Y.
Se decide realizar una recuperación espermática quirúrgica (TESE) asociada a estudio histológico. La recuperación quirúrgica bajo visión microscópica (microTESE) pareciera tener mayores probabilidades de encontrar gametos viables en pacientes azoospérmicos8. Existe controversia en la importancia de los predictores de éxito de recuperación espermática. Una revisión reciente del tema le resta valor pronóstico a variables clínicas como nivel de FSH y volumen testicular8. Deruyver at al. concluyen que la superioridad de la microTESE se observa principalmente en pacientes con síndrome de solo células de Sertoli (y espermatogénesis parchada) independiente de los parámetros clínicos del paciente8. Nuestro protocolo institucional es comenzar con TESE tradicional, y si fracasa, ofrecer microTESE en segunda instancia.
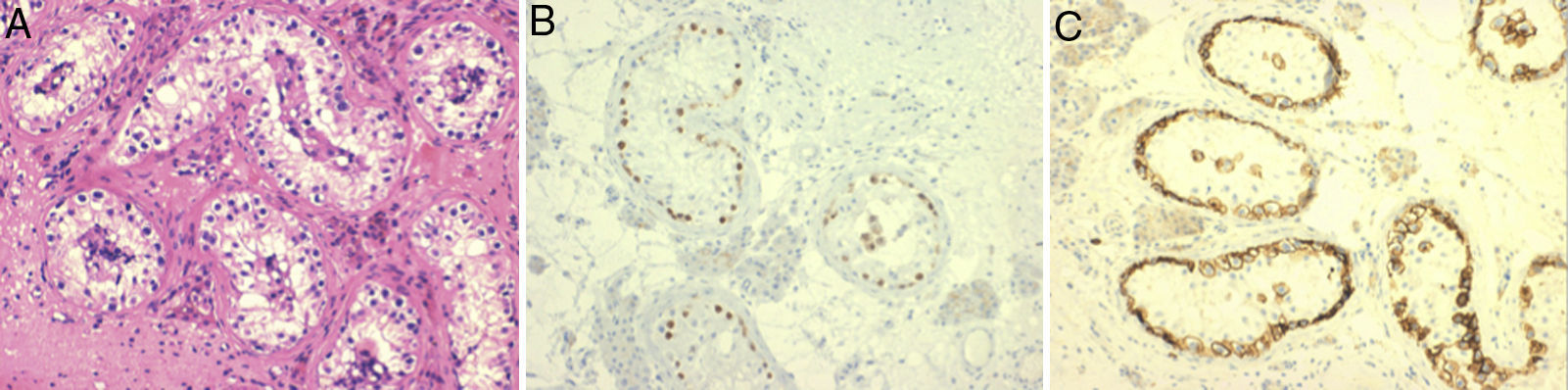
Bajo anestesia local, se toman 2 muestras de parénquima de cada testículo, una de ellas para búsqueda de espermatozoides y otra para estudio anatomopatológico. No se observan espermatozoides en las muestras extraídas. En el estudio anatomopatológico se observan túbulos seminíferos con un 60% de hialinosis y ausencia de células germinales. Los túbulos no hialinizados están tapizados por células con marcada atipia, con inmunohistoquímica positiva para OCT 3/4 y cKit. El diagnóstico histológico definitivo es de TIN bilateral (fig. 1).
Microfotografía de biopsia testicular con TIN. A. Presencia de células atípicas sustituyendo la celularidad germinal. Tinción hematoxilina y eosina. B. Positividad nuclear de las células neoplásicas con la tinción inmunohistoquímica para OCT 3/4. C. Positividad citoplasmática de las células neoplásicas con la tinción inmunohistoquímica para cKit.
El 82,5-95% de las piezas quirúrgicas de orquiectomías por tumor testicular presentan TIN asociada, tanto adyacente al tumor como de forma difusa en el resto de la pieza9. El 5% de los pacientes con tumor testicular presentan TIN contralateral y hasta un 42% de los tumores germinales primarios extragonadales tienen TIN asociada2. La coexistencia de azoospermia y TIN bilateral, como en el caso presentado, es un fenómeno poco frecuente, casi no descrito en la literatura.
Diferentes autores sugieren que al diagnosticar incidentalmente una TIN se debe descartar un tumor germinal primario testicular o retroperitoneal. Se deben solicitar pruebas de imagen (ecografía testicular y TAC abdominopélvica) y marcadores tumorales (alfa-fetoproteína, lactato deshidrogenasa y gonadotropina coriónica humana beta). La visualización de microlitiasis en una ecografía testicular puede indicar el diagnóstico de TIN, sin embargo el diagnóstico definitivo es histológico.
El tratamiento estándar para la TIN bilateral es la radioterapia externa a dosis de 16-20Gy2; no se recomienda la realización de tumorectomía asociada a quimioterapia adyuvante por la elevada tasa de tumor residual y riesgo de progresión a tumor invasivo (del 18-50%)10. A dosis por encima de 4Gy se producen daños permanentes de las células germinales, con alto riesgo de infertilidad posradioterapia externa 11. En pacientes con deseo de descendencia, se puede realizar un seguimiento estrecho con pruebas de imagen y marcadores tumorales hasta cumplir deseo genésico o se puede plantear criopreservación de espermatozoides procedentes de TESE o eyaculado, o bien inseminación con semen de donante.
El riesgo de alteración de la función endocrina del testículo, por radioterapia externa, depende de la dosis empleada. A dosis de 16Gy los estudios no han demostrado variaciones en los niveles de testosterona a 10 años de seguimiento12. A dosis de 20Gy los pacientes presentan un descenso anual del 9% de los niveles de testosterona durante los primeros 5 años, manteniéndose estables durante los 5 años siguientes, pudiendo requerir tratamiento hormonal sustitutivo un 78% de los pacientes12.
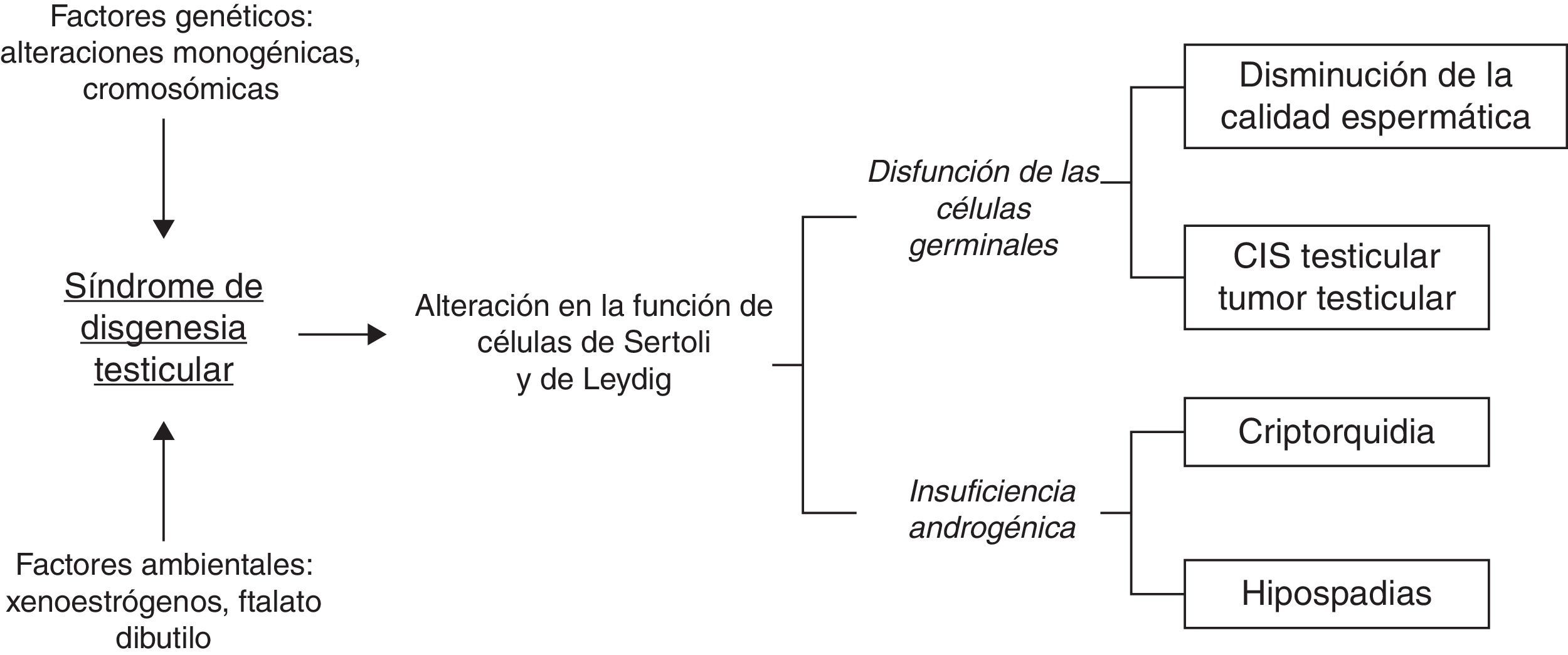
La asociación entre tumor testicular e infertilidad se podría explicar dentro del contexto del «síndrome de disgenesia testicular», descrito inicialmente por Skakkebaek et al. en 200113. Este síndrome es el resultado de una alteración en el desarrollo gonadal masculino. Engloba defectos en la espermatogénesis, criptorquidia, hipospadias, cáncer de testículo e insuficiencia androgénica en la edad adulta (fig. 2). No todos los pacientes presentan cada una de las alteraciones, ni con el mismo grado de afectación. La presencia de una o más de estas alteraciones aumenta el riesgo de desarrollar alguna de las otras14. Los autores proponen al testículo disgenético fetal como el responsable de todas las alteraciones posteriores. Entre las noxas testiculares se han descrito disruptores hormonales maternos (como xenoestrógenos o ftalato dibutilo) y mecanismos epigenéticos (como metilación del ADN). Las alteraciones cromosómicas o monogénicas son responsables de una pequeña proporción de los casos14. Estudios epidemiológicos demuestran una mayor prevalencia de TIN en la población danesa (2,2%) respecto a la población general (0,45%)6. De acuerdo con la hipótesis del síndrome de disgenesia testicular, esta población también tendría una mayor prevalencia de criptorquidia e hipospadias15,16. En el caso presentado el paciente asocia varias de las manifestaciones clínicas del síndrome de disgenesia testicular, como la criptorquidia bilateral, defectos de la espermatogénesis (azoospermia) y TIN bilateral.
Representación esquemática de los componentes del síndrome de disgenesia testicular. Modificado de Skakkebaek et al.13
El síndrome de disgenesia testicular es un concepto que ha cambiado la forma de estudiar y tratar al paciente infértil. Es conveniente considerar la asociación entre alteraciones de la espermatogénesis, del metabolismo androgénico y neoplasias de células germinales. En pacientes azoospérmicos, la recuperación quirúrgica de espermatozoides debe ir acompañada de estudio anatomopatológico, no solo para definir la causa de infertilidad sino para descartar también enfermedades graves asociadas, tales como los tumores de células germinales y las TIN.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.