CASO CLINICO
Homem de 25 anos de idade, caucasiano, com infertilidade primária conhecida desde há 4 anos. O exame ginecológico da esposa não revelou qualquer anormalidade. O espermograma solicitado pelo Ginecologista mostrava 100% de espermatozóides (Ez) imóveis, com número, morfologia e viabilidades normais. Repetiu o espermograma na nossa Unidade de Medicina da Reprodução (UMR) que confirmou a ausência completa de formas móveis. A concentração de Ez foi de 25*106/ml, o volume de sémen foi 1,7 ml, com 60% dos Ez viáveis. O doente não referia outros antecedentes médicos para além de problemas respiratórios na infância sem sequelas actuais.
Negava antecedentes de criptorquidia, cirurgia inguinal, patologias infecciosas ou a utilização regular de fármacos ou drogas.
Nos antecedentes familiares destaca-se o caso de um irmão também com infertilidade e dextrocardia (Síndrome de Kartagener).
No exame físico o paciente apresentava características sexuais secundárias normais, canais deferentes palpáveis, epidídimos sem alterações, ausência de varicocelo clínico, e ambos os volumes testiculares eram normais.
O estudo complementar revelou: Radiografia do tórax normal; Estudo hormonal, com FSH, LH e TT dentro dos parâmetros habituais; Cariótipo 46XY; Estudo Molecular do Cromossoma Y sem microdelecções.
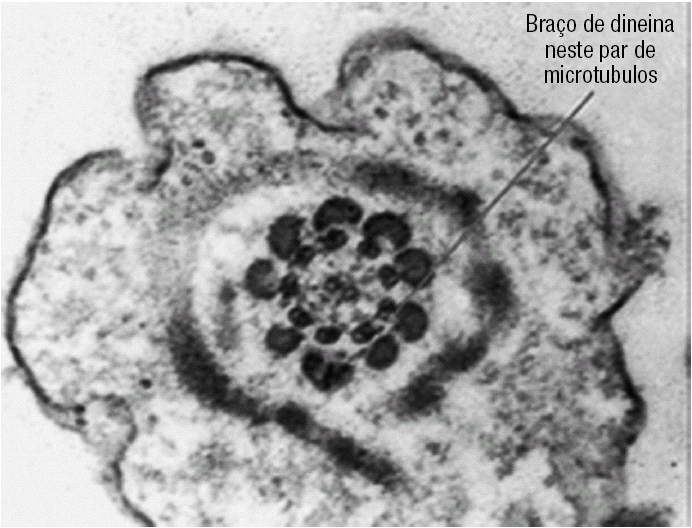
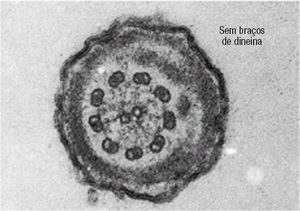
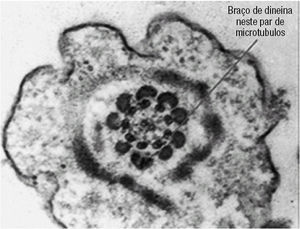
Foi requerida a avaliação dos Espermatozóides por Microscopia Electrónica de Transmissão (ME). As cabeças dos Ez apresentavam núcleos e regiões acrossómicas intactos (fig. 1). Contudo, em 85 a 90% dos espermatozóides faltavam ambos os braços de dineína (figs. 2 a 5). A figura 3 representa esquematicamente um corte transversal do axonema presente na cauda dos espermatozóides, e mostra as proteínas e os locais de ligação existentes entre os pares de microtúbulos periféricos e os centrais.
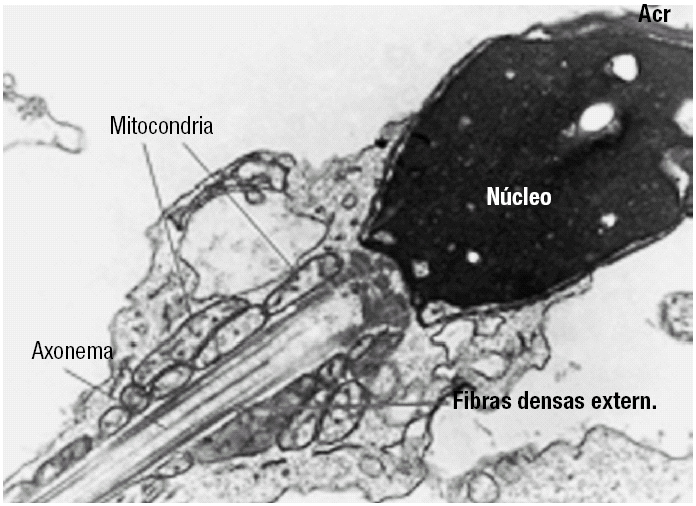
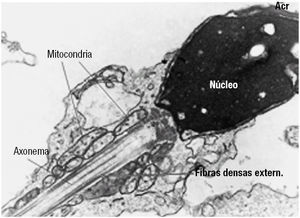
Figura 1. Um espermatozóide em corte longitudinal, revelando normalidade dos constituintes da cabeça (núcleo e acrossoma) e das peças intermédia e principal. Destaca-se, nesta última, as mitocôndrias que produzem o ATP, as fibras densas externas, e o axonema.
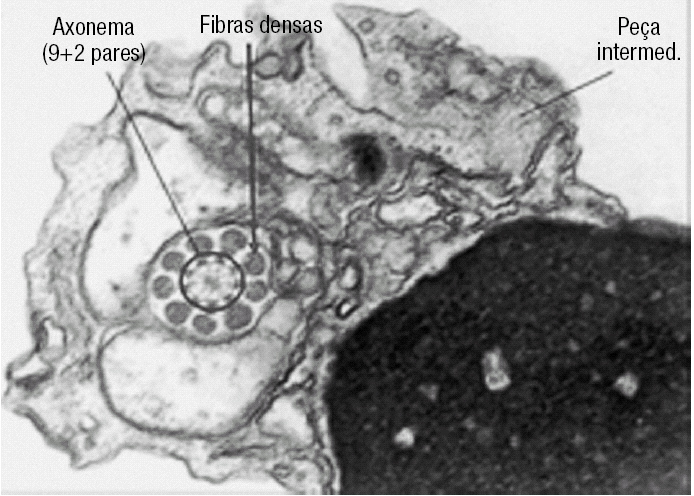
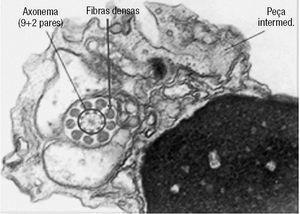
Figura 2. Corte transversal ao nível do núcleo e peça intermédia de um espermatozóide. É possível observar o arranjo circular das estruturas microtubulares do axonema, rodeado pelas fibras densas.
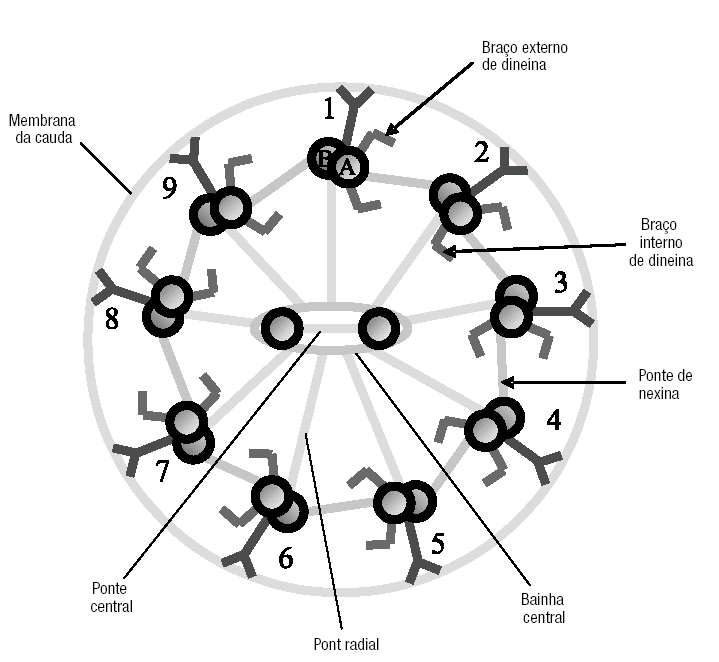
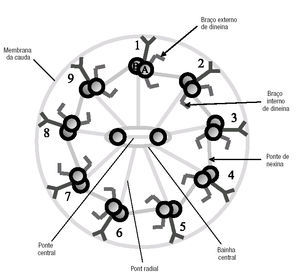
Figura 3. Representação esquemática do axonema de um flagelo, composto por 9 pares de microtúbulos periféricos e 2 simples centrais. Os microtúbulos periféricos estão ligados ao par central por pontes radiais. Os 2 microtúbulos centrais estão conectados entre si por uma ponte central, dentro da baínha central. Os pares de microtúbulos periféricos conectam entre si por pontes de nexina. O microtúbulo A possui 2 braços de dineína, interno e externo, com actividade ATPásica (vide texto).
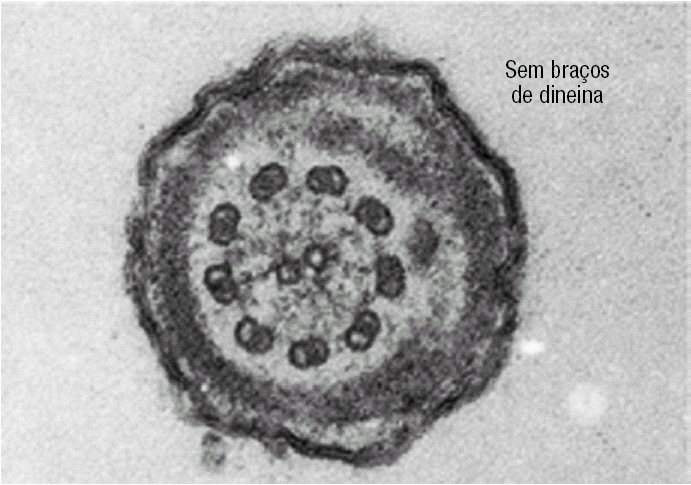
Figura 4. Cauda de um espermatozóide em corte transversal, onde se observa a ausência completa de braços de dineína no axonema.
Figura 5. Neste espermatozóide é possível observar braços de dineína em alguns dos microtúbulos periféricos.
O casal foi submetido a 2 ciclos de tratamento com ICSI, utilizando-se Ez do ejaculado. Nos dois casos foram fertilizados 3 em 12 ovócitos, mas a implantação não foi bem sucedida.
DISCUSSÃO
O uso da Microscopia Electrónica permitiu o estudo ultra-estrutural dos espermatozóides. Os defeitos grosseiros da cauda, como a curvatura ou o enovelamento, podem ser identificados com a Microscopia Óptica, mas para detectar anomalias das mitocôndrias, das fibras densas ou dos microtúbulos é necessária a ME1-3.
Os defeitos mais comuns do axonema envolvem números anormais de microtúbulos e dos seus elementos associados3-5. O axonema é um círculo de microtúbulos, composto por 9 pares periféricos (fundidos entre si) e 2 simples centrais (independentes) (figs. 2 a 6). Cada par é constituído por um microtúbulo mais interno (A) e outro mais externo (B) (fig. 3). Os pares estão unidos entre si por pontes de nexina (entre o A e o B de pares adjacentes). Os pares ligam-se aos 2 centrais pelos filamentos radiais. De cada microtúbulo A saem 2 braços de dineína, que são ATPases responsáveis pelo deslizamento entre os pares periféricos de microtúbulos e que originam o movimento flagelar (o ATP vem das mitocôndrias). Assim, alterações da organização standard 9+2 microtúbulos podem resultar em espermatozóides imóveis. Os defeitos destes elementos do cito-esqueleto não foram ainda completamente caracterizados3,5-7.
O defeito mais frequente envolve a ausência completa de ambos os braços de dineína, interno e externo1,3,5. Outros padrões consistem na ausência de um dos braços5. No mesmo doente podemos encontrar espermatozóides com diferentes defeitos (mosaicismo da dineína)4,6,8.
A ultra-estrutura dos cílios do tracto respiratório é similar à da cauda dos espermatozóides. Ambas têm 9 microtúbulos periféricos doublet e um par de microtúbulos centrais. Assim, os defeitos ultra-estruturais do axonema estão muitas vezes, mas não sempre, associados a defeitos idênticos nos cílios do tracto respiratório3-5. Quando isso acontece, estamos perante uma condição conhecida como Síndrome dos Cílios Imóveis (SCI) [Eliasson et al, 1977]. As infecções crónicas do tracto respiratório são comuns nestes pacientes. Aproximadamente 50% destes pacientes demonstram dextrocardia com ou sem situs inversus, patologia que se designa por Síndrome de Kartagener2-9.
Estudos genéticos demonstram um padrão de hereditariedade autossómica recessiva, com um gene ligado a determinados haplótipos HLA (Bianchi et al, 1992)3,5,6. Outros estudos confirmaram tratar-se de uma patologia autossómica recessiva com heterogeneidade extensa de locus, e com cerca de 90% de penetrância7,10. Contudo, nenhuma sequência completa de ADN dos genes humanos da cadeia pesada de dineína foram publicados nem qualquer mutação deletéria foi encontrada7. O axonema ciliar é constituído por aproximadamente 250 polipeptídeos, pelo que há muitos genes candidatos que podem contar para a heterogeneidade genética da SCI3,7,10. Esta patologia afecta igualmente homens e mulheres e foi diagnosticada em indivíduos de todas as raças7,9.
A incidência de SCI é de 1:20000 nascimentos. A Síndrome de Kartagener descrita em 1933, uma variante clínica desta patologia, tem uma incidência de 1:40000. A forma clássica de apresentação é a tríade clínica de sinusite crónica, bronquiectasias e situs inversus (Afzelius, 1976)3-5,9.
A maioria dos casos de Cílios Imóveis é diagnosticada na infância devido às dificuldades respiratórias e à sinusite3,4.
Os cílios presentes na retina e no ouvido podem também ser deficientes e levar à Retinite Pigmentosa e surdez na Síndrome de Usher3,7.
Nestes pacientes foram encontrados outros defeitos ultra-estruturais nos flagelos. Por exemplo, anomalias dos filamentos radiais, transposição de microtúbulos, ausência do par central e displasia das fibras densas4,6. Assim, esta síndrome é heterogénea e a motilidade pode ser mantida por alguns espermatozóides (Sturgess et al, 1979; Jouannet et al, 1983)3,5-7. Por causa da diversidade destes achados, alguns investigadores consideram incorrecto o termo Síndrome dos Cílios Imóveis e acreditam que esta condição seria melhor classificada como Síndrome de Discinésia Ciliar (Rossmann et al, 1981)3,5.
A Discinésia Ciliar Primária é uma patologia congénita com um fenótipo de variabilidade clínica reconhecida7. Um exemplo é que apenas metade dos pacientes de uma dada família têm situs inversus, facto que se confirma no nosso caso clínico.
Os microtúbulos são elementos do cito-esqueleto essenciais para muitos processos cruciais em todas as células. No que às células germinativas diz respeito, eles são responsáveis pela separação dos cromossomas durante a mitose e a meiose, bem como pela migração do espermatozóide e núcleo do ovo durante a fertilização. Considera-se que um ou mais defeitos dos microtúbulos podem ser prejudiciais ao movimento ciliar e/ou às divisões mitótica ou meiótica, prejudicando assim a fertilização. Assume-se que para a fecundação ter sucesso necessita da restauração do centrossoma (em que o Ez tem o papel central) e da motilidade mediada pelos microtúbulos de cromossomas emparelhados na primeira mitose. Estudos demonstraram que os defeitos na organização microtubular resultam na incapacidade de fertilizar5,6.
Em 1996 foi relatado o primeiro caso de uma gravidez conseguida através da ICSI e, desde essa data, esta técnica tem sido usada com algum sucesso nos casos de infertilidade por Síndrome de Kartagener2,5,6,8,10.
A ICSI no nosso caso resultou em fertilização de 25% dos ovócitos aspirados e embriões clivados. A injecção de Ez completamente imóveis implica o risco de injectar um espermatozóide morto. Alguns autores, tal como fizemos no nosso caso, recomendam a utilização do teste hipoosmótico para a selecção de Ez viáveis para ICSI11. Alguns autores advogam a utilização de Ez testiculares referindo obter melhores resultados de fertilização e gravidez11. Outros investigadores, porém, não encontraram benefício no uso de Ez testiculares, defendendo por outro lado o uso de Ez após 3 ou 4 ejaculações repetidas e sem abstinência sexual (Tournaye e tal, 1996)2,8.
O nascimento de crianças clinicamente saudáveis sem situs inversus, através do uso da ICSI, parece justificar eticamente o uso destas tecnologias em casos de Síndrome dos Cílios Imóveis. Como em todas as doenças hereditárias em que a natureza do defeito é desconhecida e os sintomas são heterogéneos, o resultado da intervenção reprodutiva é, em última análise, desconhecido. Em pacientes com SCI, a ICSI e outros procedimentos que levam à concepção podem resultar no nascimento de crianças perfeitamente saudáveis, mas há a possibilidade de problemas de fertilidade e outros problemas médicos virem a ser diagnosticados mais tarde. Todos os pacientes devem ser informados acerca destes riscos e receber aconselhamento e estudo genético apropriados antes do uso da ICSI ser considerado5,6,10.
CONCLUSÕES
A Microscopia Electrónica deve ser considerada em pacientes cujo espermograma revele muito baixa motilidade dos espermatozóides, mas com vitalidade razoavelmente alta, ou em casos esporádicos de infertilidade inexplicada.
Apesar de não haver cura para estas alterações ultra-estruturais, os espermatozóides podem ser usados para FIV com Injecção Intracitoplasmática de Espermatozóides.
O tratamento da infertilidade nesta população deve ser recomendado com cautela, uma vez que algumas destas condições têm base genética.
Correspondencia: Vitor Nuno de Magalhães Oliveira.
Unidade de Andrologia, Serviço de Urologia do Centro Hospitalar de Vila Nova de Gaia.
Avenida Beira Mar, 3307 1.o Esq. 4400-382 Vila Nova de Gaia. Portugal.
Correo electrónico: vitorolive@gmail.com